
研究背景:
糖尿病是一种全球性代谢疾病,影响着超过4.63亿人的健康,其中糖尿病溃疡是严重并发症之一。高血糖环境加剧伤口感染与氧化应激,血糖控制是愈合的关键。同时,活性氧(ROS)在抗菌治疗中起着重要作用,但持续的ROS产生也会引发细胞损伤。因此,需要一种智能调控系统来平衡抗菌与氧化应激的关系。现有的治疗方法,如功能性水凝胶,通过响应性释放药物来促进糖尿病创面的愈合,但缺乏与伤口微环境的有效反馈。然而,当前的局部胰岛素递送方案存在时空敏感性的限制,过量胰岛素释放也可能导致低血糖风险。
为解决这一问题,本文提出了一种可编程水凝胶(CPAN-AMP),该水凝胶结合了葡萄糖氧化酶和胰岛素递送系统,能够在高血糖环境中催化ROS生成,同时根据血糖波动调节胰岛素释放,确保了血糖平衡与创面愈合的双重调控,从而为糖尿病创面愈合提供新的治疗策略。

针对上述问题,西安交通大学郭宝林团队提出了一种葡萄糖激活的自切换酶类活性编程水凝胶,旨在解决糖尿病患者因血糖调节功能缺陷导致的慢性伤口愈合延迟问题。本文提出一种可编程水凝胶(CPAN-AMP),由苯硼酸修饰的壳聚糖(CP)、疏水性2-硝基咪唑(NI)修饰的藻酸钠(AN)以及苯硼酸修饰的Au-MoS₂(AMP)组成的可编程水凝胶,该材料具有葡萄糖激活的自切换酶样活性,为感染性糖尿病创面愈合提供新途径(图1)。该技术可提高伤口愈合速率,约为市售敷料的三倍,并通过调节血糖稳态和分阶段治疗方案显著促进慢性糖尿病创面愈合,为糖尿病伤口护理提供创新解决方案。该文章于2025年2月2日以《Glucose-Activated Programmed Hydrogel with Self-Switchable Enzyme-Like Activity for Infected Diabetic Wound Self-Adaptive Treatment》为题发表于《Advanced Materials》(10.1002/adma.202419158)。
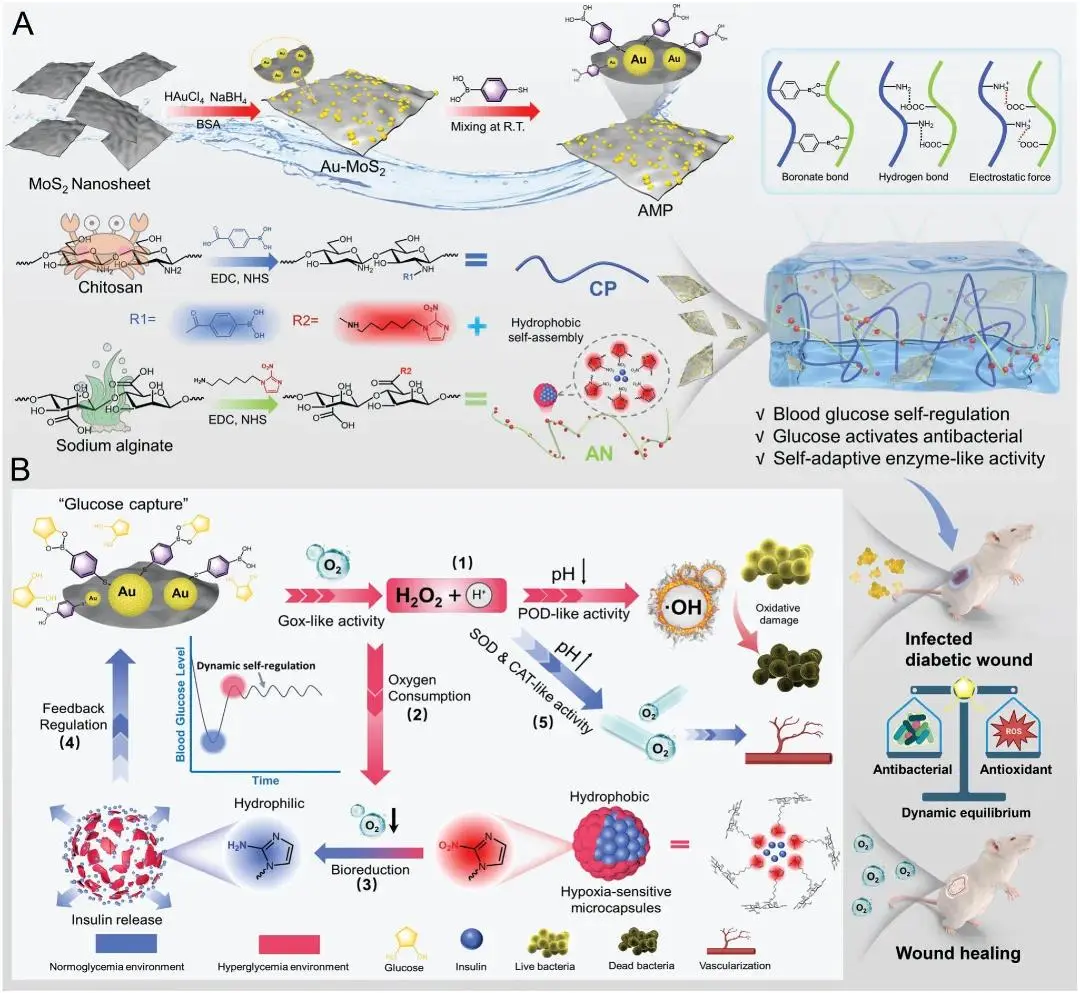
图1 葡萄糖激活型编程水凝胶促进感染性糖尿病创面愈合
(1)可编程水凝胶CPAN-AMP的制备与表征
图像结果显示,金纳米颗粒分布在二硫化钼纳米片的表面(图2A),元素分布的结果证实了Au和B元素的存在。金纳米粒子包覆后,纳米粒子的电位从-29.8 mV降至-0.7 mV,经4-巯基苯硼酸修饰后进一步降至-32 mV(图2B)。封装胰岛素后的纳米胶囊粒径增大约189 nm(图2C)。进一步评估了纳米胶囊在常氧与缺氧下紫外-可见吸收峰的变化(图2D)。随着氧含量降低,NI在325 nm处的吸收峰显著减弱,同时在260 nm处出现对应2-氨基咪唑的新特征峰。傅里叶变换红外光谱(FT-IR)证实了甲苯在1647 cm⁻¹处的特征峰(图2E)。通过SEM图像观察到水凝胶的孔隙结构(图2F)。随着AMP浓度增加(图2G),水凝胶的储能模量(G′)从0.53 kPa分别升至约0.85、1.15和2.14 kPa,证实AMP参与了水凝胶模量的调控。随后,也证实该水凝胶在剪切频率增加时粘度迅速降低,从而能够通过窄腔装置有效输送至深部病灶(图2H)。在交替施加高低应变条件下,水凝胶能在短时间内恢复结构稳定性,仅出现轻微模量损失。经历三次自愈合过程后,其模量损失值仍保持在初始值的90%以上(图2I)。水凝胶的宏观自愈行为表明:切割后的水凝胶经拼接可恢复完整形态,且愈合界面呈现熔融状(图2J,L)。此外,该水凝胶可在葡萄糖环境中300秒内发生快速结构破坏,证实其作为刺激响应型释放载体的潜在优势(图2M)。

图2 水凝胶的制备与表征。A)AMP纳米酶的透射电子显微镜图像及元素分布图。B)纳米酶的电位变化。C)AN与AN-I的动态光散射图。D)缺氧与有氧条件下孵育的AN紫外-可见光谱。E)CP、AN、CPAN水凝胶及AMP纳米酶的FT-IR光谱。F)水凝胶的SEM图像与宏观展示。G)CPAN-AMP的储能模量(G′)与损耗模量(G″)流变学分析。H)CPAN-AMP剪切变稀测试。I)CPAN-AMP的自愈合特性。J)水凝胶自愈合演示。K)水凝胶皮肤粘附性演示。L)水凝胶自愈合机制示意图。M)葡萄糖激活的水凝胶凝胶-溶胶转变
(2)酶样催化活性的评估
糖尿病伤口微环境复杂且易受细菌感染,在细菌感染阶段提高ROS水平对抗菌治疗至关重要。在伤口愈合阶段降低ROS水平,从而缓解氧化应激(图3A)。监测CPAN-AMP在模拟高血糖环境中降低pH值的能力,AMP的比例与pH值下降呈正相关(图3B)。通过模拟正常血糖环境进一步评估了O2生成能力(释放后的最大氧含量可达约19.6 mg L-1,释放速率可在30秒内达到10 mg L-1(图3C)。随后评估了CPAN-AMP的Gox样活性,以验证其通过氧化葡萄糖产生H₂O₂的能力(图3E)。随着葡萄糖浓度的升高,氧化TMB在650 nm处的吸收峰显著增强,证实CPAN-AMP能通过调节葡萄糖浓度来调控活性。图3F表明CPAN-AMP通过CAT样活性产生H₂O₂,进而参与了POD样活性的催化反应。如图3L所示,在常氧环境下,CPAN-AMP0经40 min释放的胰岛素峰值仅为6.15 μgmL-1,经N2脱氧处理后,释放量迅速升至常氧环境的约15倍。CPAN-AMP0的胰岛素释放量随葡萄糖浓度升高而微增(图3M),在400 mg dL-1葡萄糖溶液中,CPAN-AMP4经6 h释放后,胰岛素释放量约为100 mg dL-1溶液的2.7倍,证实CPAN-AMP4通过催化葡萄糖分解加速环境氧消耗,可实现胰岛素的活性释放。
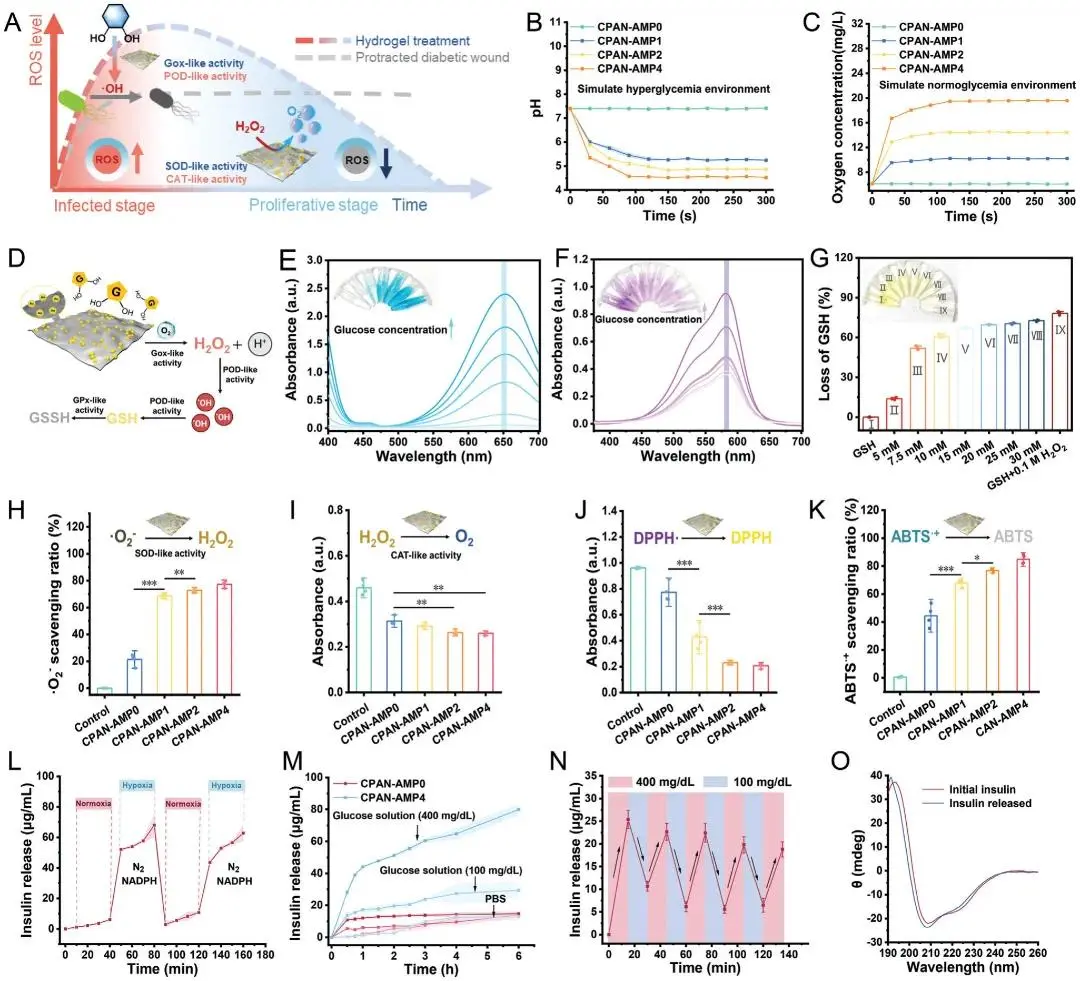
图3 水凝胶的酶样活性与智能胰岛素释放。A)水凝胶自切换纳米酶活性的示意图。B)水凝胶在模拟高血糖环境中的pH调节能力。C)水凝胶在模拟正常血糖环境下的氧释放能力。D)水凝胶级联酶活性示意图。E)模拟高血糖环境下水凝胶的Gox样活性。F)POD样活性。G)Gox样活性。H)SOD样活性。I)CAT样活性。J)DPPH清除能力。K)ABTS+清除能力。L)正常氧浓度与缺氧切换条件下水凝胶的胰岛素释放行为。M)磷酸盐缓冲盐水(PBS)、正常血糖及高血糖条件下水凝胶的胰岛素释放性能。N)模拟正常血糖与高血糖条件下水凝胶的脉冲式胰岛素释放。O)胰岛素的圆二色谱
(3)葡萄糖激活的CPAN-AMP抗菌评估
该水凝胶在模拟高血糖环境下对耐甲氧西林金黄色葡萄球菌(MRSA)和大肠杆菌的抗菌功效(图4A-C),CPAN-AMP0展现出一定程度的固有抗菌性,表明壳聚糖保留了具有抗菌特性的氨基基团。掺杂AMP后,与CPAN-AMP0相比,CPAN-AMP1对大肠杆菌和MRSA的抗菌率为72.5%和55.5%。当水凝胶中AMP比例进一步增加至CPAN-AMP4时,对两种细菌的抑制率均达98%和97.5%,基本实现细菌完全清除。如图4D所示,生理盐水中的细菌均呈现完整光滑的表面形态,经CPAN-AMP0处理的细菌表面出现轻微塌陷和收缩,经CPAN-AMP4处理的MRSA菌株产生明显细胞碎片。结果证实CPAN-AMP通过破坏细胞膜机制发挥抗菌活性。通过DCFH-DA染色评估了细菌的氧化损伤(图4F、H)。CPAN-AMP0组与生理盐水组的ROS荧光强度无显著差异。通过MRSA细菌生物膜进一步评估水凝胶的生物膜破坏效能(图4G,I)。不出所料,CPAN-AMP4展现最显著的深层渗透效果,表明其具有最强生物膜破坏能力。如图4J所示,初始状态下MRSA和大肠杆菌的电位分别为约-16.4 mV和-19.2 mV。经CPAN-AMP处理后,细菌表面电位均呈现不同程度上升。其中CPAN-AMP4处理变化尤为显著,其电位分别升至-1.7 mV和-7.9 mV。上述结果证实CPAN-AMP能有效破坏细菌膜电位稳态平衡。综上所述,CPAN-AMP在高血糖环境下具有葡萄糖激活的杀菌活性,这对糖尿病创面的选择性抗菌治疗具有重要意义。
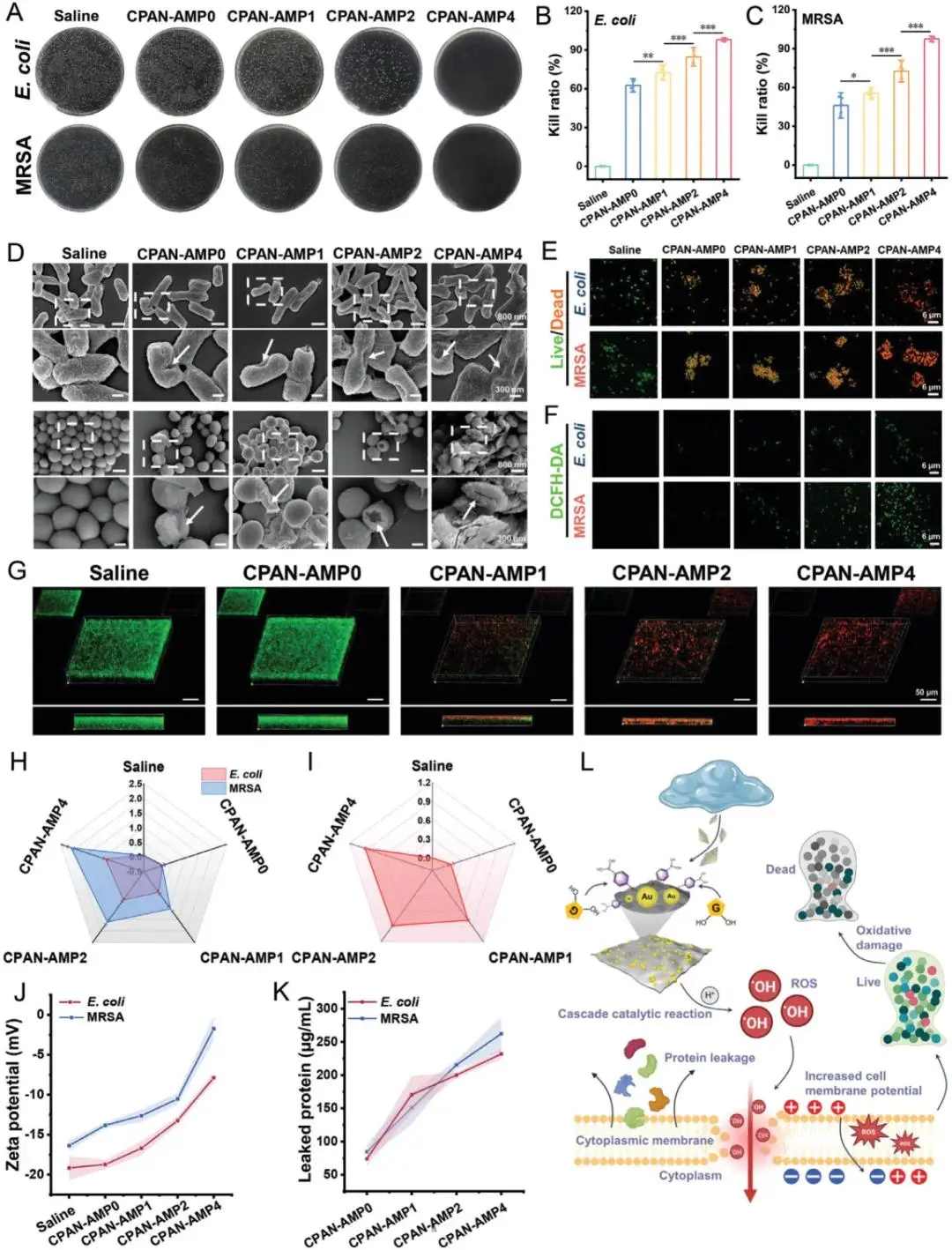
图4 水凝胶的葡萄糖激活抗菌能力。A)不同处理后大肠杆菌和MRSA残留菌落图像。B)水凝胶对大肠杆菌的抗菌率。C)水凝胶对MRSA的抗菌率。D)大肠杆菌和MRSA的扫描电子显微镜图像。E)大肠杆菌和MRSA的活/死染色图像。F)大肠杆菌与MRSA细胞内活性氧染色。G)MRSA生物膜共聚焦显微镜图像。H)大肠杆菌与MRSA活性氧荧光统计。I)水凝胶清除MRSA生物膜的效率。J)抗菌处理后大肠杆菌与MRSA的静电势。K)大肠杆菌与MRSA蛋白渗出量。L)抗菌机制示意图
(4)细胞相容性与生物活性的评估
如图5B、F所示,细胞经H₂O₂处理以诱导氧化应激。明显可见,对照组产生大量ROS的绿色荧光,而CPAN-AMP处理组的荧光强度则不同程度减弱。荧光统计显示,添加AMP使水凝胶显著降低细胞内ROS荧光强度。同时探究了CPAN-AMP在正常血糖条件下通过产氧缓解细胞缺氧状态的能力(图5C,G),PBS组与CPAN-AMP0组呈现大量缺氧信号。向水凝胶中引入1 mg mL-1的AMP浓度,已足以显著增强产氧效果。随着AMP比例增加,缺氧信号逐渐减弱。综上所述,生理环境中的CPAN-AMP具有良好抗氧化活性,能清除周围环境中的H₂O₂,防止细胞氧化应激,并主动供氧加速缓解缺氧状态。如图5H、I所示,经12 h处理后,TCP组的细胞迁移表现与CPAN-AMP0组相当。接下来,进一步验证了CPAN-AMP促进HUVECs增殖的能力(图5K,J)。在葡萄糖诱导激活氧释放后,经CPAN-AMP4处理的细胞通透性显著增强,且明显优于其他水凝胶组和TCP组。基于HUVECs的迁移性能,评估其血管生成潜力(图5L),仅在TCP组形成少量管状结构。相比之下,含AMP的水凝胶更显著地促进了管状结构的形成。随着AMP浓度从1 mg mL-1增加至4 mg mL-1,细胞管状结构愈加完善,管状分支数量与长度均进一步增加。综上所述,CPAN-AMP具有促进细胞增殖、迁移和血管生成的良好生物活性,使其在糖尿病创面愈合领域具有巨大应用潜力。
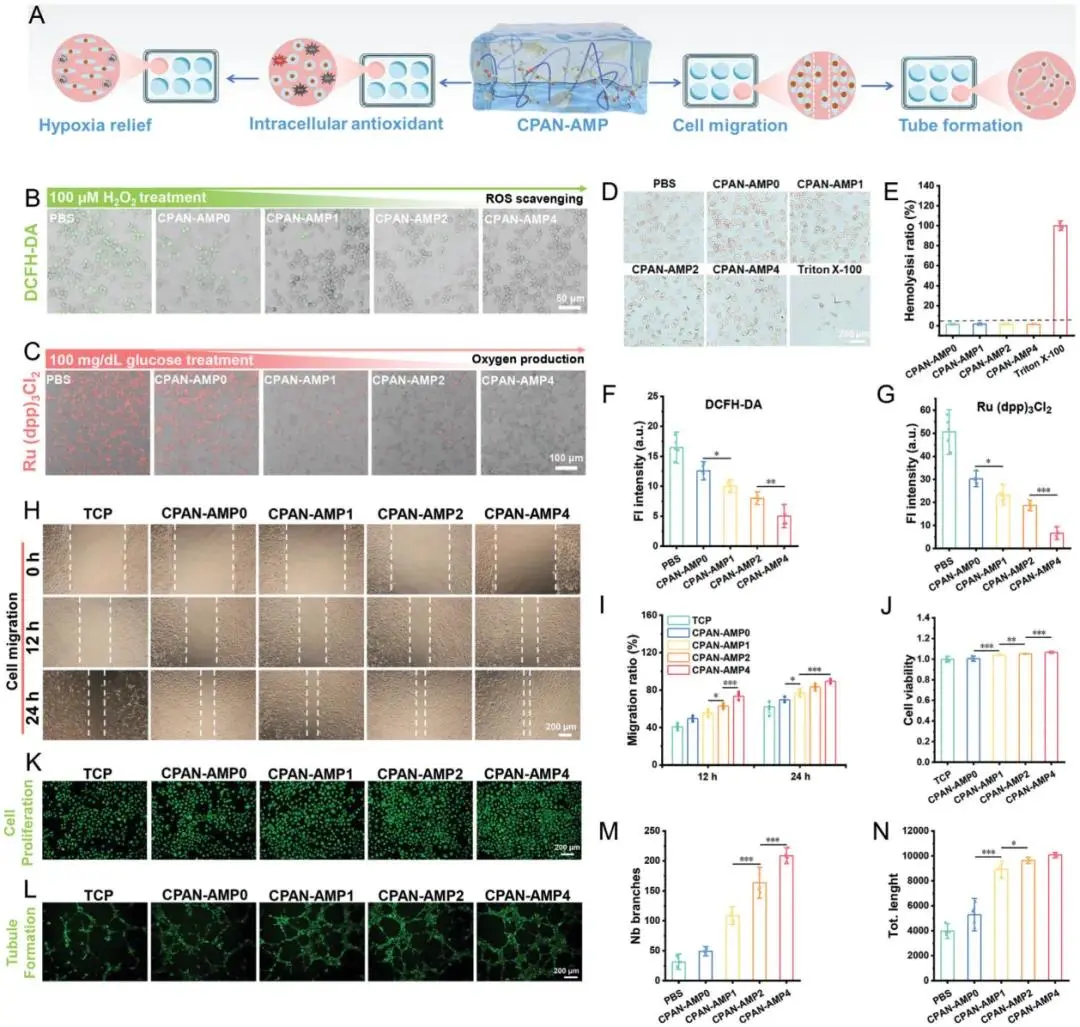
图5 水凝胶的生物相容性与生物活性。A)CPAN-AMP生物活性的示意图。B)DCFH-DA染色后的细胞内(ROS)图像。C)通过氧探针验证的细胞内氧生成检测。D)红细胞的光学显微镜图像。E)水凝胶溶血率。F)细胞内ROS荧光统计。G)细胞内O₂生成统计。H)经水凝胶处理的HUVECs划痕显微镜图像。I)HUVECs迁移率统计分析。J)HUVECs增殖率统计分析。K)HUVECs细胞增殖染色图像。L)管状结构形成图像。M)管状结构分支数量分析。N)管状结构长度分析
(5)感染性糖尿病创面愈合效果评估
首先,使用链脲佐菌素(STZ)诱导小鼠糖尿病,并在其背部建立皮肤缺损并感染MRSA。实验组包括不含胰岛素的水凝胶(CPAN-AMP0、CPAN-AMP4)和含胰岛素的水凝胶(CPAN-AMP0-I、CPAN-AMP4-I),并与市售Tegaderm敷料对照。如图6B所示,在伤口愈合3天后,所有组别均出现不同程度的感染,CPAN-AMP4和CPAN-AMP4-I组的感染程度最轻。伤口闭合率统计显示,CPAN-AMP4-I组的愈合效果最佳(图6C、E)。随后评估了不同处理方式下机体血糖变化:CPAN-AMP4-I设为第1组,CPAN-AMP0-I设为第2组,Tegaderm薄膜设为第3组。第1组血糖在1小时内降至正常水平(图6G),并持续维持达11小时。此外,实验期间未观察到任何小鼠出现低血糖症状。这些发现表明CPAN-AMP4-I能通过快速酶联催化反应产生缺氧环境,促进胰岛素释放,从而实现血糖调控。通过HE染色和Masson染色(图6I-M)愈合3天后,Tegaderm薄膜组、CPAN-AMP0组及CPAN-AMP0-I组创面均可见大量炎症细胞,这归因于细菌感染及氧化应激作用。相反,CPAN-AMP4组炎症程度减轻,CPAN-AMP4-I组炎症细胞浸润程度最低,原因是高血糖环境抗菌活性的激活以及胰岛素的释放抑制了炎症因子。通过分析该阶段胶原沉积水平,观察到CPAN-AMP4组与CPAN-AMP4-I组的胶原沉积更加厚实致密,其中CPAN-AMP4-I组的胶原纤维排列更紧密。愈合21天后,各组基本完成创面闭合。相较于Tegaderm薄膜组,水凝胶治疗组的真皮间隙更短,表明皮肤重塑程度有所提升。基于上述实验结果,我们证实CPAN-AMP4-I通过促进糖尿病创面上皮化、胶原沉积及再生组织重塑,从而加速糖尿病创面愈合。

图6 水凝胶的生物相容性与生物活性。A)CPAN-AMP生物活性的示意图。B)DCFH-DA染色后的细胞内ROS图像。C)通过氧探针验证的细胞内氧生成检测。D)红细胞的光学显微镜图像。E)水凝胶溶血率。F)细胞内ROS荧光统计。G)细胞内O₂生成统计。H)经水凝胶处理的HUVECs划痕显微镜图像。I)HUVECs迁移率统计分析。J)HUVECs增殖率统计分析。K)HUVECs细胞增殖染色图像。L)管状结构形成图像。M)管状结构分支数量分析。N)管状结构长度分析
(6)促进感染性糖尿病创面愈合的机制
伤口愈合3天后,CPAN-AMP4和CPAN-AMP4-I显著降低了HIF-1α水平(图7A、C),显示出它们在缓解组织缺氧方面的显著效果。研究通过二氢乙醌(DHE)染色评估了伤口内ROS水平。结果显示,Tegaderm薄膜组ROS信号明显较强,而CPAN-AMP4组的ROS水平显著低于CPAN-AMP0-I组,表明AMP纳米酶在抗氧化中起到了关键作用(图7A、D)。接下来,研究还评估了创面愈合的早期炎症反应,特别是治疗3天后的IL-6水平。CPAN-AMP4与CPAN-AMP4-I两组均出现IL-6荧光信号显著下降(图7A、E),其中CPAN-AMP4-I组炎症浸润程度明显更低,证实CPAN-AMP4-I能有效缓解氧化应激并降低炎症细胞因子的表达水平。为探索CPAN-AMP是否能够调节巨噬细胞极化并缓解炎症,结果显示,水凝胶治疗能有效促进M1巨噬细胞向M2表型转化,CPAN-AMP4-I组的M1/M2比值最低,表明其在调控巨噬细胞向抗炎表型分化方面表现优异(图7B、F-H)。此外,CPAN-AMP4组和CPAN-AMP4-I组都能显著促进VEGF的表达(图7B、I),支持其对新生血管生成的促进作用。Tegaderm薄膜组和CPAN-AMP0组的Ki67表达较弱,而CPAN-AMP0-I组通过胰岛素的作用促进了上皮细胞和成纤维细胞的增殖(图7B,J)。相比之下,CPAN-AMP4组的Ki67表达显著上调,表明纳米酶的类酶活性在抗氧化和产氧作用下促进了细胞迁移。CPAN-AMP4-I组在促进Ki67表达方面表现出最佳稳定性。总体来看,该水凝胶通过调控巨噬细胞极化、缓解缺氧、促进细胞增殖、加速上皮化过程、提升胶原沉积和血管生成,显著改善糖尿病伤口的修复效果。
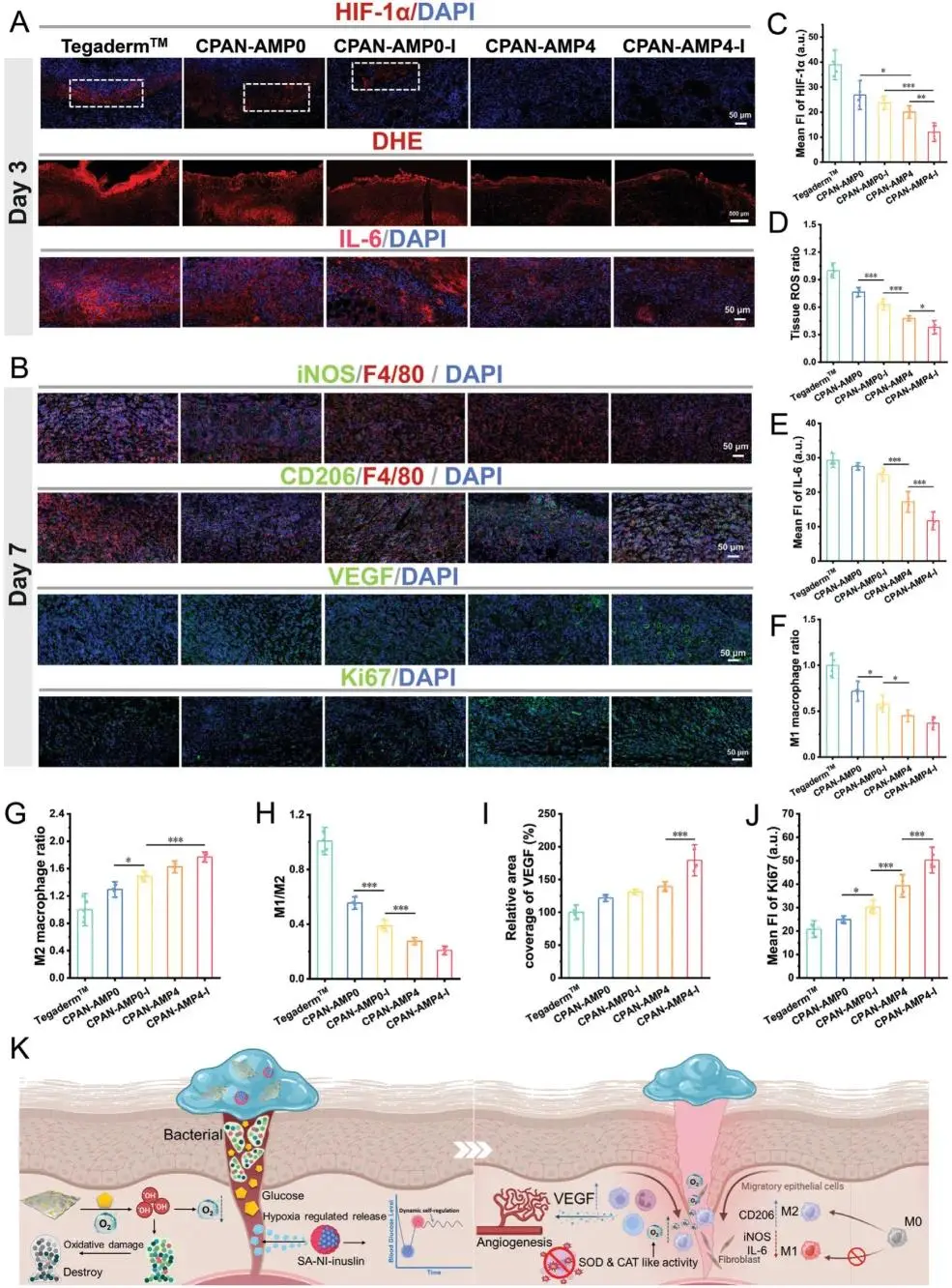
图7 感染性糖尿病创面愈合机制评估。A)创面愈合3天后HIF-1α、DHE及IL-6染色图像。B)创面愈合7天后iNOs、CD206、VEGF及Ki67染色图像。C)HIF-1α荧光强度。D)组织ROS水平。E)IL-6荧光强度。F)M1型巨噬细胞比例。G)M2型巨噬细胞比例。H)M1/M2比值。I)VEGF荧光强度。J)Ki67荧光强度的定量统计分析。K)机制示意图
该研究团队开发了一种具有葡萄糖激活自切换酶样活性的编程水凝胶,以实现动态反馈血糖调节和糖尿病感染性创面愈合各阶段的自适应治疗。该编程水凝胶通过组装源自生物体的天然改性聚合物与复合纳米酶制备而成,可结合多种酶样活性。该水凝胶通过识别高血糖环境激活抗菌活性,并进一步调控胰岛素响应释放。在正常血糖阶段,水凝胶作为产氧体释放大量氧气,抑制缺氧敏感微胶囊开启,维持血糖相对平衡并促进组织缺氧缓解。体内实验结果表明,该水凝胶通过改善糖尿病创面不良愈合微环境,显著加速细胞增殖、迁移及血管生成。因此,本研究提出一种智能水凝胶设计策略,可实现糖尿病创面全阶段自适应治疗,有望成为改善糖尿病患者感染性创面愈合的新型治疗方案。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

