
免疫疗法虽已成为实体瘤治疗的重要手段,但在三阴性乳腺癌(TNBC)等“冷肿瘤”中疗效受限,主因是肿瘤微环境(TME)高度免疫抑制,其中占主导的 M2 型肿瘤相关巨噬细胞(TAM)通过抑制 CD8⁺ T 细胞功能、促进转移等方式加剧病情;现有 TAM 重编程策略面临药物瘤内富集差、脱靶毒性大、免疫网络复杂及巨噬细胞过度耗竭易复发等瓶颈,亟需精准、安全、可时空控制的新型调控手段。

针对上述问题,东南大学附属中大医院居胜红教授团队构建了一种 ROS 响应型纳米胶束 IR825@HRG用于共递送光敏剂 IR825 与 TAM 重编程蛋白 HRG;其经静脉注射后可在肿瘤部位富集,经 808 nm 激光触发,IR825 同步产生光热/光动力效应诱导肿瘤细胞免疫原性死亡并释放 DAMPs,激活树突状细胞与 CD8⁺ T 细胞,而激光产生的 ROS 就地解离 TK 键释放 HRG,将 M2-TAM 极化为 M1 表型,把免疫抑制性 TME 转为免疫活跃状态,实现原位瘤高效消融、远端转移抑制及长期免疫记忆,为“冷肿瘤”提供一种可精准时空控制的光-免疫协同治疗新范式。该文章于2025年10月10日以《Spatiotemporally Controlled Nanomicelles for Synergistic Phototherapy and Immune Reprogramming in Triple-Negative Breast Cancer》为题发表于《ACS Nano》上(DOI: 10.1021/acsnano.5c09413)。
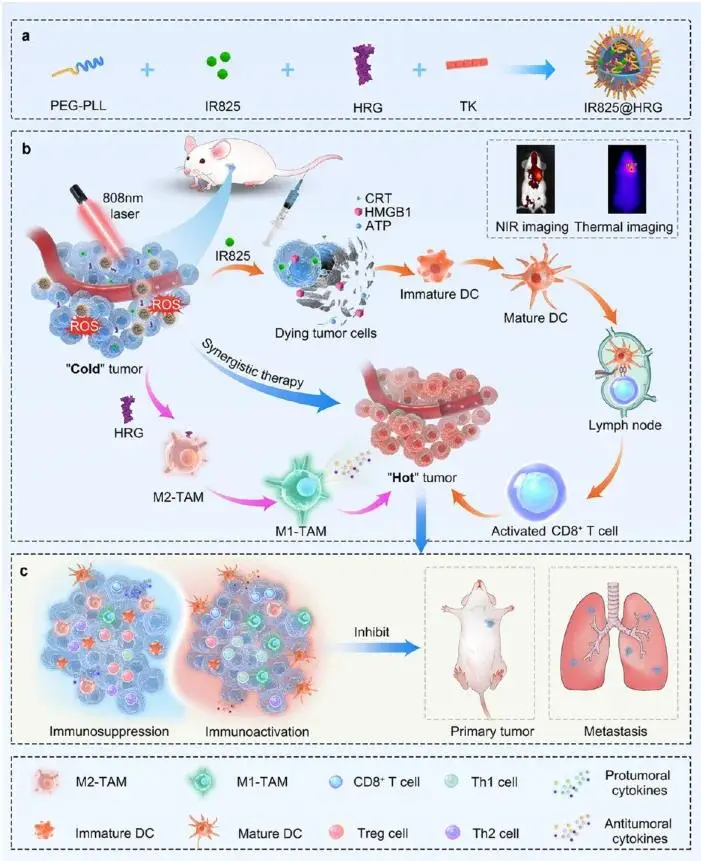
研究示意图
(1)通过scRNA-Seq和数据库的TNBC的免疫景观和预后意义
TNBC单细胞测序(图1a)显示肿瘤内免疫细胞总体增多,但构成失衡:巨噬细胞显著富集,树突细胞与T细胞相对缺如(图1b)。TCGA-BRCA队列K-means将TNBC按免疫浸润分为高、中、低三组,对应免疫细胞丰度热图见图1c。CIBERSORT显示TNBC组织内M2型TAMs为优势亚群(图1d)。Kaplan–Meier分析表明M2/M1比值高者总生存显著缩短(图1e),且M2-TAMs比例升高与CD8+T细胞呈负相关(图1f、1g)。免疫荧光进一步证实,随病理分期升高,M1/M2比值下降(图1h、1i)。
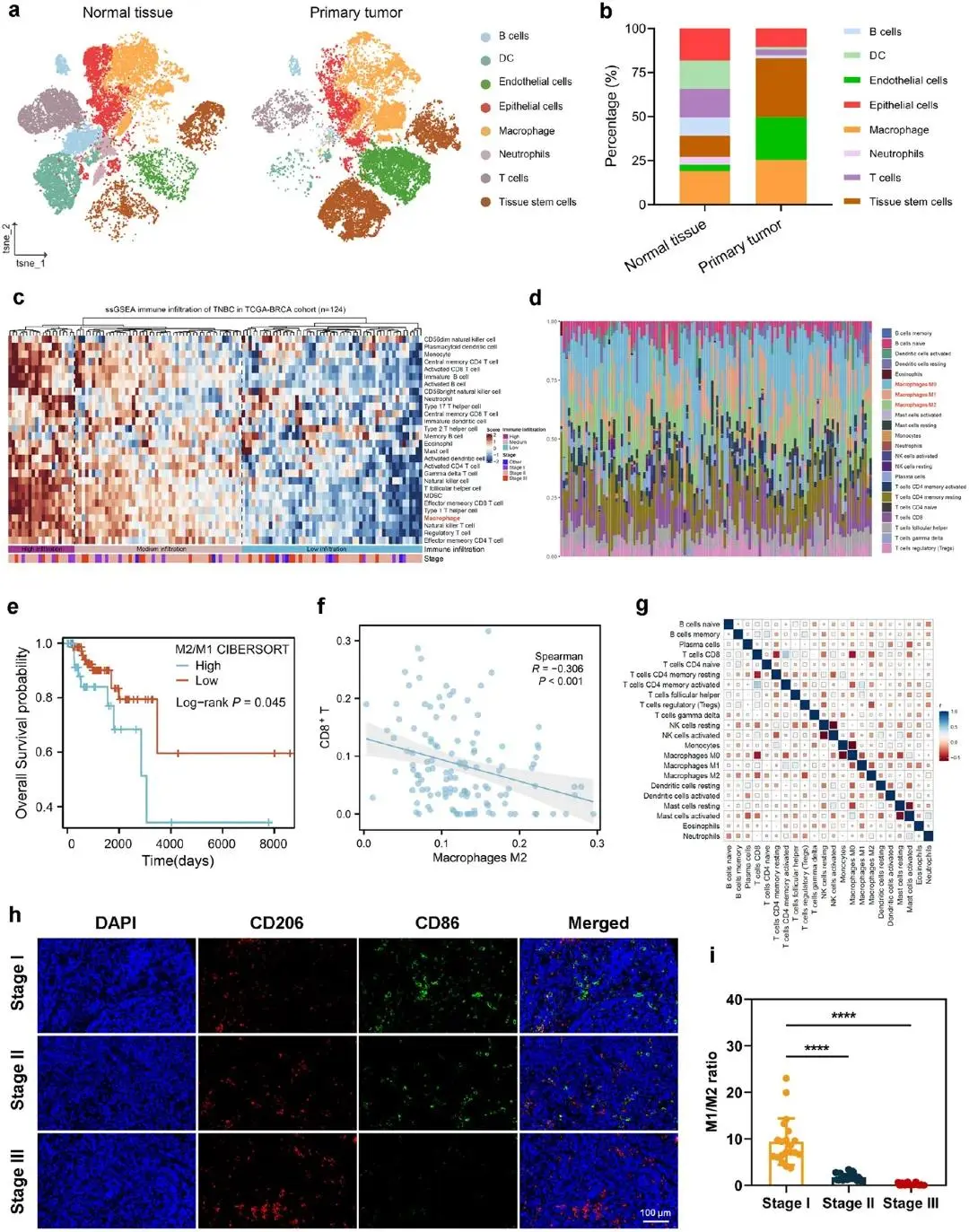
图1.基于scRNA-Seq和数据库的TNBC的免疫景观和预后意义。(a) TNBC患者新鲜组织的scRNA-seq。(b)通过scRNA-seq数据富集肿瘤组织中的免疫细胞。(c)热图描绘了TCGA-BRCA队列中高、中、低浸润样本中检测到的免疫细胞类型的平均标准化丰度。(d)使用CIBERSORT算法的TCGA-BRCA队列样本中免疫细胞比例的热图。(e)原发肿瘤中根据M2/M1比值的总生存率Kaplan - Meier曲线。(f)Pearson相关检验CD8+T细胞与M2- tam的相关性。(g)原发肿瘤中鉴定的免疫细胞的一致性。(h) I ~ III期TNBC患者(n = 20) M2- tam(CD206)和M1- tam (CD86)免疫荧光染色;(I) TNBC患者各期M1/M2比值的定量统计
(2)IR825@HRG的制备和表征
图2a~b 的TEM显示IR825@HRG纳米胶束呈均匀球形,粒径98.7 ± 21.1 nm(图2a、2b);ζ电位−18.09 mV,其在DMEM培养基中14天粒径稳定性良好(图2c、2d)。IR825@HRG纳米胶束中IR825的包封率为93.6 %、载药量15.03 %,HRG对应90.71 %、31.67 %。在808 nm激光(1 W cm⁻²)下,200 μg mL⁻¹ IR825@HRG 2 min升温42.3 °C,PBS仅4.8 °C(图2e);ΔT随功率增强而升高(图2f)。红外热成像显示相同IR825浓度(10 μg mL⁻¹)照射5 min后,IR825@HRG组升温显著高于游离IR825与PBS(图2g),且4次开/关循环温度曲线重合(图2h)。DPBF探针显示ROS生成呈浓度与时间依赖性(图2i~j)。4T1荷瘤小鼠24 h CLSM:IR825@HRG组肿瘤HRG荧光为游离HRG的3.2倍(图2k~l)。
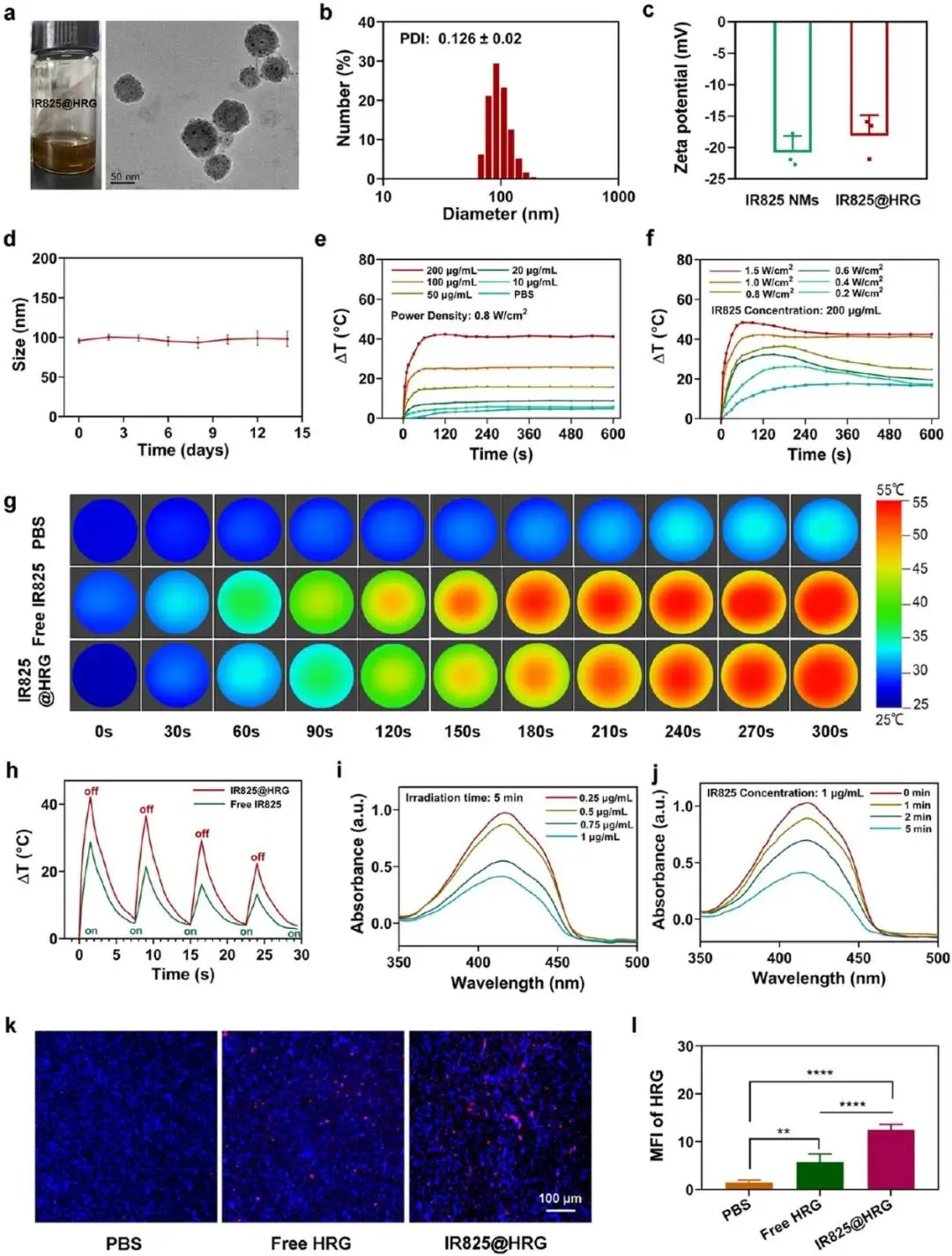
图2.IR825@HRG NMs的形态与表征。(a) IR825@HRG的TEM图像。(b) IR825@HRG的粒径分布。(c) IR825@HRG的Zeta电位。(d) IR825@HRG在DMEM中的长期稳定性。(e)不同IR825浓度和(f)不同功率密度辐照下IR825@ HRG的温度变化曲线。(g) PBS、游离IR825、IR825@HRG溶液辐照后的红外热像图,(h) IR825@HRG、游离IR825溶液经过4次光热加热后的温度变化曲线。(i)不同IR825浓度下808 nm激光照射DPBF与IR825@HRG的吸收光谱;(j)不同照射时间下808 nm激光照射DPBF与IR825@HRG的吸收光谱。(k)注射IR825@HRG后24 h HRG在TNBC肿瘤组织中的积累,(l) alexa647标记的HRG在肿瘤部位积累的荧光强度
(3)体外抗肿瘤疗效和ICD诱导
4T1细胞实验显示,IR825@HRG纳米胶束的胞内荧光强度显著高于游离IR825与PBS组,提示其摄取效率提升(图3a、3b);图3c~d显示无激光照射时细胞存活率>90%,而808 nm激光(1 W cm⁻²)照射后存活率随IR825浓度(10–200 μg mL⁻¹)递减至约30%,Calcein-AM/PI共染呈现红色荧光(死细胞)占主导且随激光功率增强而增加。ROS探针DCFH-DA显示IR825@HRG+L组绿色荧光强度约为PBS的6倍,且随功率递增(图3e、3f)。ICDM指标同步升高:ATP分泌量达2.8 nmol/10⁶细胞,为PBS的3.5倍(图3g);HMGB1核外泄率>80%,胞外浓度升高2.9倍(图3h~i);CRT转位阳性率约75%,显著高于对照(图3j~k),表明激光激活的IR825@HRG可高效产生活性氧并诱导强烈免疫原性细胞死亡。
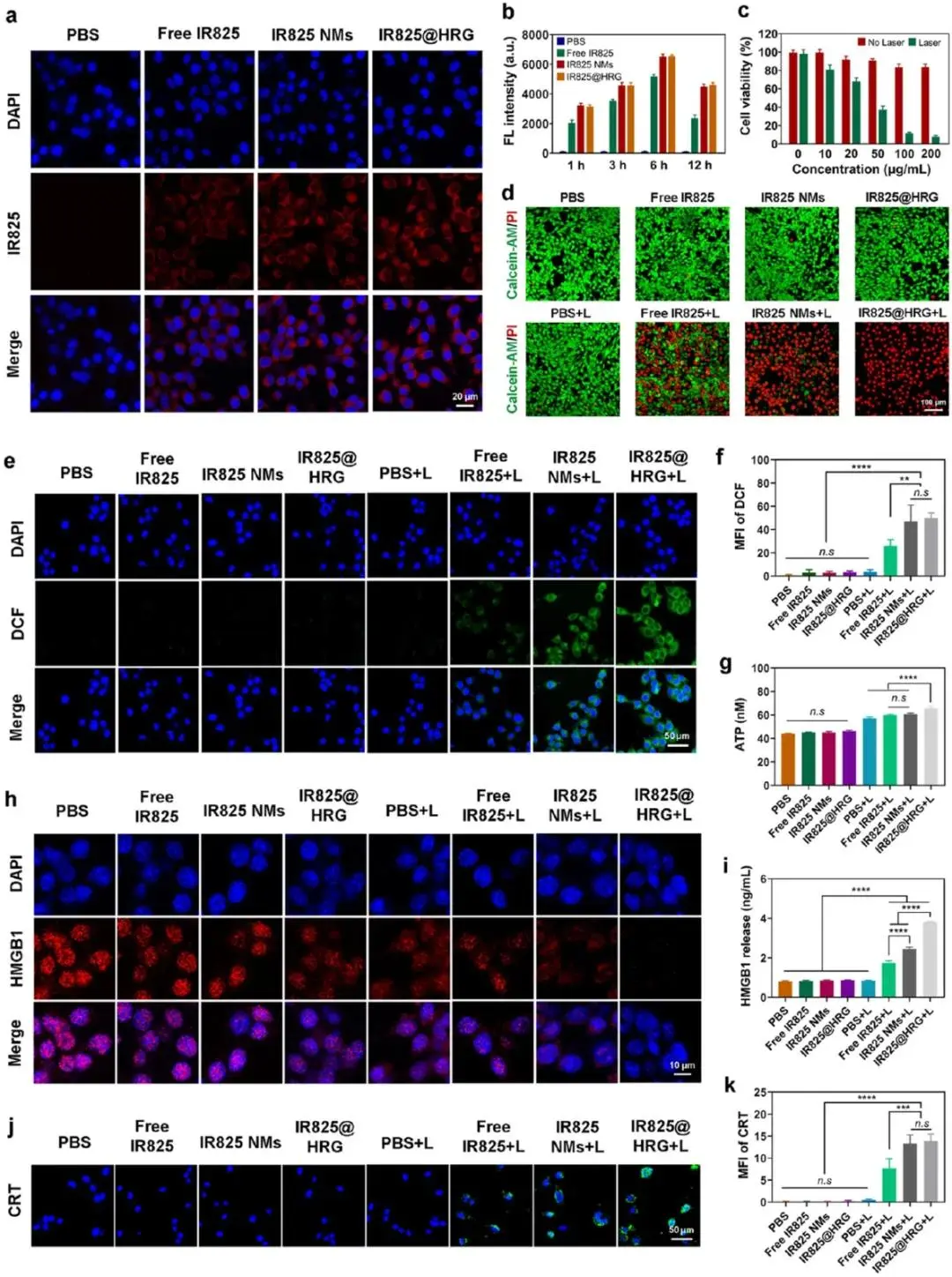
图3.体外抗肿瘤疗效及ICD效果。(a) 4T1细胞与PBS、自由IR825、IR825 NMs和IR825@HRG NMs孵育6 h的CLSM图像。(b)不同时间点的荧光强度。 (c) 4T1细胞在不同浓度IR825@HRG和激光照射下的细胞活力。(d) 4T1细胞AM和PI活/死染色的CLSM图像。(e)不同处理后4T1细胞DCF强度的CLSM图像和(f)不同处理下的荧光强度。(g)不同处理后4T1细胞内ATP的分泌情况。(h) 4T1细胞内HMGB1红色荧光的CLSM图像和(i)不同处理后细胞外HMGB1的分泌情况。(j) 4T1细胞CRT绿色荧光的CLSM图像。(k)不同处理后的荧光强度
(4)体外抗肿瘤巨噬细胞复极化
图4a显示IL-4刺激48 h后,RAW264.7巨噬细胞呈现典型M2极化形态并高表达CD206(阳性率85.4 %),同时CD86维持基线水平(阳性率9.8 %),确认M2模型建立成功。随后给予不同制剂处理并辅以808 nm激光(1 W cm⁻²,5 min),图4b~c流式细胞术显示IR825@HRG+L组CD86阳性率大幅升至68.2 ± 3.1 %,CD206阳性率降至18.4 ± 2.3 %,对应的M1/M2比值达3.7 ± 0.3,显著高于PBS组(0.12 ± 0.02)、游离HRG组(0.31 ± 0.05)、IR825@HRG无激光组(0.29 ± 0.04)以及IR825+L组(0.68 ± 0.08),差异均具有统计学意义。细胞上清ELISA检测进一步验证功能转换:抗炎因子IL-10浓度由145 ± 9 pg mL⁻¹降至42 ± 5 pg mL⁻¹,促炎因子IL-12浓度由28 ± 4 pg mL⁻¹升至96 ± 7 pg mL⁻¹,变化幅度均优于其余各对照组(图4d、4e)。
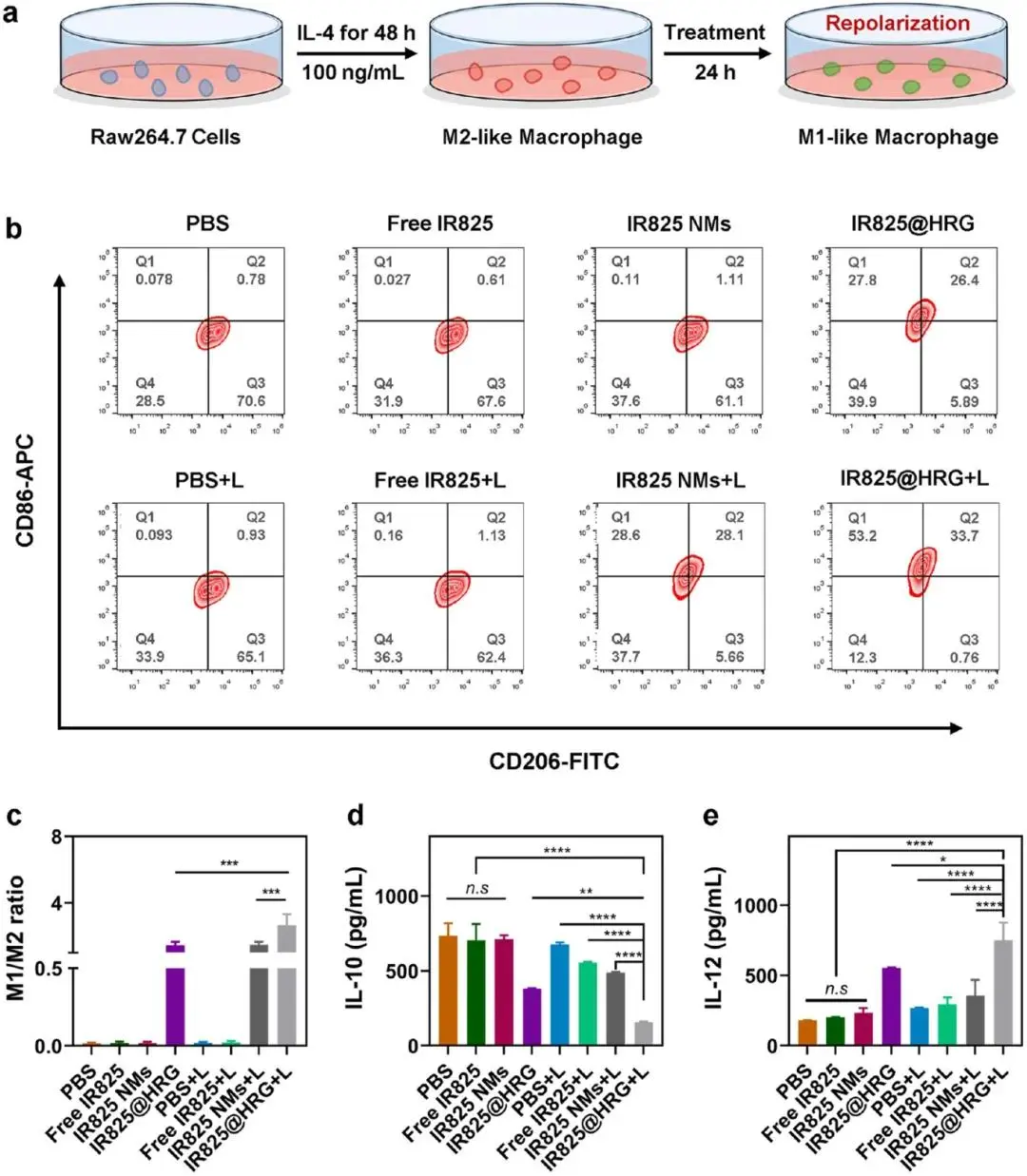
图4.体外抗肿瘤巨噬细胞再极化。(a)不同处理后巨噬细胞复极化示意图。(b)流式细胞术分析不同处理后M2样巨噬细胞(CD206)和M1样巨噬细胞(CD86)的比例和(c) M1/M2比值 (d) ELISA分析不同处理后抗炎IL-10和(e) IL-12
(5)对4T1原发性肿瘤的抗肿瘤作用
图5a~b显示静脉注射后,IR825@HRG组肿瘤荧光强度于24 h达峰值,显著高于PBS、游离IR825及IR825 NMs组,图5c~d的离体成像显示肿瘤蓄积量提高约3.2倍;图5e的时间-荧光曲线明确确定24 h为最佳照射窗口。按图5f显示实验以“给药-24 h-照射-间隔2天”三轮方案执行:第0、3、6天尾静脉注射,每次给药后24 h进行808 nm激光(1 W cm⁻²,5 min)。首次照射5 min内IR825@HRG+L组肿瘤温度升至46.1 ± 0.9 °C,显著高于游离IR825+L组(38.4 ± 1.1 °C)与PBS组(<2 °C)(图5h~i);三轮治疗期间该组肿瘤体积由初始110 mm³降至45 mm³,终末抑制率92 %,优于IR825 NMs+L组(58 %)及游离IR825+HRG+L组(61 %)(图5g、5j~k);。TUNEL显示IR825@HRG+L组阳性面积占比68 ± 5 %(图5l)。
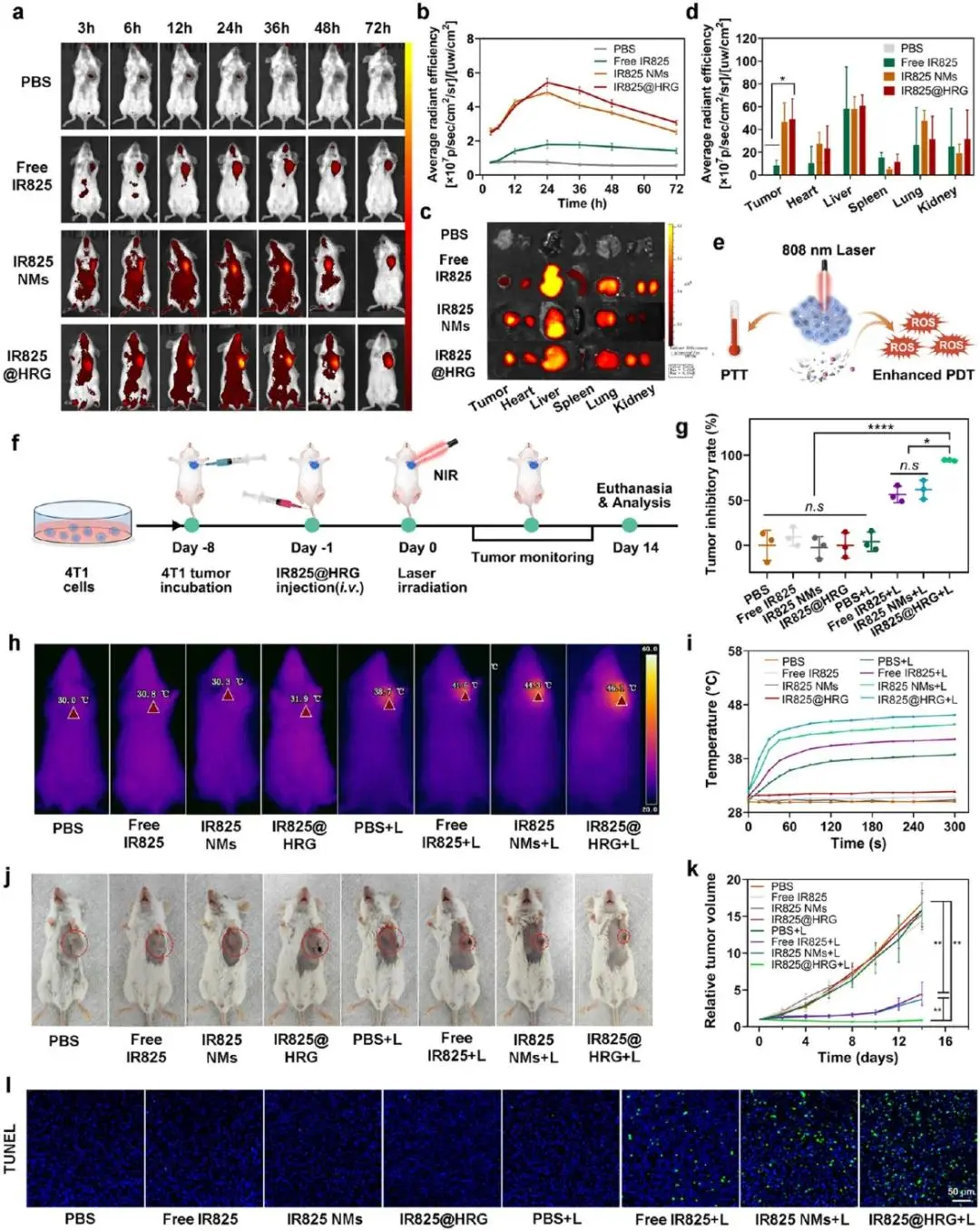
图5.对4T1原发肿瘤模型的抗肿瘤作用。(a)注射治疗在不同时间点的体内生物分布和(b)肿瘤的定量荧光信号强度。(c)注射后肿瘤和主要器官的离体荧光图像和(d)肿瘤和主要器官的定量荧光信号强度。(e)激光照射PTT和PDT的抗肿瘤作用。(f)评估4T1原发肿瘤模型抗肿瘤效果的治疗方案示意图。(g)各组小鼠肿瘤抑制率。(h) 4T1荷瘤小鼠体内热像图和(i)不同处理后肿瘤温度曲线。(j) 4T1荷瘤小鼠第14天的肿瘤生长情况,(k)肿瘤的相对体积。 (l)不同治疗后所有小鼠的TUNEL染色
(6)4T1荷瘤小鼠中免疫微环境的重塑
图6a示意图显示激光可触发ROS释放HRG,协同ICD将“冷”瘤微环境转为“热”状态,驱动M2→M1极化并激活后续免疫级联。IR825@HRG+L处理后,瘤内F4/80⁺细胞中CD206⁺M2比例由58 %降至18 %,CD86⁺M1由12 %升至51 %,M1/M2比值升至2.8(图6b–e);免疫荧光显示M2面积减少70 %,M1面积增加4.3倍(图6f~g)。细胞因子检测结果显示IL-10由145 pg mL⁻¹降至43 pg mL⁻¹(降幅70 %,图6h);IL-12、IL-6、TNF-α分别升高3.2、2.4、2.1倍(图6i)。图6j示意图显示检测范围涵盖肿瘤原发灶及引流淋巴结(TDLN);图6k–r流式结果显示肿瘤内CD11c⁺、DC中CD80⁺CD86⁺成熟比例由21 %升至64 %,TDLN中由19 %升至71 %(图6k–r)。瘤内CD8⁺CTL浸润率由4.7 %增至28 %(图6s),IHC计数每视野CD8⁺细胞由35个增至180个(图6t、u)。
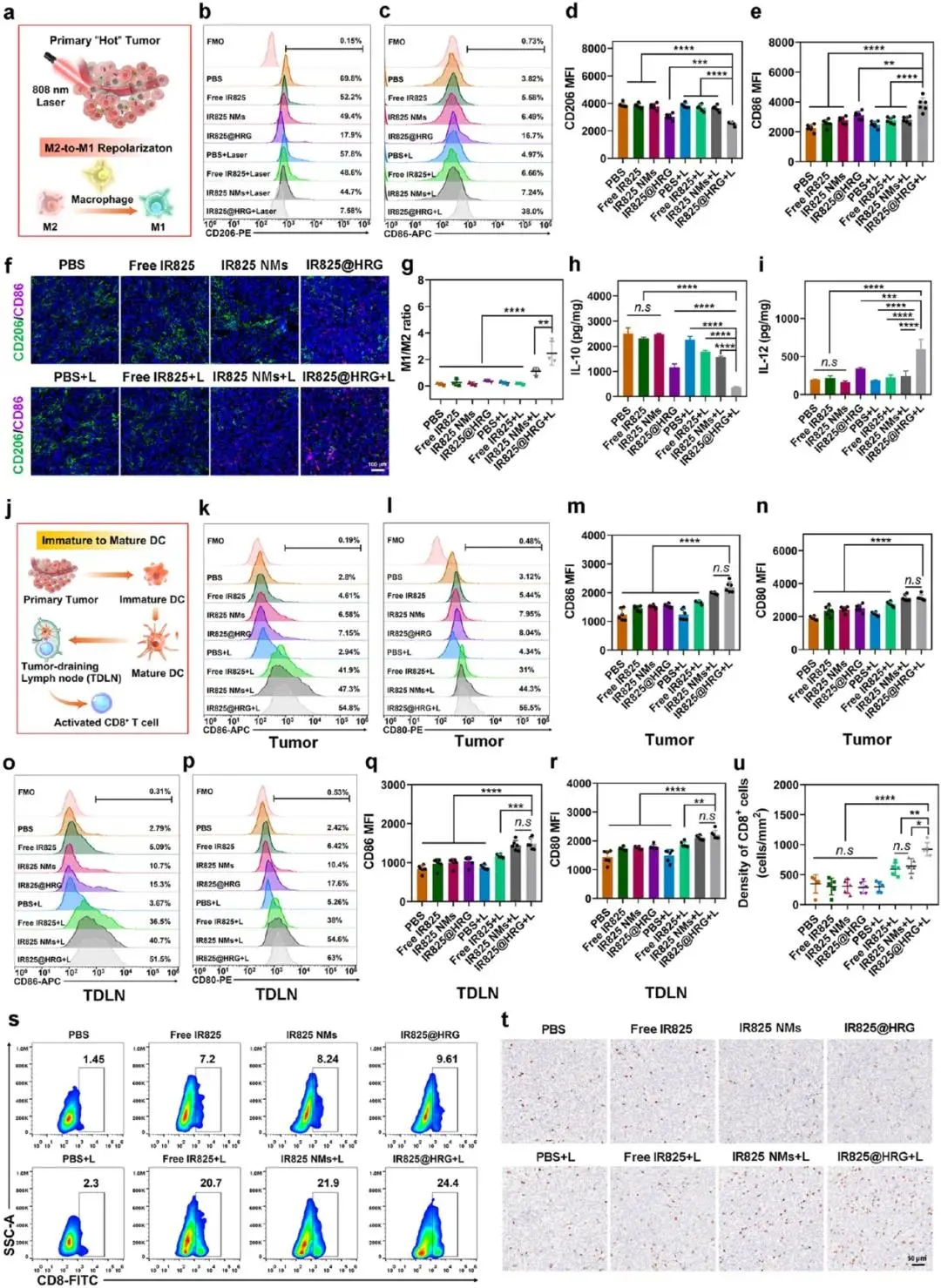
图6.4T1荷瘤小鼠免疫微环境的重塑。(a) TNBC模型中M2样到M1样巨噬细胞复极化的抗肿瘤免疫反应示意图。(b) M2样细胞(CD206阳性)和(c) M1样(CD86阳性)巨噬细胞。(d) 4T1肿瘤组织中CD206阳性细胞和(e) CD86阳性细胞表达的量化。(f)合并图像中CD206阳性细胞(绿色)、CD86阳性细胞(粉红色)和DAPI标记细胞核(蓝色)的免疫荧光图像 (g)Merge图像中M1/M2(CD86/CD206)比值的荧光强度。h)肿瘤组织中IL-10和(i) IL-12的量化。(j)原发肿瘤和TDLN抗原呈递DC成熟的抗肿瘤免疫反应示意图。(k) CD86和(l) DC成熟标志物CD80在原发肿瘤中的表达流式细胞术。(m)计算CD86阳性细胞和(n)CD80阳性细胞的表达。o)流式细胞术检测CD86和(p) CD80的表达,它们是TDLN中DC成熟的标志。(q) CD86阳性细胞和(r) CD80阳性细胞的计算表达量。(s)CD8+T细胞的流式细胞术(n = 6)。(t)CD8+T细胞的免疫组织化学图像和(u)CD8+T细胞的计算表达量
(7)在4T1远处肿瘤和肺转移模型中的抗转移功效
图7a为原发4T1模型的建立及给药示意图,具体为第0天接种原发瘤,第7、10、13天给药,第8、11、14天激光照射。图7b–d结果显示,IR825@HRG+L组第21天肺表面转移结节数降至3 ± 2个,仅占PBS组(18 ± 4个)的17%,且最大结节直径<0.5 mm;H&E量化转移灶面积占比5%,显著低于对照组25%。尾静脉Luc-4T1二次接种模型(图7e方案:第12天静注1×10⁵ Luc-4T1细胞)中,图7f~g第21天活体成像示IR825@HRG+L组肺区光子通量2.1×10⁶ p s⁻¹ cm⁻² sr⁻¹,为PBS组(11.7×10⁶)的18%,信号面积减少82%;图7h~i结果显示离体肺平均辐射强度1.4×10⁶ p s⁻¹,不足对照组1/6,且肺重量降低63%。
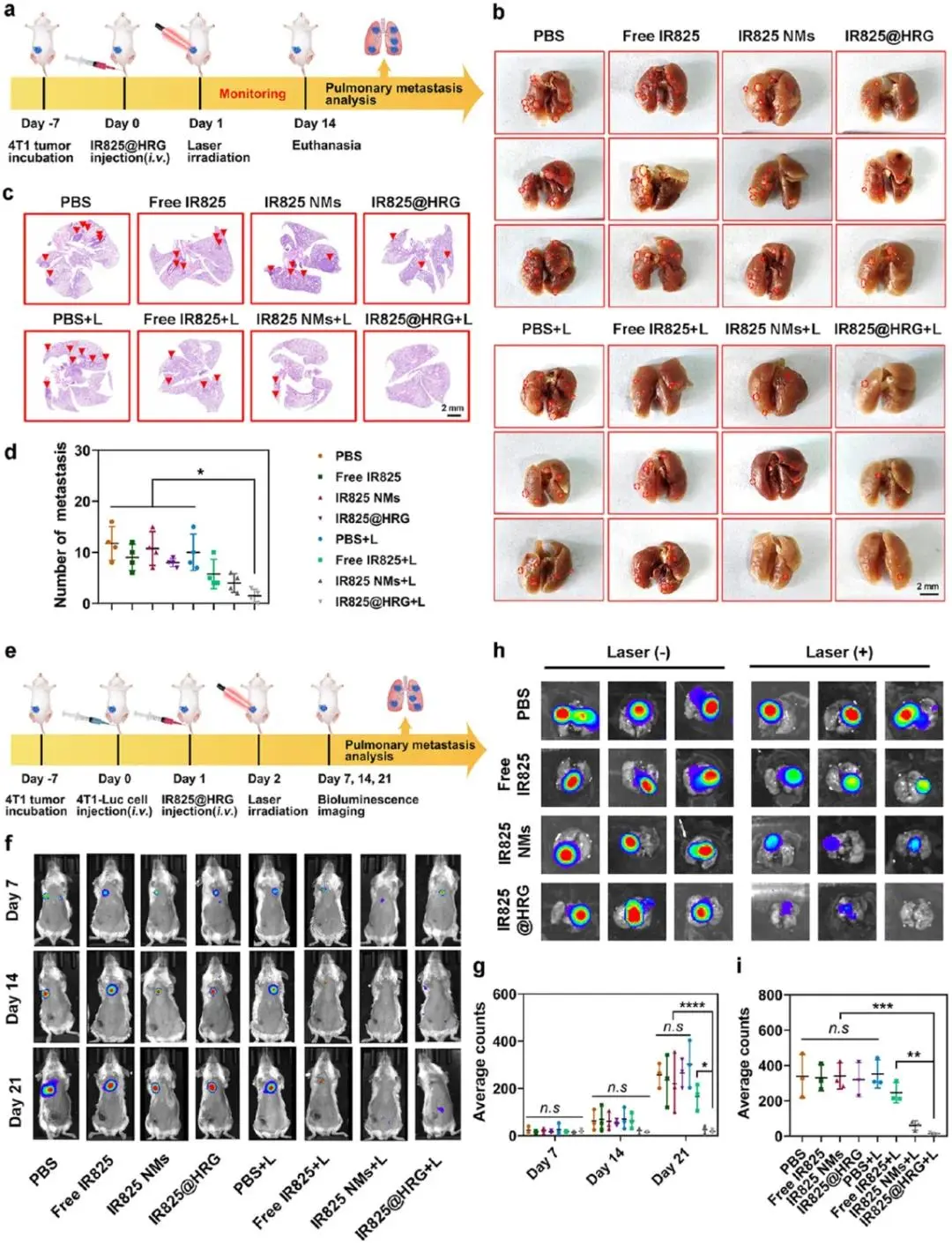
图7.4T1远处肿瘤和肺转移模型的抗转移疗效。(a) 4T1荷瘤模型中评估远处肿瘤的治疗方案示意图。(b)观察期结束时肺转移性肿瘤结节。(c)肺组织H&E染色及(d)不同治疗后肺内转移性肿瘤结节的计算。(e)肺转移模型治疗方案示意图。(f)肺转移瘤第7、14、21天的体内生物发光成像和(g)肺转移瘤荧光强度定量。(h)肺转移瘤第21天的体外生物发光成像和(i)荧光强度定量
本研究构建了一种可自组装的 IR825@HRG 纳米粒(NMs),实现光敏剂 IR825 与 TAM 重编程药物 HRG 的共递送。该纳米平台具有 ROS 响应性,可在肿瘤局部经 NIR 激光触发后同步释放两种药物:① IR825 产生 PDT/PTT 协同光疗,诱导免疫原性细胞死亡(ICD),释放 DAMPs 促进 DC 成熟与抗原呈递,激活肿瘤特异性 CTL;② HRG 快速释放,将 M2 型肿瘤相关巨噬细胞(TAM)重极化为 M1 型,解除免疫抑制微环境。与系统性清除 TAM 的 CSF-1R 抑制剂相比,该策略仅在激光照射的肿瘤部位“按需”释放 HRG,既避免了全身免疫毒性,又保留了巨噬细胞的抗肿瘤功能,为“冷肿瘤”(如 TNBC)及复发/转移性癌提供了一种精准、时空可控、临床可转化的新型光免疫协同治疗模式。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

