
乳酸(LA)及其塑造的酸性肿瘤微环境(TME)被普遍认为是癌症免疫抑制的关键驱动因素。乳酸可作为营养物质支持调节性T细胞(Treg)的存活与功能,并促进Treg表面PD-1的表达,从而抑制效应T细胞的活性,削弱包括抗PD-1和抗CTLA-4在内的免疫治疗效果。此外,乳酸还能重塑酸性TME,进一步改变肿瘤相关巨噬细胞(TAM)的表型与功能,间接导致细胞毒性T淋巴细胞(CTL)失活,最终形成一个有利于肿瘤进展的免疫耐受环境。目前已有策略尚存局限,尤其是在纳米医学领域,往往忽视了在缺氧TME中经由无氧糖酵解持续产生的乳酸,导致对酸性TME的调控效果短暂且不彻底。因此,亟需发展多靶点协同干预策略,从源头上阻断乳酸与酸性TME共同介导的免疫抑制机制。

针对上述问题,电子科技大学医学院张坤教授、浙江省人民医院孙立涛教授、电子科技大学医学院蔡璐璐教授为其共同通讯作者。研究设计了一种多通道免疫纳米调节器来抑制酸性 TME 并使非炎性巨噬细胞复极化,以根除这种癌症免疫抑制的根源,其中氟碳链 (FC) 修饰的介孔二氧化硅 (FM) 分别作为纳米反应器和载体,原位合成 CaO2和负载 R848,然后依次进行脂质体涂层、抗 CD105 修饰和 FC 介导的 O2结合。脂质体壳和颗粒内 FC 均可确保 CaO2 的安全输送。超声触发的 FC 结合 O2爆发和脂质体破坏增强的 CaO2与H+和 H2O反应产生O2。这一过程消耗了预先存在的H+,抑制了糖酵解LA的产生,从而切断了酸性TME的来源,并根除了它们在重塑癌症免疫抑制中的作用,例如消除了向非炎症性M2细胞极化的动力,标本兼治地解决了细胞毒性T淋巴细胞和PD-1+ T细胞失活等问题。癌症免疫抑制的根除促进了癌症钙化和免疫纳米调节剂在肿瘤内H2O2蓄积的抗肿瘤功效,尤其是在抗CD105介导的主动靶向蓄积之后。该文章于2025年9月26日以“Multichannel Immune Nanoregulators Suppress Lactic Acid Metabolism and Lactic Acid-Shaped Acidic Microenvironment to Uproot Anti-Tumor Immunosuppression”为题发表于《Advanced Materials》上(DOI: 10.1002/adma.202512230)。
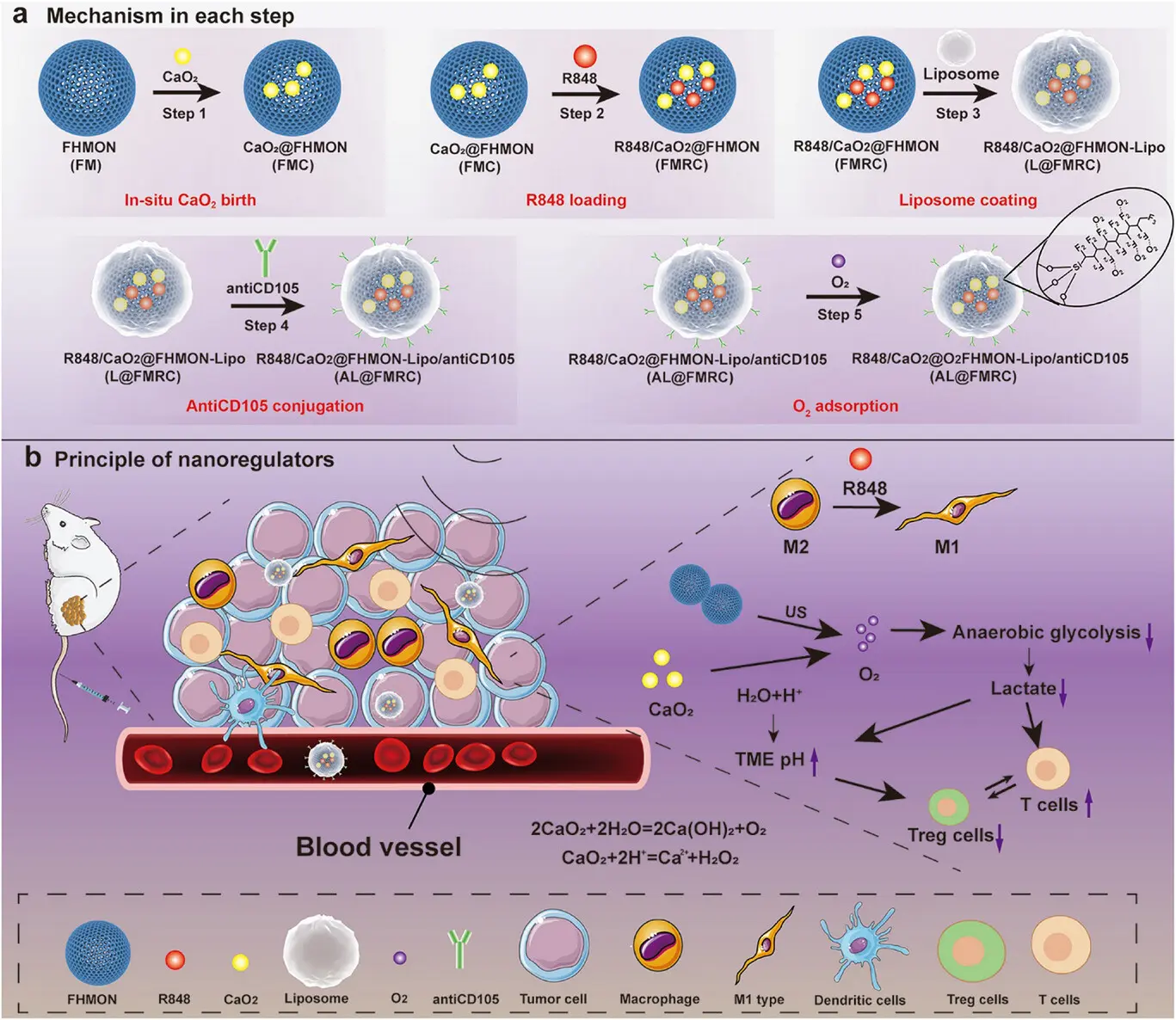
图1 多通道免疫纳米调节器原理示意图
(1)AL@O2-FMRC 的合成与表征
AL@O2-FMRC的合成流程如图2a所示,首先制备FM载体,随后在其纳米反应器中原位合成CaO2纳米颗粒并装载R848,获得FMRC;经脂质体包覆并与CD105抗体螯合后得到AL@FMRC;最后通过O2鼓泡使氟碳链结合氧,形成AL@O2-FMRC。所得的FM载体分散性良好,呈现中空结构,直径约260 nm(图2b-d),其壳层中均匀分布F原子,孔径约为4 nm,具备介孔结构(图2e,f)。紫外吸收光谱显示FMRC在320-340 nm处出现R848特征峰,表明R848成功装载(图2g)。脂质体包覆与抗CD105修饰进一步改变了材料形貌与表面化学性质(图2h,i)。元素分布图与EDS谱图显示AL@FMRC中存在F、Ca、P和S等特征元素(图2j,k),证实氟碳修饰、CaO2合成、脂质体包覆及抗体结合均成功完成。Zeta电位由FMRC的-29.8 mV转变为L@FMRC的-20.1 mV,进一步变为AL@FMRC的-25.2 mV,亦反映表面组成的逐步变化(图2l)。各阶段材料粒径保持稳定(图2m)。FTIR谱图中出现CaO2、FM、R848与抗CD105的特征峰,进一步验证AL@FMRC结构(图2n)。负载率方面,CaCl₂转化为CaO2的转化率为10.3%,AL@FMRC中CaO2负载率为4.3%;氟碳链包封率达100%,F原子负载率为15.47%;抗CD105抗体偶联效率为52.1%,负载率超过1.78%。
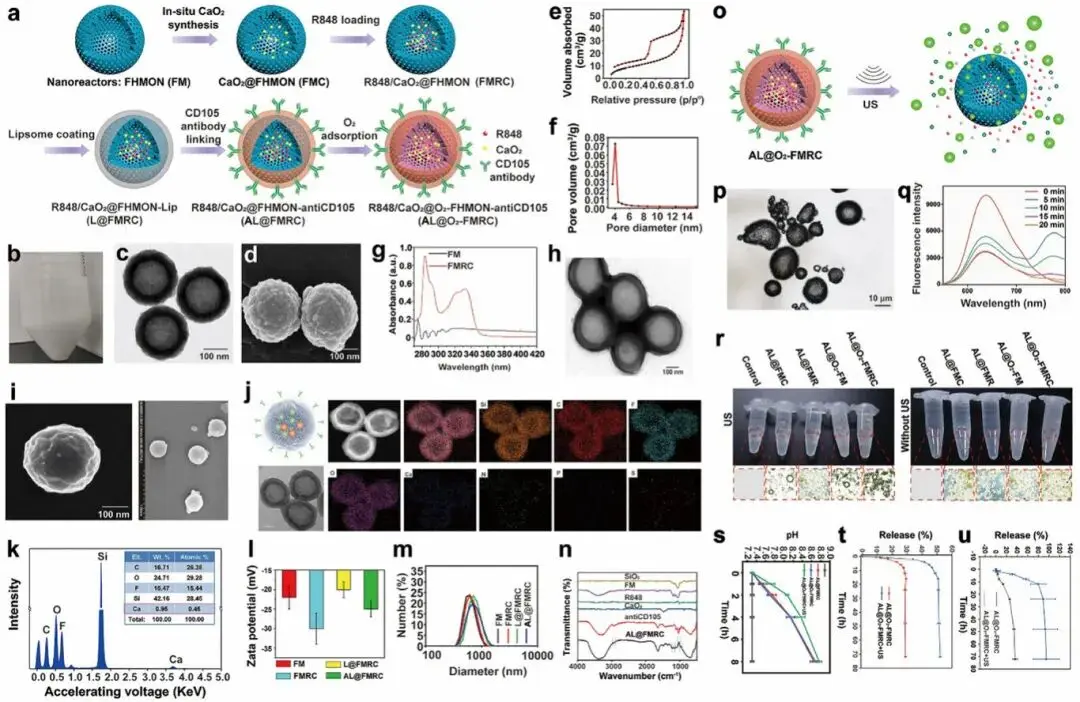
图2 AL@O2-FMRC的合成与表征。(a)合成示意图;(b) FM载体实物图;(c, d)TEM与SEM图像;(e, f)氮吸附等温线与孔径分布;(g)紫外-可见光谱;(h, i) TEM与SEM图像;(j, k)元素分布图与EDS谱;(l, m) Zeta电位与粒径分布;(n) FTIR光谱;(o) O2释放示意图;(p) 超声后结构显微图像;(q) O2释放动力学曲线;(r)不同条件下氧气生成观察;(s)pH随时间变化;(t,u)R848与Ca²⁺释放曲线
(2)US/pH 触发的结合O2的氟碳链和CaO2释放O2
氟碳链赋予AL@FMRC携氧能力,构成最终的免疫纳米调节剂AL@O2-FMRC。超声照射后材料结构发生破坏与扩张(图2p),证实了超声触发的可控氧释放。通过氧指示探针检测,AL@O2-FMRC在超声下呈现时间依赖性氧释放,20分钟内达到释放峰值(图2q),表明氟碳链吸附的氧为突发释放,难以持续缓解肿瘤微环境。为克服此局限,在FM中原位合成的CaO2通过脂质外壳与内部氟碳链疏水区形成双重阻隔,延缓其与水或H⁺接触,实现持续氧供给。在无超声条件下,AL@O2-FM与AL@FMC均无明显气泡产生;超声触发后,AL@FMC产生壁附着小气泡(持续释放),而AL@O2-FM出现更大融合气泡(突发释放)(图2r)。含CaO2组随时间延长pH逐渐上升(图2s),超声通过破坏脂质外壳加速水渗透与CaO2反应,进一步提高pH,证实其缓解酸性微环境的能力。此外,超声触发的氧爆发与脂质体破坏促进免疫佐剂R848的释放(图2t),同时加速CaO2与H₂O反应释放更多Ca²⁺(图2u),从而激活Ca²⁺介导的细胞凋亡途径。
(3)细胞水平主动靶向、H+耗竭、O2释放、糖酵解抑制和钙化,以减轻缺氧和酸性TME并抑制LA的产生
CaO2除与H₂O反应生成Ca(OH)₂和O2外,还可与肿瘤内H⁺反应,消耗H⁺并生成H₂O2与Ca²⁺(图3a)。抗CD105可使AL@O2-FMRC特异性靶向并富集于高表达CD105的4T1肿瘤细胞,而在低表达的L-02细胞中积累较少(图3b)。我们进一步评估了AL@O2-FMRC中CaO2在4T1细胞内与H₂O和H⁺的反应。含CaO2组(G6–G8)的细胞pH显著升高,表明CaO2有效消耗H⁺,缓解酸性肿瘤微环境,其中G8因主动靶向与超声促渗透作用具有最高pH及最低细胞外酸化速率(图3c,d)。在氧含量与缺氧缓解方面,AL@O2-FMR+US(G5)因超声引发O2释放但无法持续供氧,缺氧缓解短暂(图3e–i)。而含CaO2组(G6–G8)中,氟碳链与脂质体疏水区延缓H₂O渗透,延长O2释放时间,使G8在短期与长期均维持最高O2水平并最大程度缓解缺氧(图3e-i)。随着处理从G1到G8,癌细胞中LDHA表达及乳酸生成逐渐降低,G8因缺氧改善最显著,LDHA与乳酸水平最低(图3j–l)。含CaO2组(G6–G8)引起明显Ca²⁺蓄积,G8因主动靶向促进纳米颗粒内化,Ca²⁺含量最高,钙化程度也最强(图3m,n)。同时,G8在超声破坏脂质体后促进H2O2生成最多(图3o)。Western blot结果进一步证实,G8中HIF-1α下调、Calpain 1上调,说明该处理可有效缓解缺氧并促进Ca²⁺沉积(图3p,q)。
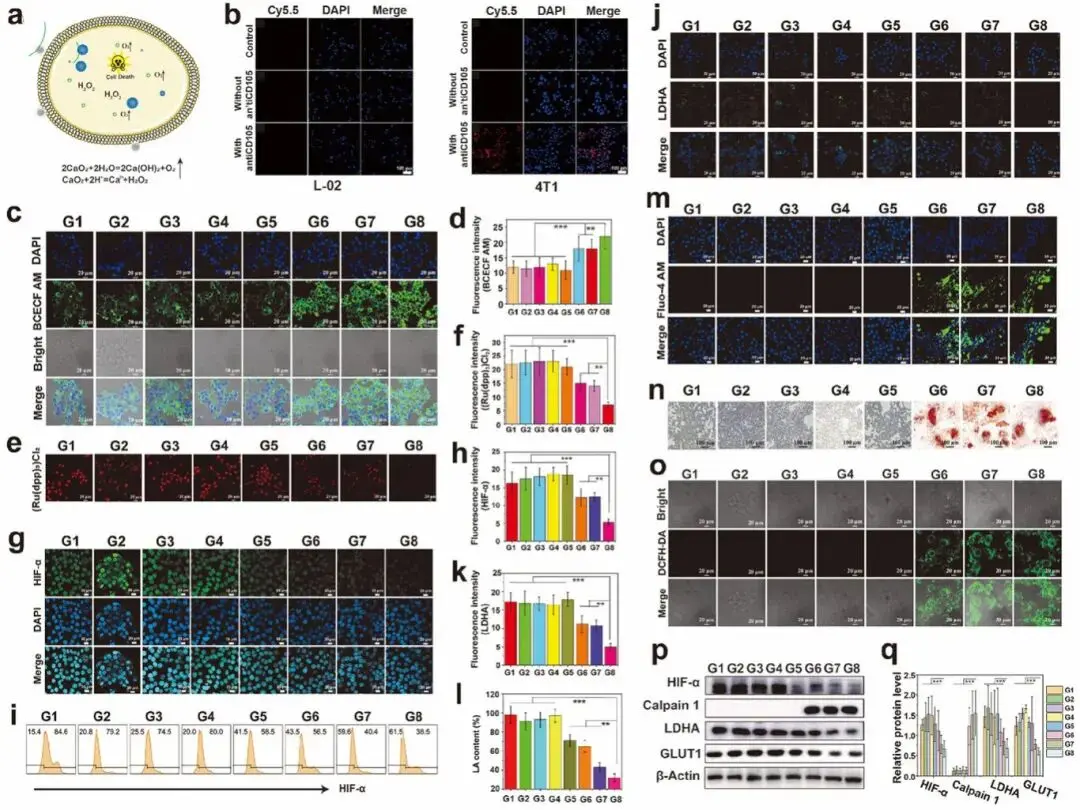
图3 AL@O2-FMRC缓解肿瘤缺氧与酸性微环境的细胞水平评估。(a)机制示意图;(b)细胞对纳米颗粒的摄取(红色:Cy5.5标记纳米颗粒;蓝色:DAPI染核);(c, d)各组细胞pH值;(e, f)细胞O2含量;(g-i)HIF-α表达水平;(j, k)LDHA表达;(l)乳酸含量;(m)细胞内Ca²⁺;(n)细胞钙化;(o)细胞内ROS;(p, q)缺氧、钙沉积及糖酵解相关蛋白表达。注:G1-G8分别为Control、US、AL@FM+US、AL@FMR+US、AL@O2-FMR+US、AL@O2-FMRC、L@O2-FMRC+US、AL@O2-FMRC+US。US参数:1 MHz,60%占空比,1.0 W cm⁻²,脉冲照射1.5 min,间隔30 s;FM剂量为200 µg mL⁻¹
(4)细胞水平抗肿瘤试验
为评估AL@O2-FMRC在超声作用下的系统效应,首先检测了线粒体膜电位变化。结果显示,G8组细胞由高膜电位向低膜电位迁移最为显著,表现为单体增多、J-聚集体减少,显示细胞凋亡程度最高(图4a)。Calcein-AM/PI染色进一步证实G8处理对肿瘤细胞具有最强细胞毒性(图4b,c),流式细胞术也显示G8组细胞死亡率最高(图4d)。使用Annexin V-mCherry/SYTOX green染色区分凋亡与坏死,发现G8组中凋亡与坏死共存细胞数量最多,坏死细胞核呈明显绿色荧光(图4e)。Western blot分析表明,促凋亡蛋白Caspase 3/7与Bax在G8组表达最高,而抗凋亡蛋白Bcl-2表达最低(图4f,g)。以上结果说明,该多通道免疫纳米调节剂在超声促进O2释放及CaO2与H₂O/H⁺反应的协同作用下,通过诱导Ca²⁺与H₂O2积累、抑制乳酸生成与糖酵解、缓解缺氧与酸性微环境等系统效应,有效触发促凋亡蛋白表达,导致肿瘤细胞发生凋亡与坏死。
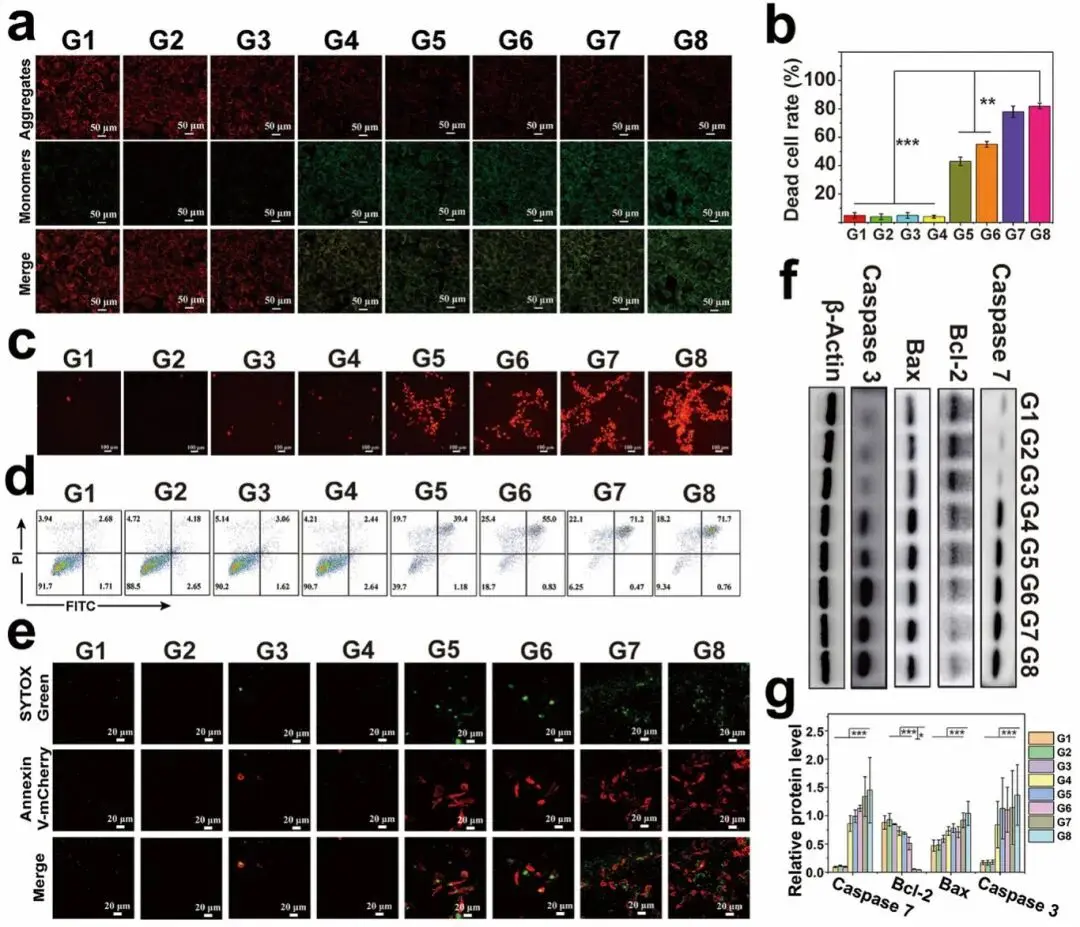
图4 AL@O2-FMRC在细胞水平的抗肿瘤效应。(a)线粒体膜电位;(b, d)细胞活力定量、CLSM图像及FCM分析;(c) Calcein-AM/PI染色(绿色:活细胞;红色:死细胞);(e)细胞凋亡/坏死染色;(f, g)凋亡相关蛋白WB条带及半定量分析
注:G1-G8分别为Control、US、AL@FM+US、AL@FMR+US、AL@O2-FMR+US、AL@O2-FMRC、L@O2-FMRC+US、AL@O2-FMRC+US。US参数:1 MHz,60%占空比,1.0 W cm⁻²,脉冲照射1.5 min,间隔30 s;FM剂量为200 µg mL⁻¹。
(5)细胞水平免疫原性细胞死亡 (ICD)、树突状细胞 (DC) 成熟和 TAM 极化
对多通道免疫纳米调节剂诱导的免疫原性细胞死亡(ICD)及免疫激活作用进行评估。结果显示,G8处理显著提升了癌细胞中钙网蛋白(CRT)与热休克蛋白70(HSP70)的积累,并促进高迁移率族蛋白B1(HMGB1)的释放,使其细胞内水平最低(图5a-f)。同时,G8组细胞外ATP含量也降至最低(图5g)。进一步研究显示,G8处理促使由癌细胞抗原诱导的树突状细胞成熟比例最高(图5h–j),并促进成熟树突状细胞分泌更多IL-6与TNF-α等抗肿瘤细胞因子(图5k)。在巨噬细胞极化方面,AL@O2-FMRC在超声作用下释放R848,可有效引导M0型巨噬细胞向M1表型极化(图5l-o),并抑制其向M2型分化。此外,该处理还能将已有的M2型巨噬细胞重新极化为M1型,其中G8组的复极化率最高(图5p-s)。细胞因子检测结果进一步印证,G8处理使M2相关因子IL-10显著下降,M1相关因子IL-12显著上升(图5t,u)。以上结果表明,该多通道免疫纳米调节剂可有效增强ICD反应、促进树突状细胞成熟,并引导巨噬细胞向M1抗肿瘤表型极化,从而系统激活抗肿瘤免疫应答。
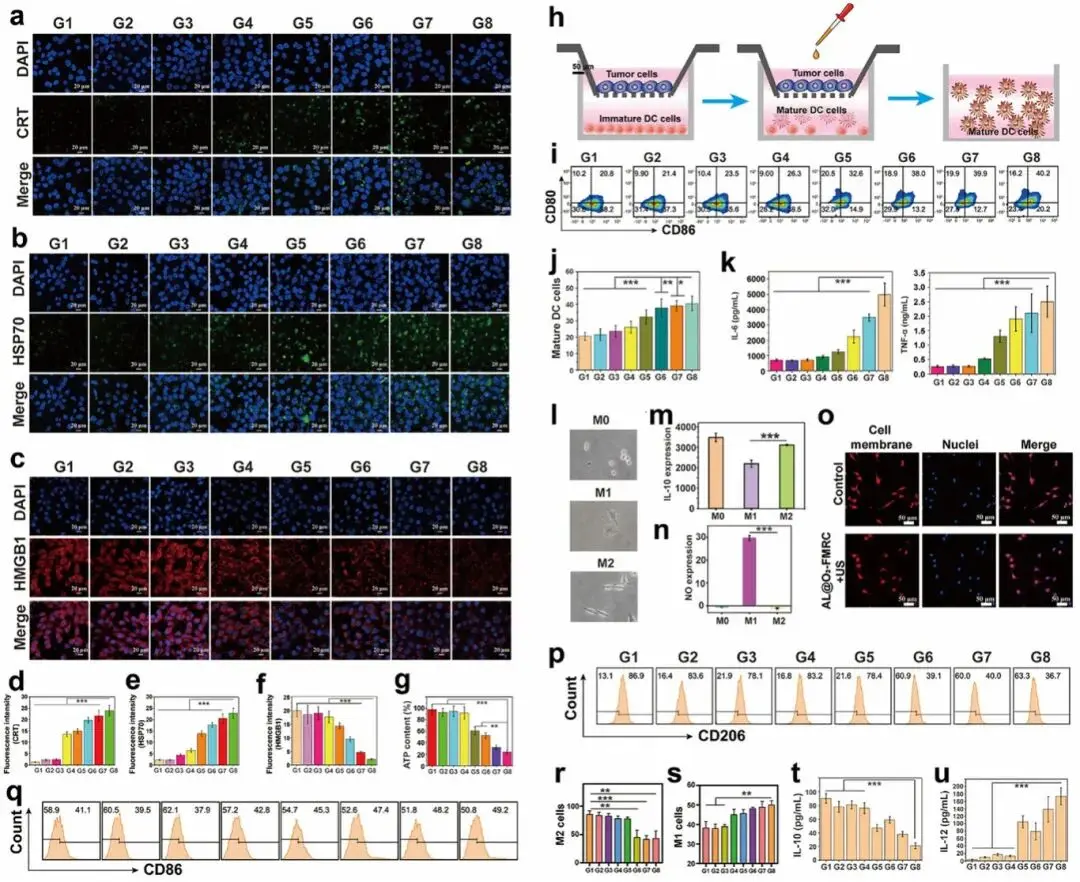
图5 细胞水平的免疫调控效应。(a-c) ICD相关蛋白CRT、HSP70与HMGB1的免疫荧光图像;(d-g) CRT、HSP70、HMGB1及ATP的半定量分析;(h) DC成熟实验示意图;(i, j) 成熟DC的流式细胞术分析及统计;(k) DC中IL-6与TNF-α的分泌水平;(l) 不同表型巨噬细胞的形态观察;(m, n) 巨噬细胞中IL-10与NO的表达;(o) M0巨噬细胞极化表型的免疫荧光图像;(p, q) M0巨噬细胞CD206与CD86表达的流式分析;(r, s) M2与M1巨噬细胞比例的统计分析;(t, u) M0巨噬细胞中IL-10与IL-12的分泌水平。注:G1-G8分别为Control、US、AL@FM+US、AL@FMR+US、AL@O2-FMR+US、AL@O2-FMRC、L@O2-FMRC+US、AL@O2-FMRC+US。US参数:1 MHz,60%占空比,1.0 W cm⁻²,脉冲照射1.5 min,间隔30 s;FM剂量为200 µg mL⁻¹
(6)体内肿瘤生长抑制及免疫调控探索
在体内抗肿瘤评估中,通过皮下移植肿瘤模型并静脉注射纳米调节剂,结合超声照射进行治疗(图6a)。药代动力学显示纳米调节剂半衰期延长(图6b),且主动靶向介导其在肿瘤中特异性积累并保留超过48小时(图6c)。抗肿瘤效果方面,G8组表现出最显著的肿瘤生长抑制(图6d, e)和最低的肿瘤重量(图6f, g)。含CaO2组(G6-G8)中肿瘤组织水含量显著下降,G8因超声促进CaO2与H₂O反应而含水量最低(图6h)。此外,G8处理组小鼠生存期显著延长(图6i)。机制研究表明,G8在提高肿瘤内pH值(图6j)及抑制乳酸生成(图6k)方面效果最为显著,糖酵解关键蛋白GLUT1与LDHA也呈现明显下调(图6l,m)。组织化学分析显示G8组肿瘤细胞密度下降、血管形成受抑制、增殖减少及凋亡增强,分别通过H&E、CD31、Ki67和TUNEL染色证实(图6n-q)。Western blot结果进一步表明,G8中HIF-1α、LDHA和GLUT1表达下调,Calpain 1上调(图6r),同时凋亡相关蛋白Caspase 3/7与Bax表达升高,Bcl-2下降(图6s)。以上结果表明,该多通道免疫纳米调节剂通过缓解缺氧与酸性微环境、诱导钙积累及凋亡,系统性地抑制肿瘤进展。
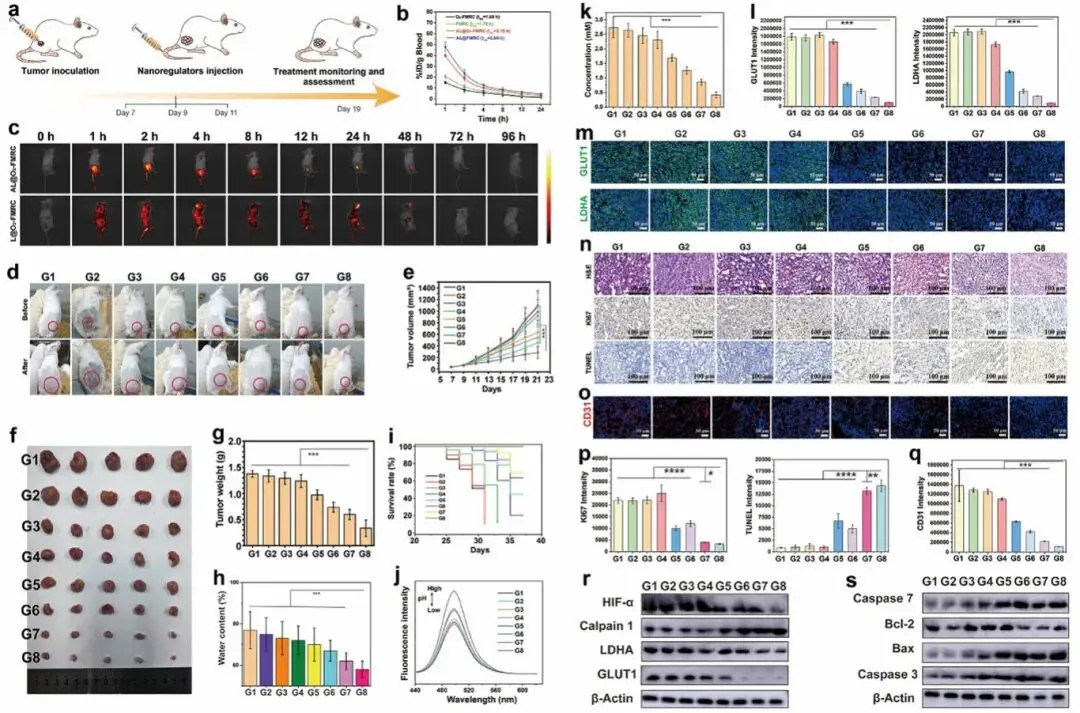
图6 AL@O2-FMRC的体内抗肿瘤效果。(a)治疗流程;(b)药代动力学曲线;(c)体内荧光成像;(d)治疗前后小鼠肿瘤照片;(e)肿瘤体积变化;(f, g)肿瘤照片与重量;(h)肿瘤含水量;(i)小鼠存活曲线;(j)肿瘤pH值;(k)肿瘤乳酸含量;(l, m)GLUT1与LDHA表达的荧光图像与定量;(n, q)H&E、Ki67、TUNEL染色的组织图像与定量;(o, q)CD31染色的微血管图像与定量;(r, s)缺氧、钙沉积、糖酵解及凋亡相关蛋白的Western blot分析。注:G1–G8分别为Control、US、AL@FM+US、AL@FMR+US、AL@O2-FMR+US、AL@O2-FMRC、L@O2-FMRC+US、AL@O2-FMRC+US。US参数:1 MHz,60%占空比,1.0 W cm⁻²,脉冲照射3 min,间隔30 s;FM剂量:10 mg kg⁻¹/次,注射3次
(7)体内癌症免疫抑制缓解和免疫激活研究
为阐明多通道免疫纳米调节剂在体内增强抗肿瘤免疫的作用,对G1-G8各组处理后的免疫原性细胞死亡(ICD)水平及肿瘤内免疫细胞进行了系统分析。该调节剂通过缓解酸性TME、抑制糖酵解及乳酸生成,从根源上消除了M2型巨噬细胞极化的驱动因素,并有望恢复细胞毒性T淋巴细胞(CTL)功能、促进自然杀伤(NK)细胞与树突状细胞募集,同时抑制调节性T细胞(Treg)。实验结果显示,伴随G1至G8处理强度的递增,抗肿瘤免疫反应逐步增强。在超声激发的G8组中,ICD标志物CRT、HMGB1和HSP70表达显著上升(图7a, b)。流式细胞术分析进一步表明,G8组肿瘤组织中成熟树突状细胞(图7c,d)与CD8⁺ T细胞浸润最多(图7e, f),同时M1型巨噬细胞比例上升(图7g,h),M2型下降(图7i, j),表明巨噬细胞极化向抗炎M1表型转变。此外,G8处理有效解除对NK细胞(图7k, l)和CTL(图7m, n)的抑制,恢复其活性。PD-1⁺ T细胞数量也显著增加(图7o,p),有助于增强抗PD-1/PD-L1免疫治疗效果。相应地,G8组中免疫抑制性Treg细胞(图7q,r)和髓源性抑制细胞(MDSC)(图7s,t)的浸润程度最低。综上所述,该多通道免疫纳米调节剂联合超声(G8)可有效激活肿瘤免疫循环,逆转免疫抑制微环境。

图7 体内免疫细胞分析。(a, b)肿瘤组织ICD标志物CRT、HSP70、HMGB1的荧光图像及定量;(c-t)流式细胞术检测各类免疫细胞比例:(c, d)成熟DCs;(e, f)CD8⁺ T细胞;(g, h)M1巨噬细胞;(i, j) M2巨噬细胞;(k, l) NK细胞;(m, n) CTL;(o, p) PD-1⁺ T细胞;(q, r)Treg细胞;(s, t)MDSCs。注:G1-G8分别为Control、US、AL@FM+US、AL@FMR+US、AL@O2-FMR+US、AL@O2-FMRC、L@O2-FMRC+US、AL@O2-FMRC+US。US参数:1 MHz,60%占空比,1.0 W cm⁻²,脉冲照射3 min,间隔30 s;FM剂量:10 mg kg⁻¹/次,注射3次
本文成功构建了一种多通道免疫纳米调节剂,通过重塑酸性微环境与非炎性巨噬细胞极化,有效逆转肿瘤免疫抑制。该调节剂以原位合成于FM纳米反应器中的CaO2为核心,脂质外壳与内部氟碳链形成双重阻水层,保障CaO2在储存与递送中的稳定性。在超声辐照下,氟碳释放O2并破坏脂质结构,促使CaO2持续与H⁺和H₂O反应生成O2,实现短期与长期的肿瘤缺氧缓解。该过程不仅消耗已有的H⁺,还通过抑制无氧糖酵解及乳酸生成,从源头阻断酸性微环境的形成,从而消除乳酸驱动的免疫抑制。此外,该策略有效阻断了巨噬细胞向M2表型的极化,促进M1型巨噬细胞增多,抑制Treg与MDSC的浸润,同时增强CTL、PD-1⁺ T细胞和NK细胞的活化和肿瘤浸润。所产生的副产物Ca²⁺与H₂O2进一步诱导肿瘤钙化与ROS累积,降低ATP水平,直接杀伤肿瘤细胞,并与免疫调控协同增强抗肿瘤效应。综上,本研究所开发的多通道免疫纳米调节剂,从根源上解决了乳酸介导的酸性肿瘤微环境与非炎性巨噬细胞相关的免疫抑制问题。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

