
肝细胞癌是全球第六大常见癌症和第三大癌症相关死亡原因,治疗选择有限。尽管免疫检查点抑制剂等癌症免疫疗法已被纳入晚期HCC的一线治疗方案,但由于HCC具有"冷肿瘤"特性(肿瘤免疫微环境中缺乏淋巴细胞浸润),其对ICIs的响应率仍不理想。铜死亡是一种由铜离子过度积累引发的细胞死亡方式,可通过免疫原性细胞死亡(ICD)释放损伤相关分子模式(DAMPs),激活树突细胞并招募T细胞,从而重塑肿瘤免疫微环境。然而,现有铜离子载体诱导铜死亡的策略存在选择性差、肿瘤滞留不足及副作用大等问题,限制了其临床应用。

为了解决上述挑战,浙江大学陈鸣宇、Sarun Juengpanich及蔡秀军教授团队开发了一种声敏性(TPEN)包载的靶向癌细胞纳米颗粒(STCNs),用于诱导内源性铜死亡并增强HCC的免疫治疗。STCNs通过叶酸受体介导的内吞作用特异性靶向HCC细胞,并在超声激活下释放TPEN。TPEN作为铜螯合剂,能从超氧化物歧化酶中移除Cu2+,增加细胞内Cu2+水平,进而通过类芬顿反应产生活性氧并升高Cu+水平。这种氧化应激破坏了细胞防御机制,诱导内源性铜死亡,同时产生的ROS激活ICD,刺激树突状细胞成熟和T细胞浸润,从而将HCC免疫抑制性的“冷”肿瘤微环境转化为免疫原性的“热”肿瘤状态。该策略利用STCNs实现时空可控的内源性铜死亡诱导,克服了铜离子载体的局限性,显著提高了HCC的免疫治疗效果。该文章于2025年7月20日以《Targeted Intracellular Copper Reservoir Enhances Liver Cancer Immunotherapy》为题发表于《Small》(DOI:10.1002/smll.202502783)。
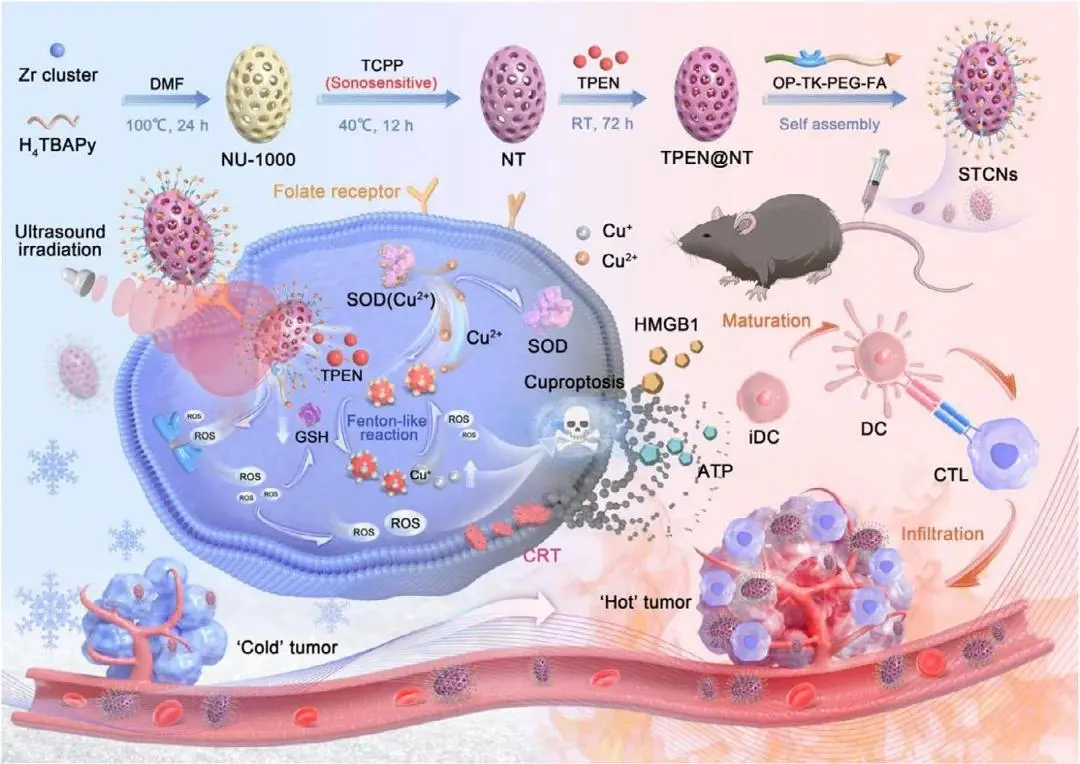
图1. 研究示意图
(1)STCN的合成与表征
NU-1000、NT及TPEN@NT纳米颗粒均呈现纺锤形且尺寸均一(图2a),经SCPLs包覆后形成的STCNs在超声作用下由簇状分布转变为离散颗粒。元素分析证实STCNs中Zr、C、O、N、S均匀分布(图2b)。动态光散射测试表明TPEN@NT包覆后Zeta电位由+38.36 mV降至-36.42 mV,流体力学尺寸由125 nm增至200 nm(图2c-d)。红外光谱在1700 cm-1和1171 cm-1处分别检测到C-N键和PEG链特征峰(图2e),X射线衍射证实材料结晶结构稳定(图2f)。稳定性实验显示STCNs在生理环境中4周内保持稳定(图2g)。药物释放测试表明TPEN在超声72小时后释放率达89%(图2i),活性氧检测显示STCNs与TCNs均具有显著的声动力活性(图2j-k)。
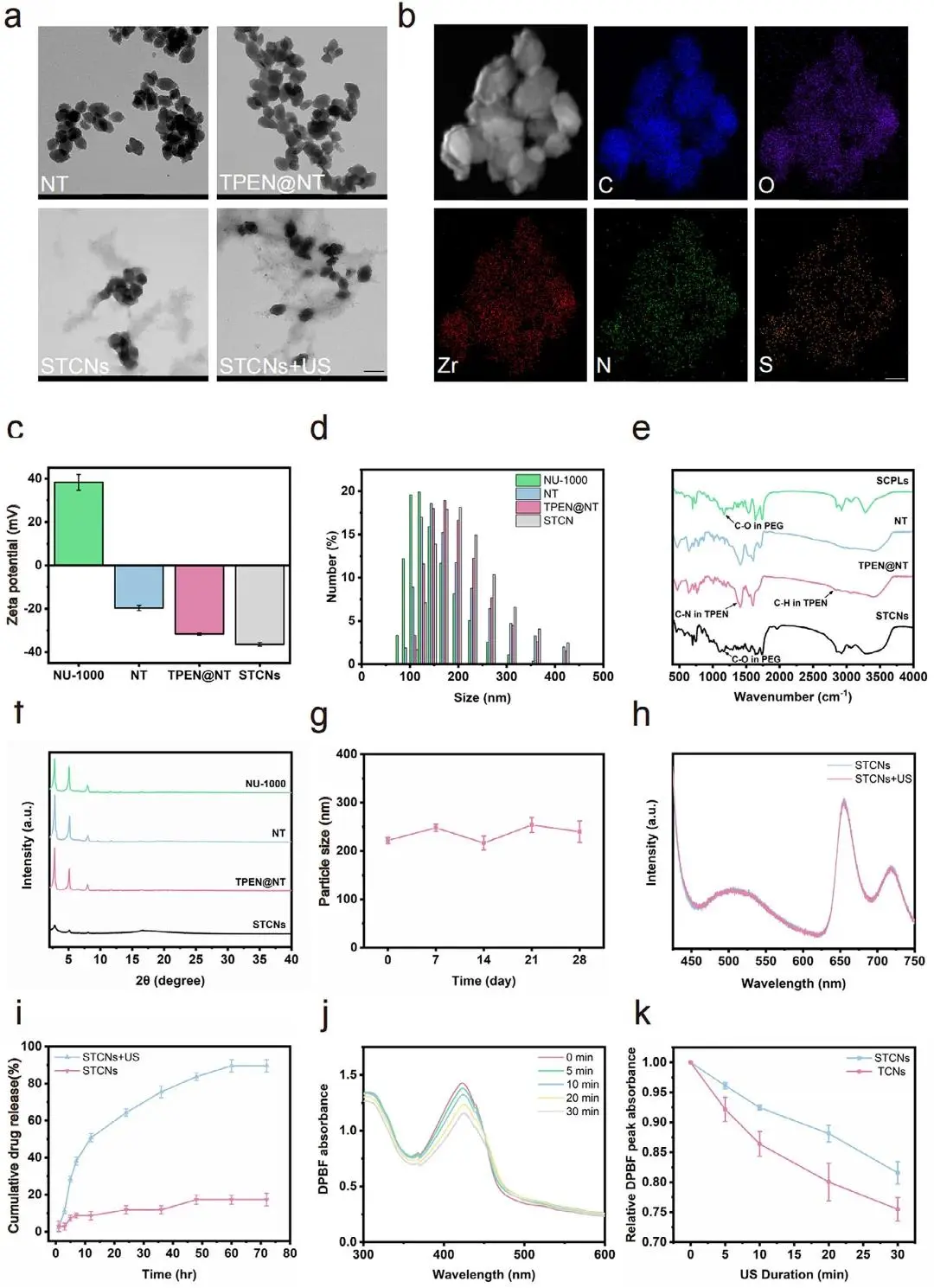
图2 STCNs的表征。(a)NT、TPEN@NT和STCNs在有无超声照射下的透射电子显微镜(TEM)图像;(b)STCNs的成像及能量色散谱(EDS)映射;(c)NT、TPEN@NT和STCNs的ζ电位;(d)NT、TPEN@NT和STCNs的粒径分布;(e)SCPLs、NT、TPEN@NT和STCNs的傅里叶变换红外光谱(FTIR)分析;(f)NU-1000、NT、TPEN@NT和STCNs的X射线衍射谱;(g)STCNs在PBS中的稳定性测试,指定时间间隔(0、7、14、21、28天)的粒径分布;(h)STCNs在有无超声照射下的TCPP荧光强度;(i)STCNs的体外药物释放曲线;(j)STCNs在超声照射下的DPBF吸光度谱变化;(k)STCNs/TCNs在超声照射下的相对DPBF峰吸光度
(2)STCN的细胞摄取和细胞毒性
STCNs在肝细胞癌(HCC)细胞HuH-7和Hepl-6中的摄取情况,结果表明STCNs在细胞内的浓度随时间增加,在24小时达到峰值(图3a)。透射电子显微镜(TEM)观察显示,肿瘤细胞内的STCNs逐渐积累在细胞质中(图3b)。在超声照射下,STCNs在HCC细胞系中的细胞毒性显著高于正常肝细胞AML-12(图3c)。STCNs与US联用时,对Hep1-6和HuH-7细胞的半数抑制浓度(IC50)显著降低,表明其抗肿瘤作用的协同效应(图3d)。STCNs组在超声照射下表现出显著的抗肿瘤效果,而SCNs组未显示明显的增殖抑制(图3e)。此外,STCNs在其他肿瘤模型中也显示出良好的细胞毒性,表明其在临床应用中的潜力(图3f)。
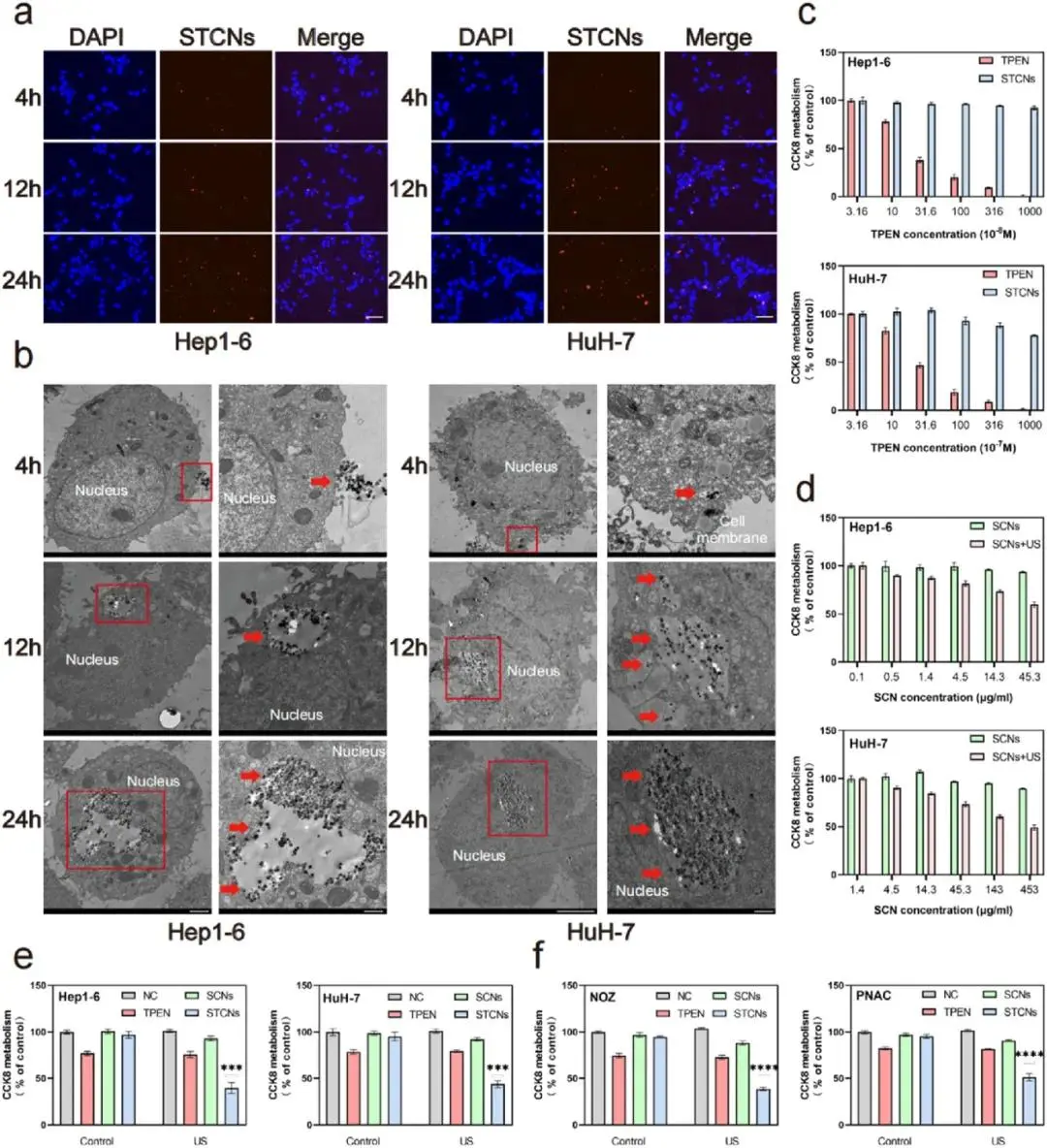
图3 STCNs与HCC细胞的相互作用及抗肿瘤活性。(a)不同时间点Hep1-6或HuH-7细胞对STCNs的摄取荧光图像;(b)不同时间点Hep1-6或HuH-7细胞对STCNs的冷冻透射电子显微镜(Cryo-TEM)图像(红箭头指示STCNs);(c)不同浓度TPEN或STCNs处理48小时后Hep1-6或HuH-7细胞的CCK-8实验结果;(d)不同浓度SCNs或超声照射5分钟下的SCNs处理48小时后Hep1-6或HuH-7细胞的CCK-8实验结果;(e)正常培养基、TPEN、SCNs或STCNs在有无超声照射下处理48小时后Hep1-6或HuH-7细胞的CCK-8实验结果;(f)正常培养基、TPEN、SCNs或STCNs在有无超声照射下处理48小时后NOZ或PNAC细胞的CCK-8实验结果
(3)STCNs内源性铜中毒机制及ICD效应
TPEN释放后,与Cu2+结合,失活SOD,并激活Fenton样反应,产生ROS和Cu+,消耗细胞内抗氧化系统,导致脂酰化DLAT形成不溶性复合物,阻断线粒体功能,诱导细胞死亡。STCNs联合US照射可降低GSH水平,促进铜死亡,并激活抗肿瘤免疫(图4a)。STCNs与US联合应用显著降低了SOD活性、Cu水平,并消耗了GSH,且TPEN等效剂量下的SOD活性和Cu水平显著低于STCNs+US组(图4b)。STCNs+US处理显著降低了肿瘤细胞的FDX1表达和DLAT脂酰化,修复了线粒体功能,并诱导了细胞形态变化(图4c)。RNA测序显示,STCNs+US处理与对照组相比,基因表达存在差异,特别是与免疫应答相关的基因上调,表明STCNs+US能够激活抗肿瘤免疫(图4d)。STCNs+US处理显著增加了促使抗原呈递、促进免疫反应的DAMPs(包括CRT、HMGB1、ATP)水平,并提高了CD86和CD80的表达,表明STCNs+US能够促进树突状细胞(DCs)成熟,激活免疫系统,有效消除肿瘤(图4e)。
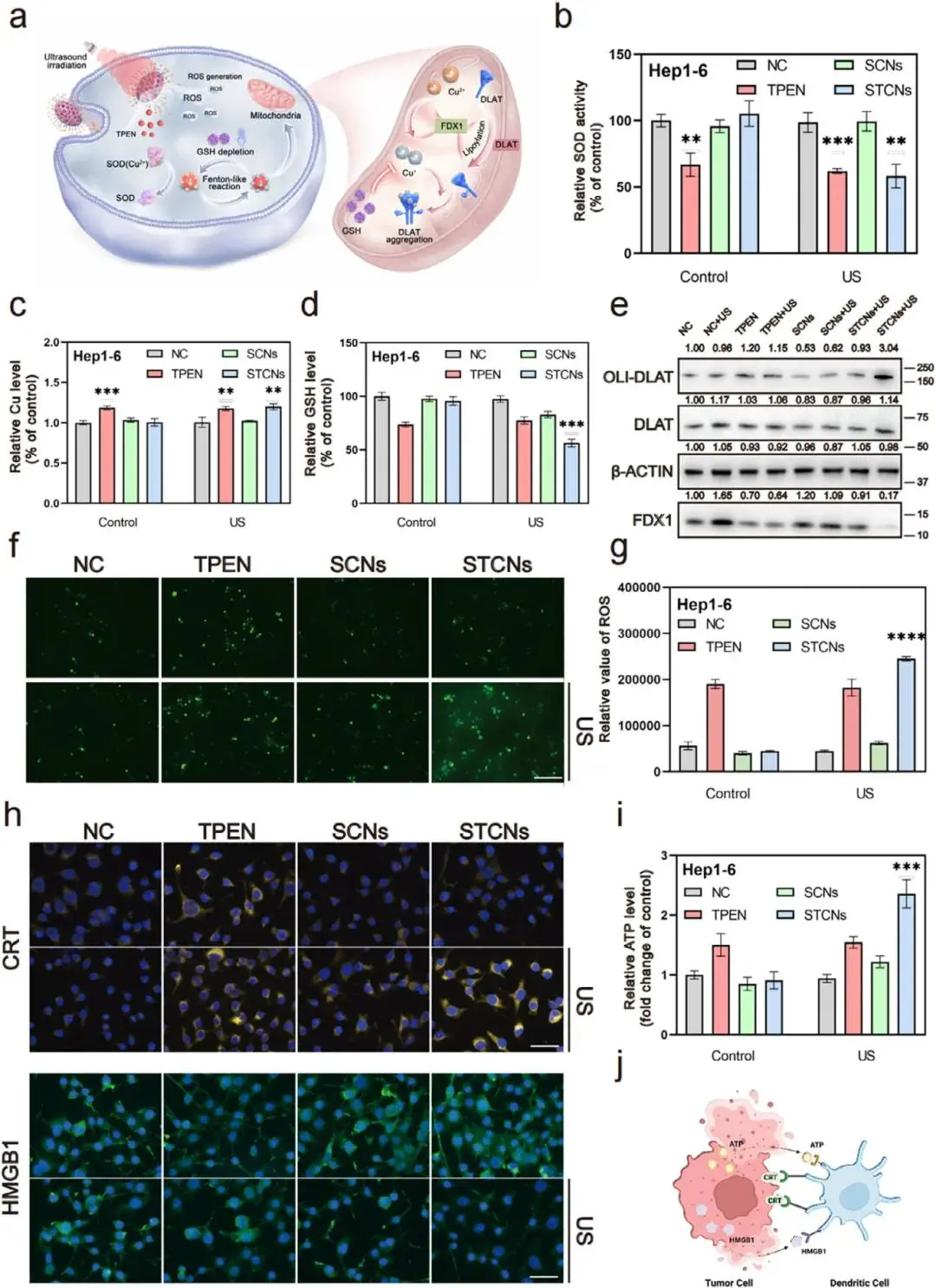
图4 STCNs诱导内源性铜死亡和免疫原性细胞死亡的评估。(a)STCNs诱导内源性铜死亡机制的示意图;(b)Hep1-6细胞在不同处理条件下的超氧化物歧化酶(SOD)活性;(c)Hep1-6细胞中铜的相对水平;(d)Hep1-6细胞中谷胱甘肽(GSH)的相对水平;(e)Hep1-6细胞中OLI-DLAT、DLAT、β-Actin和FDX1的Western blot结果;(f)Hep1-6细胞内活性氧(ROS)的观察;(g)Hep1-6细胞中ROS的相对值;(h)Hep1-6细胞中CRT和HMGB1的免疫荧光图像;(i)Hep1-6细胞中细胞外ATP水平的测定;(j)ICD触发树突状细胞成熟的示意图
(4)STCN的疗效评价及免疫应答激活
TCNs联合超声治疗组(17.5 mg/kg,1.0 W/cm²超声)显著抑制皮下HCC小鼠肿瘤生长,肿瘤体积最小(图5a-c);该组中位生存期延长至74天(PBS组38天),且未引起明显体重异常(图5d)。免疫荧光显示STCNs+US显著激活肿瘤免疫微环境(图5e)。联合PD-1抑制剂后,肿瘤体积进一步减小,协同增效作用显著(图5f-g)。
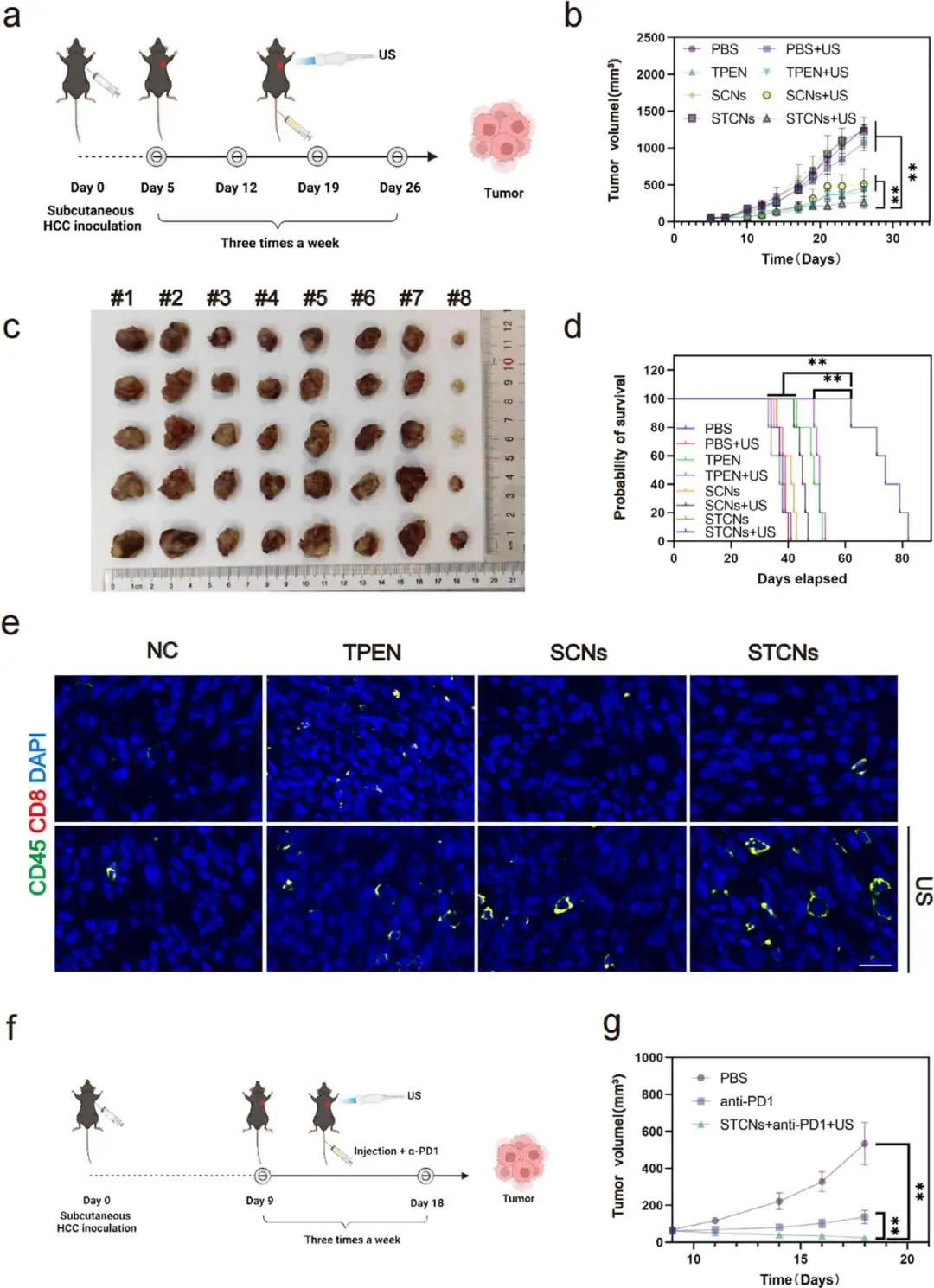
图5 STCNs的治疗效果及免疫反应激活评估。(a)治疗效果评估的实验流程示意图;(b)不同组别在皮下HCC模型治疗期间的肿瘤体积变化;(c)治疗21天后不同组别的肿瘤图像;(d)不同组别小鼠皮下HCC模型的生存曲线;(e)不同处理后肿瘤组织中CD45+细胞和CD8+ T细胞的荧光图像;(f)结合STCNs与α-PD1的治疗效果评估示意图;(g)不同组别在皮下HCC模型治疗期间的肿瘤体积变化
(5)STCN的肿瘤靶向能力、生物分布和生物安全性
STCNs在注射后不同时间点(1, 4, 8, 12, 24, 36 h)的体内荧光成像,显示STCNs在肿瘤部位的滞留能力和靶向能力,以及在肝脏、肾脏和肿瘤中的主要分布(图6a);STCNs治疗40天后,与健康小鼠相比,血细胞参数无显著变化(图6b);STCNs治疗40天后,肝功能检测结果无显著变化(图6c);STCNs治疗40天后,主要器官(肾脏、脾脏、肺、心脏、肝脏)的H&E染色切片未显示明显异常(图6d)。
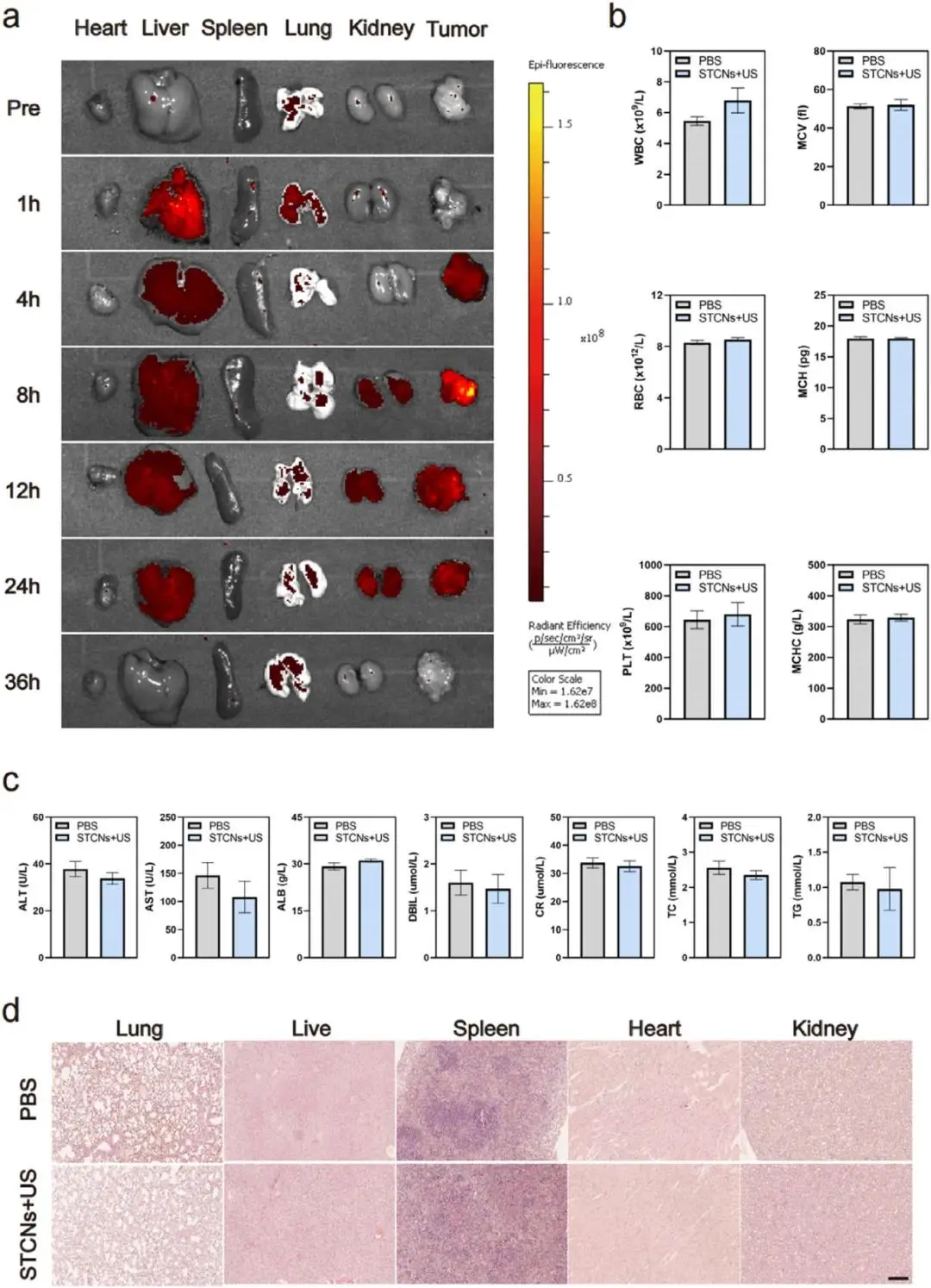
图6 STCNs的肿瘤靶向能力、生物分布和生物安全性。(a)不同时间点从小鼠收集的肿瘤及其他器官的荧光图像;(b)健康小鼠每周静脉注射30天后进行血液学分析;(c)健康小鼠每周静脉注射30天后进行血液生化分析;(d)STCNs体内毒理学的H&E染色分析
本研究开发的STCNs纳米系统为治疗"冷"肿瘤提供了创新性解决方案。该系统通过叶酸配体实现肿瘤靶向递送,减少用药剂量和脱靶风险;超声响应性聚合物涂层显著提升生物相容性,避免药物提前释放;其诱导的"内源性"铜死亡克服了外源性铜死亡的时空局限性;超声激活的声动力治疗具有深层组织穿透性,在破坏肿瘤抗氧化防御系统的同时保护正常组织。该策略不仅能增强抗肿瘤活性,还能促进细胞毒性T细胞浸润肿瘤微环境,显著提升免疫治疗效果。更重要的是,STCNs的可修饰性使其能针对不同肿瘤特征进行个性化治疗,具有重要的临床转化价值。这项研究为激活"冷"肿瘤提供了新思路,为肿瘤免疫治疗开辟了新视角。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

