
极端冲击防护领域长期面临“高抗冲击强度-高韧性”难以兼顾的矛盾:传统陶瓷/金属装甲可瞬间耗散高速弹丸或冲击波的动能,却因脆性大而缺乏韧性;而仿生高分子水凝胶虽能借助多级结构实现高韧性和能量耗散,却因无机相含量低、相容性差,难以满足弹道级防护需求。螳螂虾“冲击棒”通过外层高矿化纤维、中间弹性生物聚合物、内核致密矿化区的多层分级结构,在万次高速撞击下仍保持完整,为破解上述矛盾提供了生物蓝本。

中南大学湘雅医院王杨团队通过苦杏仁苷(amygdalin, AMY)和甘草酸(glycyrrhizic acid, GLA)——这两种源自中药的天然化合物——的自发分子自组装,开发了一种全天然生物活性成分水凝胶(命名为AG-gel)(Scheme 1)。一方面,这些成分在生理环境下通过非共价相互作用自组装成三维纤维网络,形成无载体的水凝胶基质,无需合成交联剂。同时,材料优化使其具有与脑组织匹配的模量,允许在TBI模型清创术后进行脑内给药。另一方面,AG-gel通过特异性下调补体C3,有效减轻由创伤引发的病理性补体激活。随后对小胶质细胞-星形胶质细胞相互作用的调节,通过破坏胶质细胞激活和炎症介质释放的自我延续循环,减轻了神经炎症。这种治疗效果与完全使用天然成分所带来的固有生物安全性相结合。在临床上,AG-gel通过与神经外科清创术的协同整合展示了转化潜力,术后立即给药可建立局部补体抑制。总之,这种外科辅助性FNBCs水凝胶通过局部补体调节,为缓解TBI后继发性神经损伤这一关键未满足需求提供了解决方案,并提供了一种潜在的治疗选择。该文章于2025年9月3日以《Surgical-Adjuvant Hydrogel of Full-Natural Bioactive Compounds from Chinese Medicine for Enhanced Traumatic Brain Injury Therapy by Inhibiting Complement Activation》为题发表于《Advanced Functional Materials》(DOI: 10.1002/adfm.202508893)。
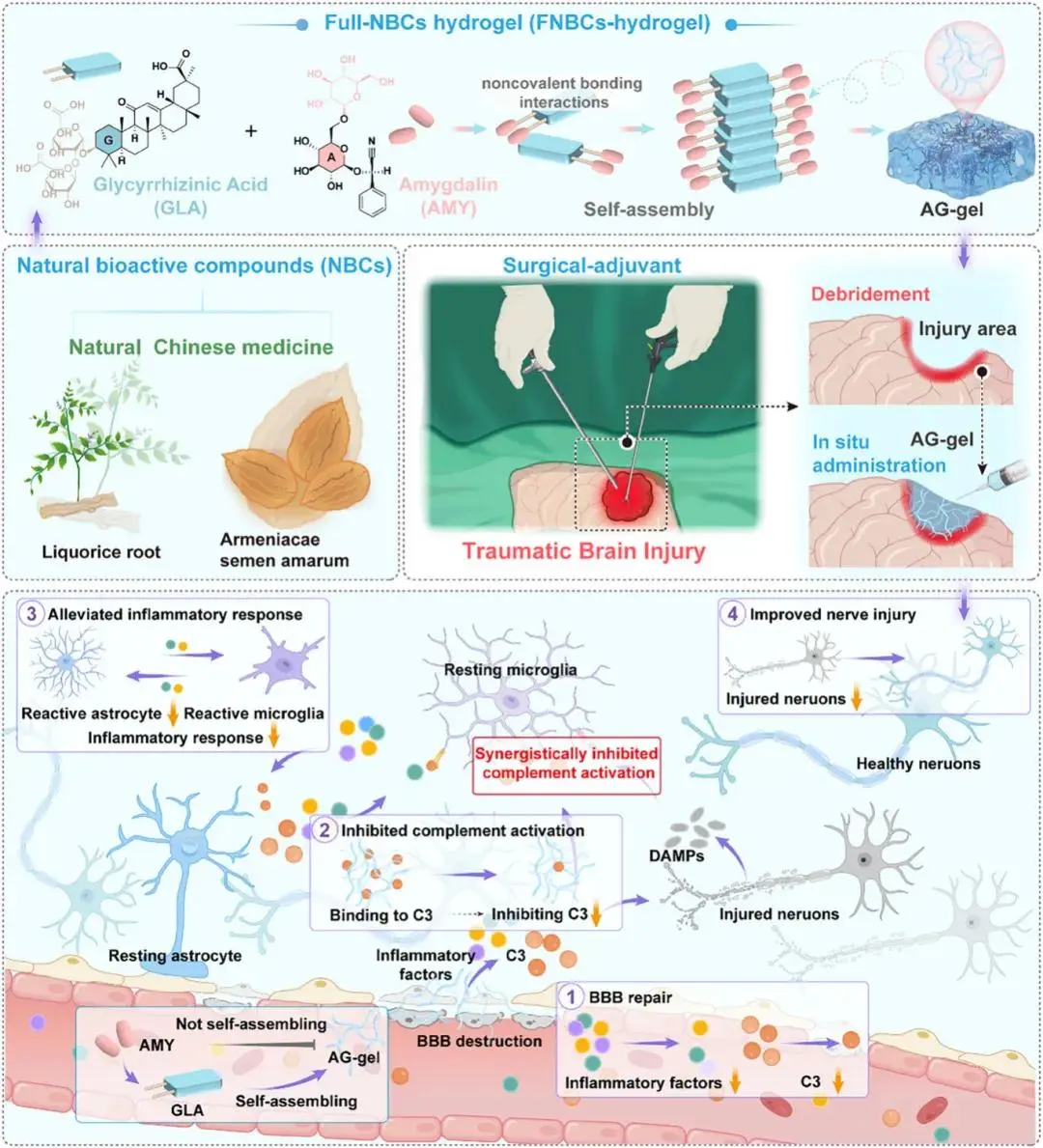
Scheme 1 外科辅助水凝胶(AG-gel)通过清创术后局部给药抑制异常补体激活以增强TBI后神经保护的示意图
在本研究中,通过分子自组装策略设计了AG-gel,其利用完全源自中药的天然生物活性成分,以实现对早期补体激活的调控。AG-gel由天然生物活性成分(苦杏仁苷和甘草酸)在生理条件下自组装而成,表现出可注射性和内在的药理功能。在TBI清创术后单次施用,AG-gel在临床前TBI模型中显示出改善神经功能的功效。具体而言,AG-gel通过一种双重机制协同抑制补体系统激活:该机制结合了保护血脑屏障以阻断外周C3浸润以及直接与C3结合,从而破坏了由胶质细胞激活交互对话所驱动的自我放大的神经炎症循环,同时增强了内源性神经保护作用。总而言之,这项工作为干预TBI及相关外科操作中的补体激活提供了一种替代性的外科辅助水凝胶策略。
(1) AG-gel的制备与筛选和表征
采用自组装方法,作者在生理性溶液中制备了不同比例和浓度的AG-gel,并筛选出适配脑模量的AG-gel进行下一步研究。
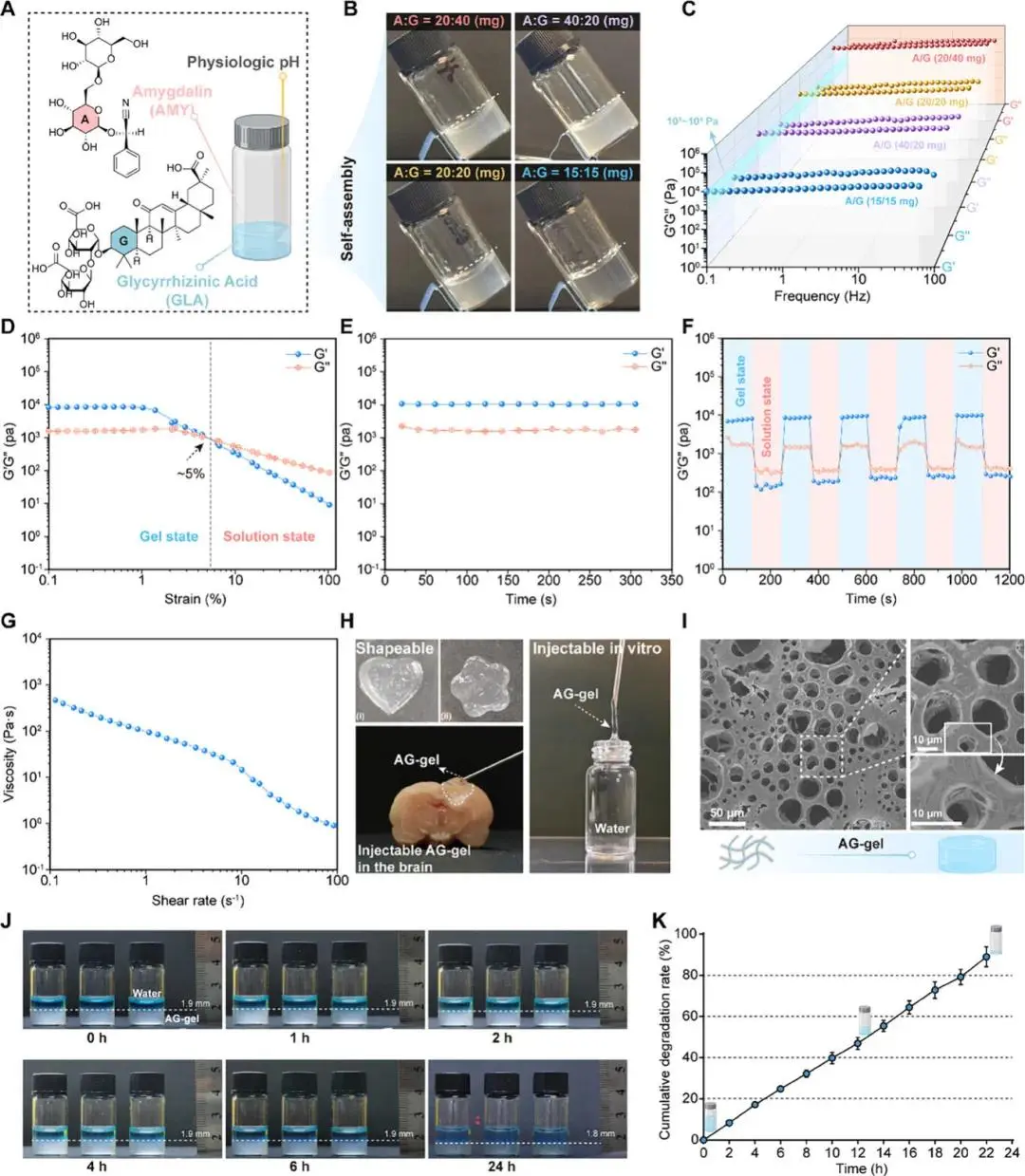
图1 AG-gel的制备与表征。A)AG-gel基质中amygdalin和glycyrrhizinic acid的分子结构。B)显示不同比例和浓度条件的AG-gel的照片。C)不同AG-gel在低应变下的动态频率扫描分析。D)AG-gel与应变相关的振荡剪切流变特性。E)AG-gel在低应变下的动态时间扫描。F) AG-gel在低和高应变条件下的阶跃应变测试。G)AG-gel的复合粘度随剪切速率的变化。H)展示AG-gel 注射时形成的几何形状、在脑内的可注射性以及注入超纯水中时形成条纹的代表性图像。I)AG-gel的扫描电子显微镜(SEM)图像。J)AG-gel的溶胀特性(n = 3)。K)AG-gel的体外累积降解率(n = 3)
(2)通过酶诱导矿化制备的MNG
通过多种物理化学方法、分子动力学模拟,解析了可能的组装机制,即:AG-gel由多种非共价键相互作用形成。
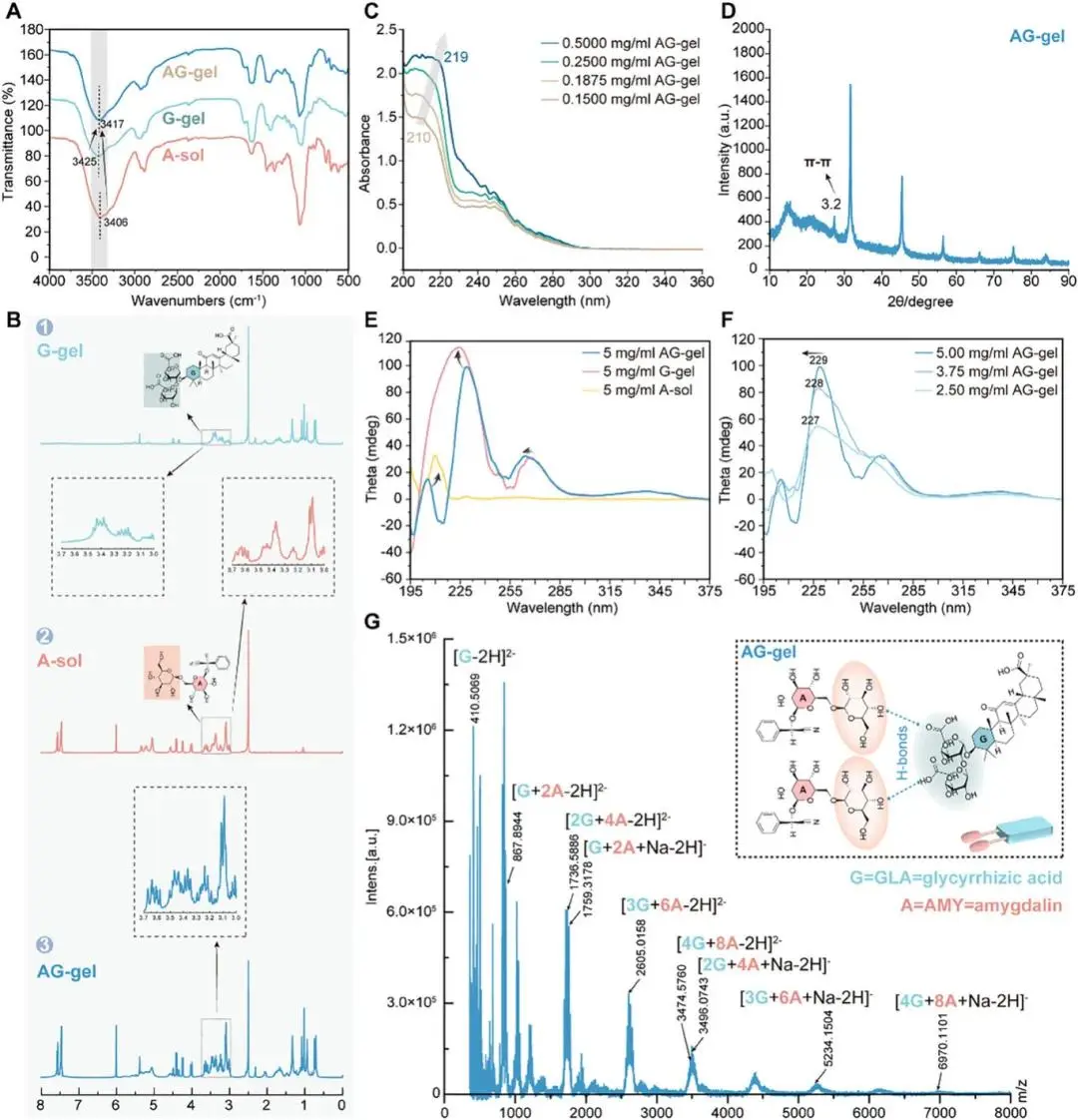
图2 AG-gel的组装机制。A)A-sol(苦杏仁苷溶液)、G-gel(甘草酸凝胶)和AG-gel的傅里叶变换红外光谱(FTIR)。B)DMSO-d6溶液中G-gel、A-sol和AG-gel的1H-NMR谱图。C)不同浓度AG-gel的UV–vis光谱。D)AG-gel的X射线衍射谱图。E)A-sol、G-gel和AG-gel的圆二色谱谱图。F)不同浓度AG-gel的CD谱图。G)AG-gel的飞行时间质谱图
(3)AG-gel的分子动力学模拟
2分子的苦杏仁苷之间可能通过π−π stacking形成堆叠,进而通过氢键相互作用与1分子的甘草酸形成聚集体。随后,该聚集体通过多种非共价键相互作用进一步组装成高阶聚集体,最终形成水凝胶形式。
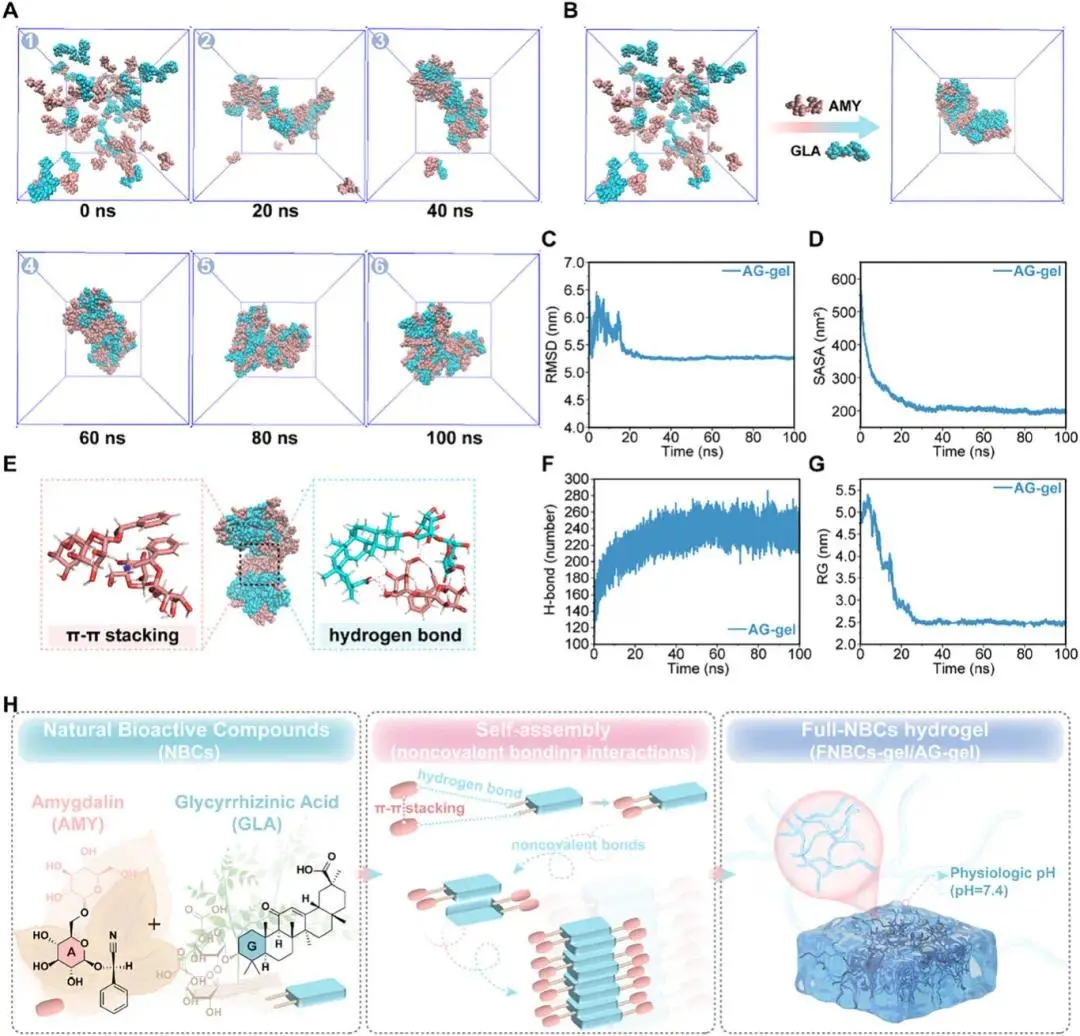
图3 AG-gel的全原子分子动力学(AAMD)模拟。A)模拟过程中每20 ns AG-gel结构变化的时间过程(红色分子簇:苦杏仁苷;蓝色分子簇:甘草酸)。B)AG-gel在0 ns和100 ns时的结构变化。C)模拟时间内AG-gel的均方根偏差(RMSD)。D)模拟时间内AG-gel的溶剂可及表面积(SASA)。E)AG-gel中的分子间相互作用分析。F)模拟时间内AG-gel的氢键数量。G)模拟时间内AG-gel的回转半径(RG)。H)AG-gel自组装形成机制的图示
(4)AG-gel在TBI小鼠模型中增强整体神经保护作用
通过CCI构建TBI小鼠模型,在局部应用AG-gel后,通过多种行为测试及神经相关指标检测,研究者明确了AG-gel具有协同增强神经保护效应。
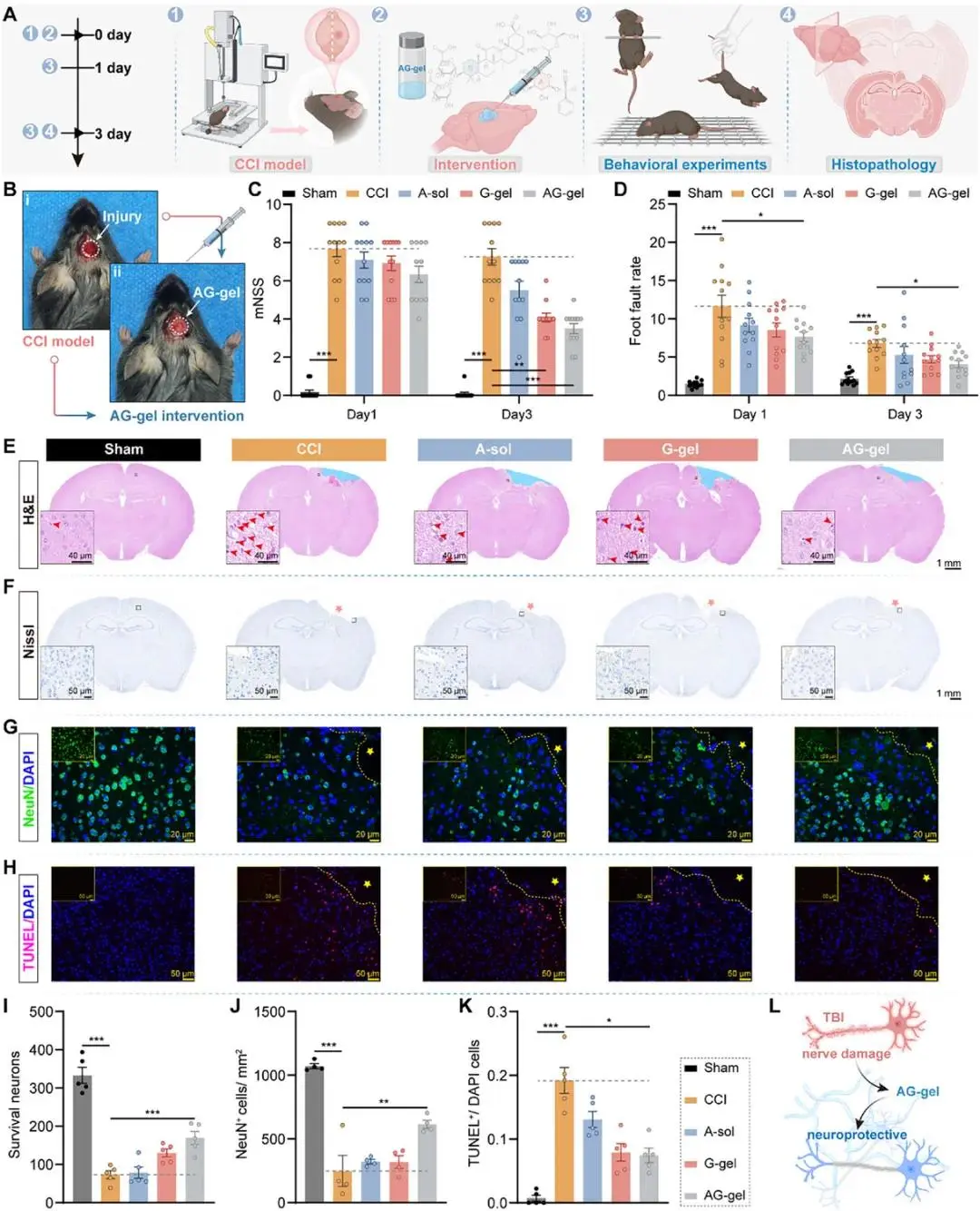
图4 AG-gel TBI小鼠模型中的神经保护作用。A)实验设计和药物干预方案。B)描绘TBI小鼠脑损伤和AG-gel局部给药的代表性图像。C)不同时间点各组小鼠的改良神经功能缺损评分 (mNSS) (n = 12)。D)不同时间点各组小鼠的足误率(n = 12)。E)TBI后第3天不同组的苏木精-伊红染色脑切片代表性图像,黑框突出了损伤区域的放大视图。F)TBI后第3天不同组的尼氏染色脑切片代表性图像,黑框指示了放大的损伤区域。G)TBI后第3天不同组小鼠损伤区域NeuN染色的代表性图像。H)TBI后第3天不同组小鼠损伤区域TUNEL染色的代表性图像。I)TBI后第3天存活神经元的定量分析(n=5)。J)TBI后第3天NeuN+细胞的定量分析(n = 4)。K)TBI后第3天TUNEL+细胞的定量分析(n = 5)。L) AG-gel原位给药以增强TBI后神经保护的示意图。所有定量数据均表示为平均值±标准误(SEM)。统计学显著性标示如下:*p < 0.05, **p < 0.01, ***p < 0.001。星号标记指示由CCI引起的脑损伤侧
(5)AG-gel减轻TBI后的神经炎症反应
通过检测胶质细胞标志物、多种炎症因子表达,明确了AG-gel能够协同改善TBI后神经炎症反应。
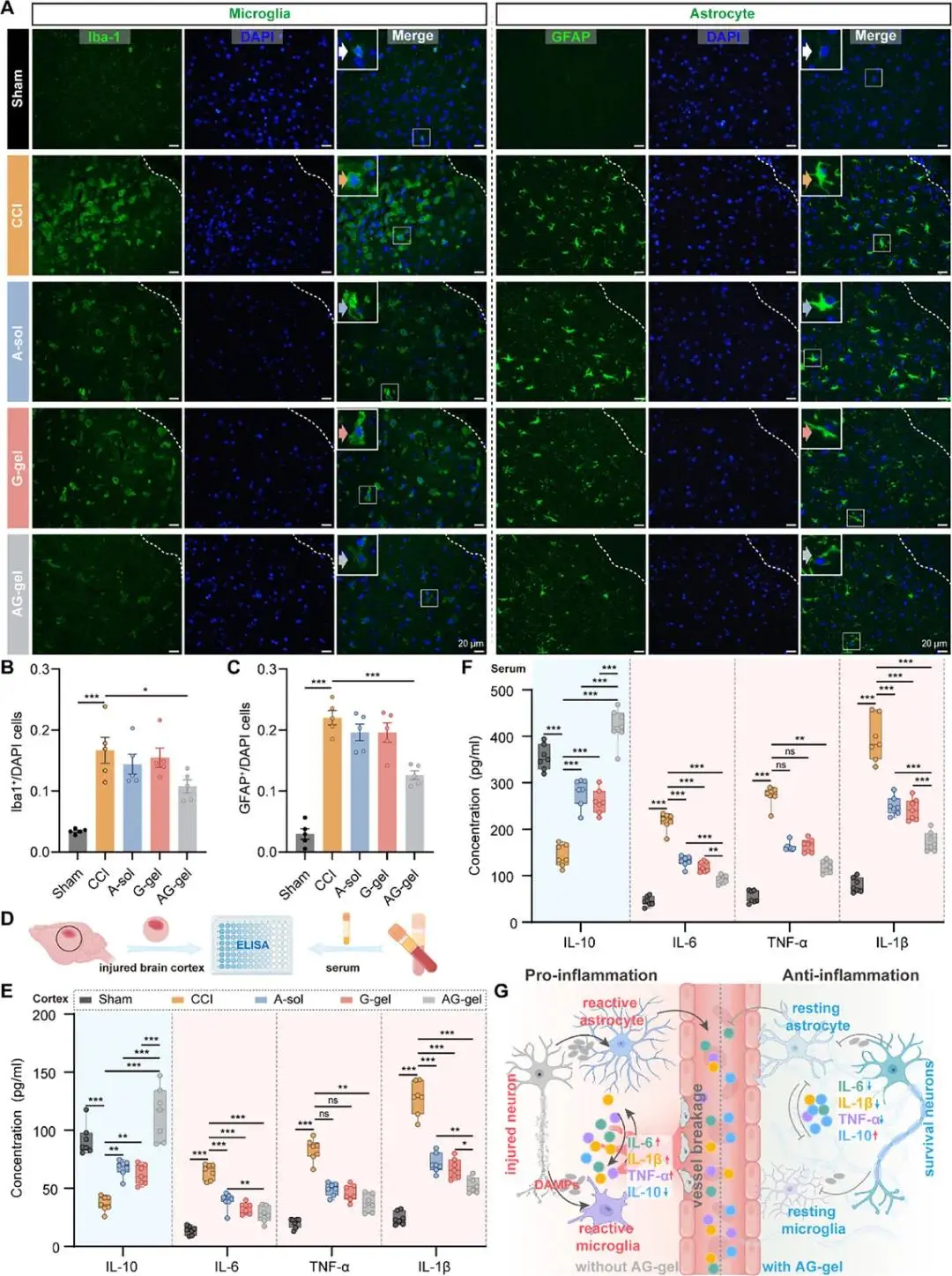
图5 AG-gel在TBI小鼠模型中对神经炎症的抑制作用。A)脑损伤周围区域Iba-1(左侧,绿色,小胶质细胞标记物)和GFAP(右侧,绿色,星形胶质细胞标记物)的代表性免疫荧光染色图像。放大区域中的箭头指示典型的细胞形态。B)不同组中Iba-1阳性细胞比例的定量分析(n=5)。C)不同组中GFAP阳性细胞比例的定量分析(n=5)。D)通过酶联免疫吸附测定试剂盒检测脑皮质和血清中炎症因子的示意图。E)不同组间脑损伤周围皮质中抗炎因子(蓝色,白细胞介素-10 (IL-10))和促炎因子(红色,IL-6,TNF-α,白细胞介素-1β的比较分析(n=7)。F)不同组间血清中抗炎因子(蓝色,IL-10)和促炎因子(红色,IL-6, TNF-α, IL-1β)的比较分析(n=7)。G) AG-gel在TBI后增强其抗炎作用机制的示意图。所有定量数据均表示为平均值± SEM。统计学显著性标示如下:*p < 0.05, **p < 0.01, ***p < 0.001
(6)蛋白质组学分析揭示AG-gel以C3为核心下调TBI后补体系统的激活
通过损伤区脑组织蛋白质组学测序,作者联合生物信息学分析,证实了AG-gel能够显著抑制TBI后补体激活,尤其是补体C3。
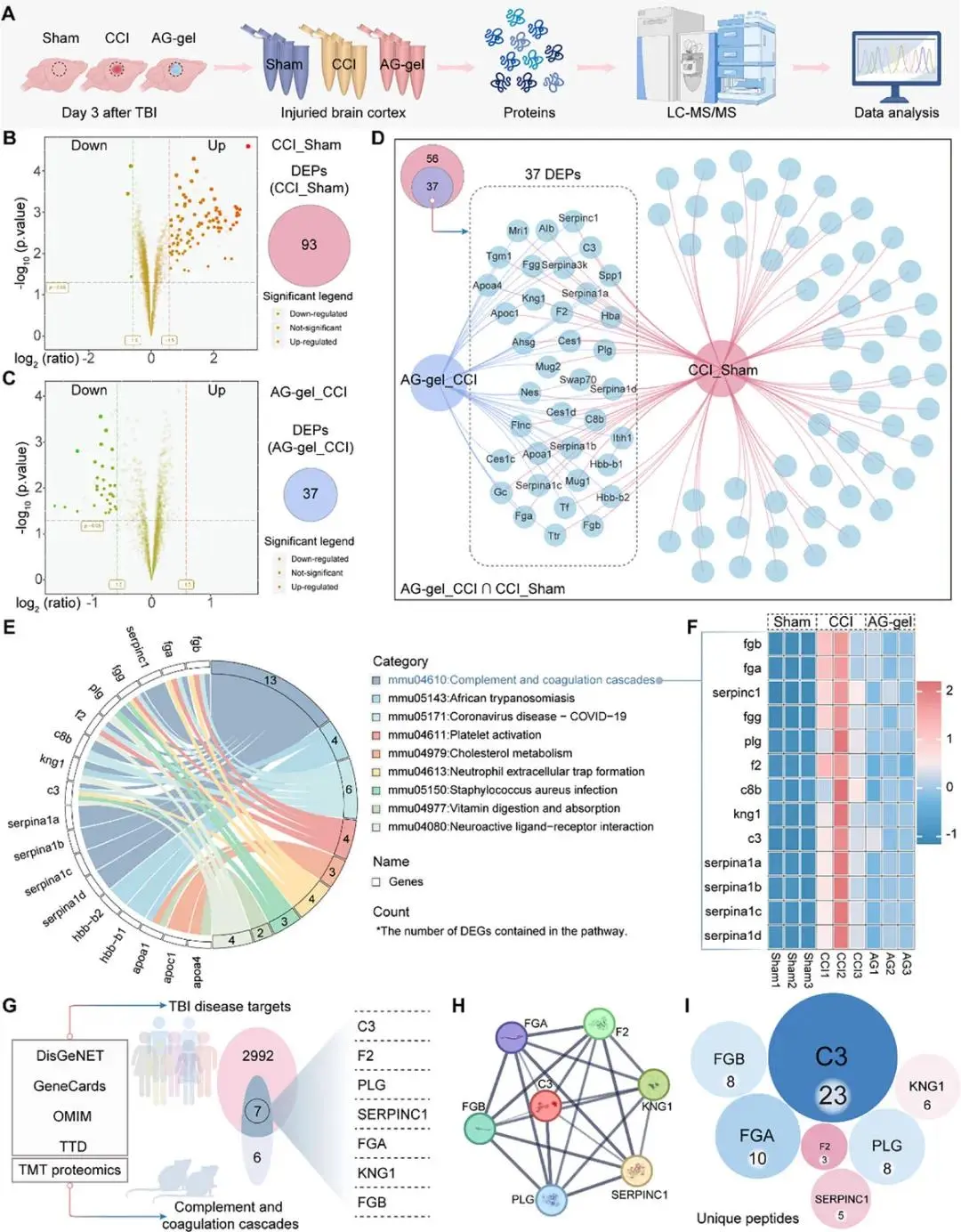
图6 蛋白质组学与TBI相关基因联合分析鉴定AG-gel干预后的核心通路和DEPs(差异表达蛋白)。A)对干预后第3天收集的小鼠损伤部位周围脑皮质进行TMT蛋白质组学分析的示意图(n = 3)。B) CCI组与Sham组蛋白质水平的火山图。右侧圆圈内的数值表示有 93个DEPs。C) AG-gel组与 CCI 组蛋白质水平的火山图。右侧圆圈内的数值表示有37个DEPs。D)显示AG-gel干预组相对于CCI组的DEPs的维恩图。虚线框突出显示了总共37个交叉蛋白。E)对37个DEPs进行的KEGG通路富集分析。F)不同组中富集在补体和凝血级联通路中的13个DEPs表达模式的热图可视化,每组包含三个样本。G)从四个数据库构建TBI相关基因集,并与蛋白质组学分析结果整合以鉴定交叉基因。具体而言,突出了2999个TBI相关基因与13个DEPs的交集。H)七个DEPs的蛋白质-蛋白质相互作用(PPI)网络分析。I)基于独特肽段的七个DEPs排序。数值代表相应独特肽段的数量,圆圈的大小对应这些数值
(7) AG-gel通过减少外周C3浸润并直接结合C3实现双重C3抑制
进一步通过检测血脑屏障相关指标、外源性及内源性C3表达水平,验证了AG-gel能够显著抑制C3表达。通过分子对接、SPR技术更进一步证实了AG-gel与C3直接结合能力。
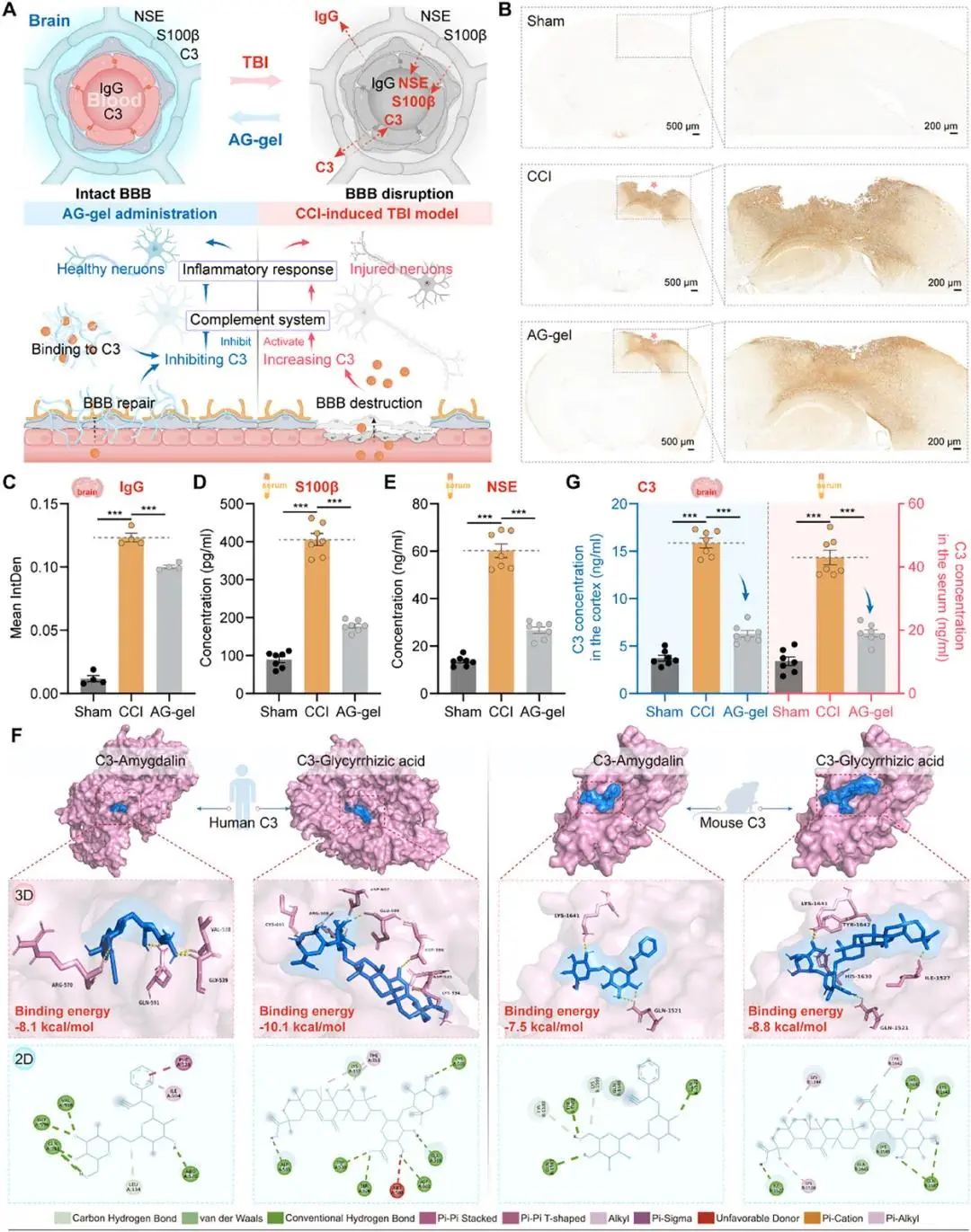
图7 AG-gel通过双重机制减弱脑内C3表达。A)示意图说明AG-gel的双重机制:1)保护血脑屏障(BBB)完整性以限制外周C3浸润,和2)在损伤区域直接结合C3以实现局部抑制。B)实验组(Sham, CCI, AG-gel)的免疫球蛋白G (IgG)免疫染色。右侧面板显示损伤区域的高倍放大视图。星号表示同侧损伤侧。C)大脑中平均IgG积分密度的定量分析(n = 4)。D) Sham、CCI和AG-gel组血清中枢神经系统特异性蛋白β (S100β)浓度的定量分析 (n = 7)。E) Sham、CCI和AG-gel组血清神经元特异性烯醇化酶(NSE)浓度的定量分析 (n = 7)。F)苦杏仁苷/甘草酸分别与人源和小鼠源C3的分子对接。G) Sham、CCI和AG-gel组血清(右)和皮质(左)C3浓度的定量分析(n = 7)。所有定量数据均表示为平均值±SEM。统计学显著性标示如下:***p < 0.001
(8)AG-gel的体内和体外生物安全性评估
AG-gel 300 µg 剂量低于文献安全上限。小鼠体重曲线无异常。主要器官H&E切片未见病理改变(图 8A、B);血清 ALB、ALT、AST、TBIL、UREA、CREA、BUN 与 Sham 组差异无统计学意义(图 8C–H、S9)。溶血率<5%(图8I)。BV2 细胞与300 µg mL⁻¹ AG-gel 共培养72 h,存活率仍>80%(图S10)。
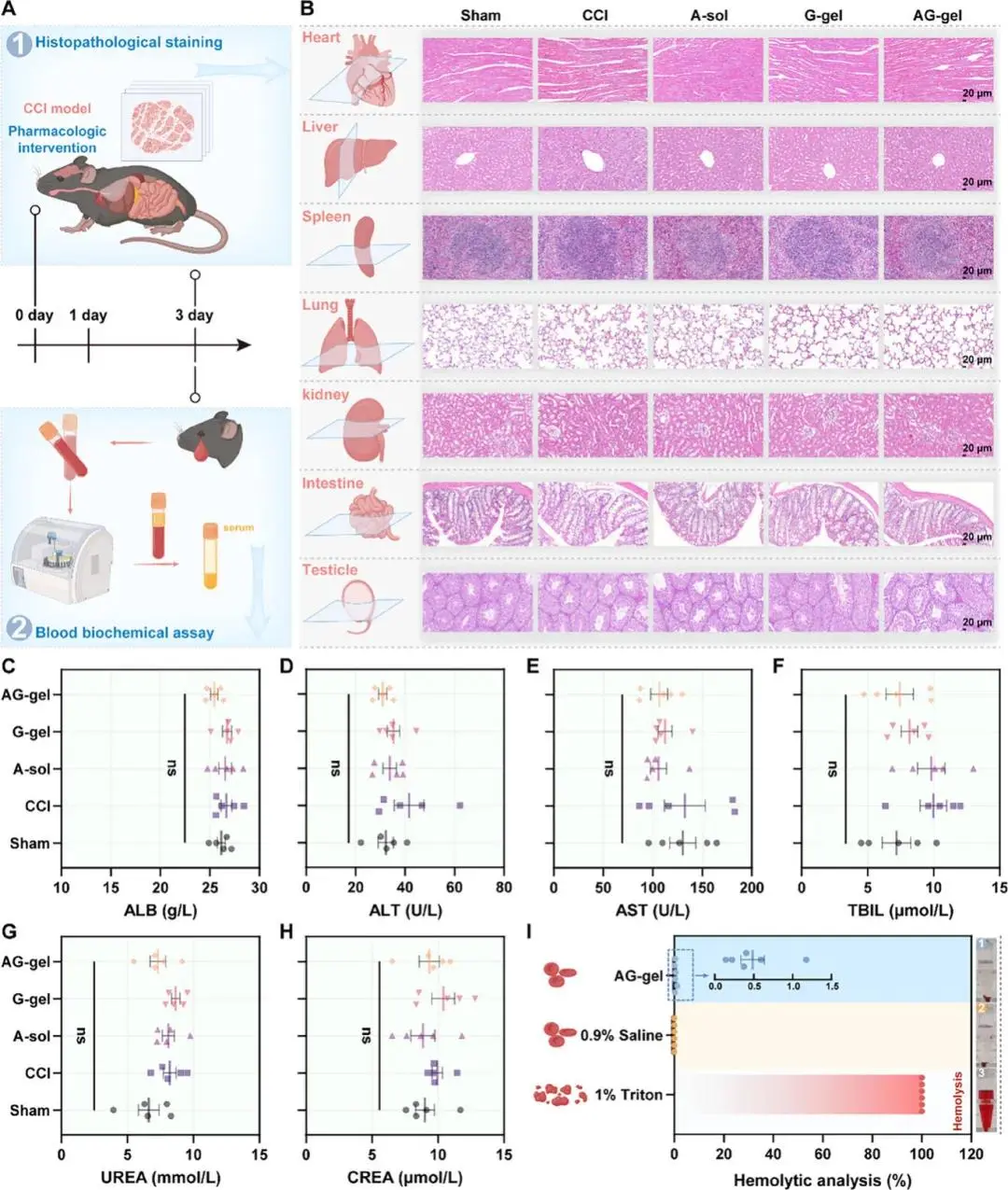
图8 AG-gel的体内和体外生物安全性评估。A)实验设计示意图。B) TBI后第3天各器官(心、肝、脾、肺、肾、肠、睾丸)的H&E染色代表性图像。C–F) TBI后第3天测量的肝功能指标,包括ALB(白蛋白)、ALT(丙氨酸转氨酶)、AST(天冬氨酸转氨酶)和 TBIL(总胆红素)(n = 5)。G,H) TBI后第3天评估的肾功能指标 UREA(尿素)和CREA(肌酐)(n = 5)。I) AG-gel的溶血试验 (n = 6)。插图放大了AG-gel组溶血率的数值分布。随附照片说明了不同实验组的溶血状态。ns =无统计学显著差异
作者开发了一种完全天然的生物活性水凝胶系统,其由两种中药来源的成分——苦杏仁苷和甘草酸自组装而成。AG-gel在生理溶液中制备并优化至最佳模量,实现了用于TBI清创术后原位给药的集成式外科辅助策略。为解决早期局部干预的挑战,AG-gel在手术早期阶段的局部干预中展现出多方面的优势。i) 采用全天然生物活性成分的自组装模式确保了高生物相容性,消除了外源性交联剂的毒性风险。结合术中局部注射,这使得早期干预成为可能,并增强了临床转化潜力。ii) AG-gel能协同抑制由胶质细胞激活触发的早期炎症级联放大循环,改善急性期损伤区域的免疫微环境。iii) AG-gel有效抑制TBI后的补体激活。具体而言,通过恢复血脑屏障(BBB)完整性,AG-gel阻断了外周C3向脑实质的浸润。同时,两种生物活性成分直接与补体激活的核心效应分子——C3结合,协同降低脑内C3水平,从而减轻神经炎症,最终实现增强的神经保护作用。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

