
急性肝衰竭(Acute Liver Failure, ALF)是一种进展迅速、病死率极高的危重症,其特征为大面积肝细胞坏死及肝功能迅速丧失。氧化应激在ALF的发病机制中起关键作用,过量的反应性氧/氮物种(RONS)会攻击细胞蛋白与DNA,引发严重细胞毒性及细胞死亡。同时,DAMPs与PAMPs的释放可触发免疫细胞大量浸润,形成炎症风暴,加剧肝组织损伤。尽管肝脏具备一定的再生能力,但在持续的氧化损伤与炎症刺激下,肝脏再生潜能逐渐耗竭,最终导致不可逆的器官功能衰竭。
目前,肝移植是唯一有效的治疗手段,但受限于供体短缺和免疫抑制治疗等问题,急需寻找更安全高效的替代治疗策略。间充质干细胞(MSCs)疗法因其低免疫原性与组织修复潜力受到关注,然而其体内清除快、驻留率低及微环境适应性差等问题限制了临床效果,因此,如何提升MSC在损伤肝组织中的功能保持与靶向输送,成为研究热点。

针对上述问题,中山大学附属第三医院陶玉、李明强教授团队合作设计并构建了一种源自猪肝的去细胞外基质水凝胶(PLdECM)平台,协同整合预处理人脂肪来源间充质干细胞(IFN-γ诱导的hASCs)微凝胶与铜掺杂的铂纳米酶(PtCu-DHLA),用于急性肝衰竭的精准治疗。通过微流控技术制备PLdECM-MA改性水凝胶负载细胞微凝胶,增强其免疫调节能力;同时引入PtCu-DHLA纳米酶,不仅展现出优异的RONS清除能力,还可激活NRF2信号通路,从而提升抗氧化、抗炎、促增殖与促血管新生等综合修复效应。该系统实现了干细胞与纳米酶的联合递送,既改善了细胞微凝胶在肝组织中的生存与功能,又重塑了不良微环境,协同促进肝组织再生。整体上,该多功能协同平台为ALF治疗提供了新颖且具有临床转化潜力的策略。该文章于2025年2月25日以《Bioactive Decellularized Extracellular Matrix Platform Integrating Multifunctional Nanozymes and Cell-Laden Microgels for Acute Liver Failure Treatment》为题发表于《ACS Nano》上(DOI:10.1021/acsnano.4c13709 )。
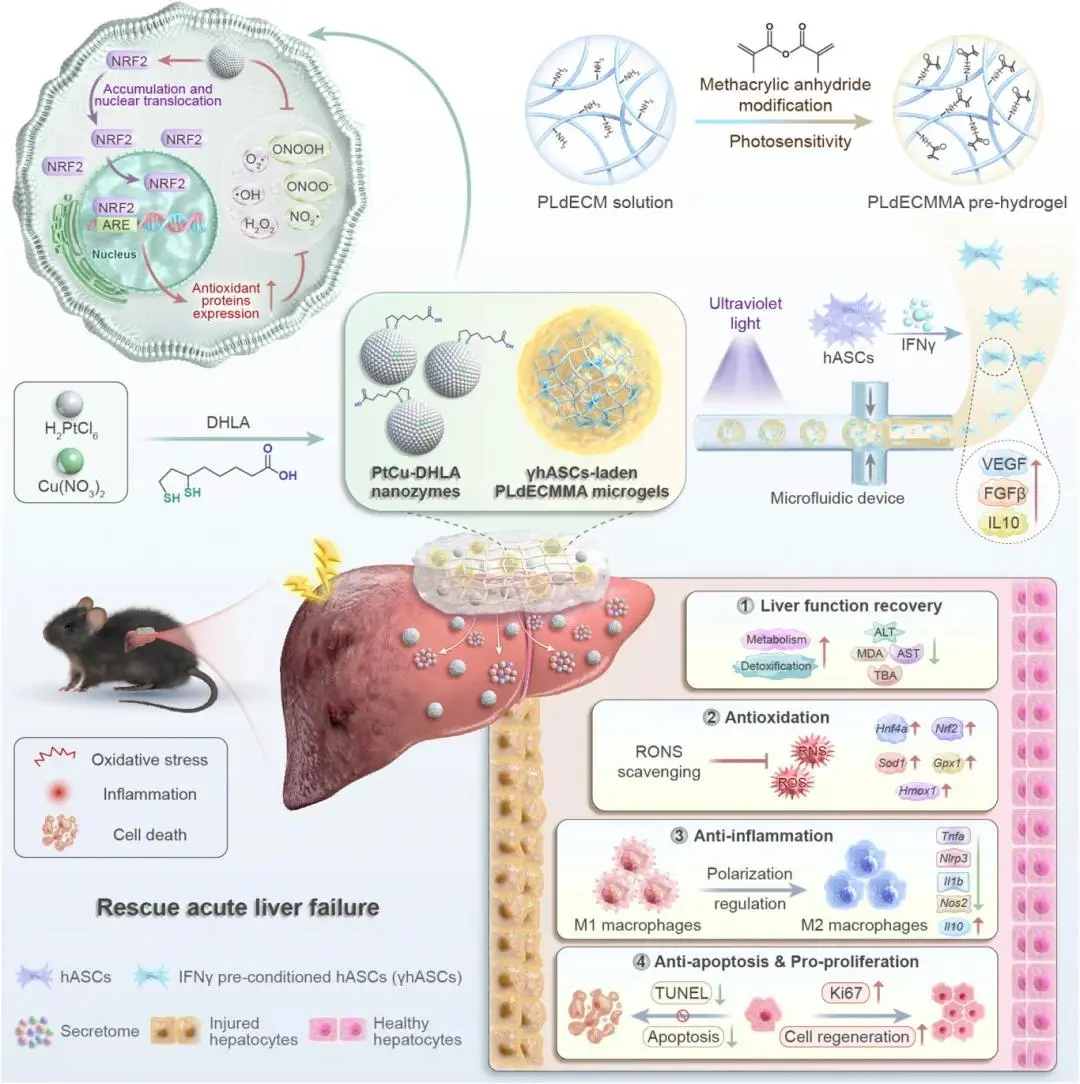
示意图.生物活性dECM平台的构建。该平台整合PtCu-DHLA纳米酶与负载细胞的微凝胶,用于治疗CCl₄诱导的急性肝衰竭,表现出恢复肝功能、清除氧化应激、抑制肝内炎症风暴、减轻肝损伤及促进肝再生的综合治疗效果
(1)PtCuDHLA的筛选、合成和表征
Pt纳米酶经不同保护配体(DHLA、MPA、NAC)与掺杂金属(Cu、Co、Mn)组合筛选后,发现DHLA保护并掺杂Cu的PtCu-DHLA具备最优的抗氧化性能(图1A)。动态光散射(DLS)显示PtCu-DHLA水合粒径为6.4 ± 0.3 nm,接近Pt-DHLA(6.1 ± 0.2 nm)(图1B),Zeta电位约为−23.7 mV(图1B)。TEM图像显示其粒径小、分散性好、形貌均一(图1C)。FT-IR显示未检测到DHLA的–SH振动峰(2500–2600 cm⁻¹),而出现–OH(3200–3500 cm⁻¹)和C═O(∼1700 cm⁻¹)特征峰,证实DHLA成功修饰(图1E)。XPS分析表明PtCu-DHLA表面同时存在Pt与Cu信号(图1F),Cu 2p谱图出现Cu 2p₃/₂与Cu 2p₁/₂特征峰(图1G),且Pt 4f区域因Cu掺杂产生轻微能级偏移。ICP-MS分析表明其Pt和Cu含量分别为96.7%和3.3%(图1D)。合成后UV–vis谱图中前驱体Cu(NO₃)₂与H₂PtCl₆的吸收峰消失(图1H),综合结果表明PtCu-DHLA成功构建。
(2)PtCu-DHLA的ROS和RNS清除活性
PtCu-DHLA展现出多种类RONS的清除能力。其具备类SOD酶活性,可浓度依赖性地清除超氧阴离子(O₂·⁻)(图1J),并具备类CAT酶活性,能够分解H₂O₂生成H₂O和O₂(图1K)。同时,对Fenton反应生成的高反应性·OH亦具明显清除作用(图1L)。ABTS⁺·体系验证了其在低浓度下对ROS的整体清除能力(图1M)。在RNS方面,PtCu-DHLA对DPPH·表现出显著清除作用,在325 μM浓度下抑制率接近90%(图1N)。综合结果表明,PtCu-DHLA具备强效的ROS与RNS双重清除活性,可通过类酶级联机制将其转化为无害的水与气体(图1I)。
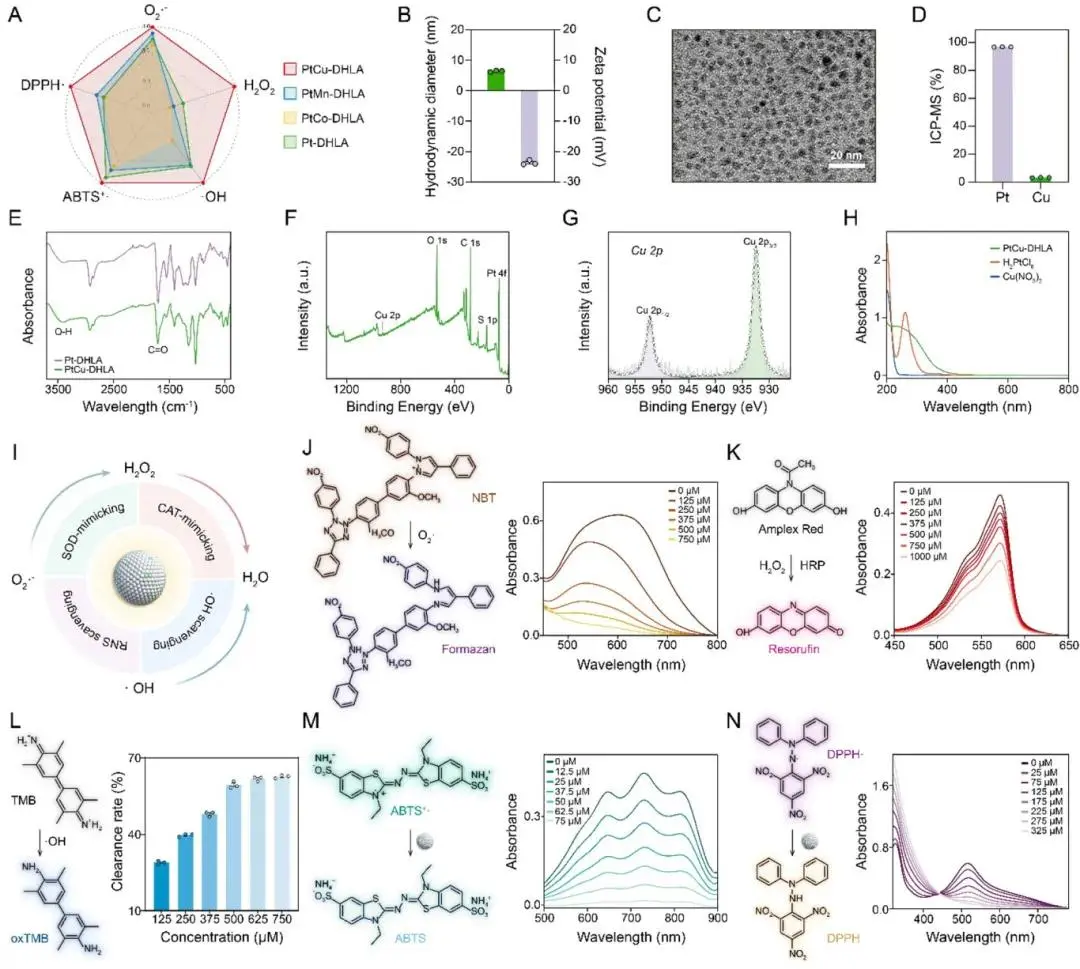
图1. PtCu-DHLA的合成与表征。(A)不同活性物种清除能力的雷达图(数据均归一化至PtCu-DHLA);(B)PtCu-DHLA的水合粒径与Zeta电位;(C)PtCu-DHLA的TEM图像;(D)PtCu-DHLA中金属元素含量(ICP-MS测定);(E)Pt-DHLA与PtCu-DHLA的FT-IR谱图;(F)PtCu-DHLA的XPS全谱图;(G)PtCu-DHLA的高分辨Cu 2p XPS图谱及峰拟合分析;(H)PtCu-DHLA的合成过程UV–vis光谱;(I)PtCu-DHLA通过类酶协同机制清除RONS并将·O₂⁻与H₂O₂转化为H₂O的示意图(由BioRender.com绘制);(J)PtCu-DHLA的SOD类酶活性(NBT法评估);(K)CAT类酶活性(Amplex Red法评估);(L–N)PtCu-DHLA对·OH(L)、ABTS⁺·(M)与DPPH·(N)的清除能力
(3)PtCu-DHLA的协同抗氧化和抗炎作用
PtCu-DHLA表现出良好的生物相容性,对AML-12、Raw264.7及hASCs细胞无明显毒性。FITC标记实验与流式细胞术显示PtCu-DHLA可高效被AML-12与Raw264.7细胞摄取,2小时内摄取率分别达96.9%与98.8%(图2A,2B)。在H₂O₂诱导的氧化损伤模型中,PtCu-DHLA显著提高AML-12细胞活力,并降低细胞内·O₂⁻、ROS与RNS水平(图2C–E);流式细胞术进一步证实其高效的细胞内RONS清除能力(图2F–H)。
RT-qPCR与Western blot分析显示,PtCu-DHLA可显著上调AML-12细胞中Hnf4a、Nrf2、Sod1、Hmox1与Gpx1的表达(图2I,2J),其中HNF4A、NRF2和SOD1蛋白表达分别提升2.4、2.1和1.9倍,优于Pt-DHLA组。免疫荧光结果显示,PtCu-DHLA促进NRF2从胞质向细胞核转位,Pearson系数约为0.5,远高于对照组与H₂O₂组(图2K);高倍图像中NRF2与细胞骨架共染分析进一步证实其在细胞核的富集与表达增强(图2L)。机制示意图总结了PtCu-DHLA通过直接清除RONS和激活NRF2通路的双重抗氧化机制(图2M)。
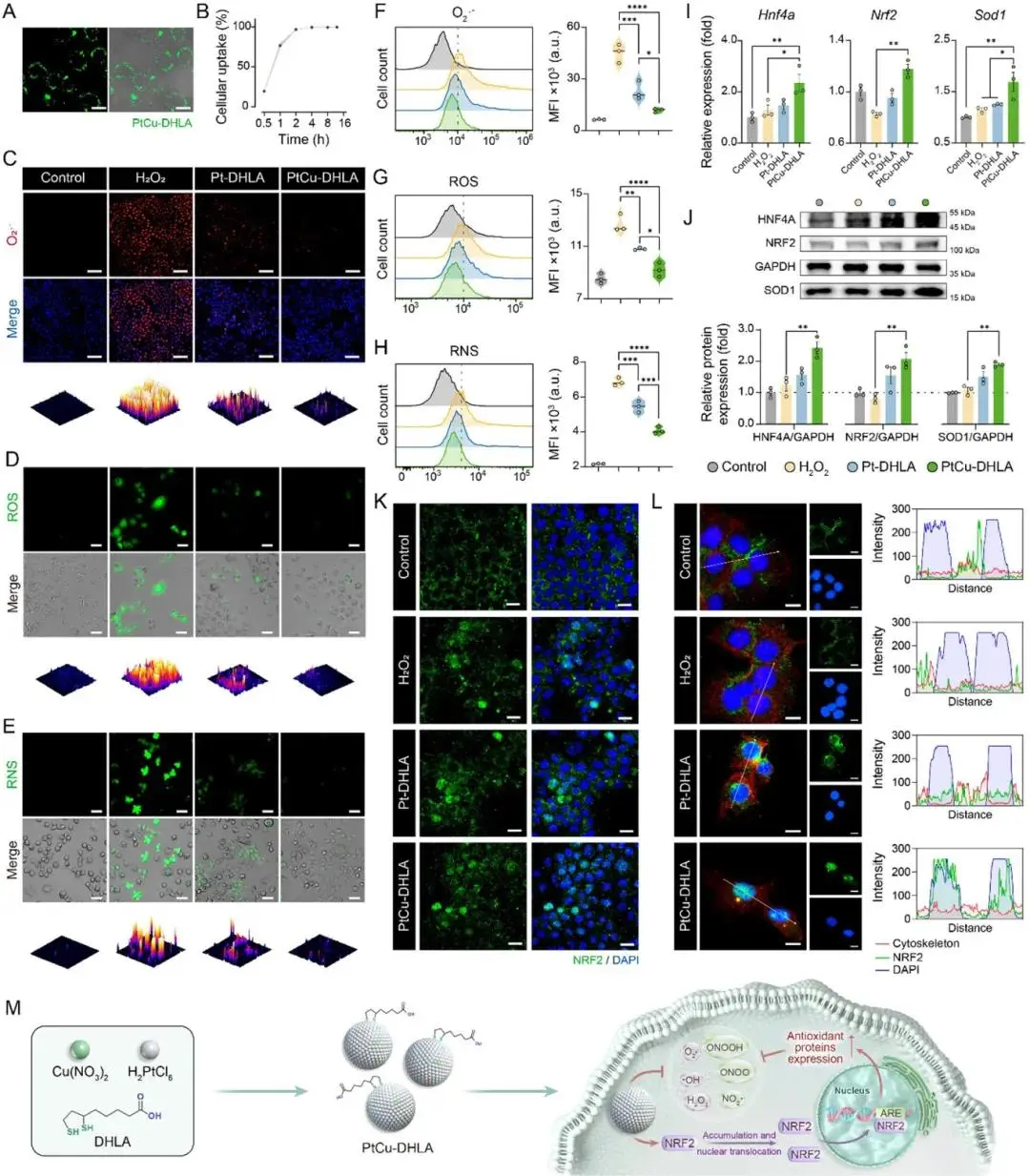
图2. PtCu-DHLA在过氧化氢处理肝细胞中的抗氧化活性。(A)FITC标记的PtCu-DHLA在AML-12细胞内的摄取荧光及明场图;(B)流式细胞术检测的时间依赖性摄取曲线;(C–E)处理后AML-12细胞的·O₂⁻(C)、ROS(D)和RNS(E)荧光染色图及对应3D表面图定量分析;(F–H)流式细胞术检测的·O₂⁻(F)、ROS(G)和RNS(H)水平及其平均荧光强度;(I)处理组AML-12细胞中Hnf4a、Nrf2和Sod1的mRNA相对表达水平;(J)Western blot检测HNF4A、NRF2和SOD1蛋白表达及灰度值定量分析;(K)低倍荧光图显示NRF2在AML-12细胞中的核转位情况;(L)高倍荧光图进一步展示NRF2亚细胞定位及沿白线的荧光强度分析;(M)PtCu-DHLA介导的NRF2信号通路激活机制示意图
炎症在ALF中同样关键,PtCu-DHLA可显著下调Raw264.7细胞中促炎因子Tnfa、Nos2、Nlrp3与Cd86的mRNA表达,并上调抗炎因子Il10与Mrc1(分别升高1.9倍与2.3倍)(图3B,3C)。免疫荧光染色显示,PtCu-DHLA处理后NOS2表达降低、CD163表达增强(图3D,3E);流式细胞术显示,PtCu-DHLA将F4/80⁺CD80⁺(M1型)比例从77.7%降低至40.0%,并使F4/80⁺CD206⁺(M2型)比例提高3倍,效果优于Pt-DHLA组(图3F–I)。
在模拟ALF的炎症-氧化共损伤模型中,使用LPS刺激的巨噬细胞上清液(CM)与H₂O₂联合作用于AML-12细胞,结果显示在无干预条件下细胞死亡严重;而引入PtCu-DHLA后显著改善细胞存活率(图3J–L)。若巨噬细胞经PtCu-DHLA预处理,其CM对AML-12的损伤亦明显减轻,说明PtCu-DHLA通过抗氧化与抗炎协同机制打破“炎症-自由基恶性循环”,具备肝细胞保护潜力。
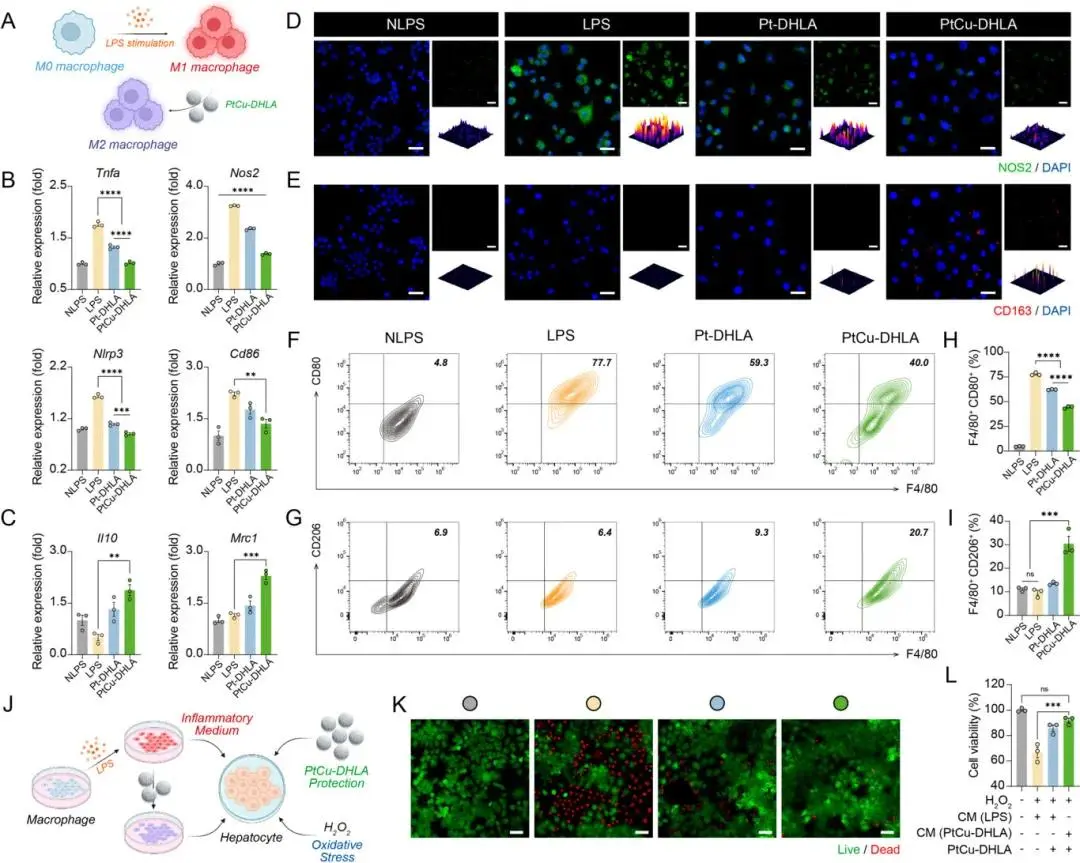
图3. PtCu-DHLA在LPS刺激的巨噬细胞中的抗炎活性。(A)PtCu-DHLA促进巨噬细胞极化的示意图(由BioRender.com绘制);(B)处理后Raw264.7细胞中Tnfa、Nos2、Nlrp3和Cd86等促炎因子的mRNA表达水平;(C)Il10和Mrc1等抗炎因子的mRNA表达水平;(D, E)处理后Raw264.7细胞中NOS2(D)和CD163(E)的免疫荧光染色图及3D表面图定量分析;(F, G)CD80和CD206的流式细胞术分析结果;(H, I)F4/80⁺CD80⁺与F4/80⁺CD206⁺巨噬细胞亚群的流式定量结果;(J)PtCu-DHLA阻断炎症与自由基恶性循环保护肝细胞的机制示意图;(K, L)AML-12细胞的活/死染色图(K)和CCK-8法细胞活力检测(L),验证PtCu-DHLA的协同抗炎与抗氧化作用
(4)PtCu-DHLA的促增殖和促血管生成潜能
PtCu-DHLA在氧化应激环境下展现出显著的促增殖与促血管生成潜力。H₂O₂刺激下AML-12细胞中增殖相关核蛋白Ki67表达被抑制,PtCu-DHLA可有效恢复其表达水平(图4B,4C);同时,增殖标志物Ccnd1的mRNA表达亦在PtCu-DHLA处理组中恢复至接近正常水平(图4D)。此外,PtCu-DHLA显著促进HUVECs迁移,36 h迁移率达92.6%(图4F,4G);成管实验显示PtCu-DHLA可促进血管网络形成,提升网格面积与分支数量,在5 h与10 h均有增强效果(图4I,4J)。上述结果表明PtCu-DHLA具备优异的组织再生促进能力(图4A,4E,4H)。
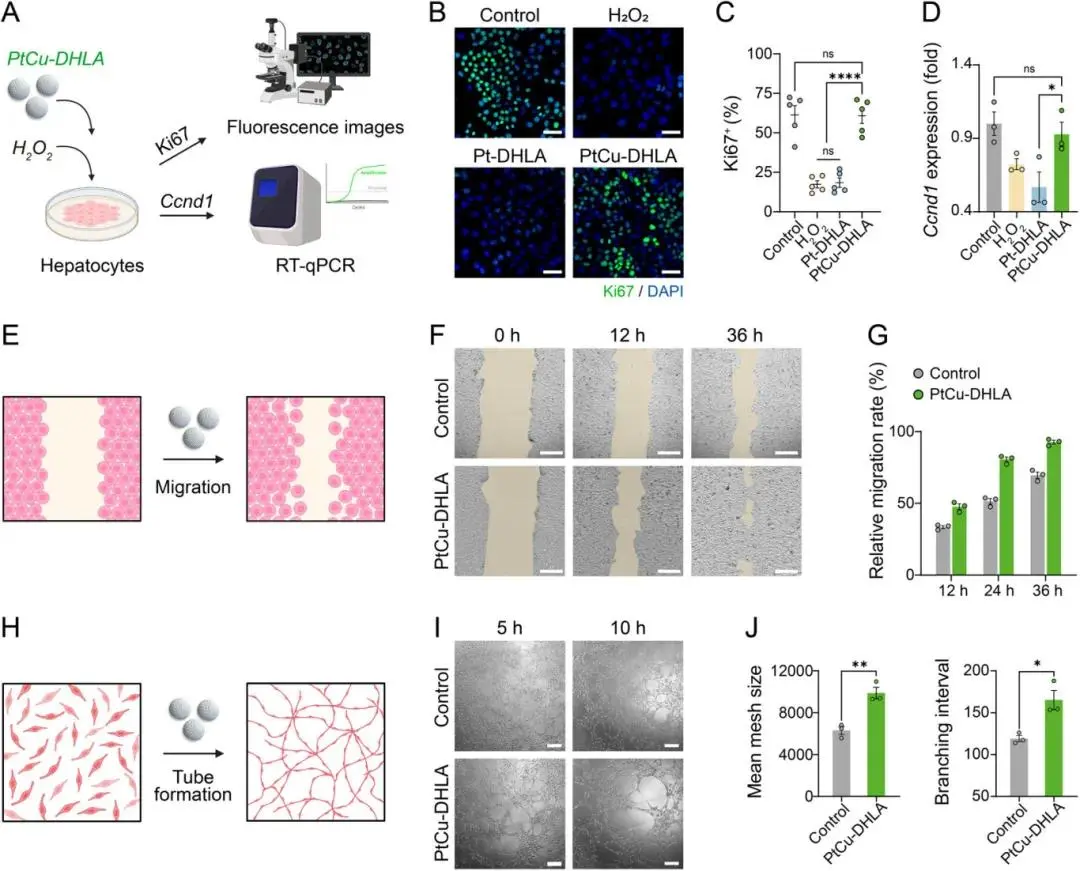
图4. PtCu-DHLA的促增殖与促血管生成潜能。(A)PtCu-DHLA处理H₂O₂刺激的AML-12细胞后,通过检测Ki67与Ccnd1表达评估其促增殖能力示意图(由BioRender.com绘制);(B)不同处理下AML-12细胞的Ki67荧光染色图;(C)Ki67阳性细胞比例的定量分析;(D)AML-12中Ccnd1的mRNA表达水平;(E)PtCu-DHLA促进HUVECs迁移的机制示意图(由BioRender.com绘制);(F)PtCu-DHLA共孵育下HUVECs在0、12和36 h的迁移图像;(G)不同时间点的迁移速率对比;(H)PtCu-DHLA促进HUVECs形成管状结构的示意图;(I)PtCu-DHLA共孵育5与10 h后的HUVECs成管图像;(J)成管能力的相关参数分析结果
(5)负载γhASCs的PLdECMMA微凝胶的制备与表征
PLdECM经甲基丙烯酸酐(MA)改性成功制备成光敏性PLdECMMA(图5A),其1H NMR与FT-IR谱图分别显示MA引入的烯丙基质子与C═C伸缩振动峰,交联后该特征峰消失,验证其可光交联聚合(图5B,5C)。PLdECMMA具备良好的多孔结构与力学性能(图5D,5F),紫外照射30秒内迅速成胶,适用于细胞封装(图5E)。剪切变稀特性验证其适用于微流控加工(图5G)。基于微流控技术,将γhASCs封装于PLdECMMA中形成尺寸约为238.7 ± 10.9 μm的高度均一微凝胶(图5I,5J)。封装3天后活死染色显示细胞存活良好(图5K),CCK-8检测确认细胞活力未受影响(图5L),验证PLdECMMA微凝胶对γhASCs具良好生物相容性。
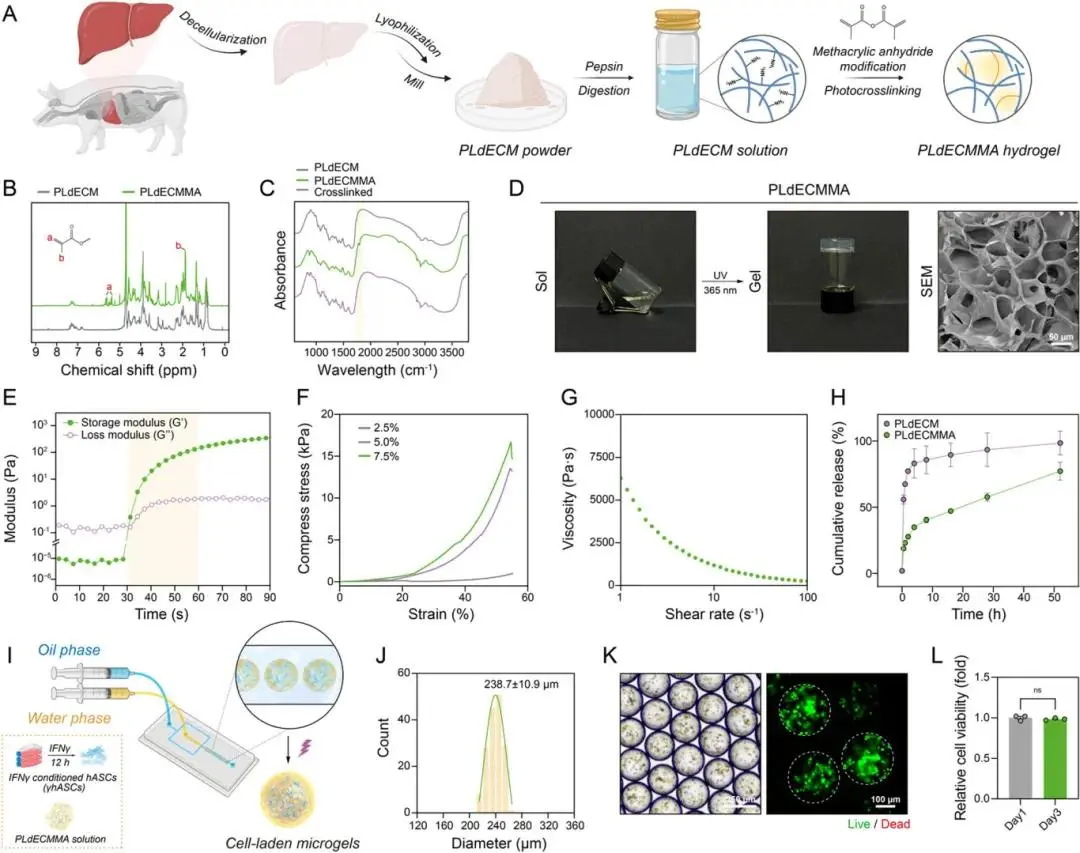
图5. 基于微流控技术构建负载细胞的PLdECMMA微凝胶。(A)PLdECM通过甲基丙烯酰化改性制备PLdECMMA的示意图;(B)PLdECM与PLdECMMA在D₂O中的¹H NMR谱图;(C)PLdECM、PLdECMMA及其交联水凝胶的FT-IR谱图,浅黄色区域为C═C伸缩振动峰;(D)PLdECMMA在紫外光照下的溶胶-凝胶转变及其冷冻干燥后交联结构的SEM图像;(E)PLdECMMA对紫外响应的流变学测试,浅黄色区域为紫外照射时间段;(F)PLdECMMA的剪切变稀行为;(G)不同浓度PLdECMMA的压缩力学性能;(H)PLdECM与PLdECMMA的累积释放曲线;(I)含IFNγ预处理hASCs(γhASCs)的PLdECMMA预水凝胶通过微流控技术构建负载细胞微凝胶的示意图;(J)细胞微凝胶的粒径分布;(K)细胞微凝胶的明场图与活/死染色图;(L)包埋第1天与第3天的细胞活性分析
(6)γhASCs-PLdECMMA微凝胶+ PtCu-DHLA复合物(PMPC)对四氯化碳诱导的酒精性脂肪肝的治疗作用
PMPC通过将PtCu-DHLA纳米酶与γhASCs负载的PLdECMMA微凝胶(PM)共封装于PLdECM水凝胶中构建而成。PLdECM外层实现PtCu-DHLA的快速释放应对早期病理过程,内层PM提供持续修复作用(图5H)。PtCu-DHLA嵌入后保持其功能稳定,且不影响水凝胶成胶性。移植后未引起小鼠T细胞亚群比例异常,提示生物相容性良好。
在CCl₄诱导的小鼠ALF模型中,PMPC治疗显著降低血清ALT、AST水平,改善肝脏外观及组织形态(图6A,B,I)。抗氧化相关基因Hnf4a、Nrf2、Sod1、Gpx1与Hmox1分别上调2.4、3.6、1.6、1.9与2.0倍(图6E);促炎因子Tnfa、Il1b、Nlrp3与Nos2分别降低至7.3%、4.6%、26.3%与22.8%(图6C);IL-10表达显著升高(图6D,F)。PMPC组肝组织中MDA含量最低,SOD1活性最高(图6G,H),提示氧化损伤明显缓解。TUNEL染色显示PMPC显著抑制肝细胞凋亡(图6J,L);Ki67染色显示其显著促进肝细胞增殖(图6K,L)。
在第3天进一步评估中,PMPC组的ALT、AST、TBA及MDA水平均低于自由细胞组(APC),肝坏死区域面积接近健康组水平,且Ki67表达达峰值,优于其他所有组别。综合来看,PMPC通过协同抗氧化、抗炎与促增殖机制有效逆转ALF。
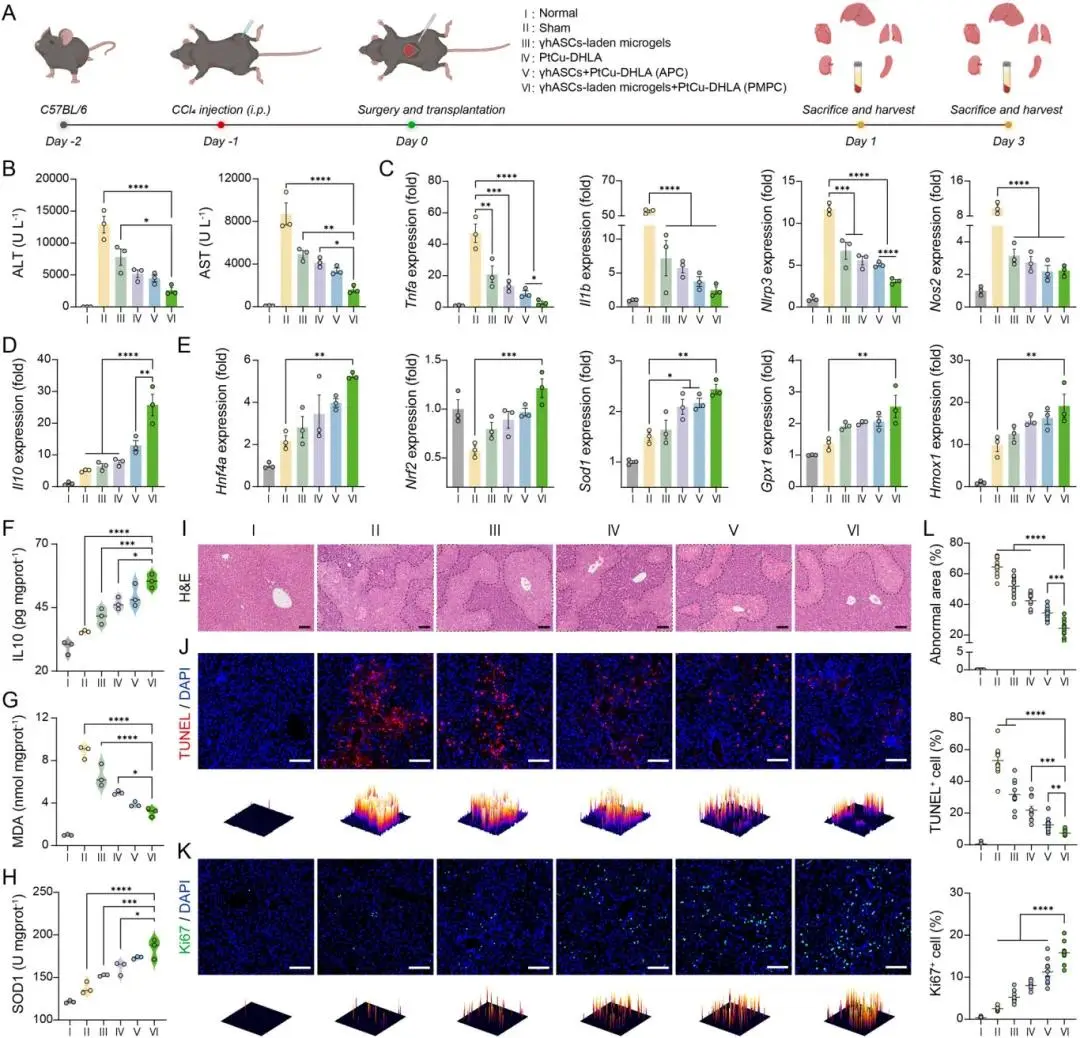
图6. PMPC对CCl₄诱导的急性肝衰竭的治疗效果。(A)动物实验整体流程示意图;(B)治疗1天后小鼠血清中ALT与AST水平;(C, D)小鼠肝组织中促炎因子Tnfa、Il1b、Nlrp3、Nos2(C)与抗炎因子Il10(D)的mRNA表达水平;(E)肝组织中Hnf4a、Nrf2、Sod1、Gpx1与Hmox1的mRNA表达水平;(F–H)肝组织中IL-10(F)、MDA(G)与SOD1(H)的含量;(I)治疗1天后肝组织的H&E染色图,黑色虚线标注异常区域;(J)肝组织的TUNEL染色图及3D表面图定量分析;(K)肝组织的Ki67免疫荧光染色图及3D表面图定量分析;(L)对应的异常区域比例(I)、TUNEL阳性细胞(J)及Ki67阳性细胞(K)的定量分析结果
(7)转录组分析支持PMPC的治疗效果
PMPC在治疗ALF过程中的分子机制通过肝组织转录组测序进行解析。PCA分析显示Treatment组在三维分布上更接近Healthy组,说明其转录水平与正常状态趋同(图7A)。三组间共表达19019个基因,其中Healthy与Treatment组特有共表达基因为947个,明显区别于ALF组(图7B)。差异基因分析显示,Treatment与ALF组间共检测到1975个上调基因和1686个下调基因(图7D),表达谱密度图和热图也印证了Treatment与Healthy组表达水平相似(图7C)。功能注释结果表明,Treatment组抗氧化相关基因显著上调(图7E),炎症相关基因表达被逆转(图7F)。GO富集分析显示“氧化还原酶活性”“催化活性”等GO条目在ALF中下调而在Treatment组中恢复上调,提示PMPC可调节氧化还原失衡(图7G)。三大类GO Top 20中显著富集条目主要涉及氧化应激与炎症调控(图7H)。此外,细胞增殖相关GO条目在Treatment组中显著富集,而凋亡相关条目则较为低表达(图7I)。KEGG通路分析进一步揭示了关键机制。PMPC显著激活与肝功能恢复相关的“谷胱甘肽代谢”“过氧化物酶体”等抗氧化通路,并抑制“蛋白加工(内质网)”相关通路,减轻内质网应激(图7J)。炎症相关通路如“IL-17信号通路”“TNF信号通路”“Toll样受体信号通路”均下调(图S20);细胞凋亡通路被抑制,而铁死亡与程序性坏死无显著改变(图7K)。综上,PMPC通过调控氧化应激、炎症反应、细胞凋亡及细胞增殖等多条关键路径,实现对CCl₄诱导ALF的多维治疗作用。
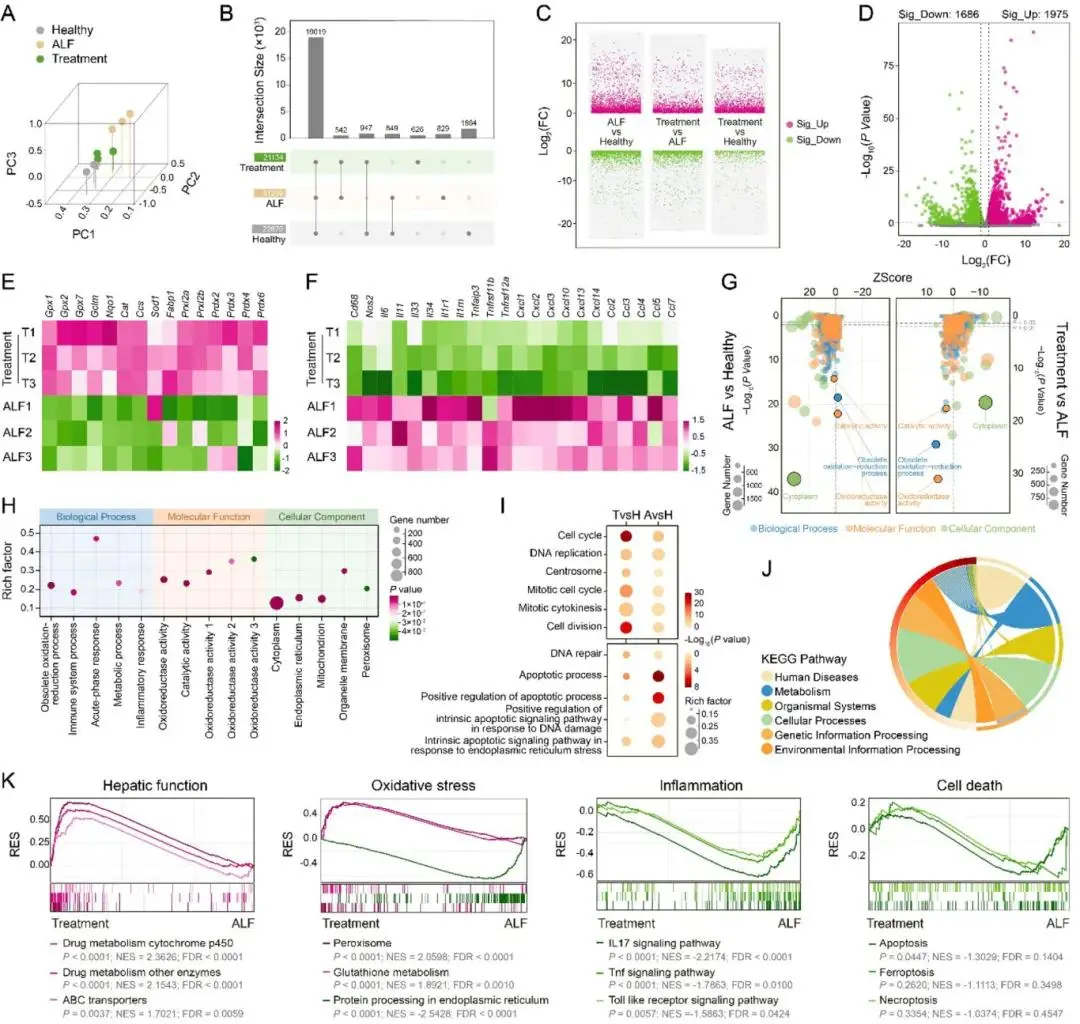
图7. 肝组织的转录组分析。Healthy组为正常小鼠,ALF组为模型对照组,Treatment组为PMPC治疗组;(A)三组样本的三维主成分分析(PCA);(B)三组间差异基因数量及交集的Upset图;(C)多组学差异基因(DEGs)火山图(p < 0.05 且 |log₂FC| > 1);(D)Treatment组与ALF组间显著上调与下调DEGs的火山图;(E, F)与抗氧化(E)及炎症(F)相关的DEGs热图;(G)ALF vs Healthy与Treatment vs ALF比较中的GO富集分析气泡图;(H)Treatment vs ALF中三大类Top 20 GO条目中的功能项,包含氧化还原酶活性相关条目;(I)ALF vs Healthy与Treatment vs Healthy中与细胞增殖(上)及凋亡(下)相关的GO功能富集分析;(J)Treatment vs ALF中KEGG通路富集分析的Circos图;(K)基于KEGG通路的GSEA富集分析,揭示与肝功能、氧化应激、炎症及细胞死亡相关的上下调通路
本研究构建了一种集成PtCu-DHLA纳米酶与IFNγ预处理间充质干细胞微凝胶的生物活性水凝胶平台(PMPC),用于治疗CCl₄诱导的急性肝衰竭。该平台通过PtCu-DHLA的类酶活性实现对ROS/RNS的高效清除,同时激活NRF2信号通路增强内源性抗氧化防御;并通过调控巨噬细胞极化、抑制炎症因子表达显著缓解肝内炎症环境。负载的γhASCs微凝胶维持了干细胞的免疫调节和组织修复功能,进一步促进肝细胞增殖与组织再生。体内实验表明,PMPC可显著改善肝功能指标、降低细胞凋亡、促进增殖标志物表达。转录组分析揭示其治疗机制涉及氧化还原平衡恢复、炎症信号通路抑制及凋亡与再生调控。综上,PMPC为急性肝衰竭提供了一种具有协同抗氧化、抗炎和促再生功能的多功能治疗策略,具备良好的应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

