
胶质母细胞瘤(GBM)患者的预后不良主要归因于手术切除后残留的高侵袭性微小肿瘤,几乎所有患者都会在最初切除病灶的狭窄边缘内复发。有效的 GBM 治疗需要精确的术中指导和有效的术后辅助治疗。

针对上述问题,南京大学医学院卢光明教授团队报道了一种多功能纳米平台SPIT探针,用于胶质母细胞瘤(GBM)的SERS引导切除、光热治疗和免疫治疗。SPIT探针由AuNS核、拉曼报告层和源自巨噬细胞膜的基因过表达SIRPα变体组成,具有强大独特的拉曼信号,可实现精准术中肿瘤切除。手术后,其光热效应可消融残留微小肿瘤灶,且巨噬细胞膜上SIRPα变体过表达能阻断CD47-SIRPα通路,增强巨噬细胞介导的肿瘤细胞吞噬作用,结合光热治疗可放大抗肿瘤免疫反应。实验结果表明,该联合疗法在原位胶质母细胞瘤模型中实现了优越的抗肿瘤效果,显著抑制肿瘤复发,将小鼠中位生存期延长两倍以上,为改善GBM治疗结果和预防肿瘤复发带来希望。该文章于2025年5月19日以《SERS-Guided Precision Resection Combined with Photothermal-Immunotherapy for Glioblastoma Recurrence Prevention》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202425168)。
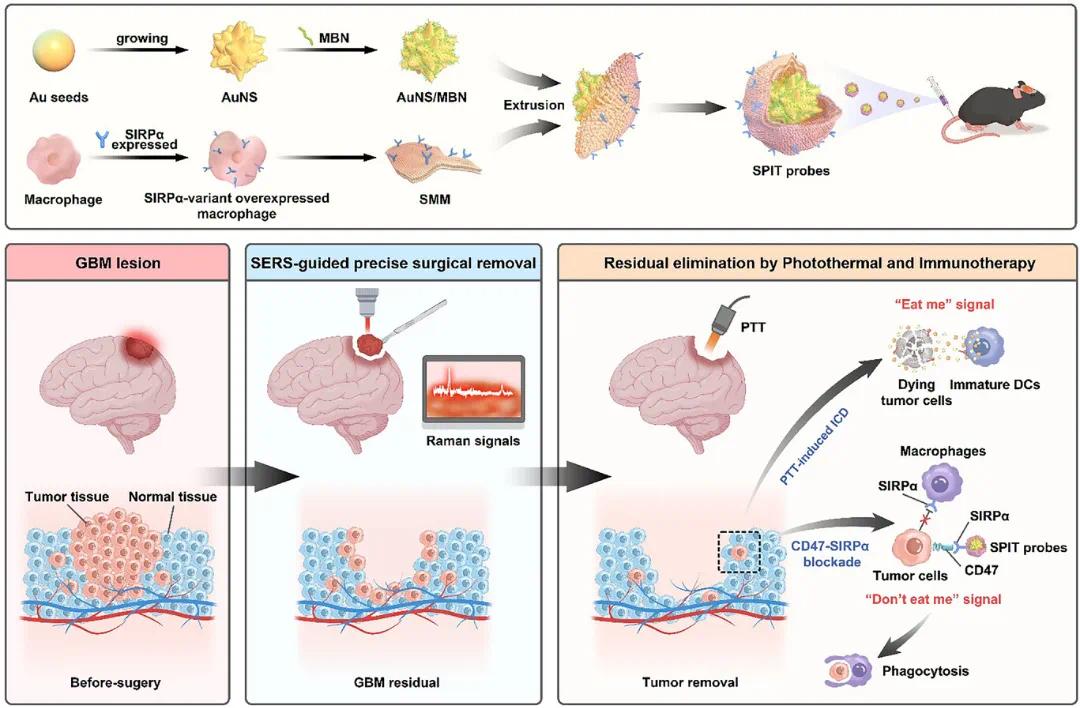
研究示意图
(1)SPIT探针的形态、拉曼和光热特性
慢病毒载体将编码突变型SIRPα变体(vSIRPα)的质粒转染入RAW 264.7细胞,增强细胞表面SIRPα蛋白表达。共聚焦成像显示,RAW 264.7-vSIRPα对CD47的亲和力高于野生型RAW 264.7细胞(图1A)。流式细胞术验证了RAW 264.7-vSIRPα细胞表面vSIRPα的功能(图1B)。
40 - 42 AuNSs因尖锐尖端具有优异SERS性能被选为SERS基底,MBN分子中的腈基(─C═N)提供独特拉曼峰,减少样品基质干扰。44 MBN通过Au - S键组装,AuNS/MBN在2228 cm⁻¹处表现出最大峰强度。通过共挤压工艺将AuNS/MBN包覆上RAW 264.7 - vSIRPα细胞膜,制备SPIT探针。透射电子显微镜(TEM)显示,AuNS/MBN被厚度约4 - 5 nm的巨噬细胞膜成功包覆(图1C)。AuNSs包覆上RAW 264.7 - vSIRPα细胞膜(SMM)后,zeta电位从 - 27.9 mV变为 - 28.4 mV,平均直径从73.6 nm增加到91.1 nm(图1D)。紫外 - 可见光谱显示,SMM包覆后,代表纵向局域表面等离子体共振的峰值发生轻微红移(4.9 nm)(图1E)。AuNSs、MBN和SPIT探针的拉曼光谱如图1H,AuNSs无信号,MBN粉末信号微弱,SPIT探针在相同MBN浓度下信号更强,显示其作为拉曼成像SERS报告分子的潜力。SPIT探针的拉曼信号在细胞培养基中孵育72小时内基本保持一致(图1I),验证了拉曼信号在生物环境中的稳定性。
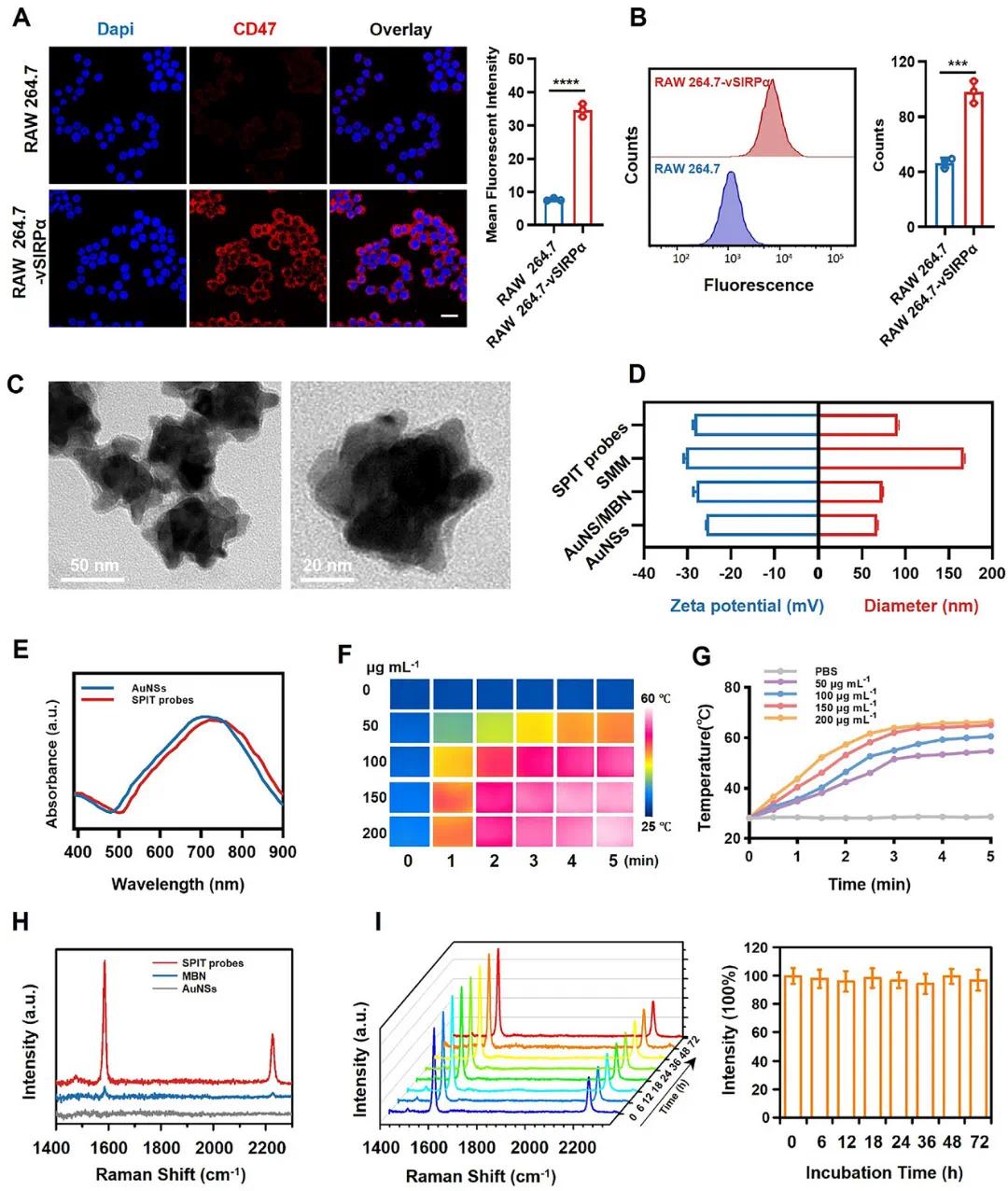
图1 SPIT探针的制备与表征。(A,B)免疫荧光分析和流式细胞术分析SIRPα在野生型RAW 264.7细胞和RAW 264.7-vSIRPα细胞中的CD47结合能力,标尺=25 µm;(C)SPIT探针的透射电子显微镜(TEM)图像;(D)动态光散射分析测量的不同NPs的尺寸分布和zeta电位;(E)水溶液中AuNSs和SPIT探针的紫外-可见吸收光谱;(F)激光照射不同浓度SPIT探针后的温度升高(PBS,50,100,150和200 µg mL⁻¹);(G)激光照射不同浓度SPIT探针后的热图像;(H)MBN、AuNSs和SPIT探针的拉曼光谱;(I)SPIT探针在血清中孵育72小时后拉曼信号的稳定性及2217 cm⁻¹峰强度变化(n=3,785 nm激光,150 mW,5×物镜,0.5 s积分时间)
(2)SPIT探针的BBB跨越机制和靶向能力
已有研究表明巨噬细胞膜上整合素α4与Mac - 1及内皮细胞上ICAM - 1或VCAM - 1相互作用,会触发细胞内信号级联反应,导致紧密连接(TJ)破坏和肌动蛋白细胞骨架重组,增加BBB通透性,还可激活CAM介导的内吞作用。Western blot分析检测SPIT探针上相关分子存在情况(图2A),证实整合素α4和Mac - 1在巨噬细胞膜上表达且在SPIT探针上保存完好。使用Transwell系统中体外BBB模型研究SPIT探针跨越BBB能力(图2B),bEnd.3细胞在上室培养形成完整单层,TEER值超过200Ω·cm²才有效,模型中紧密单层TEER值达300Ω·cm²(图2C)。通过免疫荧光染色检测bEnd.3细胞中ZO - 1表达评估SPIT探针引入后TJ破坏情况(图2D),ZO - 1是与TJ相关蛋白,SPIT组中ZO - 1表达分散且较PBS、AuNS和AuNS/MBN@MM组分别降低2.3、2.1和1.7倍(图2E),表明SPIT探针降低TJ紧密度,促进其穿过血脑屏障。通过测量治疗后12小时下层腔室Au浓度量化SPIT探针穿透效率(图2F),SPIT探针血脑屏障通透性最高,与PBS、AuNS和AuNS/MBN@MM组相比,穿透效率分别高约211.4、2.6和1.7倍。基于下层腔室中GL261细胞摄取评估SPIT探针肿瘤靶向能力,共聚焦激光扫描显微镜(CLSM)(图2G)和流式细胞术分析(图2H)均显示,ICG标记的SPIT探针肿瘤细胞靶向效率显著高于游离ICG、ICG标记的AuNS和ICG标记的AuNS/MBN@MM,这种增强靶向效率可能由vSIRPα过表达介导,与GL261细胞上CD47相互作用。此外,评估SPIT探针在活细胞中SERS成像能力,用SPIT探针孵育4小时后,细胞可通过SERS成像清晰可视化(图2I),表明其可用于活细胞轮廓可视化。
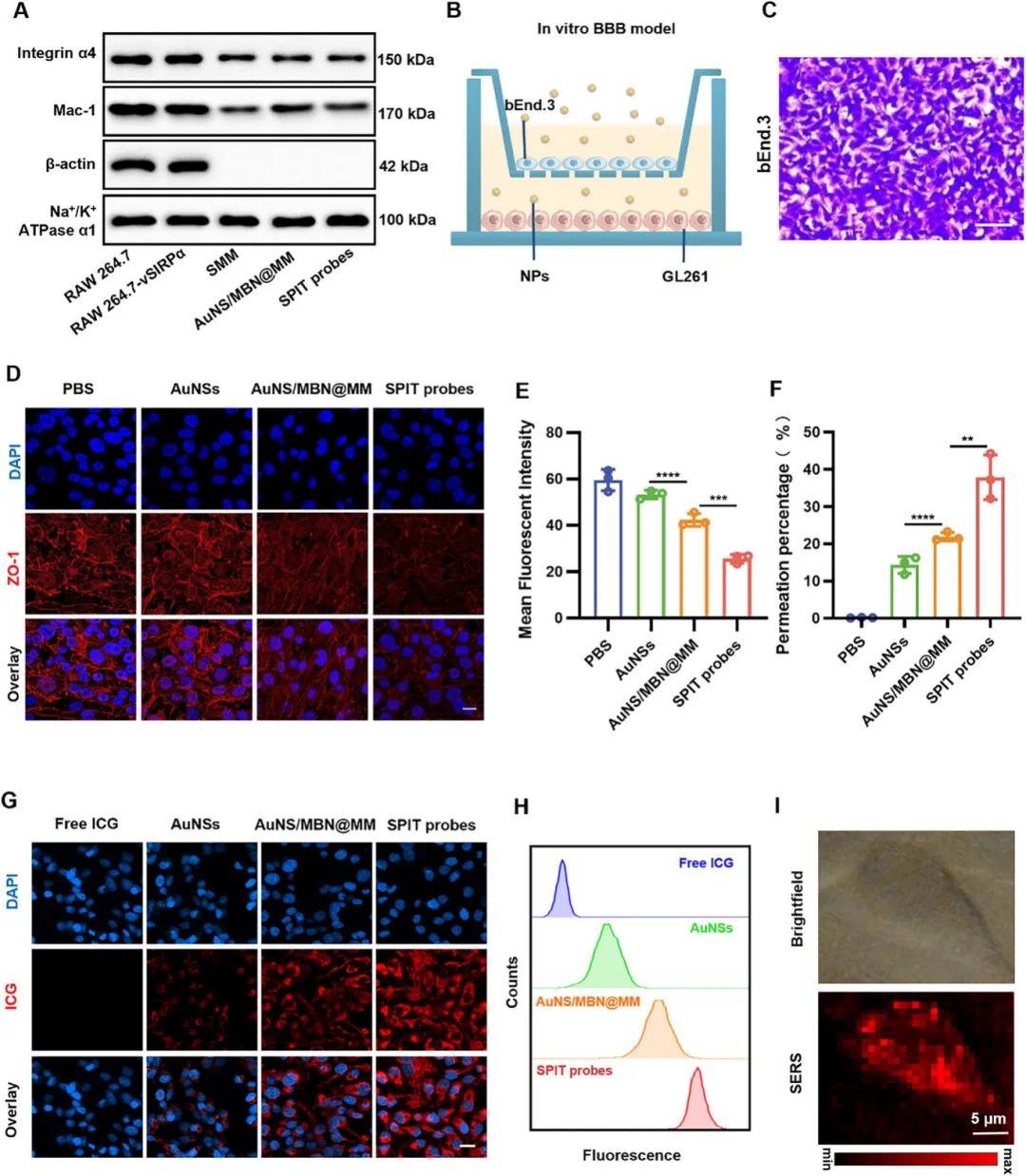
图2 SPIT探针的跨血脑屏障(BBB)和靶向能力。(A)Western blot分析显示RAW 264.7细胞、RAW 264.7-vSIRPα细胞、SMM、AuNS/MBN@MM和SPIT探针中整合素(Integrinα4和Mac-1)的表达;(B)体外血脑屏障模型的示意图;(C)上室中培养的bEnd.3细胞的CLSM图像,标尺:100µm;(D)经PBS、AuNSs、AuNS/MBN@MM和SPIT探针处理后的bEnd.3细胞的代表性免疫荧光图像和(E)ZO-1荧光强度的定量,ZO-1呈红色,细胞核呈蓝色,标尺=25µm;(F)与PBS、AuNSs、AuNS/MBN@MM和SPIT探针孵育12小时后,下室中Au的含量;(G)经BBB渗透后,GL261细胞中游离ICG、ICG标记的AuNS、ICG标记的AuNS/MBN@MM和ICG标记的SPIT探针积累的代表性CLSM图像和(H)流式细胞术分析;(I)与SPIT探针孵育12小时后,GL261细胞的明场和SERS图像
(3)体外抗肿瘤治疗效果
CCK - 8法评估SPIT探针在GL261和bEnd.3细胞中的细胞毒性,结果表明其在两种细胞系中均表现出剂量依赖性的低细胞毒性(图3A),具有良好的生物相容性。Calcein - AM/PI染色评估经SPIT探针和激光照射(SPIT + laser)处理的GL261细胞活力,CLSM成像显示SPIT + laser组呈现强烈红色荧光信号,细胞大量死亡,而PBS、仅激光和仅SPIT组主要呈现绿色荧光,细胞活力较高(图3B)。流式细胞术分析凋亡结果相似(图3C)。Western blot结果显示,SPIT + laser组凋亡相关蛋白Bcl - 2下调,Bax和cleaved Caspase - 3上调(图3D),与凋亡流式细胞术分析结果一致,证明SPIT + laser组能显著诱导肿瘤细胞凋亡,且在激光照射下,GL261细胞的杀伤作用呈剂量依赖性,SPIT探针剂量增加,细胞活力显著下降(图3A)。光热疗法(PTT)可诱导肿瘤细胞发生免疫原性细胞死亡(ICD),释放TAAs和DAMPs。免疫荧光分析和ELISA评估SPIT探针介导的PTT处理后GL261细胞中CRT暴露及HMGB1和ATP分泌情况,结果显示SPIT + 激光处理显著上调CRT表达并增强HMGB1和ATP释放(图3E),表明SPIT探针介导的PTT能有效诱导ICD。共培养RAW 264.7细胞和GL261细胞,评估高亲和力vSIRPα增强巨噬细胞吞噬功能的能力,CLSM和流式细胞术均显示高亲和力vSIRPα蛋白导致巨噬细胞吞噬能力显著增加(图3F)。
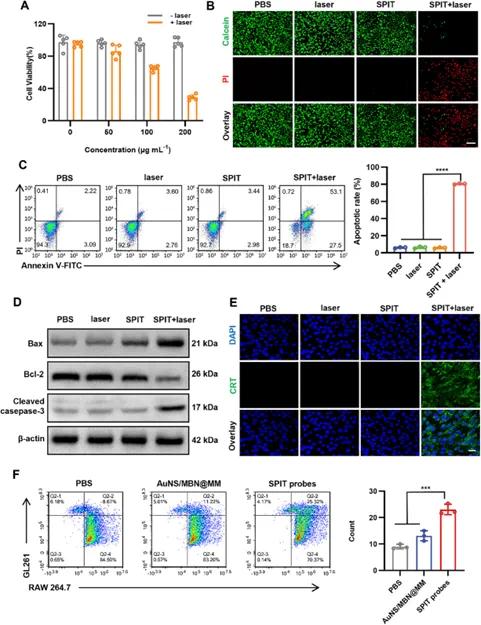
图3 体外治疗效力和免疫效力评估。(A)不同浓度下使用SPIT探针处理GL261细胞的相对活力,有或无激光照射,通过CCK - 8测定法确定,数据表示为平均值±标准差(n=5);(B)用PBS、激光、SPIT和SPIT + 激光处理的GL261细胞的活/死染色图像,死细胞用PI染成红色,活细胞用Calcein - AM染成绿色,标尺=100µm;(C)流式细胞术分析不同处理24小时后的GL261细胞凋亡情况,数据表示为平均值±标准差(n=3),****p<0.0001;(D)不同处理后GL261细胞中Bax、cleaved Caspase - 3和Bcl - 2表达的Western blot分析;(E)不同处理后GL261细胞中CRT表达的荧光图像,标尺=25µm;(F)流式细胞术分析(左)和相对定量(右)不同处理后RAW 264.7巨噬细胞对GL261细胞的吞噬情况
(4)靶向效率、SERS 特性及光热疗法在原位胶质母细胞瘤异种移植模型中的表现
为评估SPIT探针在体内的肿瘤靶向效率,建立了GL261原位胶质母细胞瘤小鼠模型。静脉注射游离ICG、ICG标记的金纳米颗粒(AuNSs)和ICG标记的SPIT探针后,在不同时间点进行体内荧光成像。结果显示,游离ICG组在肿瘤部位未检测到可识别的荧光信号,AuNSs组显示微弱荧光信号,而SPIT组在肿瘤区域表现出强烈荧光强度,注射后12小时达到峰值(图4A)。为分析SPIT探针的生物分布,在小鼠注射后12小时处死,取出大脑和其他主要器官进行离体荧光成像,SPIT组在原位脑肿瘤中显示出最强荧光信号(图4B,C),且SPIT探针也在肝脏和脾脏中积聚。这些结果表明SPIT探针具有高肿瘤蓄积性。随后,在注射后24小时收获主要器官和肿瘤,通过电感耦合等离子体原子发射光谱法(ICP - AES)对其Au含量进行定量。
为验证SPIT探针的肿瘤特异性,在注射后24小时采集脑组织,使用苏木精和伊红(H&E)染色及荧光显微镜进行分析,结果表明SPIT探针主要定位于GBM肿瘤区域(图4D),证明其具有穿过血脑屏障的能力和肿瘤选择性积累,其在GBM部位的稳定SERS信号和高积累效率,凸显了在手术导航方面的巨大潜力。为验证基于SPIT探针的图像引导肿瘤切除术的可行性,使用正立共聚焦拉曼显微镜光谱仪收集SERS信号。通过拉曼成像观察整个完整肿瘤,并在手术切除过程中采用SERS对肿瘤组织去除进行实时监测(图4E,F),发现手术后强SERS信号的像素数量逐渐减少。在原发肿瘤最大切除后,使用SERS扫描手术区域以检查残留的微肿瘤,拉曼成像成功揭示了显微镜下无法检测到的额外残留微肿瘤信号,对这些残留微肿瘤病灶的手术切除持续进行,直到检测不到拉曼信号,以确保最大程度肿瘤切除。这些结果表明,使用SERS进行图像引导的手术切除术有助于界定肿瘤边缘,促进原发肿瘤切除,并识别术后残留的微肿瘤。为进一步研究肿瘤边缘,对切除的组织进行拉曼光谱映射和苏木精 - 伊红染色,SERS成像精确地勾勒出了肿瘤与正常组织之间的边界(图4G),且透射电子显微镜(TEM)证实肿瘤组织中存在大量SPIT探针,而在邻近的正常组织中未观察到探针(图4H),表明拉曼成像策略可有效应用于图像引导的肿瘤切除术。
最终评估了SPIT探针在体内的光热性能。在治疗后12小时,对GL261原位肿瘤小鼠用808 nm激光(0.5 W cm⁻²)照射5分钟,结果显示SPIT探针对肿瘤床产生了良好的光热效应,照射5分钟后使其温度从28.9℃升高到45.0℃(图4I,J),而对照组在相同条件下仅表现出轻微的温度升高。
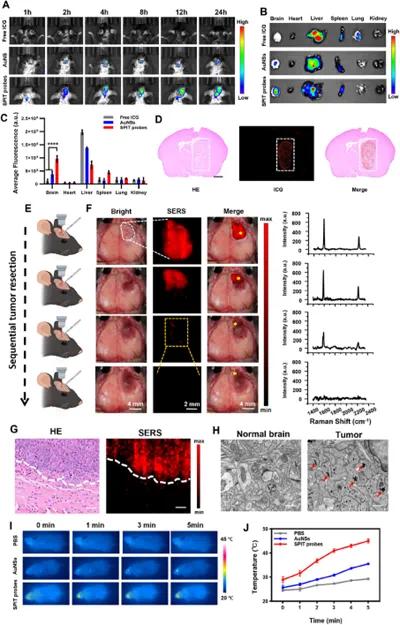
图4 体内SPIT探针的肿瘤蓄积、SERS引导手术和光热治疗。(A)注射游离ICG、ICG标记的AuNS和ICG标记的SPIT探针后,不同时间点GL261胶质母细胞瘤小鼠原位肿瘤的实时生物发光图像;(B)治疗后肿瘤小鼠主要器官(心脏、肝脏、脾脏、肺、肾脏和大脑)的荧光图像;(C)不同主要器官体外荧光成像的半定量结果;(D)包含肿瘤的全脑切片的苏木精 - 伊红染色及相应肿瘤切片的荧光图像,SPIT探针标记ICG(红色),标尺=1毫米;(E)GBM手术中SERS引导的顺序切除示意图;(F)根据拉曼信号位置识别肿瘤,依次切除肿瘤,所有肿瘤在肉眼判断完全切除后,组织中仍检测到几个小的拉曼信号焦点(橙色虚线方框所示),继续切除直至未检测到进一步拉曼信号,相应的代表性拉曼光谱(星号符号)展示了SERS引导的GBM切除的连续阶段;(G)一例GBM边缘的H&E染色和拉曼光谱图像,虚线表示肿瘤边缘,比例尺=50µm;(H)GL261原位肿瘤小鼠GBM组织和对侧正常脑组织的代表性TEM图像,显示肿瘤组织中存在SPIT探针(红色箭头),比例尺=50µm;(I)808 nm激光照射后残留肿瘤腔内的红外热图像,显示温度变化;(J)照射区域的相应温度曲线
(5)原位胶质母细胞瘤小鼠模型的治疗效果和生物相容性
确定SPIT探针在肿瘤组织中的保留时间和光热效应后,提出了一种结合SERS图像引导手术、PTT和免疫治疗的多模式肿瘤治疗方案(图5A)。利用表达荧光素酶的GL261肿瘤细胞建立生物发光原位胶质母细胞瘤小鼠模型,肿瘤植入后一周,将小鼠随机分为六组(每组8只):G1(对照组)未治疗;G2(手术组)无图像引导的肿瘤切除术;G3(SERS引导手术组)SERS引导手术;G4(SERS引导手术+PTT组)SERS引导手术+PTT;G5(SERS引导手术+免疫治疗组)SERS引导手术+免疫治疗;G6(SERS引导手术+PTT+免疫治疗组)SERS引导手术+PTT+免疫治疗。G3和G4组中封装AuNS/MBN的巨噬细胞膜来自野生型RAW 264.7细胞。G3组手术前12小时接受SPIT探针处理,随后进行SERS引导的肿瘤切除术;G4组接受相同处理,但在手术期间额外进行808 nm激光照射用于PTT。生物发光成像监测肿瘤生长,结果显示,对照组肿瘤渐进性生长,手术组最初肿瘤缩小后快速复发,两组肿瘤复发率均为100%(图5B、C)。与手术组相比,S-surg组因SERS检测到微观残留肿瘤而延迟肿瘤复发,S-surg+PTT组和S-surg+IT组进一步增强肿瘤抑制效果,分别有50%和37.5%的小鼠观察到肿瘤复发,而S-surg+PTT+IT组仅12.5%的小鼠出现肿瘤复发(图5D),其总生存期(OS)中位数超过70天,显著长于其他组(图5E)。组织学分析显示,H&E染色、Ki67免疫荧光和TUNEL检测表明S-surg+PTT+IT治疗最有效地抑制GBM增殖并诱导细胞凋亡(图5F - H)。PBS组和协同治疗组在白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、血细胞比容(HCT)、血小板(PLT)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿素氮(BUN)或肌酐(Cr)水平方面未观察到显著差异,表明无血液学、肝毒性或肾毒性。
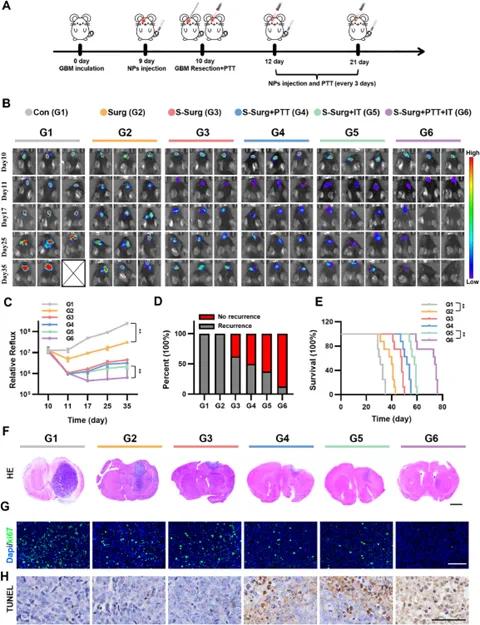
图5 体内治疗效果。(A)示意图说明评估不同方案抗复发疗效的治疗方案时间线,GL261 - Luc细胞原位接种到C57小鼠脑内,第9天生物发光强度相似的小鼠随机分配到六个治疗组,静脉注射纳米颗粒(NPs),注射后12小时进行胶质母细胞瘤切除,手术结束后立即对肿瘤腔进行808 nm激光照射(5分钟),第12天到第21天每3天进行一次额外的纳米颗粒注射和光热治疗;(B)不同治疗方案下GL261原位胶质母细胞瘤小鼠肿瘤进展的代表性生物发光图像,灰色框表示死亡小鼠;(C)原位胶质母细胞瘤肿瘤的定量生物发光水平,数据表示为均值±标准差(n=3),**p<0.01;(D)肿瘤复发率和(E)Kaplan - Meier生存曲线显示不同组小鼠的生存情况,数据表示为均值±标准差(n=8),**p<0.01;(F)H&E(标尺=2 mm),(G)Ki67(标尺=100µm),和(H)TUNEL(标尺=100µm)染色为不同治疗后肿瘤小鼠脑组织切片
(6)体内免疫反应研究
治疗三周后收集残余复发肿瘤组织进行流式细胞术分析,S-surg+PTT+IT组肿瘤部位的DC细胞(CD11c、CD80+和CD86+)数量高于其他组(图6A),原因是PTT消融后肿瘤细胞释放的TAA能募集更多DC细胞,且CD47阻断增强了巨噬细胞对肿瘤细胞的吞噬作用并激活先天免疫系统,成熟DC细胞作为APC促进了后续免疫反应。该组肿瘤部位的CD8+T细胞和CD4+T细胞浸润显著增加(图6B,C),Treg(CD25+、Foxp3+T细胞)百分比下降(图6D),免疫荧光染色也证实了联合治疗后CD4+T细胞和CD8+T细胞向肿瘤组织的浸润增加(图6E)。此外,ELISA检测显示S-surg+PTT+IT组肿瘤组织中IL - 6、TNF - α、IFN - γ和IL - 12分泌显著增加,而IL - 10分泌减少(图6F - J),表明该策略在增强肿瘤内抗肿瘤淋巴细胞浸润和减少免疫抑制性淋巴细胞浸润方面表现出色,实现了强大的抗肿瘤免疫效应,且全身抗肿瘤免疫被激活。
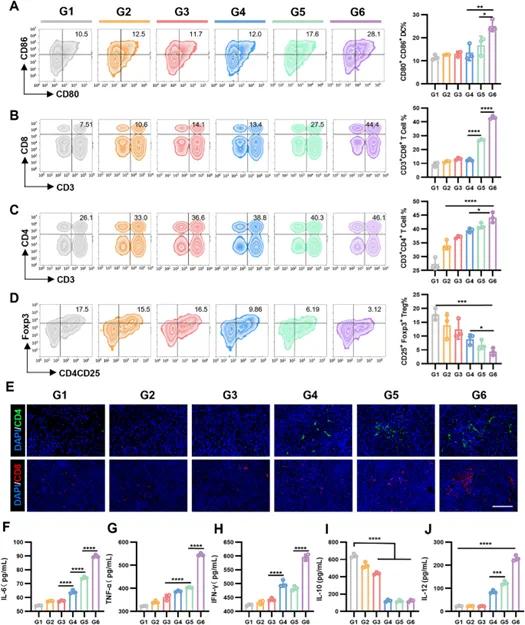
图6 体内免疫应答激活。流式细胞术分析显示不同治疗组肿瘤中(A)CD80+CD86+树突状细胞的百分比,(B)CD3+CD8+T细胞的百分比,(C)CD3+CD4+T细胞的百分比,以及(D)CD25+Foxp3+调节性T细胞的百分比;(E)肿瘤组织中CD4+和CD8+T细胞的免疫荧光图像,标尺=100µm;(F - J)不同治疗后检测到的血清IL - 6、TNF - α、IFN - γ、IL - 10和IL - 12水平,所有数据均表示为均值±标准差(n=3)
(7)抗肿瘤治疗的机制探索
从接受PBS和S - surg+PTT+IT治疗的小鼠体内收集肿瘤组织进行转录组分析,两组肿瘤的基因表达谱差异由图7A中的Venn图所示,共鉴定出869个差异表达基因,包括632个上调基因和237个下调基因(|log₂FC|>1.0,P≤0.05)。火山图(图7B)展示了DEGs的分布,显著上调的基因以红色表示,下调的基因以蓝色表示。差异表达基因通过基因本体论(GO)分析被归类为“生物过程”、“细胞组分”和“分子功能”模块,在细胞粘附、细胞外空间、微丝马达活性等过程中发挥关键作用。进一步筛选出20个与免疫相关的差异表达基因,包括抗原处理和呈递相关的CD1B和CALR,细胞因子相关的ADM2、ANGPTL5和AMBN,趋化因子相关的CCL13和CAMP,这些基因在S - surg+PTT+IT组中显著上调(图7C),表明PTT联合免疫治疗能有效刺激肿瘤组织中的免疫反应。免疫相关基因的京都基因与基因组百科全书(KEGG)分析显示,免疫反应的激活主要依赖于细胞因子和炎症反应、C型凝集素受体信号通路以及细胞色素P450的氧化作用,S - surg+PTT+IT治疗有效激活了小鼠的免疫反应,调节了免疫抑制性微环境,增强了胶质母细胞瘤免疫治疗的疗效。RNA - Seq数据的KEGG富集分析显示,S - surg+PTT+IT治疗改变了胶质母细胞瘤中与HIF - 1α信号通路、MEK/ERK信号通路和PI3K - Akt信号通路等相关的基因表达(图7D)。Western blot检测显示,在S - surg+PTT+IT组中p - MEK和p - ERK水平降低,而MEK、ERK、PI3K、P - AKT和HIF - 1α水平没有显著变化(图7E),免疫荧光分析进一步证实了S - surg+PTT+IT组中P - MEK和P - ERK表达的显著下调(图7F),表明S - surg+PTT+IT治疗抗GBM效应的可能机制之一是MEK/ERK信号通路的抑制。
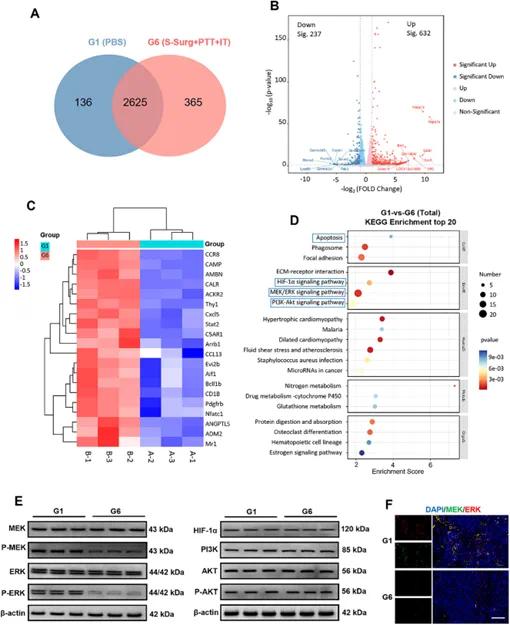
图7 转录组分析抗肿瘤机制。(A)显示PBS组和S-surg+PTT+IT组肿瘤基因表达重叠的维恩图;(B)PBS组和S-surg+PTT+IT组肿瘤中上调和下调基因的火山图;(C)显示差异表达免疫相关基因的热图;(D)PBS组和S-surg+PTT+IT组上调和下调基因簇的KEGG富集分析;(E)各组肿瘤组织中HIF - 1α、MEK、P - MEK、ERK、P - ERK、PI3K、AKT和P - AKT的表达的Western印迹;(F)GBM组织中P - MEK和P - ERK的免疫荧光染色,标尺=20µm
本研究构建了用于全面治疗脑瘤的创新SPIT探针,通过结合手术导航和术后治疗实现综合管理。这些纳米颗粒封装在巨噬细胞 - vSIRPα膜中,具有增强的穿越血脑屏障能力,并能在脑肿瘤部位有效富集。该探针利用高灵敏度SERS实现术中实时引导,结合光热治疗(PTT)和CD47 - SIRPα阻断免疫治疗,最大限度地消除残留微肿瘤,抑制肿瘤复发,显著提高GBM小鼠模型的生存率,为GBM治疗提供了一种有前景的方法。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

