
腹壁缺损修复存在诸多挑战,主要因感染、生物相容性差及修复材料机械性能不足等并发症。合成网片虽常用于腹壁重建,但易引发感染、器官损伤、血清肿形成和组织整合延迟等严重并发症,且缺乏可降解性,难以实现长期修复。同时,修复材料常引发过度炎症、纤维化和异物反应,导致粘连、器官损伤和材料排斥等。此外,修复材料在机械强度和柔韧性之间实现平衡仍面临较大挑战。

针对上述问题,东南大学张天柱教授团队开发了3DPF贴片,其核心材料为4arm-PLGA-GPO(4A-GPO),由GPO肽序列与4armPLGA偶联合成,可增强生物活性和机械性能。贴片封装bFGF刺激细胞增殖和迁移,抗菌层由大黄素和妥布霉素组成。体内研究显示,3DPF贴片减少纤维化和粘连,促进血管生成和胶原蛋白沉积,调节免疫反应加速组织修复。转录组学分析显示,贴片下调IL-17介导的炎症途径,上调细胞粘附分子相关途径。分子对接研究表明,贴片与VEGF和COL3等关键分子相互作用,增强血管生成和基质重塑。相关成果于2025年5月2日以《Collagen-Inspired 3D Printing Electrospinning Biomimetic Patch for Abdominal Wall Defect Regeneration》发表在《Advanced Fiber Materials》(DOI:10.1007/s42765-025-00547-4)。
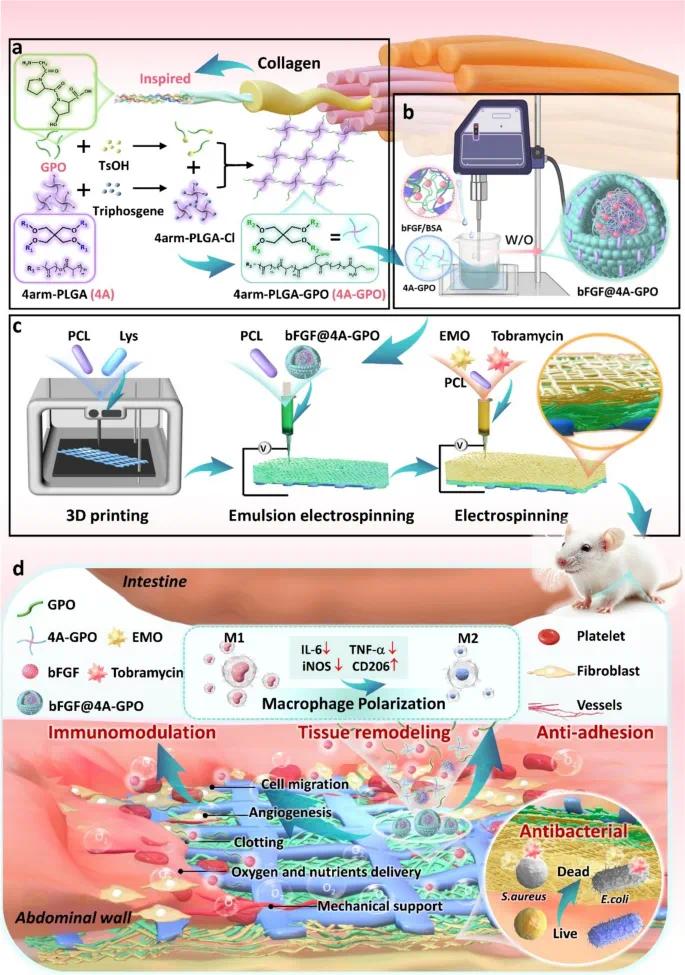
研究示意图
(1) 4A-GPO 的设计与表征
通过固相肽合成(SPPS)方法合成GPO三肽。图1a展示了将GPO三肽共轭到4A聚合物上的合成路线。图1b显示GPO化学结构由甘氨酸、脯氨酸和羟脯氨酸组成。图1c的圆二色性(CD)光谱在220 nm附近呈现负峰,表明存在β-转角结构。图1d显示不同浓度GPO的紫外-可见吸收光谱,吸光度随浓度增加而上升。图1e展示了4A-GPO的结构,表明GPO成功共轭到4A上。图1f的¹H-NMR光谱和图1g的FTIR光谱进一步验证了4A-GPO的化学结构。图1h的热重分析(TGA)显示GPO在约200°C下稳定,4A在约280°C下稳定。图1i和j的溶血试验显示4A-GPO的溶血率低于5%,表明其生物相容性良好。
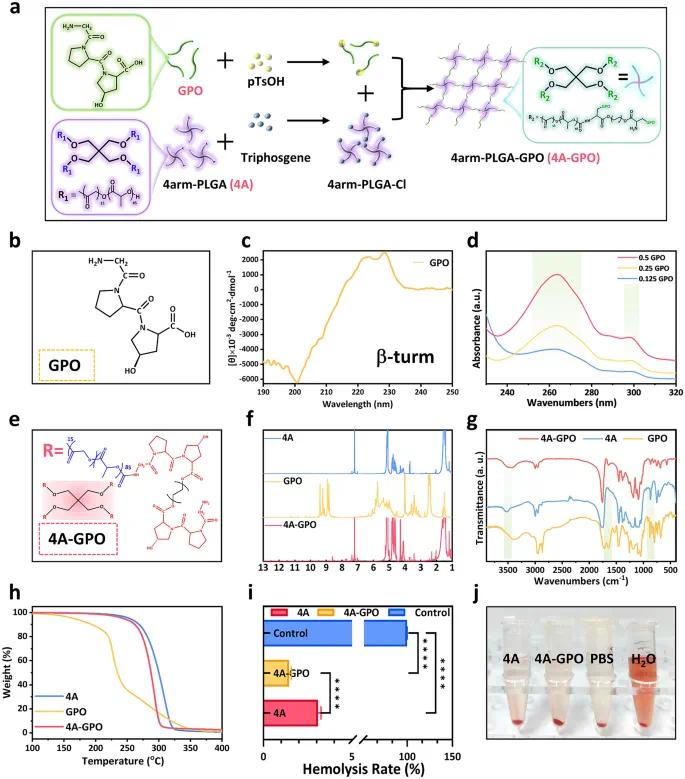
图1 4A-GPO的合成与表征。(a)4A-GPO的设计;(b)GPO的分子结构;(c)GPO的CD光谱;(d)GPO的紫外-可见光谱;(e)4A-GPO的分子结构;(f)4A、GPO和4A-GPO的¹H-NMR光谱;(g)4A、GPO和4A-GPO的FTIR光谱;(h)4A、GPO和4A-GPO的TGA光谱;(i)和(j)4A和4A-GPO的体外溶血实验
(2)乳液纳米纤维支架的设计与表征
图2a展示了bFGF@4A-GPO的制备过程,bFGF通过W/O乳液法封装在4A-GPO中形成纳米纤维支架。图2b显示4A-GPO组细胞密度高于对照组,表明其促进细胞黏附,且bFGF@4A-GPO组细胞数量更多,定量分析也证实了这一点(图2c),说明bFGF进一步促进细胞增殖。图2d显示bFGF@4A-GPO组细胞迁移能力最强,伤口闭合率约85%,显著高于其他组。图2f的活/死染色显示4A-GPO和bFGF@4A-GPO组活细胞数量显著增加。图2g的DPPH清除结果表明4A-GPO中抗氧化成分中和了更多自由基,bFGF@4A-GPO活性最高,接近150%。图2h显示bFGF@4A-GPO组L929细胞存活率最高,显著优于其他组。

图2 bFGF@4A-GPO的制备及表征。(a)bFGF@4A-GPO的制备及乳液纳米纤维支架的制造流程;(b)贴片上培养的L929细胞的光学图像;(c)细胞数量定量结果;(d)划痕试验的荧光染色图像;(e)伤口闭合百分比;(f)贴片上培养24小时的L929细胞的活/死染色分析;(g)DPPH的紫外-可见光谱;(h)与贴片共培养不同时间后L929细胞的存活率
(3)3DPF 贴片的制备与表征
图3a展示了仿生3DPF贴片的制备流程:先用PCL和Lys通过3D打印构建宏观支架结构,再通过乳液静电纺丝技术在支架上制备含bFGF@4A-GPO的修复层,最后涂覆包含大黄素和妥布霉素的抗菌层。图3b为3D打印层的SEM图像,显示纤维直径分布均匀。图3c统计显示,3D打印层平均纤维直径约625.9μm,多在500–700μm范围内,有助于维持结构完整性和生物学功能,促进细胞渗透并提供机械支撑。修复层水接触角为67.8°(图3d),亲水性利于液体渗透、GPO/bFGF释放及细胞黏附增殖,其平均纤维直径209.3nm(图3e),纤细结构及高表面积体积比利于细胞附着。抗菌层水接触角128.8°(图3f),疏水性可保护结构免受水分侵蚀,避免抗菌效能下降,平均纤维直径416.9nm(图3g)。图3h对比P贴片与3DPF贴片的力学性能应力-应变曲线:P贴片延展性好,可承受高达700%的应变,应力峰值约3.5MPa;3DPF贴片在应变约160%时应力达9MPa左右,延展性和强度均优于P贴片,多层结构提升了力学性能,满足强度与柔韧性的平衡需求。图3i的光学图像显示3DPF贴片宏观形态均匀,弯曲不断裂,兼具微观结构功能性与宏观结构稳定性,对生物应用中的实际效能至关重要。

图3 3DPF贴片的制备与表征。(a)通过3D打印和静电纺丝技术制备3DPF贴片的示意图;(b)顶层(3D打印层)的SEM图像及水接触角观测;(c)顶层纤维直径统计结果;(d)层(抗菌层)的SEM图像及水接触角观测;(g)底层纤维直径统计结果;(h)P贴片与3DPF贴片的力学性能对比;(i)3DPF贴片的柔韧性展示
(4)3DPF 贴片的体外生物相容性与抗菌性能
图4a展示了3DPF贴片与细胞共培养的示意图。图4b为3DPF贴片与细胞共培养的光学显微镜图像。3D打印层构建了支架的整体形态和多孔结构,对细胞浸润和营养物质运输至关重要。纳入具有特定生物活性的纳米纤维(如bFGF@4A-GPO)可模拟细胞外基质(ECM),增强细胞黏附、迁移和分化。图4c通过分子对接分析揭示了3DPF材料与整合素之间的相互作用机制。图4d、e和f展示了3DPF在不同时间点(24小时和72小时)对细胞增殖的影响,与对照组相比,3DPF显著提高了细胞存活率和增殖率。活/死染色结果显示,3DPF组细胞密度和形态更均匀,活细胞活性的绿色荧光强度显著增强。图4g展示了3DPF对大肠杆菌和金黄色葡萄球菌的抗菌效果,其通过释放EMO和妥布霉素以及疏水性表面结构抑制细菌生长。图4h的琼脂扩散实验结果显示,3DPF在琼脂平板上形成了明显的抗菌区。图4i的抗菌活性平板计数实验结果显示,与对照组相比,经3DPF处理后细菌菌落数量显著减少,两种细菌的生长均被完全抑制。
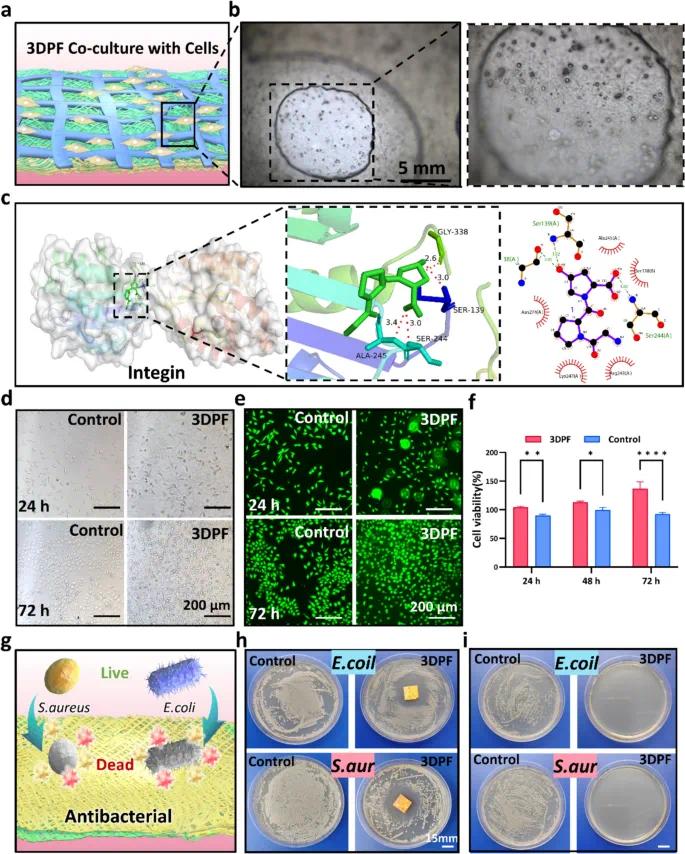
图4 3DPF贴片的细胞培养与抗菌性能。(a)3DPF贴片引导细胞生长的示意图;(b)在3DPF贴片上培养的L929细胞的光学图像;(c)基于能量最小化的整合素与GPO组装的分子对接图像;(d)在3DPF贴片上培养24小时和72小时的L929细胞的光学图像;(e)在贴片上培养24小时和72小时的L929细胞的活/死染色分析;(f)与贴片共培养24小时、48小时和72小时后L929细胞的存活率;(g)3DPF贴片抗菌性能的示意图;(h)3DPF贴片的抗菌环试验;(i)用3DPF贴片处理的金黄色葡萄球菌和大肠杆菌悬浮液的琼脂平板照片
(5)3DPF 贴片在腹壁缺损模型中的治疗效果
图5a为实验设计概述,大鼠在D0接受腹壁缺损手术,切口长度10mm,分别在D7、D14和D30收集组织样本。图5b展示了使用四种贴片(对照组、P贴片、3DP贴片和3DPF贴片)治疗的大鼠腹壁修复愈合进程。D7时,对照组修复程度最低且存在粘连,而其他三组未出现粘连,3DPF贴片组伤口部位血管生成增加。D14时,对照组仍存在粘连,其他三组表面光滑,3DPF贴片组修复平整且无粘连。D30时,对照组因过度修复形成粘连,其他三组愈合情况改善,3DPF贴片组形成新的光滑腹膜,且在任何时间点均未出现粘连。
图5c显示小鼠术后恢复期间体重逐渐增加,表明材料未引起显著毒性或全身性不良反应。图5d为30天后贴片植入区域的粘连评分,对照组评分最高,P贴片组次之,3DP贴片和3DPF贴片组评分最低,3DPF贴片组在减少粘连方面显著优于其他组。
图5e的H&E染色结果显示,对照组存在粘连、大量中性粒细胞聚集和炎症浸润,纤维分布松散不均匀;P贴片组有一定愈合潜力,但存在轻度炎症;3DP贴片组组织愈合改善,炎症减轻;3DPF贴片组组织愈合完全,炎症反应显著减少,且有细胞增殖、胶原沉积和新生血管形成。
图5f的Masson染色结果显示,对照组胶原纤维排列紊乱、密度低;P贴片组纤维化和胶原沉积减少;3DP贴片组纤维结构略有改善;3DPF贴片组胶原纤维排列规则、密度增加,定量结果表明其胶原密度最高。
图5g的天狼星红染色结果显示,随着时间推移,对照组和P贴片组中I型胶原占主导,P贴片组胶原表达高于对照组。图5h的免疫荧光分析显示,与对照组相比,P贴片组的CD31和Ki67表达增加;3DP贴片组CD31表达进一步上升;3DPF贴片组CD31和Ki67表达最高,显著促进血管生成和细胞增殖。
图5i的免疫组织化学分析显示,对照组TNF-α和IL-6信号较强,P贴片组信号减弱,3DP贴片组进一步减弱,3DPF贴片组信号最弱,炎症显著减少。这些结果表明,3DPF贴片有效减少了粘连形成、胶原沉积、血管生成、细胞增殖和炎症,且未对小鼠正常生长产生负面影响,是治疗腹壁缺损的有前途的抗粘连材料。
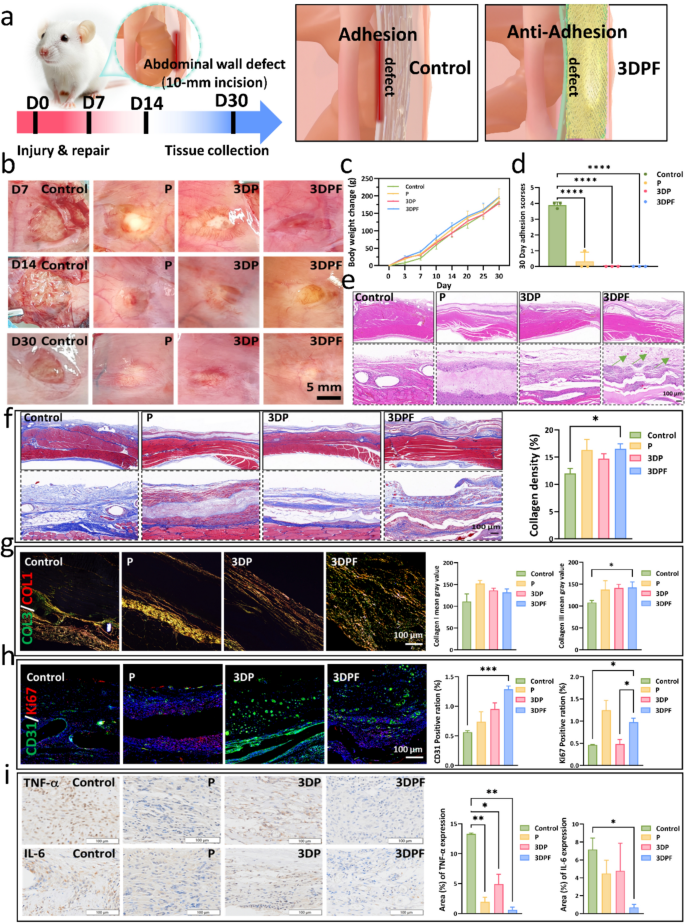
图5 腹壁缺损修复实验结果。(a)腹壁缺损实验设计示意图;(b)不同贴片治疗的腹壁缺损照片;(c)修复后大鼠的体重变化;(d)粘连形成评估;(e)H&E染色的组织学图像;(f)M&T染色及切片中胶原的定量分析;(g)天狼星红染色图像及胶原沉积定量分析;(h)免疫荧光染色评估(蓝色:DAPI,红色:CD31,绿色:Ki67)及定量分析;(i)IL-6和TNF-α免疫组化染色分析及定量分析
(6)3DPF 贴片组织修复的潜在机制
图6a展示了各组中iNOS(M1型标志物,绿色)和CD206(M2型标志物,红色)的表达情况,结果显示3DP和3DPF组显著向M2型极化,而对照组和P组含有更多M1型巨噬细胞。图6b的统计分析表明,iNOS阳性细胞显著减少,CD206阳性细胞增加,3DPF组最为明显,说明3DPF可促进巨噬细胞向M2型极化。图6c阐释了巨噬细胞极化机制,M1型诱导炎症反应,M2型介导抗炎与修复功能,分子对接显示GPO通过与CD206的特定位点形成氢键,增强M2型极化及其抗炎作用。
图6d的火山图显示3DPF组中有853个基因上调、648个基因下调,表明其在基因水平上对组织修复相关过程进行了广泛调控。图6e的热图突出显示了3DPF诱导的独特转录组变化。图6f的KEGG通路富集分析发现,3DPF显著参与吞噬作用、MAPK信号传导和细胞黏附等通路。图6g的GO富集分析进一步将3DPF的作用与组织修复和再生相关功能联系起来。
图6h的GSEA分析显示,IL-17信号通路的富集分数为负值(NES=-2.18),表明该通路受到抑制,3DPF组的促炎环境得到改善;细胞黏附分子通路高度激活(NES=2.0053),提示细胞黏附、迁移和细胞外基质重塑能力增强。
图6i通过分子对接分析展示了3DPF组与关键分子(包括COL3、肌动蛋白和VEGF)的作用机制,表明3DPF可通过与这些分子结合来增强其生物活性或稳定性,从而促进组织修复的多种机制,尤其是在伤口愈合、软组织修复和血管生成方面。
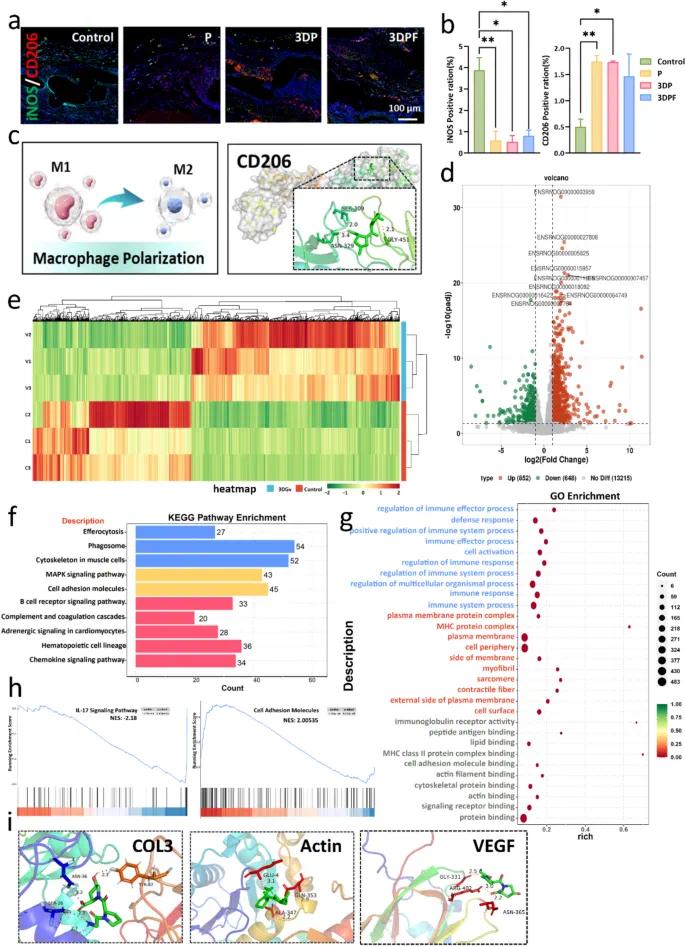
图6 3DPF补片在组织修复中的潜在机制。(a)CD206、iNOS的免疫荧光染色及(b)定量分析;(c)巨噬细胞极化示意图及基于能量最小化的CD206与GPO组装的分子对接图像;(d)差异表达基因火山图;(e)层次聚类分析后表达水平热图;(f)KEGG通路富集分析;(g)3DPF组与对照组之间差异表达基因的功能注释;(h)IL-17信号通路和细胞黏附分子的GSEA图;(i)基于能量最小化的COL3、Actin和VEGF与GPO组装的分子对接图像
本研究通过整合3D打印和静电纺丝技术开发了用于腹壁修复的仿生3DPF复合贴片。该贴片模拟胶原蛋白分子4A-GPO,结合bFGF,通过乳液静电纺丝显著增强生物活性。分层结构提供机械支撑,同时整合EMO和妥布霉素实现抗菌特性。体内评估证实该贴片具有抗粘连功效,促进血管生成、胶原蛋白沉积,并调节巨噬细胞从促炎表型到抗炎表型的极化。转录组学分析揭示其在下调炎症途径的同时增强细胞粘附。分子对接研究表明其与COL3、肌动蛋白和VEGF等关键因子相互作用,支持组织再生。
3DPF贴片由具有明确化学成分的生物衍生材料组成,显示出强大的临床转化潜力,为组织工程提供了一种有前途的策略,解决了复杂手术应用中免疫调节、感染控制和结构加固的关键挑战。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

