
生物膜感染伤口治疗极为困难,常导致患者显著不适,甚至引发严重并发症,如败血症、组织坏死,甚至死亡。目前临床主要依赖抗生素治疗,但生物膜屏障削弱了抗生素效果。高剂量使用虽可增强抗菌效果,却可能促使细菌进化为耐药菌株,并引发肾损伤、神经系统损伤等副作用。外科清创虽能去除生物膜,但残留细菌易导致伤口感染复发,给患者带来巨大身体创伤和经济负担。因此,迫切需要开发新的有效治疗生物膜感染的方法。

针对上述问题,南京工业大学董晓臣教授开发了一种基于硫化铋(Bi2S3)的I型光动力抗菌纳米协同剂,并将其整合到可溶性微针贴片中,用于治疗细菌生物膜感染伤口。研究通过缺陷工程和形貌调控制备了富含缺陷的海胆状硫化铋纳米颗粒,并在其表面包裹儿茶酚-镓离子(Ga3+)复合物,形成BSPG纳米颗粒,再将其嵌入透明质酸基微针矩阵中。该微针贴片能够穿透皮肤/生物膜屏障,释放纳米颗粒穿透细菌膜,在808 nm激光照射下,BSPG可产生过氧化氢和超氧阴离子,灭活细菌。同时,在酸性生物膜环境中,释放的Ga3+可干扰细菌抗氧化防御机制,增强光动力抗菌效果。体外和体内实验表明,该微针贴片能有效清除生物膜,减轻炎症反应,加速伤口愈合,为治疗复杂生物膜感染伤口提供了新思路。该文章于2025年6月16日以《Bismuth Sulfide Microneedle Patch for MRSA Biofilm Removal via Oxidative Stress Amplification》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202507540)。
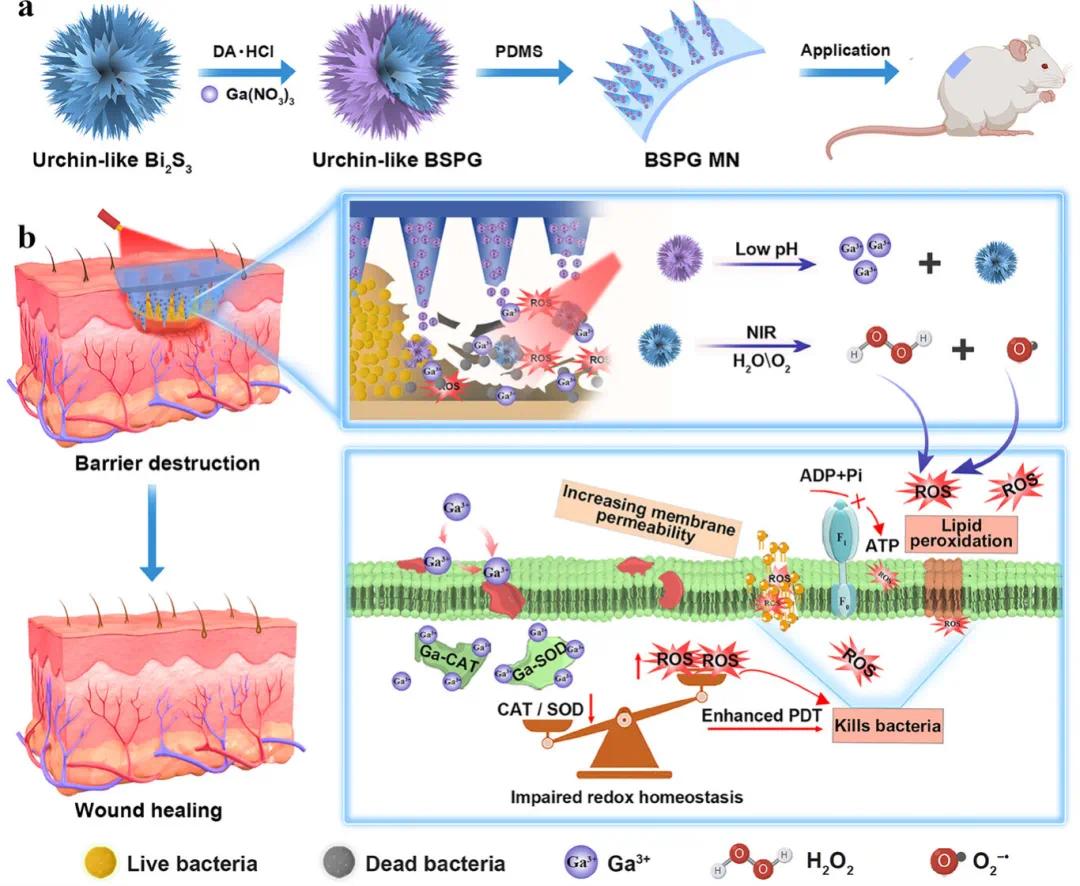
生物膜感染伤口治疗示意图。(a)BSPG微针贴片制备的示意图;(b)BSPG微针贴片破坏生物膜屏障并促进伤口愈合的机制
(1) BSPG的合成与表征
通过聚乙烯吡咯烷酮辅助自组装策略,在乙二醇中合成了海胆状硫化铋(BS)。如图1a所示,BS具有明确的海胆状形态,平均尺寸为2 µm,高分辨透射电子显微镜(HRTEM)图像(图1b)显示BS表面存在缺陷。为了制备镓离子(Ga3+)功能化的BS(BSPG),在BS表面涂覆了聚多巴胺(PDA)层,并通过Ga3+与儿茶酚配位形成复合物将Ga3+负载到PDA壳中,如图1c所示,Ga3+负载后BSPG的结构与BS相似,但表面有一层薄而均匀的聚合物涂层(图1d),且元素分布图(图1e)显示Bi、S、N和Ga四种元素在BSPG中均匀分布。XPS光谱(图1f)确认Ga以Ga3+形式存在,而非晶态镓,拉曼光谱(图1g)进一步证实了Ga3+与PDA的配位作用。实验表明,BSPG在酸性条件下(pH 5.5)释放Ga3+的速率高于中性条件(pH 7.4)(图1h)。通过2’,7’-二氯荧光素(DCFH)荧光探针验证了BSPG的光动力性能(图1i),结果显示,BSPG在激光照射下可产生活性氧(ROS),且其生成效率高于BS。此外,利用二氢乙锭(DHE)和DHR123探针分别检测了超氧阴离子(O2-)和过氧化氢(H2O2)的生成(图1j和图1k),表明BSPG的ROS生成机制主要遵循I型光动力途径,通过电子转移产生ROS,不依赖氧气,适用于厌氧生物膜环境。
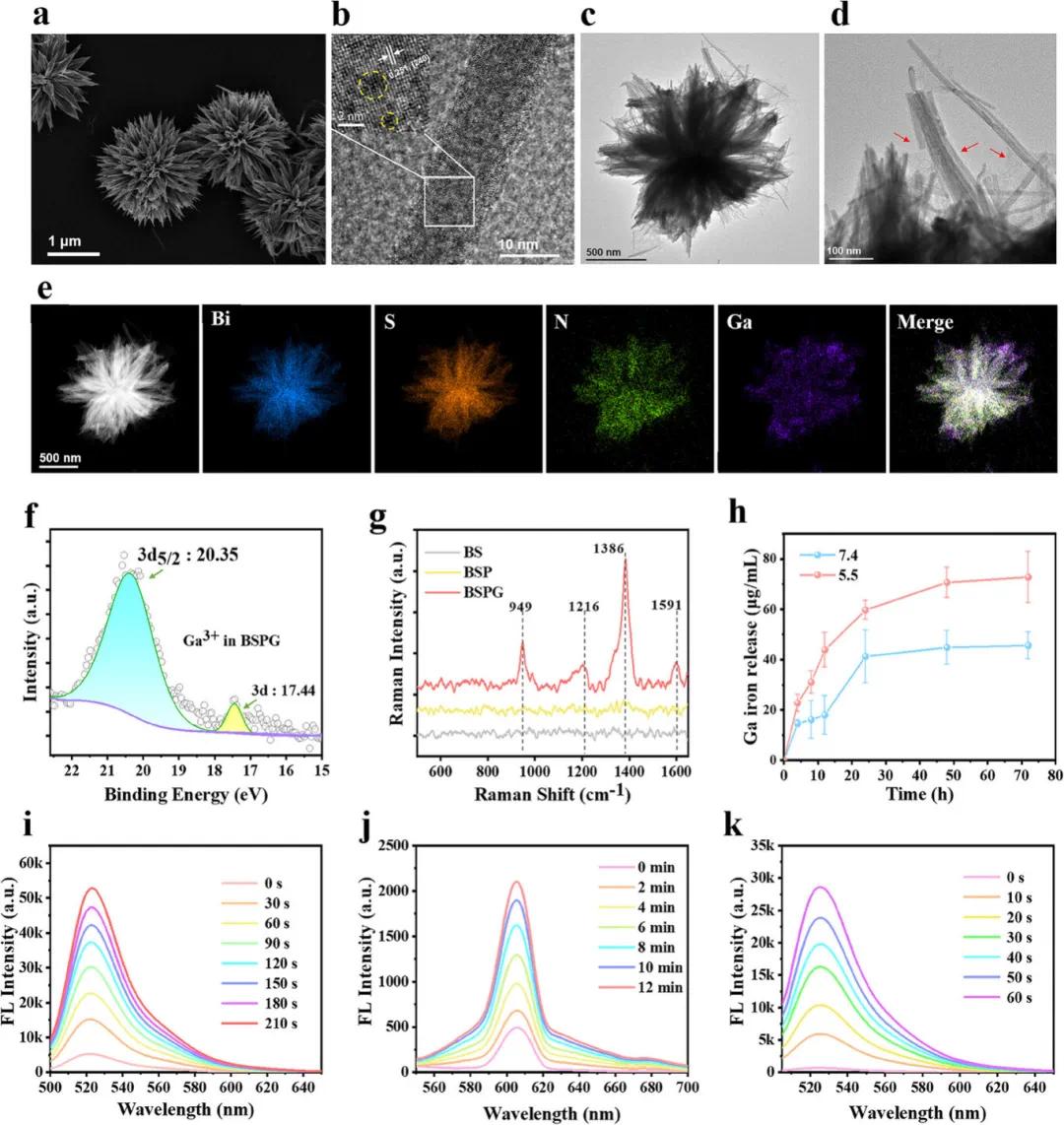
图1.BS和BSPG的表征。(a)BS的扫描电镜(SEM)图像;(b)BS的高分辨透射电镜(HRTEM)图像;(c,d)BSPG的透射电镜(TEM)图像;(e)BSPG的元素分布;(f)BSPG的X射线光电子能谱(XPS)Ga 3d轨道谱;(g)不同材料的拉曼光谱分析;(h)BSPG在不同pH条件下的Ga3+释放曲线;(i)利用DCFH探针评估BSPG的总ROS生成;(j)利用DHE探针评估O2-生成;(k)利用DHR123探针评估H2O2生成
(2)BSPG的体外抗菌和抗生物膜活性
为了评估BSPG的光动力抗菌活性,将大肠杆菌(E. coli)和耐甲氧西林金黄色葡萄球菌(MRSA)与不同浓度的BSPG(0–128 µg/mL)共孵育,并暴露于808 nm激光下10分钟。图2a和图2b显示,经过12小时孵育后,E. coli和MRSA的存活率随着BSPG浓度的增加显著降低,在pH 5.5条件下,BSPG对E. coli的最小杀菌浓度(MBC)为32 µg/mL,对MRSA为64 µg/mL。在pH 7.4条件下,BSPG对E. coli的MBC为64 µg/mL,对MRSA为128 µg/mL,这种差异源于两种细菌细胞壁结构的不同:耐甲氧西林金黄色葡萄球菌(MRSA)作为革兰氏阳性菌,其厚的肽聚糖层对BSPG诱导的损伤(如物理穿孔和ROS介导的损伤)具有显著的保护作用,而大肠杆菌作为革兰氏阴性菌,其外层结构较薄,更容易受到BSPG等外界因素的影响。因此,BSPG对E. coli的抗菌效果显著优于MRSA。在后续实验中,主要以MRSA为对象进行抗菌评估,图2c显示,与对照组相比,BSPG+激光(L)处理组的细菌数量减少了近6.5个对数级,平板上几乎无菌落(经10³倍稀释后),而单独使用BSPG或Ga3+处理的组仅分别减少了1.6和2.5个对数级,平板上仍有大量菌落。为了验证I型光动力疗法在缺氧环境中的有效性,使用缺氧袋对比了BSPG在常氧和缺氧条件下的抗菌性能(图2g)。图2d显示,无论在常氧还是缺氧条件下,BSPG+L处理均能减少6个对数级的细菌,活/死荧光染色结果(绿色:活菌,红色:死菌)表明,BSPG+L处理组显示出最明显的红色荧光信号,进一步证实了其最佳的抗菌效果(图2e),常氧和缺氧条件下的活/死染色结果与平板实验结果一致(图2d),证明BSPG的抗菌效果不受感染环境氧水平的限制。此外,扫描电镜(SEM)观察结果显示,在PBS和PBS+L组中,细菌保持完整的球形结构,细胞壁未受损(图2f)。BSPG-L组与PBS组相比仅有轻微差异,而BSPG+L处理组的细菌不再呈典型球形,细胞壁出现大量凹陷和塌陷。

图2. BSPG的体外抗菌活性。(a)不同pH条件下,经不同浓度BSPG处理后大肠杆菌的存活率;(b)耐甲氧西林金黄色葡萄球菌(MRSA)的存活率;(c)不同处理后存活MRSA的定量分析;(d)常氧和缺氧条件下,经BSPG处理后MRSA的菌落形成单位(CFUs)/mL定量分析;(e)不同处理后MRSA的共聚焦激光扫描显微镜(CLSM)图像;(f)不同处理后MRSA的扫描电镜(SEM)图像;(g)缺氧抗菌实验示意图
(3)BSPG的潜在抗菌机制
通过Calcein AM探针检测生物膜内活菌来评估BSPG的抗生物膜活性。如图3a所示,对照组生物膜结构完整,荧光信号强;硝酸镓处理组因Ga3+的抗菌性荧光略有下降,与平板计数结果一致;BSPG-L处理组生物膜结构变化不大,但抗菌活性增强;BS+L和BSP+L组荧光显著减弱但仍存信号,表明部分细菌存活;而BSPG+L组几乎无绿色荧光,说明生物膜中大部分细菌被破坏。图3b的菌落统计结果和图3c的结晶紫染色分析进一步确认BSPG+L通过I型光动力抗菌疗法和Ga3+抗菌疗法展现出更强的抗菌活性。本研究制备的BSPG纳米颗粒具有胆海状形态,其表面的刺状结构对细菌的捕获和穿透细菌细胞膜具有显著影响。实验结果表明,BSPG表面的刺状结构不仅有效促进了细菌在其表面的聚集,还成功穿透了细菌细胞膜(图3d),这可能有助于后续过程中Ga3+的局部释放(图3e)。此外,Ga3+已被证实能够破坏细菌的铁平衡,从而削弱其抗氧化系统。因此,研究进一步探讨了Ga3+与光动力疗法(PDT)的协同抗菌效果。结果显示,与对照组相比,仅用BS处理的组中细菌的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性增加,这是由于PDT产生的活性氧(ROS)诱导了细菌的氧化应激反应,从而触发了抗氧化酶活性的代偿性上调以对抗氧化损伤。然而,在硝酸镓和BSPG处理的组中,MRSA的SOD和CAT活性显著降低(图3f),表明BSPG能够抑制细菌的抗氧化防御机制。通过药物相互作用系数(CDI)评估Ga3+与PDT的协同效应结果表明,对于MRSA,单独使用Ga3+(16.25 µg/mL)或BS(32 µg/mL)处理时,细菌存活率分别为97.44%和76.44%,而联合使用Ga3+和BS处理时,存活率降至9%,计算得出CDI值为0.121,同样,当使用更高浓度的Ga3+(32.5 µg/mL)或BS(64 µg/mL)单独处理时,存活率分别为93.22%和11.99%,而联合处理进一步将存活率降至3.33%,对应的CDI值为0.298(图3g)。在两种情况下,CDI值均显著低于0.7,表明Ga³⁺与BS联合处理的抗菌活性并非简单的加和效应,具有而是显著的协同作用。
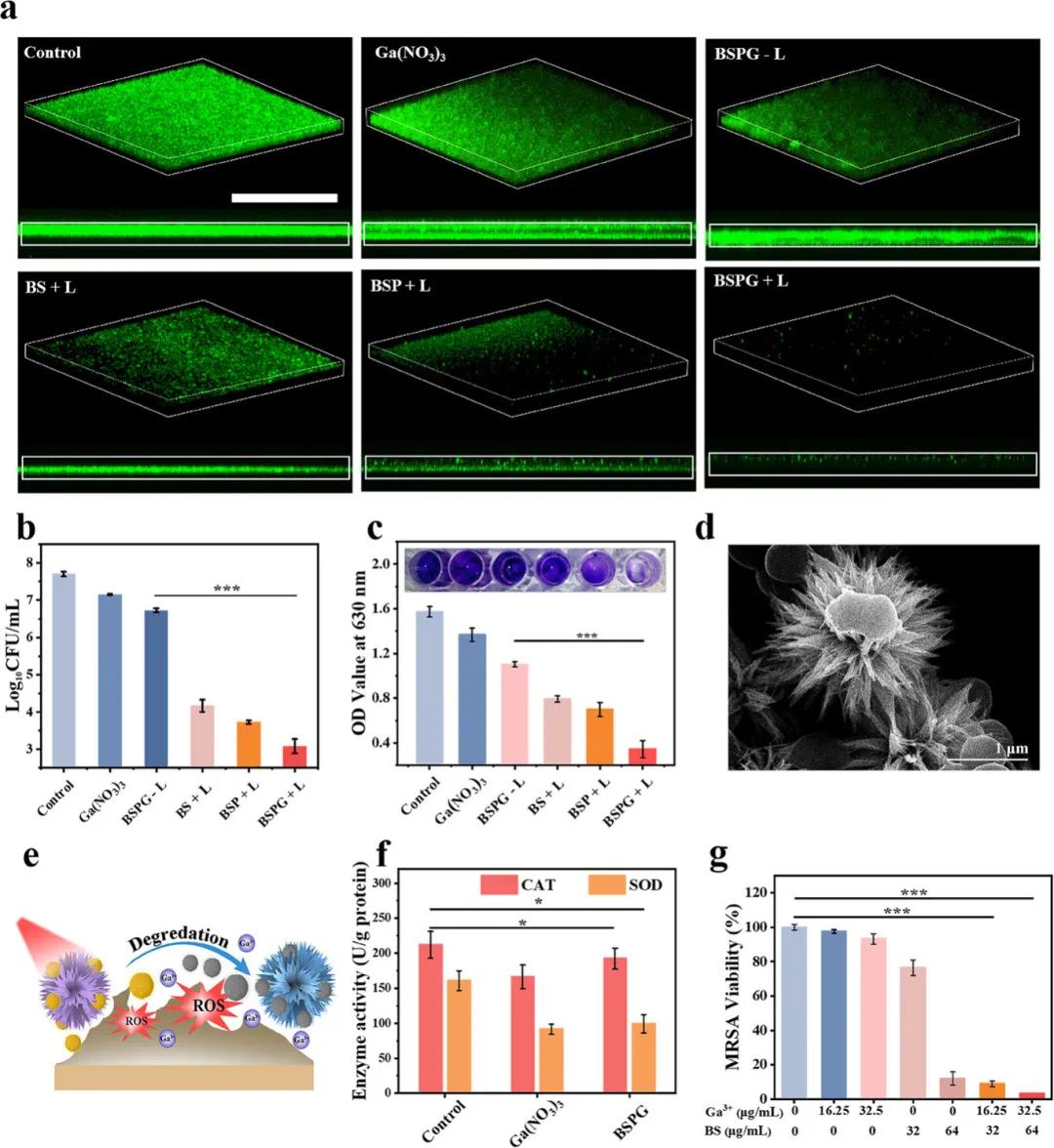
图3. BSPG的抗菌机制。(a)不同处理后MRSA生物膜的荧光图像及其对应的横截面图像;(b)平板上的菌落形成单位(CFU)计数;(c)不同处理后结晶紫染色的生物膜图像及其在630 nm处的吸光度值;(d)展示BSPG捕获和穿透MRSA的代表性扫描电镜(SEM)图像;(e)BSPG在酸性感染微环境中杀菌机制的示意图;(f)经硝酸镓(16 µg/mL)和BSPG纳米颗粒(32 µg/mL)处理后MRSA的过氧化氢酶(CAT)活性和超氧化物歧化酶(SOD)活性;(g)不同处理下MRSA的存活率
为了进一步探究BSPG的抗菌机制,对经BSPG处理后的MRSA进行了原核转录组测序(RNA-seq)分析,以鉴定差异表达基因(DEGs)。结果显示,与对照组相比,共有2124个基因表达发生显著变化,其中236个基因上调,385个基因下调(图4a,b),表明BSPG处理后MRSA的转录组发生了显著变化。通过基因本体(GO)富集分析发现,包括铁硫簇结合、营养水平响应、精氨酸代谢过程和谷氨酰胺家族氨基酸代谢过程等在内的多个基因类别在BSPG处理后被下调(图4c),这表明BSPG干扰了细菌的能量代谢并削弱了其应对氧化应激的能力。同时,上调的GO类别包括脂质氧化、氧化应激响应、细胞氧化应激响应和铁离子跨膜运输等(图4d),证实了MRSA细胞中发生了氧化损伤,并导致脂质过氧化物的大量积累。此外,KEGG富集分析将DEGs分类到多种代谢途径中,其中上调的DEGs主要涉及糖酵解、嘌呤代谢、RNA降解和脂肪酸降解等86条途径;而下调的DEGs主要集中在ABC转运蛋白、氮代谢、嘧啶代谢和半胱氨酸及蛋氨酸代谢等82条途径(图4e),这些结果表明,这些代谢途径在BSPG抑制MRSA活性过程中发挥了关键作用。
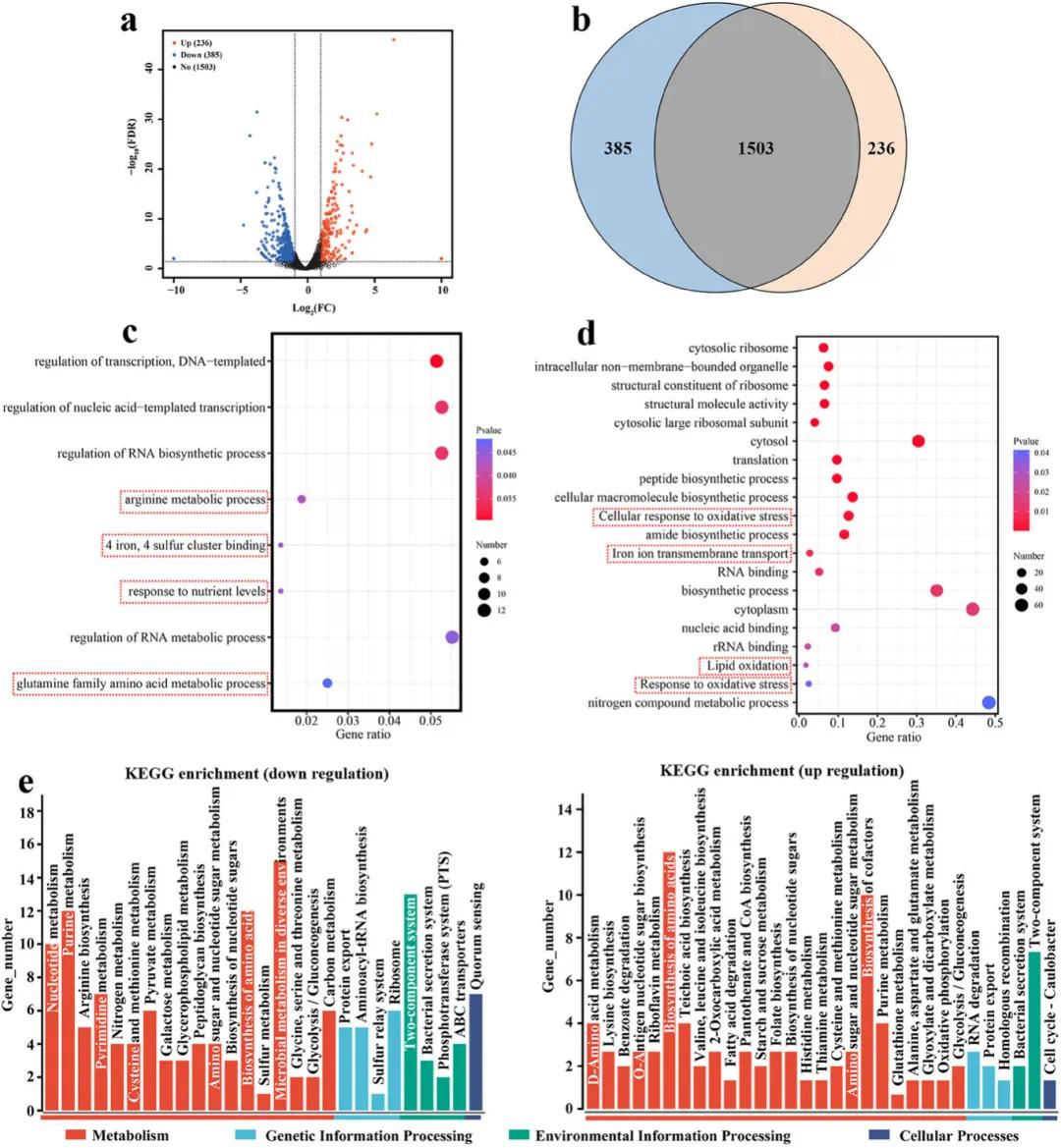
图4. MRSA经BSPG处理后的转录组变化。(a)差异表达基因(DEGs)分布的火山图;(b)差异表达基因(DEGs)分布的饼图;(c)下调DEGs的基因本体(GO)富集分析;(d)上调DEGs的基因本体(GO)富集分析;(e)上调和下调DEGs在KEGG通路中的富集分析
(4)PCR验证基因表达水平
利用实时荧光定量PCR(qPCR)检测了与铁稳态和氧化应激调控相关的差异表达基因(DEGs)的表达水平。研究发现,MRSA在经BSPG处理后,fur基因表达下调,feoB基因表达上调(图5a,b),表明细菌内部铁稳态失衡。同时,抗氧化酶相关基因(如gpx、sodA、katE和ahpC)的表达上调(图5c–g),说明细菌的抗氧化系统在BSPG处理下被激活。此外,编码琥珀酸脱氢酶亚基A的sdhA基因表达呈下降趋势(图5h),这会减少电子传递链中的电子供应,抑制ATP合成过程,从而影响细菌代谢。研究假设BSPG破坏细菌铁稳态并诱导氧化还原失衡,其关键特征是细胞膜中不饱和脂肪酸的氧化,导致脂质过氧化物(LPO)的形成。结果显示,经BSPG+激光(L)处理的细菌中ROS含量显著高于对照组(图5i)。LPO水平检测表明,BSPG单独处理和BSPG+L处理组的LPO水平均显著高于对照组(图5j)。此外,丙二醛(MDA)作为LPO降解的产物,在BSPG+L处理后也显著增加(图5k)。转录组分析显示BSPG+L处理影响了细菌的糖酵解过程(图4e)。图5l显示,经BSPG处理的细菌中ATP水平较对照组降低,BSPG+L组降低更为显著。最后,通过o-硝基苯基-β-D-吡喃半乳糖苷(ONPG)探针检测细菌通透性,结果显示BSPG处理组的ONPG摄取显著高于对照组(图5m),表明BSPG处理对细菌细胞膜造成了严重损伤。
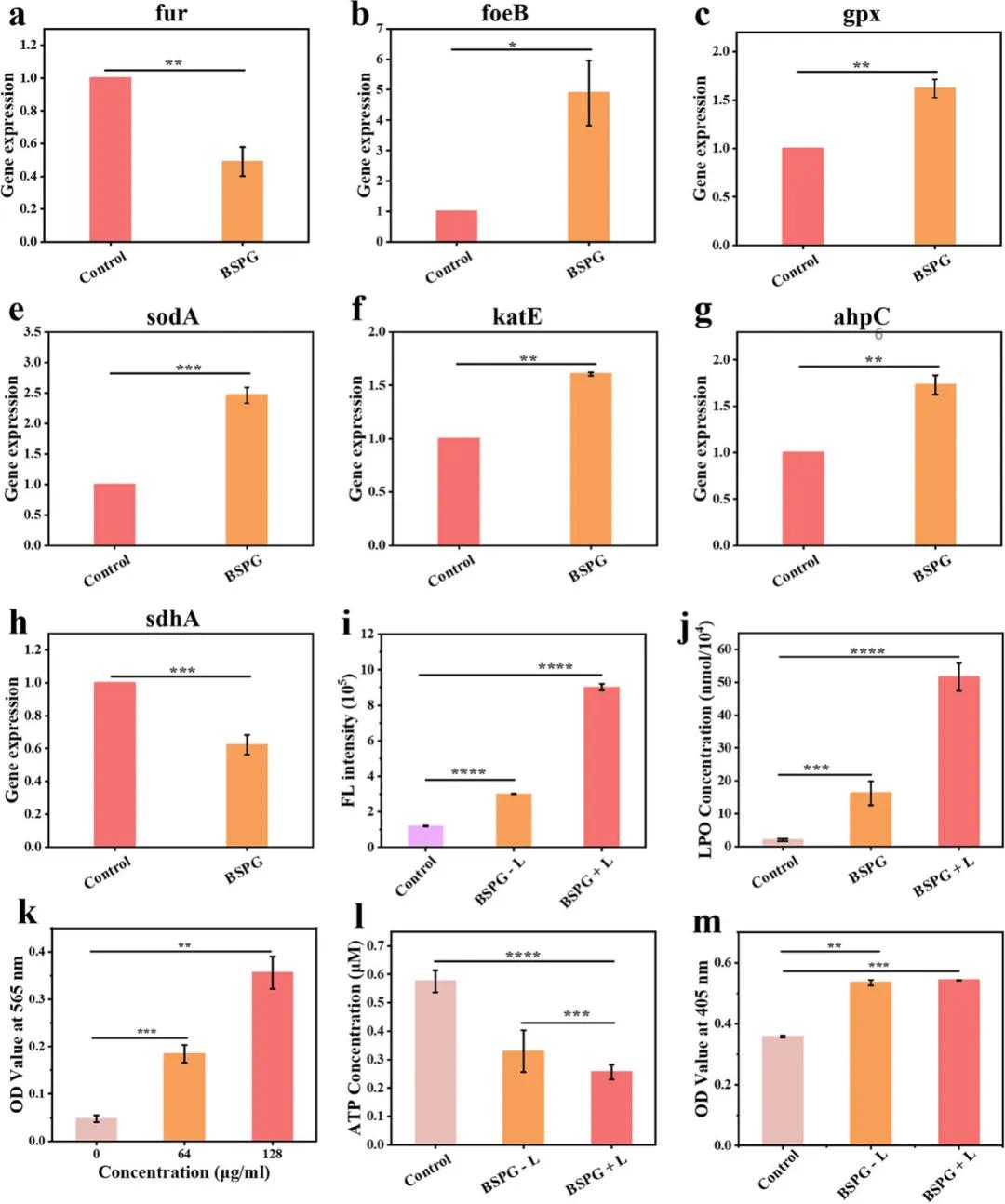
图5. PCR验证基因表达水平。(a–h)经BSPG处理后金黄色葡萄球菌中铁稳态和氧化应激调控相关DEGs的qPCR分析;(i)不同处理后细菌中ROS含量;(j)不同处理后细菌中LPO含量;(k)在近红外激光照射(808 nm,1 W/cm2,10分钟)下,经不同浓度BSPG处理的细菌产生的丙二醛(MDA)含量;(l)不同处理后金黄色葡萄球菌中ATP浓度;(m)通过ONPG测定金黄色葡萄球菌细胞膜通透性的变化
(5)BSPG微针贴片的治疗效果评估
细菌生物膜是导致60%慢性伤口和6%急性伤口愈合延迟的原因,生物膜基质屏障和皮肤屏障的存在使得治疗药物难以直接与细菌接触,为此,将BSPG装载到可生物降解的微针(MN)贴片中,用于增强体内BSPG的递送(图6a)。具体方法是将含有BSPG纳米颗粒的透明质酸溶液注入模具腔体中,抽真空并加热以形成可生物降解的针尖。扫描电镜(SEM)图像显示,制备的BSPG微针贴片具有高度为600微米、基底直径为250微米的尖锐锥形结构(图6b),证实了微针贴片能够穿透生物膜感染伤口表面的皮肤屏障,并将药物直接递送至目标部位。构建了MRSA生物膜感染伤口模型以评估微针(MN)贴片的治疗潜力,感染小鼠随机分为五组:对照组、BSPG组、BSPG+激光(L)组、BSPG微针组和BSPG微针+激光组,动物实验过程如图6c所示。治疗期间,使用数码相机跟踪记录小鼠伤口愈合情况。如图6d–f所示,经过10天治疗,对照组感染伤口面积缩小至原始面积的51.7%;BSPG组伤口面积缩小28%;BSPG微针组伤口面积缩小至24.8%,略小于BSPG组,可能是由于微针贴片增强了穿透效果。值得注意的是,BSPG微针+激光组的感染伤口在第10天几乎完全愈合,伤口面积缩小至12.8%,表明在激光照射下,BSPG微针贴片更有效地加速了伤口愈合。进一步探究其机制,第10天将伤口组织匀浆后,采用平板计数法评估细菌存活情况,如图6g所示,BSPG微针+激光组存活细菌极少,仅1.20%存活,远低于BSPG+激光组的7.52%,证实BSPG微针因微针穿刺作用帮助BSPG突破细菌生物膜,展现出更强的抗菌生物膜感染效果。此外,治疗期间小鼠体重无显著变化(图6h),表明BSPG微针+激光治疗在短期内无明显毒性。
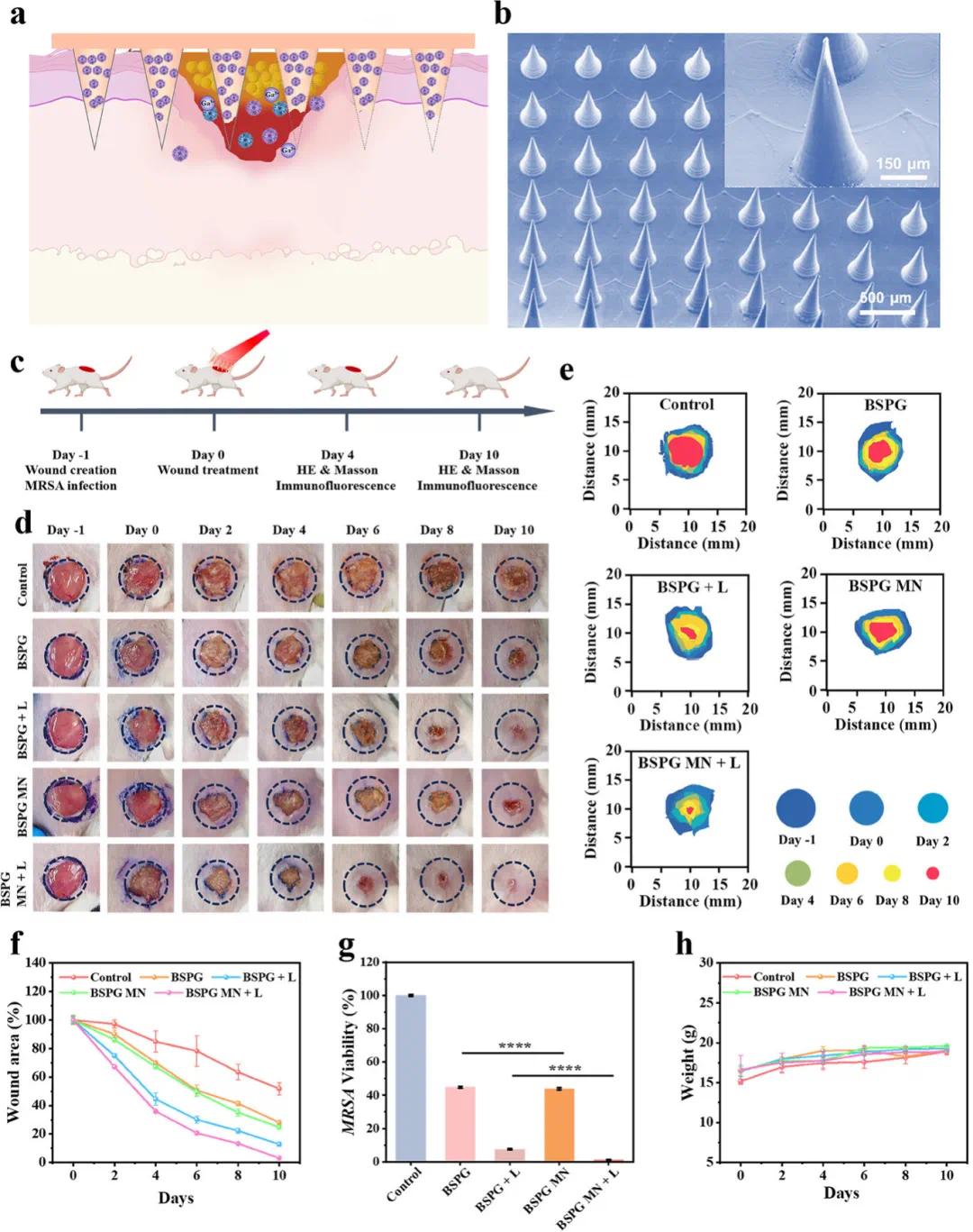
图6. BSPG微针贴片的体内治疗效果评估。(a)BSPG微针穿透生物膜感染伤口的示意图;(b)BSPG微针的扫描电镜(SEM)图像;(c)MRSA生物膜感染伤口治疗的示意图;(d)各治疗组在治疗前1天、第0天、第2天、第4天、第6天、第8天和第10天的感染伤口代表性图像,以及(e)对应的伤口面积统计;(f)伤口面积随时间的变化;(g)感染组织样本中MRSA的存活率;(h)治疗期间小鼠体重的变化
通过苏木精-伊红(HE)染色和Masson三色染色进一步评估伤口愈合进程。结果显示,第4天各组皮肤结构均不完整,胶原沉积不明显(图7a)。到第10天,对照组、BSPG组和BSPG微针组的皮肤仍存在损伤,而BSPG+激光(L)组和BSPG微针+激光组的皮肤相对完整且排列有序,其中BSPG微针+激光组的胶原沉积和皮肤完整性最为显著,与未感染小鼠的伤口愈合过程最为相似。此外,在评估BSPG微针的抗感染效果时发现,第4天各组促炎因子IL-1β表达均较高(图7b,c),但到第10天,BSPG微针+激光组的IL-1β水平最低,抗炎因子Arg-1表达最高(图7d)。这些结果表明,BSPG微针不仅能清除感染区域的致病菌,还能通过调节炎症反应加速伤口愈合。总体而言,BSPG微针有助于BSPG突破生物膜屏障,增强其对细菌生物膜感染的治疗效果,并通过增加胶原沉积和减轻炎症反应促进伤口愈合。
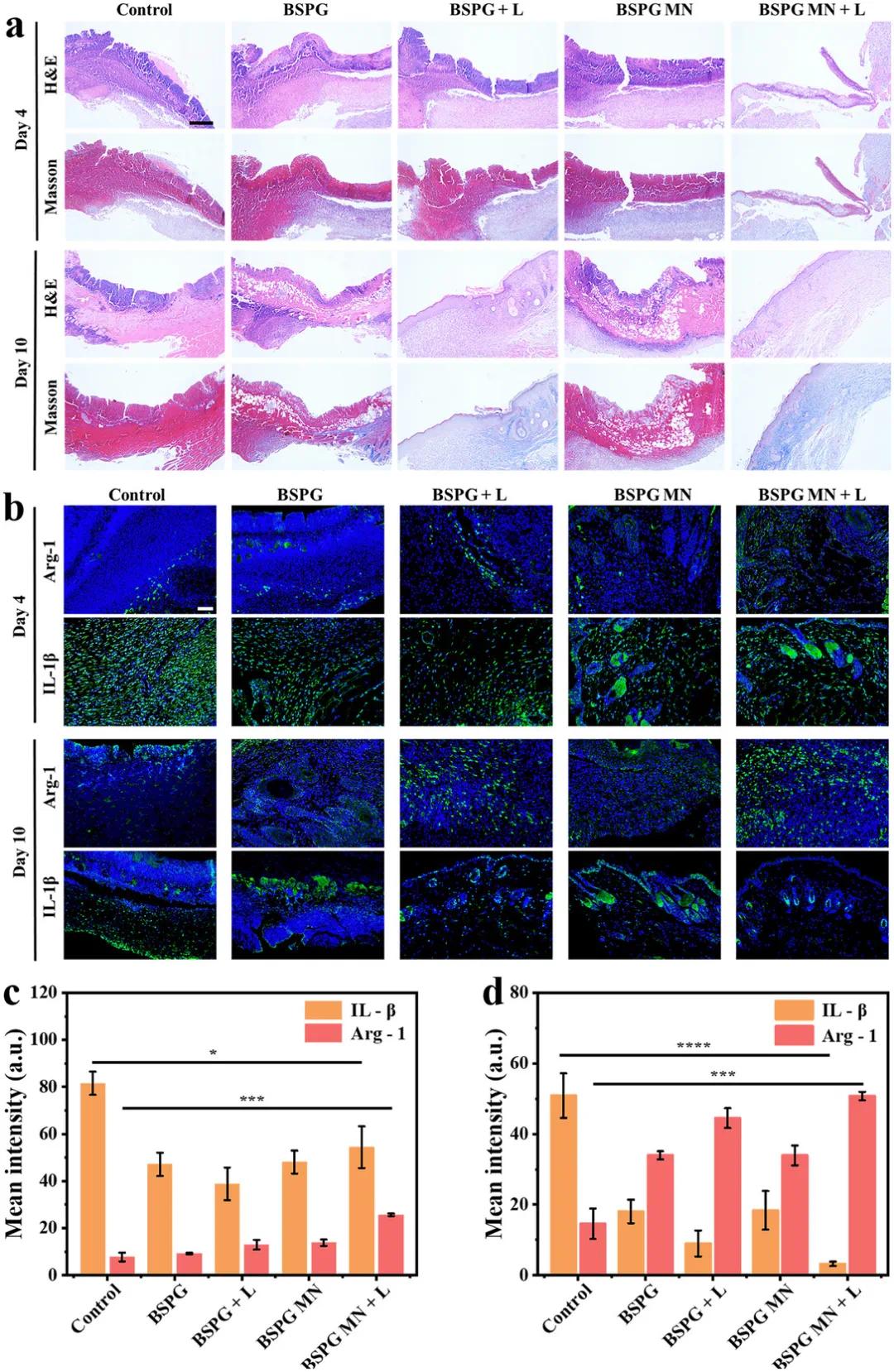
图7. 病理学染色验证修复效果。(a)治疗第4天和第10天感染伤口组织的苏木精-伊红(H&E)染色和Masson三色染色代表性图像;(b)治疗第4天和第10天IL-1β和Arg-1的代表性免疫荧光图像;(c)定量分析图b中第4天的荧光强度;(d)定量分析图b中第10天的荧光强度
总之,该团队开发了一种具有氧化应激增强型I型光动力治疗效果的可生物降解BSPG微针贴片,用于治疗细菌生物膜感染伤口。BSPG微针贴片能够穿透皮肤/细菌生物膜屏障,将BSPG纳米颗粒递送至感染部位,该氧非依赖性的I型光动力疗法即使在厌氧生物膜中也能有效产生活性氧(ROS)。在感染微环境的酸性条件下,BSPG纳米颗粒释放Ga3+,进一步干扰细菌的抗氧化系统,与I型光动力疗法产生协同治疗效果,有效清除细菌生物膜。抗菌机制涉及BSPG破坏细菌代谢、抑制ATP生成以及增加脂质过氧化物积累,最终导致细菌细胞死亡。体内实验结果证实,BSPG微针贴片能够消除细菌生物膜,减轻炎症反应,并加速伤口愈合,本研究为提高光动力疗法治疗细菌生物膜感染伤口的效果提供了有力参考。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

