
全球超7000万人受瓣膜性心脏病(VHD)影响,瓣膜置换是主要治疗手段。然而,机械瓣膜和生物瓣膜存在局限性。去细胞化心脏瓣膜(DHVs)虽保留结构和活性成分,但体内易降解,引发炎症、血栓,阻碍组织重塑,加速功能障碍。
研究表明,微环境调节对瓣膜再生至关重要,异种细胞外基质暴露会引发凝血和炎症反应,阻碍细胞再定植和再生,甚至加剧钙化和血栓形成。逆转促炎微环境可促进内皮化和修复,抑制钙化和凝血。但水凝胶存在抑制细胞粘附、毒性风险、药物负载有限、快速释放及药物失活等问题。因此,亟需替代策略,利用心脏瓣膜微环境特性,实现内源性免疫调节剂的原位生成和持续释放,以调节DHVs植入后免疫微环境,加速初始内皮化,满足再生心脏瓣膜的需求。

针对上述问题,华中科技大学同济医学院附属协和医院董念国团队提出了一种原位生物合成策略,通过“从DNA水凝胶中生长”的方法,利用编码抗凝血酶结合寡核苷酸(NU172)的DNA模板,捕获血液中的血红素,并封装血红素氧合酶1(HO-1)将其转化为胆绿素(BV)。该水凝胶通过滚环扩增(RCA)在去细胞化心脏瓣膜(DHVs)上构建。BV作为活性氧(ROS)清除剂和抗炎剂,促进M2型巨噬细胞极化,诱导内皮型一氧化氮合酶(eNOS)磷酸化,释放一氧化氮(NO),并激活PI3K-AKT信号通路以增强瓣膜内皮化。NU172提供抗凝血特性,而聚(磺基甜菜碱甲基丙烯酸酯)(pSBMA)交联增强了水凝胶的稳定性和抗钙化特性。DNA水凝胶在内皮化过程中逐步降解,促进细胞浸润和组织再生。整合的DHV(DNA/HO1-DHV)有效调节局部免疫微环境,促进组织再生,实现瓣膜在植入后一个月内完全内皮化。该策略解决了传统药物负载和释放方法的局限性,对心脏瓣膜治疗和其他组织再生应用中的免疫调节具有重要意义。该文章于2025年06月12日以《Constructing Immunomodulator Biosynthesis Factory in Grafting-From DNA Hydrogel for Heart Valve Regeneration》为题发表于《Advanced Materials》(DOI: 10.1002/adma.202506728)。
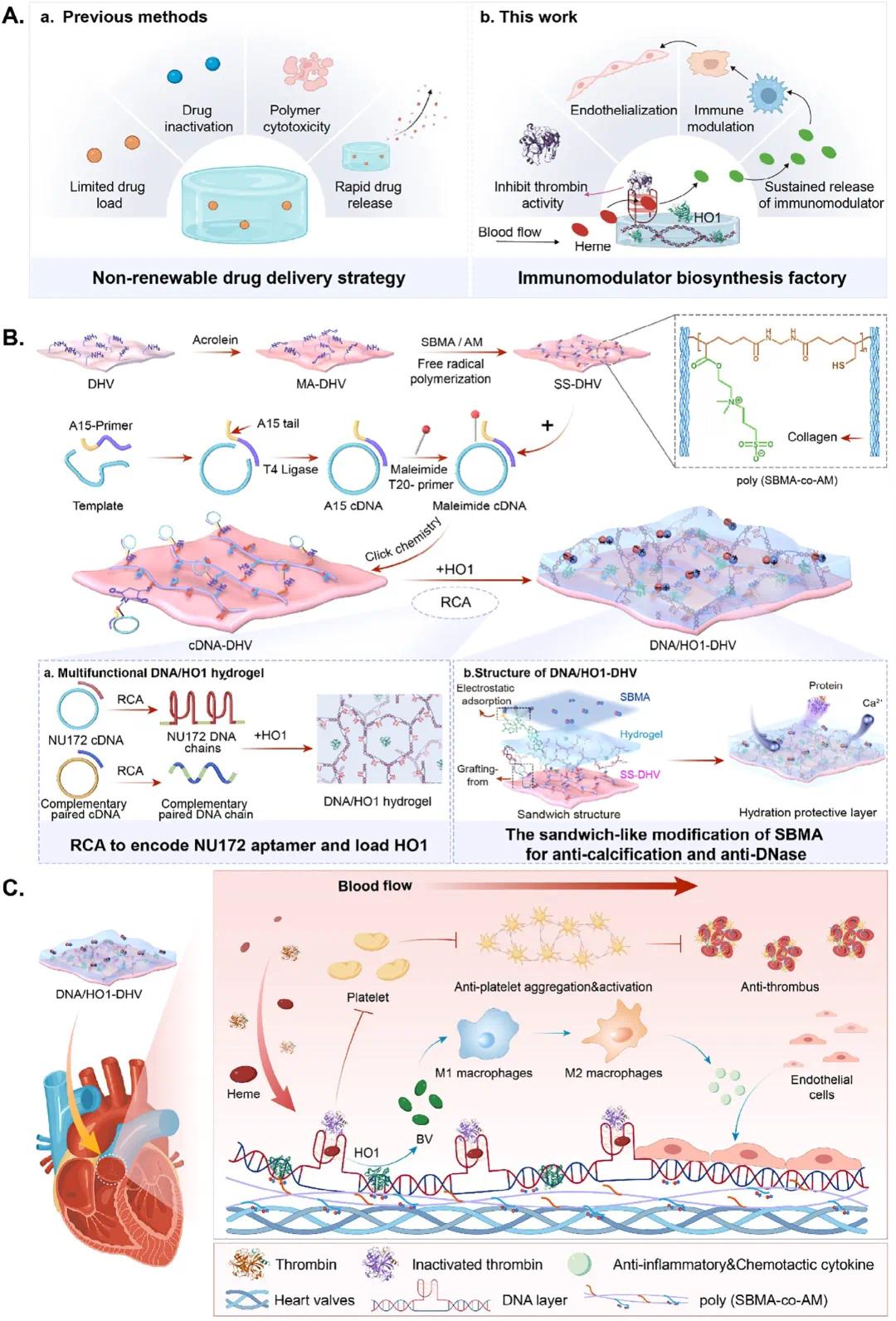
图1. DNA/HO1-DHV的制备过程、结构和功能的示意图。(A) 传统药物加载策略的挑战。(B) DNA/HO1-DHV的制备过程和结构的示意图。(C) DNA/HO1-DHV功能的示意图
(1)在DHVs表面构建免疫调节剂生物合成工厂
在去细胞化心脏瓣膜(DHVs)表面构建了用于持续生产免疫调节剂的生物合成工厂,通过滚环扩增(RCA)反应制备出“从基底生长”的DNA水凝胶。猪主动脉瓣叶经去细胞化处理后,通过丙烯醛与瓣膜表面氨基反应得到MA-DHV,再与SBMA和AM聚合反应得到SS-DHV,表面巯基密度增加(图2B)。通过调整SBMA与AM比例,确定了最佳比例以平衡稳定性和巯基含量。环状DNA模板(cDNA)通过马来酰亚胺修饰的DNA连接链固定在巯基上(图1B),并进行原位RCA反应,生成的DNA链整合了大量NU172核酸适配体用于捕获血红素(DNA-DHV),同时包载HO-1以将血红素转化为胆绿素(BV)。通过静电相互作用在表面额外吸收一层SBMA以增强DNA水凝胶的稳定性并减少钙化,最终形成DNA/HO1-DHV(图1B)。修饰过程中DHVs外观无显著变化(图2A),且保留了原始微观结构(图2C)。能量色散X射线光谱(EDS)检测到DNA-DHV和DNA/HO1-DHV表面存在大量磷元素,而DHV、GV和SS-DHV上几乎未检测到磷元素(图2C、D)。随着修饰步骤的进行,表面亲水性改善(图2E、F),且DNA-DHV和DNA/HO1-DHV表面的DNA涂层量分别为4.1±0.15μg/mg和3.63±0.31μg/mg(图2H)。Cy3.5标记的HO-1抗体染色显示DNA/HO1-DHV中HO-1分布均匀(图2I)。应力-应变曲线表明DNA/HO1-DHV的力学性能与临床上使用的GV相当(图2J),且预交联步骤显著增强了力学强度(图2K)和热稳定性(图2L)。交联和修饰后的DHVs在胶原酶处理24小时后未发生显著降解(图2M)。这些结果证实了在DHV表面成功构建了DNA涂层,并展示了其良好的物理化学性能。
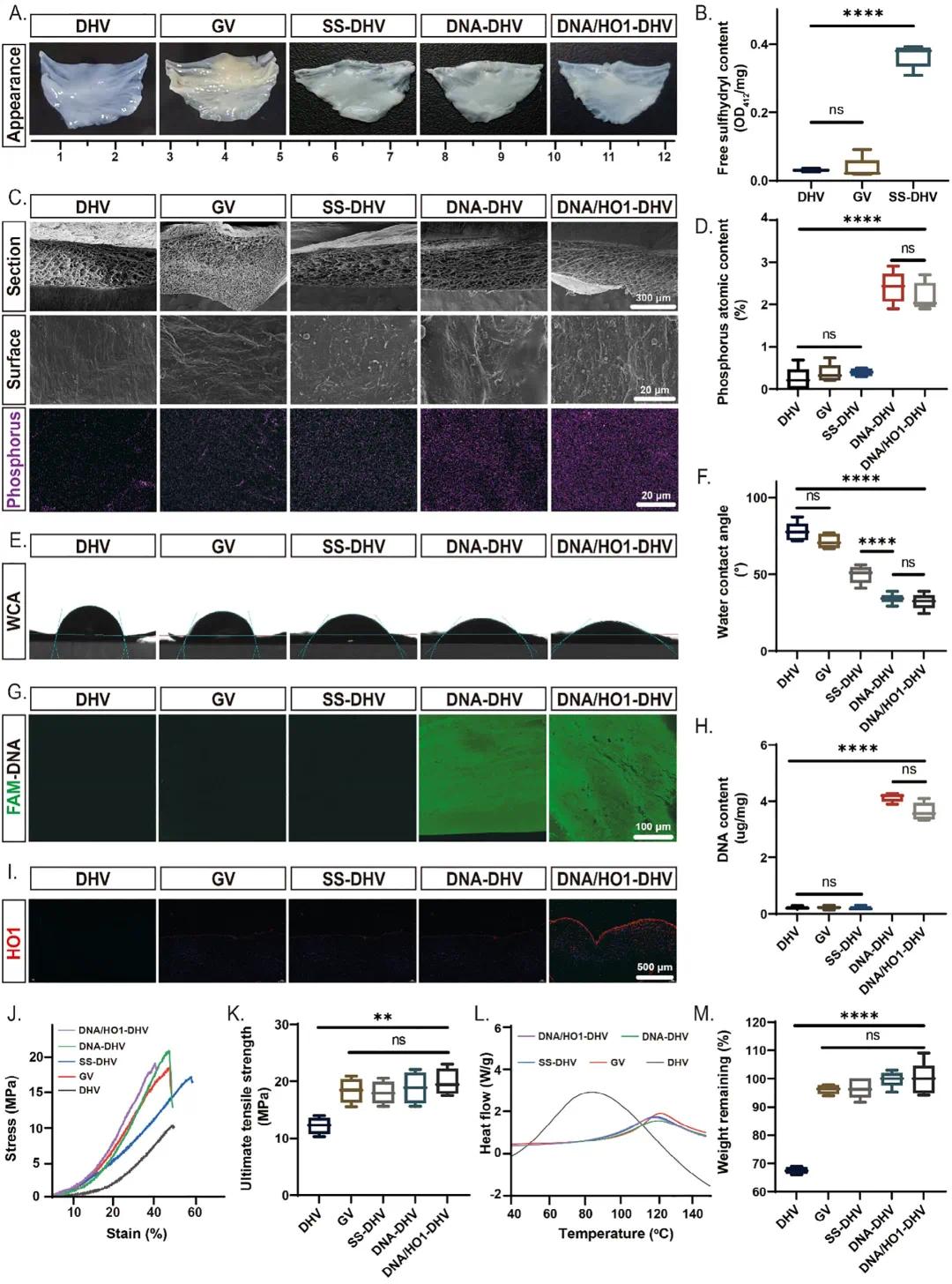
图2 DNA/HO1-DHV的表征。(a)不同DHVs的外观;(b)通过5,5'-二硫代双(2-硝基苯甲酸)(DNTB)测定SS-DHV表面硫醇基团(n = 5);(c)DHVs的表面和横截面形态的SEM图像及通过能量色散X射线光谱(EDS)识别表面磷元素;(d)通过EDS定量表面磷含量(n = 5);(e)不同样品的水接触角(WCA);(f)所有DHVs的WCA统计(n = 6);(g)DHVs与FAM-DNA探针孵育后的激光扫描共聚焦显微镜(LSCM)图像,标记DNA;(h)DNA含量定量(n = 5),通过尿素解离DNA层并用NanoDrop定量;(i)用Cy3.5修饰的HO-1抗体对DHVs切片进行免疫荧光染色;(j)DHVs的应力-应变曲线;(k)DHVs在单轴拉伸下的抗拉强度(n = 4);(l)DHVs的差示扫描量热法(DSC)热图;(m)通过定量处理24小时后重量变化评估DHVs的胶原酶稳定性(n = 5)。数据以均值±标准差表示,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001
(2)体外抗凝、抗钙化、抗粘附特性及胆绿素生成的表征
在原位免疫调节剂生物合成中,NU172编码的DNA水凝胶是关键组成部分,具有抗凝血和血红素结合功能。NU172寡核苷酸的G-四链体结构可通过400 nm吸收峰确认其结合血红素的能力(图3B)。通过质子卟啉荧光定量检测G-四链体结构(图3B)。在血红素溶液中孵育DNA/HO1-DHV时,检测到胆绿素的特征吸收峰,并通过质谱法进一步确认胆绿素的存在。胆绿素浓度在第1天达到20.51 ± 0.57 μM,第7天达到峰值89.59 ± 9.19 μM(图3C)。相比之下,DNA-DHV无法催化血红素转化为胆绿素。抗凝血活性与RCA反应时间成正比,24小时RCA的样品表现出最大抗凝血活性(图3D,E)。随机DNA片段修饰的DHV(DNARandom-DHV)无显著抗凝血性能,表明抗凝血活性源于NU172寡核苷酸。DNA/HO1-DHV在捕获血红素后仍保持抗凝血活性(图3F)。两性离子SBMA增强了抗钙化和抗蛋白质吸附特性。未修饰的DHV和GV在体外测试中显示出明显的钙化和蛋白质吸附,而SS-DHV显著减少(图3G–J)。DNA涂层进一步增强了抗钙化和抗粘附特性,SEM和荧光成像显示SS-DHV表面几乎无钙和BSA(图3G–J)。DNA/HO1-DHV在DNA酶处理7天后无显著DNA降解(图3K),表现出良好的核酸酶稳定性。在新鲜大鼠血清中和循环机械刺激下,DNA/HO1-DHV的DNA水凝胶完整性和胆绿素合成效率在14天后无显著下降。脉动流动评估表明,SS-DHV和DNA/HO1-DHV在14天机械循环应力后保持结构和功能完整性。抗凝血、抗钙化、抗粘附和稳健稳定性特性的整合,凸显了DNA/HO1-DHVs用于体内应用的潜力。
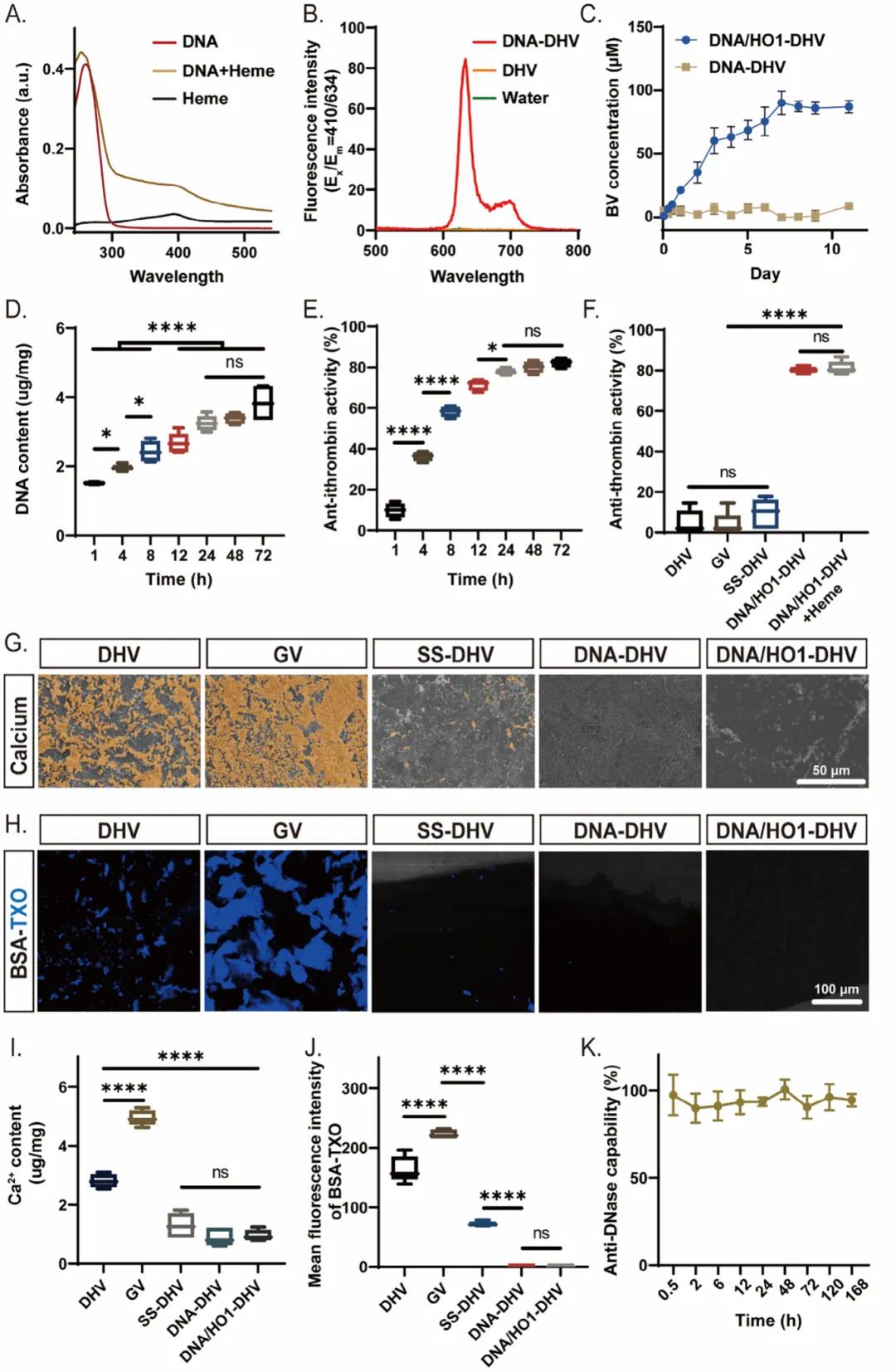
图3 体外抗凝血、抗钙化、抗粘附特性和胆绿素生成的表征。(a)NU172 DNA链的血红素捕获能力评估,通过紫外光谱分析;(b)样品表面G-四链体结构检测,使用原卟啉荧光法;(c)DNA/HO1-DHV的胆绿素释放曲线(n = 3),在反应溶液中孵育并分析吸光度;(d)RCA时间对DHVs表面DNA修饰量的影响(n = 6),通过尿素解离和NanoDrop定量;(e)RCA时间对DNA-DHV抗凝血能力的影响(n = 4),检测残留凝血酶活性;(f)血红素捕获对DNA/HO1-DHV抗凝血活性的影响(n = 6),检测残留凝血酶活性;(g)抗钙化能力表征,通过SEM可视化钙沉积;(h)抗蛋白质粘附能力表征,通过CLSM可视化蛋白质沉积;(i)样品表面钙和磷酸盐沉积的AAS定量分析(n = 5);(j)样品表面蛋白质沉积的Image J定量分析(n = 5);(k)DNA/HO1-DHV的DNA酶抗性评估(n = 4),监测表面DNA含量变化。数据以均值±标准差表示,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001
(3)体外血液相容性评估
通过富含血小板的血浆和全血评估修饰后的DHVs血液相容性(图4A)。与DHV组相比,SS-DHV、DNA-DHV和DNA/HO1-DHV表面的血小板粘附显著减少,表明修饰后表面降低了血小板亲和力,暗示较低的血栓形成潜力。SEM图像显示,DHV表面的血小板表现出延长伪足,处于激活状态;而SS-DHV表面血小板较少且处于非激活或不活跃状态,可能是由于SBMA交联所致。DNA-DHV和DNA/HO1-DHV显著减少血小板粘附和激活,几乎降至可忽略水平,可能归因于DNA水凝胶中的抗凝血NU172寡核苷酸(图4B)。溶血测试显示所有样品溶血率低,具有优异的血液相容性。
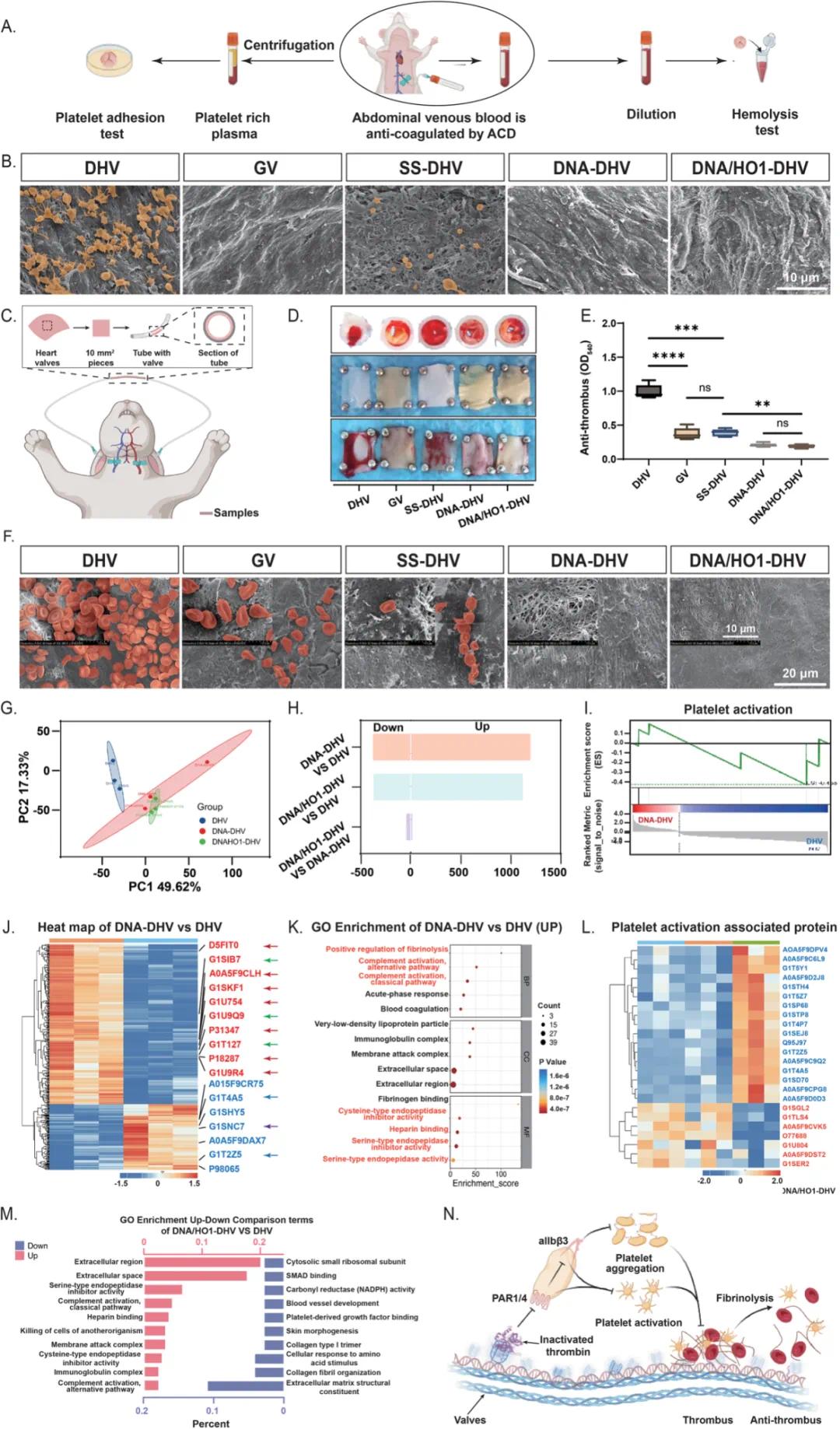
图4 体内血液相容性和抗凝血机制。(a)血液相容性实验程序示意图;(b)评估样品的抗血小板粘附性能,使用SEM分析不同表面的血小板粘附和激活情况;(c)DNA/HO1-DHV血液相容性评估程序示意图;(d)兔子颈动脉循环2小时后不同样品表面血栓形成的宏观照片;(e)颈动脉循环后不同样品表面血栓形成的定量分析(n = 5),通过紫外分光光度计在540 nm处定量血栓形成;(f)颈动脉循环后不同样品表面血栓形成的SEM结果;(g)所有蛋白质的主成分分析(PCA),每个数据点代表一个单独的样品;(h)不同样品之间差异蛋白数量统计;(i)DNA-DHV和DHV之间进行GSEA分析,分析与血小板激活相关的蛋白质;(j)DNA-DHV和DHV之间差异蛋白的热图,蓝色表示下调蛋白,红色表示上调蛋白;(k)DNA-DHV和DHV之间差异蛋白的GO富集分析,红色表示与凝血相关的信号通路;(l)DNA-DHV、DNA/HO1-DHV和DHV之间血小板激活相关蛋白的热图,蓝色表示下调蛋白,红色表示上调蛋白;(m)DNA/HO1-DHV和DHV之间差异蛋白的GO富集分析;(n)DNA-DHV抗凝血机制示意图。数据以均值±标准差表示,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001
(4)体外抗凝血机制评估
在兔颈动脉模型中评估DNA/HO1-DHV的血液相容性和抗凝血效率(图4C)。经过2小时循环后,DHV表面出现显著血栓形成导致阻塞,而GV因戊二醛毒性无血栓。SS-DHV表面有少量血栓形成,可能是由于SBMA水合层所致。DNA-DHV和DNA/HO1-DHV表面血栓形成可忽略,归因于NU172寡核苷酸抑制凝血酶活性(图4D),紫外分光光度法定量支持这一趋势(图4E)。SEM显示DHV表面密集堆积红细胞,SS-DHV表面红细胞显著减少,而GV、DNA-DHV和DNA/HO1-DHV表面粘附极少(图4F)。DNARandom-DHV在体外血栓形成和兔颈动脉实验中加剧血栓形成,可能是由于DNA负电荷吸引凝血酶。蛋白质组学分析显示,DNA-DHV和DNA/HO1-DHV与DHV不同,DNA-DHV鉴定出1195种下调蛋白和378种上调蛋白(图4H)。热图分析和GO富集显示DNA-DHV上调与纤维蛋白溶解和肝素结合相关的蛋白,下调与血小板衍生生长因子结合和胶原纤维组织相关的蛋白(图4J,K),GSEA分析显示DNA-DHV中血小板激活信号通路显著抑制(图4I)。DNA-DHV和DNA/HO1-DHV在血小板激活相关蛋白的下调模式相似(图4L),GO富集比较分析也显示全蛋白质组差异表达的相似模式(图4M)。这些结果表明,DNA包覆DHVs的抗凝血效率主要来源于NU172寡核苷酸灭活凝血酶,HO-1的加入不削弱这一效率。抗凝血机制主要由NU172寡核苷酸介导,抑制凝血酶活性,破坏血小板激活的下游信号通路,防止血小板聚集和激活,并促进血栓的纤维蛋白溶解(图4N)。与传统抗凝血策略相比,这种基于DNA的修饰策略实现了主动抗凝血,减少了非可降解聚合物的毒性风险。
(5)巨噬细胞极化和免疫调节
将促炎性M1型巨噬细胞重编程为再生性M2型巨噬细胞对心脏瓣膜再生至关重要。为克服传统药物递送方法缺乏持续释放能力的限制,构建免疫调节剂生物合成工厂可提供解决方案,持续供应胆绿素,激活PI3K-AKT-IL-10信号通路并抑制TLR4表达,调节巨噬细胞表型和免疫反应。体外实验中,通过细胞培养引入血红素模拟手术溶血过程,结果表明DNA能抑制ROS产生,DNA/HO1-DHV进一步消除ROS(图5B,G)。蛋白质组学分析显示,与DHV相比,DNA-DHV和DNA/HO1-DHV下调了ROS相关途径(图5C,E),热图分析显示ROS相关蛋白表达显著减少(图5D,F)。这些结果表明DNA修饰和胆绿素产生增强了ROS清除能力,减轻氧化应激并促进组织再生。
流式细胞术分析显示,DNA/HO1-DHV显著诱导巨噬细胞重编程,几乎全部转化为M2表型(图5I–K),而原始DHV、GV和DNA-DHV处理的巨噬细胞仍主要为M1型,表明M2极化由DNA/HO1-DHV驱动。移除辅酶的DNA/HO1-DHV(DNA/HO1-DHV-CF)取消了M2极化,而仅含辅酶的对照组未促进M2表型(图5I–K)。游离胆绿素和封装胆绿素的DNA-DHV(DNA/BV-DHV)显示出浓度依赖性M2极化。细胞因子分泌分析表明,DNA/HO1-DHV触发抗炎细胞因子释放,类似于游离胆绿素,而DNA/HO1-DHV-CF诱导促炎细胞因子,类似于原始DHV(图5L)。这些发现证明DNA/HO1-DHV通过原位胆绿素合成促进巨噬细胞向M2表型极化并释放抗炎细胞因子。
蛋白质组学研究显示,DNA-DHV和DNA/HO1-DHV显著下调促炎蛋白并上调抗炎蛋白(图5M),表明其具有体内应用的抗炎和免疫调节潜力。
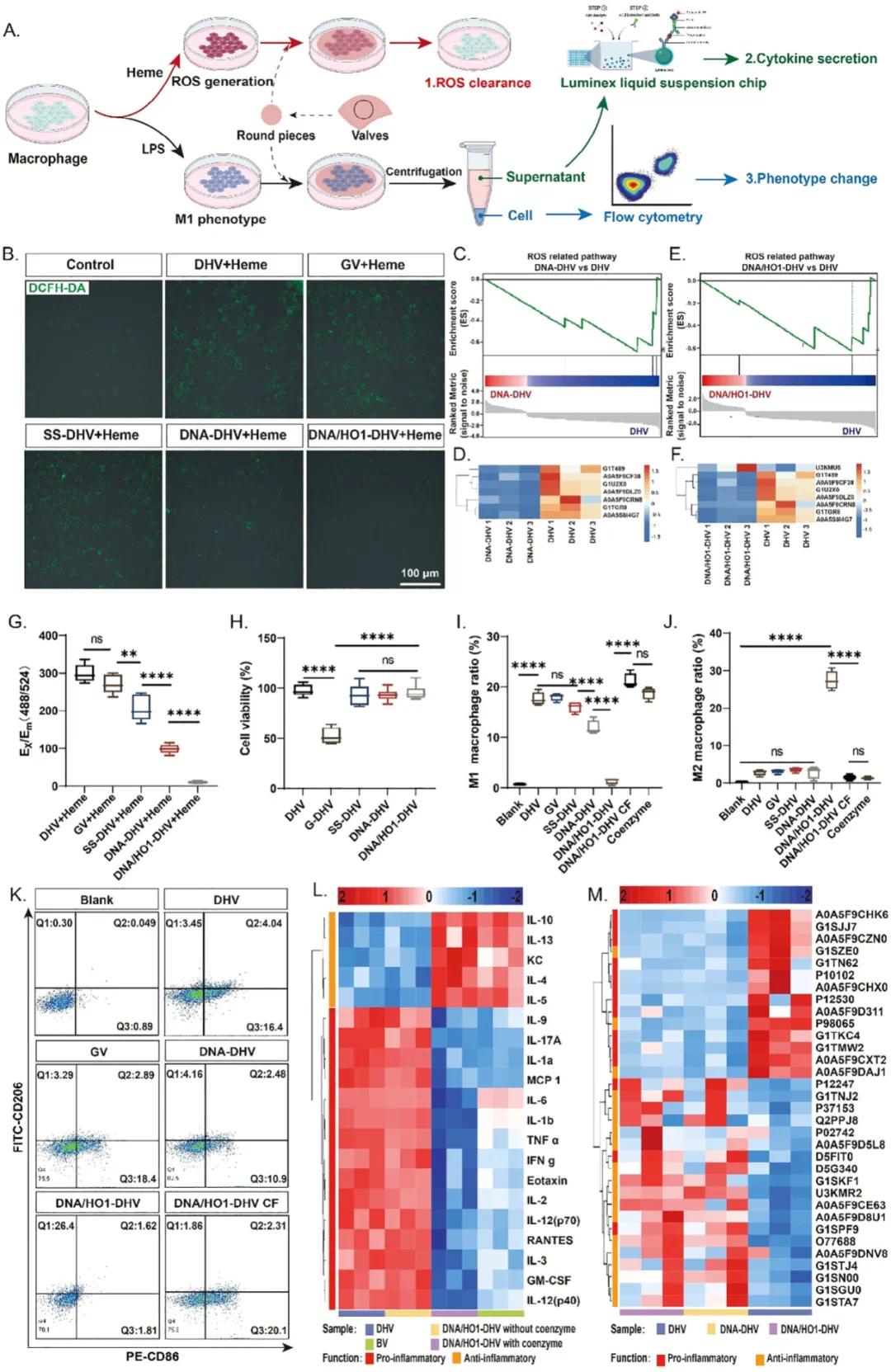
图5 巨噬细胞极化和免疫调节。(a)评估DNA/HO1-DHV免疫调节的实验程序示意图;(b)样品的ROS清除能力表征,使用H2DCFDA探针测量共培养巨噬细胞的ROS产生;(c)DNA-DHV和DHV之间ROS相关蛋白的GSEA分析;(d)DNA-DHV和DHV之间ROS相关蛋白的热图分析;(e)DNA/HO1-DHV和DHV之间ROS相关蛋白的GSEA分析;(f)DNA/HO1-DHV和DHV之间ROS相关蛋白的热图分析;(g)样品的ROS清除能力定量分析(n = 5);(h)样品对HUVECs细胞毒性的影响(n = 6),使用CCK8评估;(i–k)样品对巨噬细胞表型的影响(n = 4),使用流式细胞术评估:(i)流式细胞术结果;(j)M1表型巨噬细胞百分比;(k)M2表型巨噬细胞百分比;(l)样品对巨噬细胞分泌细胞因子的影响(n = 3),使用炎症因子微阵列检测;(m)DNA-DHV和DHV之间炎症蛋白的热图分析,基于兔颈动脉循环样品的蛋白质组学数据进行分析。数据以均值±标准差表示,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001
(6)体内心脏瓣膜再生
为评估心脏瓣膜的长期再生潜力,将DHVs植入大鼠腹主动脉并监测4周(图6A)。4周后,未包覆的DHV出现严重扩张,其他瓣膜保持形状(图6B)。多普勒超声显示所有瓣膜均通畅(图6B)。苏木精-伊红(HE)染色显示GV缺乏细胞浸润且因严重钙化而呈碎片状深紫色,而DNA-DHV和DNA/HO1-DHV显示出与未处理DHV相当的细胞浸润(图6C)。HE和Masson染色显示DNA-DHV和DNA/HO1-DHV的组织厚度显著大于DHV,表明修饰可防止瓣膜降解。伊凡蓝染色显示DNA-DHV和DNA/HO1-DHV更好地保留了弹性蛋白完整性。钙化评估显示DNA-DHV和DNA/HO1-DHV显著抑制钙化,而GV表现出严重钙化(图6C)。
免疫荧光染色显示DNA/HO1-DHV在体内显著诱导M2型巨噬细胞极化(图6D,G),与体外结果一致。相比之下,GV巨噬细胞浸润少,DNA-DHV仅有轻微M2极化。免疫荧光分析促炎和抗炎因子表明,DNA/HO1-DHV最有效地抑制炎症因子并增强抗炎分泌,而DNA-DHV抑制了大多数炎症因子但未促进抗炎分泌。免疫组化染色显示DNA-DHV和DNA/HO1-DHV中I型胶原蛋白再生(图6E,H)。免疫荧光染色显示DNA/HO1-DHV在28天内成功形成完整内皮层并有间充质细胞浸润(图6E,I),表明其实现了内皮和间充质组织再生,而DHV和DNA-DHV未观察到内皮再生(图6I)。这些结果表明DNA/HO1-DHV具有高效的细胞浸润和再细胞化能力,解决了生物瓣膜耐久性和性能的关键问题,展示了完全内皮化、ECM重塑以及显著的抗钙化和抗凝血能力。
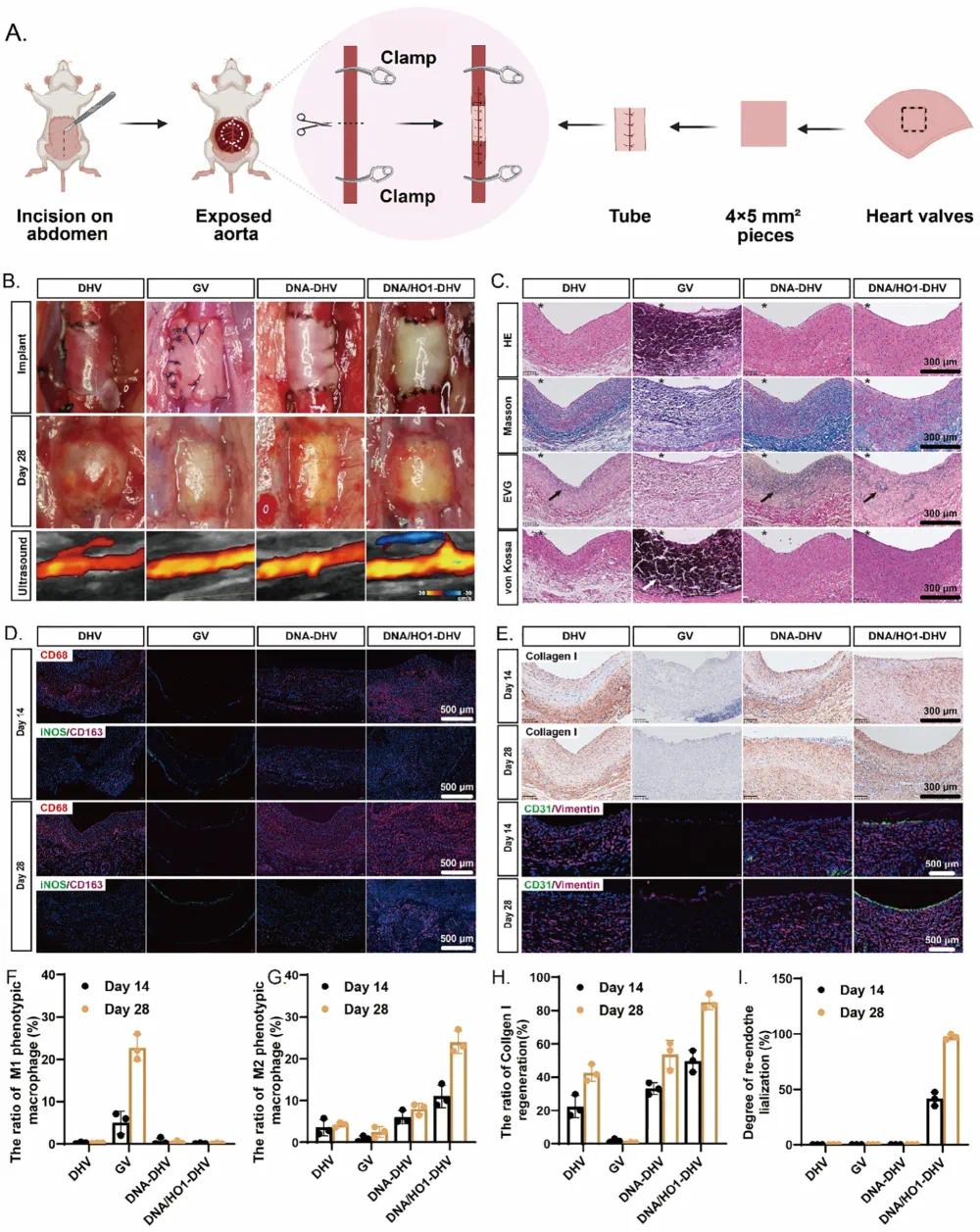
图6 体内心脏瓣膜再生。(a)大鼠腹主动脉移植模型示意图;(b)大鼠腹主动脉移植后28天的宏观照片和多普勒超声检查;(c)移植后28天的HE、MASSON、EVG、Von Kossa染色,评估细胞浸润、细胞外基质降解和钙化;(d)使用CD68、iNOS和CD163免疫荧光染色评估样品的免疫调节能力;(e)使用I型胶原蛋白、CD31和VIM免疫荧光染色评估第14天和第28天的样品;(f)统计M1表型巨噬细胞的比例(n = 3);(g)统计M2表型巨噬细胞的比例(n = 3);(h)I型胶原蛋白再生的统计数据(n = 3);(i)内皮化程度的统计数据(n = 3)。所有数据统计基于切片中相应指标的染色信号并通过Image J计算,数据以均值±标准差表示,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001
(7)DNA/HO1-DHV瓣膜再生的潜在机制
对移植后28天的腹主动脉样本进行RNA测序,研究DNA/HO1-DHV的再生机制。结果表明,DNA-DHV具有抗凝血和ROS抑制特性,下调了粘附斑通路中的基因(图7A),但对促炎环境无显著影响,表明其单独不足以调节免疫微环境。DNA/HO1-DHV系统中,GSEA显示上调了血红素信号和血红素清除途径(图7E),抑制了TNF、NF-κB、IL-17和MAPK信号通路相关基因(图7B),且这些通路被有效抑制(图7C)。Reactome和WikiPathways富集分析显示TLR级联和MyD88依赖性信号通路显著富集,表明胆绿素通过抑制TLR途径防止MyD88表达下调,从而抑制下游信号通路激活。热图分析证实了相关基因表达变化(图7D)。免疫荧光染色显示DNA/HO1-DHV显著下调了Myd88、NF-κB p65、p-JNK和p-STAT(图7G),表明其通过抑制Myd88表达调节免疫反应。此外,DNA/HO1-DHV通过激活PI3K-AKT途径增强内皮化,导致IL-10水平增加和eNOS磷酸化,从而产生NO(图7B)。相关基因的热图分析显示DNA/HO1-DHV组中关键标志物表达水平升高(图7F),下游基因(如Nos3、Igf1、Ptk2和Vegfd)也上调(图7F)。免疫荧光染色证实DNA/HO1-DHV显著激活PI3K-AKT途径,增加eNOS磷酸化(图7G,H-d,H-e,H-f)。DNA/HO1-DHV还抑制了成骨样分化,有助于防止瓣膜钙化和促进再生。综上,DNA/HO1-DHV通过释放胆绿素抑制关键信号通路激活发挥抗炎作用,其完全内皮化可能是由胆绿素介导的PI3K-AKT信号通路激活驱动的,增强了eNOS磷酸化和NO释放,使其成为推进心脏瓣膜治疗的有希望的候选者。
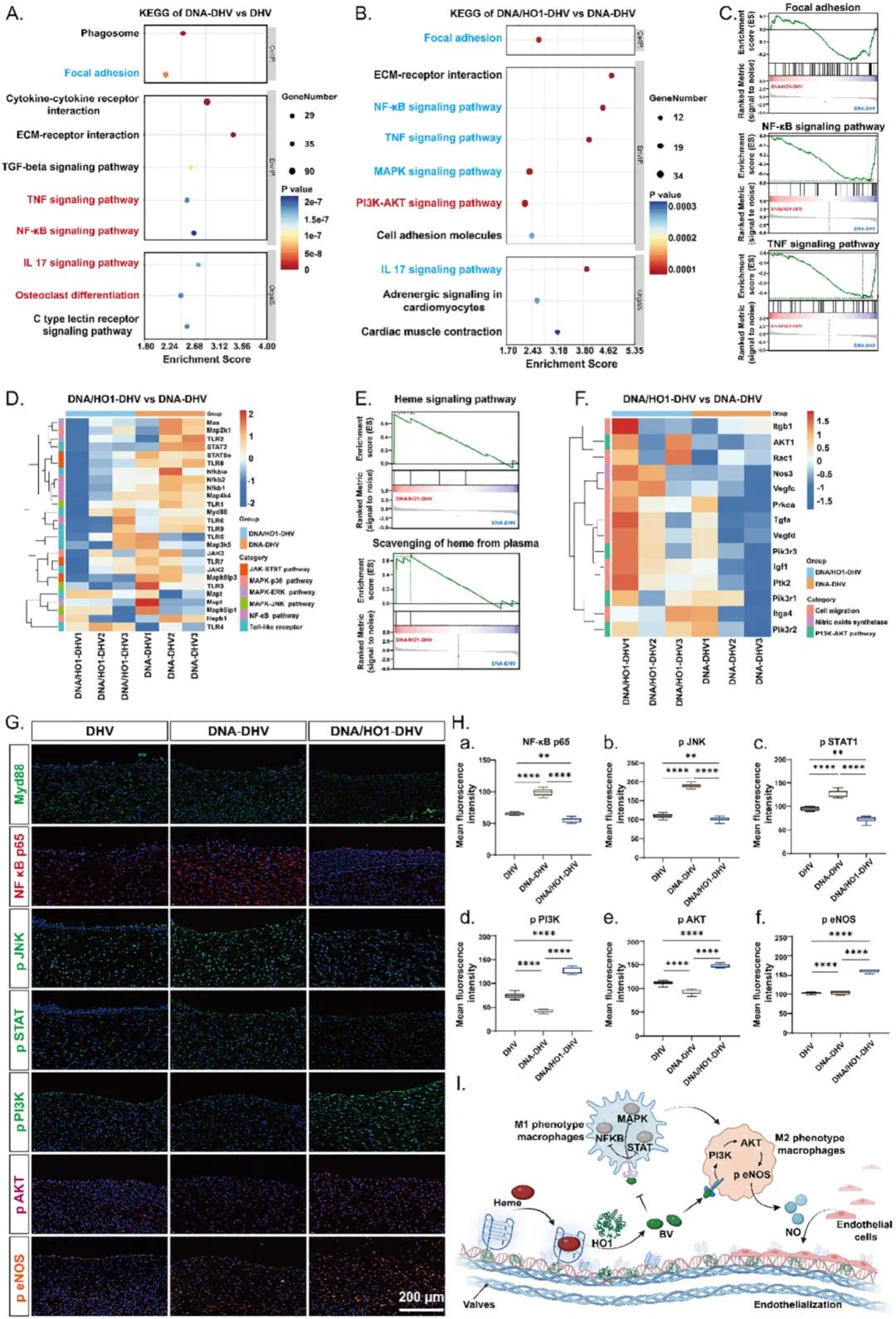
图7 DNA/HO1-DHV瓣膜再生的潜在机制。(a)DNA-DHV和DHV差异基因的KEGG富集分析;(b)DNA/HO1-DHV和DNA-DHV差异基因的KEGG分析;(c)DNA/HO1-DHV和DNA-DHV差异基因的GSEA分析;(d)与TLRs、NF-κB、MAPK和JAK-STAT信号通路相关的蛋白质热图分析,比较DNA/HO1-DHV和DNA-DHV,p值<0.05且|log2FC|>1;(e)DNA/HO1-DHV和DNA-DHV之间与血红素信号和血红素清除相关的基因的GSEA分析;(f)PI3K-AKT差异基因的热图分析,比较DNA/HO1-DHV和DNA-DHV,p值<0.05且|log2FC|>1;(g)对腹主动脉移植切片进行免疫荧光分析,检测Mdy88、NF-κB p65、p-JNK、p-STAT1、p-PI3K和p-eNOS(n = 6);(h)使用Image J分析Mdy88、NF-κB p65、p-JNK、p-STAT1、p-PI3K和p-eNOS的平均荧光强度;(i)DNA/HO1-DHV免疫调节和促再生机制示意图,蓝色和红色字体分别表示相应信号通路或基因的下调和上调。数据以均值±标准差表示,*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001
本研究开发了一种原位生物合成策略,利用可编程的DNA水凝胶在去细胞化心脏瓣膜上进行RCA,构建了定制的生物合成工厂,编码大量NU172寡核苷酸以提供抗凝血特性并捕获血红素,同时封装的HO-1催化血红素转化为胆绿素以增强免疫调节。通过两性离子聚合物pSBMA交联和抗钙化处理,进一步增强了性能。 这种工程化的心脏瓣膜(DNA/HO1-DHV)展现出卓越的抗凝血、抗粘附、抗钙化特性及良好的血液相容性。DNA水凝胶的抗氧化能力与胆绿素产生相结合,有效抑制了手术部位的ROS。体外和体内结果均证实持续的胆绿素产生触发巨噬细胞向M2表型极化,重塑免疫微环境。RNA测序分析揭示胆绿素诱导eNOS磷酸化、NO释放及PI3K-AKT信号通路激活,促进组织再生。可降解的DNA水凝胶允许在再生过程中足够的细胞浸润,一个月内实现完全的内皮细胞覆盖和细胞外基质重塑。 这种去细胞化心脏瓣膜解决了当前假体的关键局限性,包括钙化、毒性、炎症、血栓形成以及不充分的内皮化和再生能力。该原位生物合成策略为持续生产活性药物提供了有效替代方案,克服了传统药物封装的局限性,不仅在心脏瓣膜工程中具有巨大潜力,还为组织再生中耐用和有效生物材料的开发提供了新思路。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

