
脂质纳米颗粒(LNPs)在核酸递送领域取得了革命性进展,广泛应用于基因治疗、蛋白替代疗法和免疫治疗等多种疾病的治疗中。其在新冠疫情期间用于递送SARS-CoV-2疫苗的临床应用尤为突出。
然而,传统LNPs主要由离子化脂质、磷脂、胆固醇和聚乙二醇脂质四种成分组成,难以实现肝脏以外的靶向递送,因为它们会与血液中的载脂蛋白E(ApoE)结合,进而通过低密度脂蛋白受体(LDLR)介导的内吞作用在肝脏积累。递送方式和配方设计对LNPs的靶向性至关重要。例如,通过腹腔注射可将纳米颗粒重定向至胰腺;在传统LNP配方中加入第五种成分(如阳离子或阴离子脂质)可实现肺和脾脏的特异性mRNA表达;添加含有Toll样受体(TLR)7/8激动剂的佐剂脂质也可在淋巴结实现转染。这些研究表明,通过配方设计有望克服传统四组分LNPs的局限性,实现对其他难以到达组织的靶向。

针对上述问题,内华达大学拉斯维加斯分校Chandrabali Bhattacharya教授开发了一种名为内源靶向脂质纳米颗粒(ENDO)的新平台,通过在LNP配方中加入内源性配体(如维生素)作为第五组分,调节其器官趋向性并增强靶向递送能力。研究筛选了100种不同配方的LNPs,这些配方包含多种内源性维生素、不同的离子化脂质和独特的配方比例,以评估其组织特异性递送潜力。结果发现,两种含有胆钙化醇作为第五组分的配方(C-CholF2和C-CholF3)可通过静脉注射实现对胰腺的高选择性mRNA递送,其中C-CholF3在胰腺的蛋白表达效率更高,具有超过99%的选择性和长达3天的持续表达能力。研究推测其胰腺趋向性可能与维生素D受体(VDR)介导的内源靶向机制有关。此外,C-CholF3还可用于递送其他核酸载荷,包括质粒DNA和环状mRNA,且具有较低的毒性、更好的安全性和耐受性。在Ai14小鼠模型中,C-CholF3 LNP还实现了胰腺的组织特异性基因编辑。该研究证明了将内源性维生素作为LNP第五组分的重要性,并为靶向难以到达的肝脏外器官(如胰腺)提供了新的策略,有望用于治疗目前无法治愈的胰腺疾病。该文章于2025年6月12日以《Reengineering Endogenous Targeting Lipid Nanoparticles (ENDO) for Systemic Delivery of mRNA to Pancreas》为题发表于《Advanced Materials》上((DOI:10.1002/adma.202507657)。
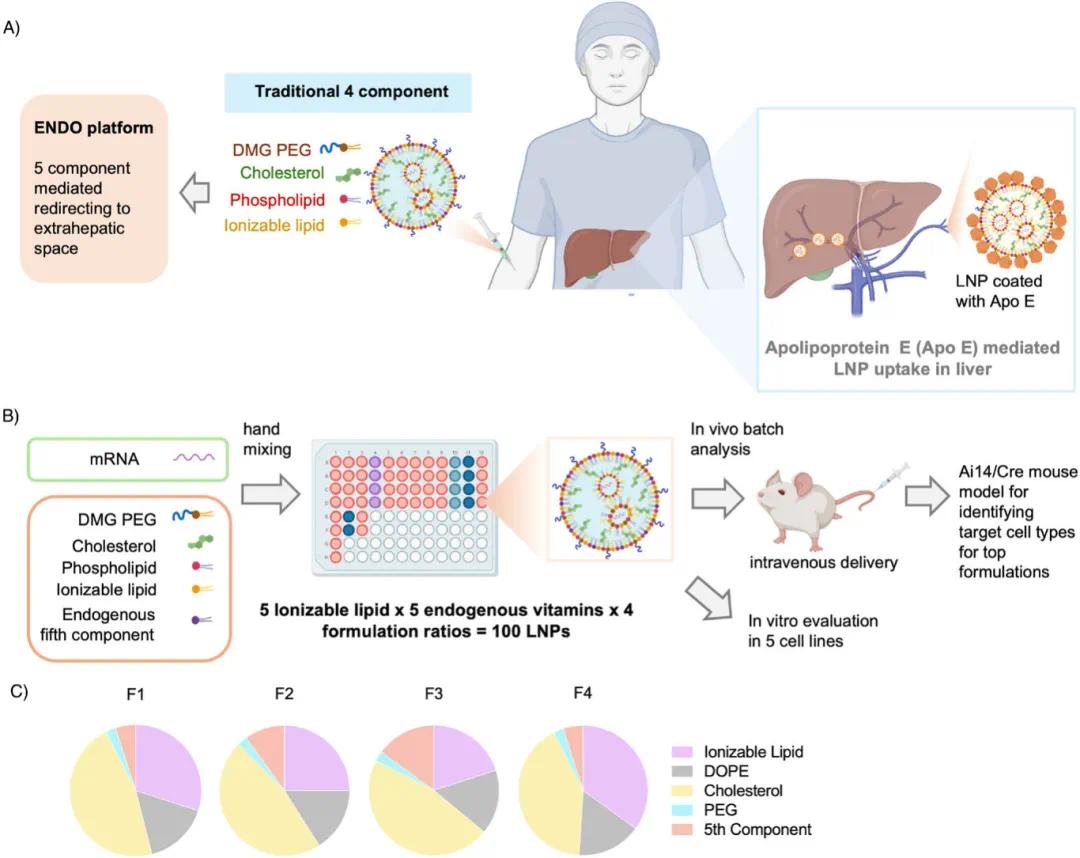
图1 第五组分ENDO LNP制剂及筛选平台概览。(a)目前开发肝外递送系统面临的挑战示意图;(b)ENDO LNP制剂及筛选平台示意图;(c)不同制剂比例的饼状图,包括可离子化脂质、磷脂、胆固醇、PEG脂质和内源性维生素第五组分
(1)ENDO LNPs 的体外筛选
传统mRNA递送用的脂质纳米颗粒(LNPs)由四种关键成分组成:离子化脂质、辅助脂质、胆固醇和聚乙二醇脂质。为增强LNPs的器官特异性递送能力,研究中加入了维生素A、B2、D3、E和K1作为第五组分。开发了一个全面的配方库,使用了SM-102、MC3、C12-200、THP1和306Oi10等离子化脂质,基于基准配方(摩尔比为35:16:46.5:2.5)设计了四种不同配方比例,并系统研究了维生素摩尔比对LNPs性能的影响(图1C)。通过手工混合在96孔板中制备了100种不同配方的LNPs,结合了五种离子化脂质、五种维生素和四种配方比例。动态光散射(DLS)测量显示,大多数LNPs的平均直径在60~140 nm之间,PDI小于0.2,与传统LNPs结构相似。
在多种细胞系(HEK293、HFF、HUVEC、RAW264.7和HMC3)中评估了所有LNPs的体外转染效率。结果表明,与对照组MC3和SM-102相比,ENDO LNPs的转染效率显著提高。例如,在HEK293细胞中,以视黄醇、核黄素和叶绿醌为第五组分的LNPs转染效率更高(图2A);在HFF细胞中,以视黄醇、核黄素和生育酚为第五组分的SM-102 LNPs转染效率更高(图2B);在HUVEC细胞中,C12-200和306Oi10为基础的LNPs表现出更高的转染效率(图2C);在RAW264.7细胞中,C12-200为基础的LNPs转染效率更高(图2D);在HMC3细胞中,以视黄醇、核黄素和叶绿醌为第五组分的C12-200 LNPs转染效率更高(图2E)。这些结果表明,将维生素作为第五组分加入ENDO LNPs可以显著提高转染效率,为实现组织特异性递送提供了依据。
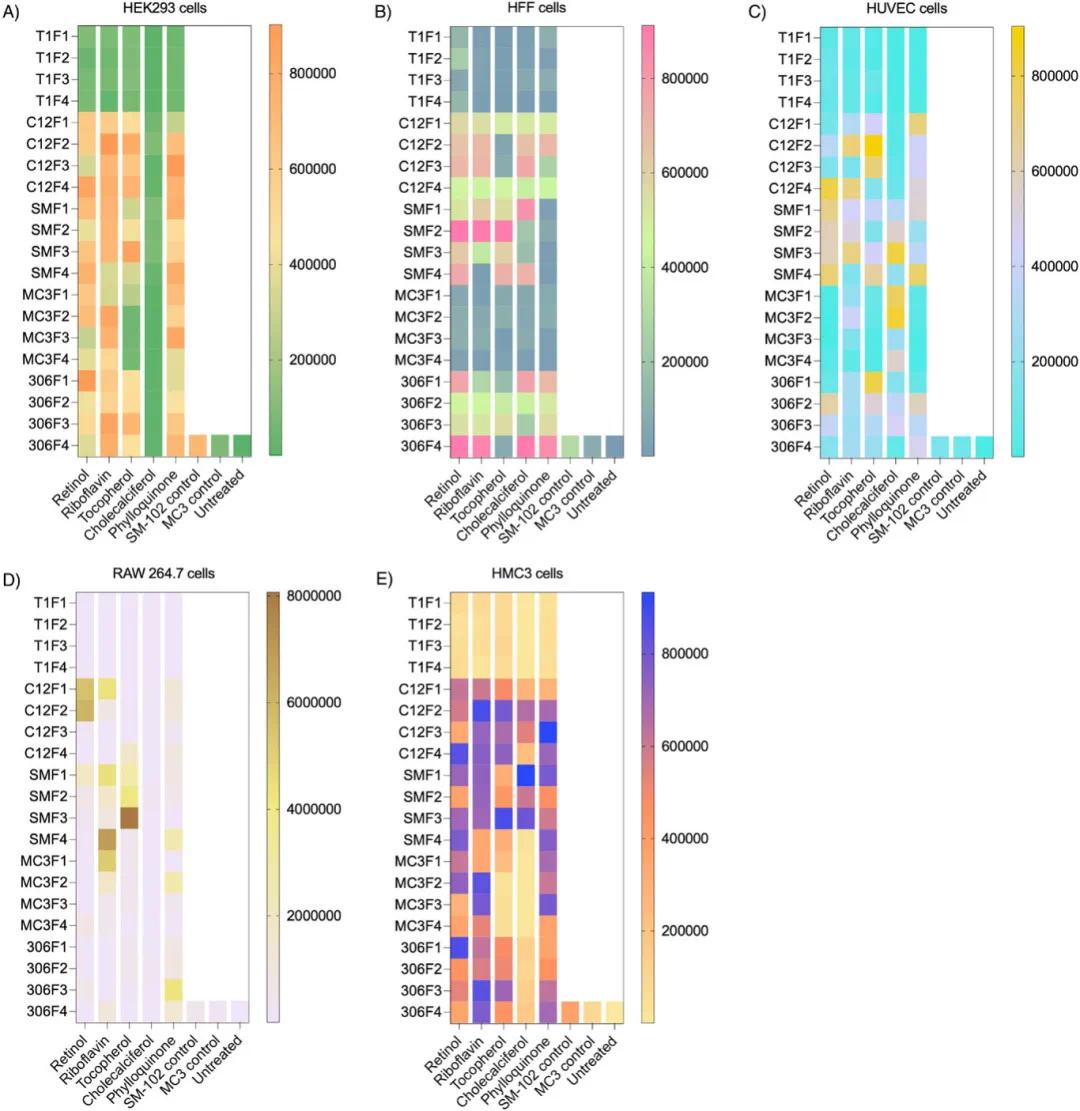
图2 ENDO LNPs的体外筛选。(a)在HEK293细胞中体外递送荧光素酶mRNA的热图(每孔125 ng mRNA,96孔板,n=3),处理24小时后量化发光强度;(b)在HFF细胞中体外递送荧光素酶mRNA的热图(每孔125 ng mRNA,96孔板,n=3),处理24小时后量化发光强度;(c)在HUVEC细胞中体外递送荧光素酶mRNA的热图(每孔125 ng mRNA,96孔板,n=3),处理24小时后量化发光强度;(d)在RAW 264.7细胞中体外递送荧光素酶mRNA的热图(每孔125 ng mRNA,96孔板,n=3),处理24小时后定量分析发光强度;(e)在HMC3细胞中体外递送荧光素酶mRNA的热图(每孔125 ng mRNA,96孔板,n=3),处理24小时后定量分析发光强度。缩写:T1,THP1;C12,C12-200;SM,SM-102;306,306Oi10;F1,配方1;F2,配方2;F3,配方3;F4,配方4
(2)使用批量分析进行ENDO LNPs体内筛选
通过综合批量分析评估了ENDO LNPs的体内递送效率。研究将100种LNPs按配方比例分为四组(F1、F2、F3和F4),每组包含25种配方。这些LNPs以0.5 mg·kg⁻¹的剂量静脉注射到C57BL/6小鼠体内,通过IVIS成像系统检测主要器官的蛋白表达。结果显示,F1和F4主要在肝脏表达,并在脾脏、肠道和胰腺有少量表达;F2和F3则显著重定向到肝脏外,其中F2在胰腺表现出选择性蛋白表达,而在其他器官(包括脾脏和肝脏)表达极少(图3A)。随后,基于离子化脂质(THP1、C12-200、SM-102、MC3和306Oi10)将F2和F3配方分为五组,每组10种LNPs进行注射。结果表明,C12-200组在胰腺表现出选择性转染,而其他离子化脂质组在多个器官均有表达(图3B)。进一步将C12-200配方按不同维生素(视黄醇、核黄素、胆钙化醇、生育酚和叶绿醌)分组,发现胆钙化醇配方在胰腺表现出选择性mRNA转染和蛋白表达(图3C)。在整个筛选过程中,SM-102和MC3作为对照,主要在肝脏积累。
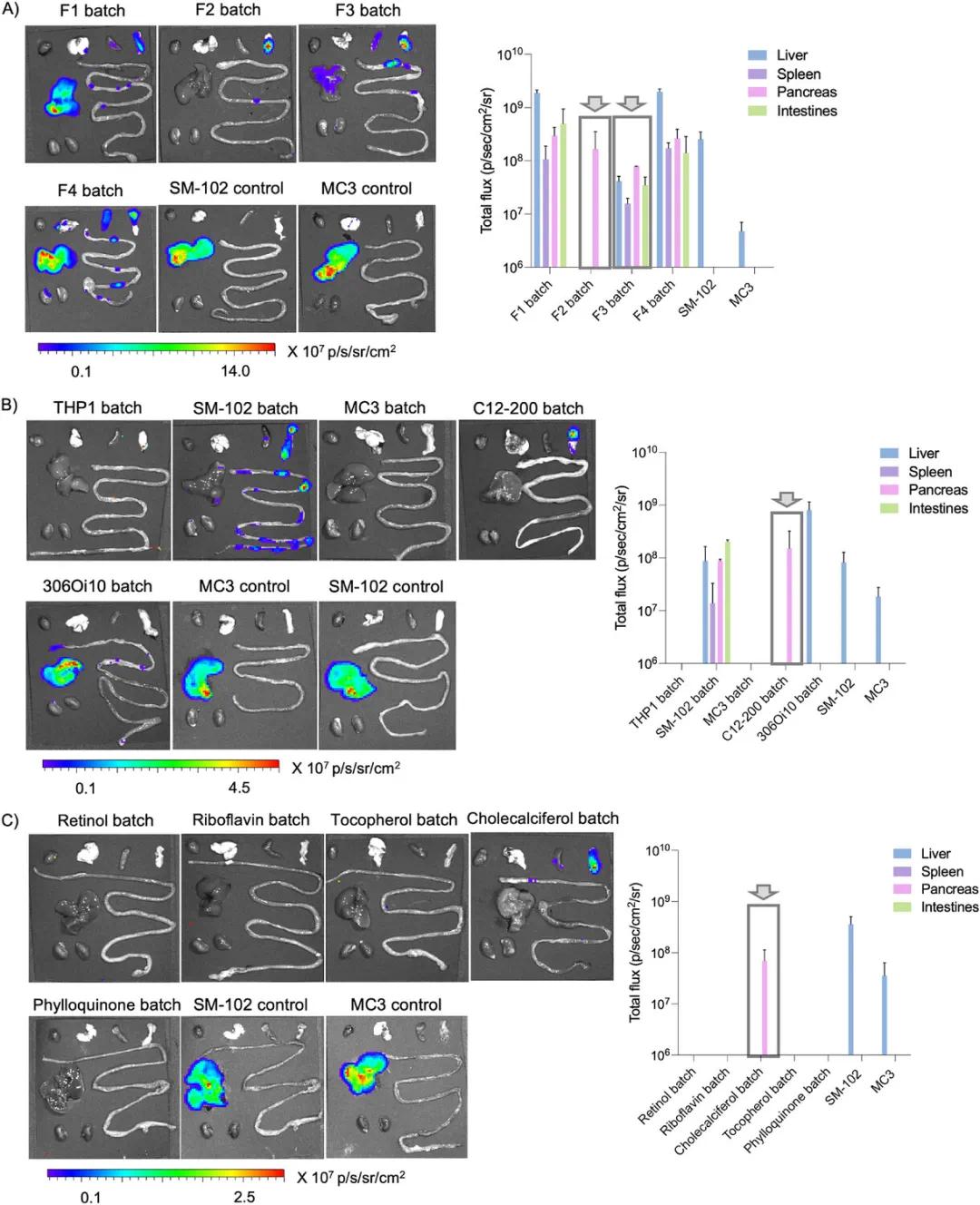
图3 使用批量分析进行ENDO LNPs体内筛选。(a)注射后24小时的IVIS图像及基于配方(F1、F2、F3、F4)的FLuc mRNA ENDO LNP池总通量的图形表示,SM-102和MC3作为对照,C57BL/6小鼠静脉注射0.5 mg·kg⁻¹混合的ENDO LNPs(n=2只生物学独立小鼠,±SD)。器官从左到右依次为:心脏、肺、脾、胰腺、肝脏、肠和肾脏。(b)注射后24小时的IVIS图像及基于可离子化脂质的FLuc mRNA ENDO LNP池总通量的图形表示,靶向胰腺的F2和F3 LNPs按可离子化脂质(THP1、C12-200、SM-102、MC3、306Oi10)分批处理后静脉注射,SM-102和MC3作为对照(n=2只生物学独立小鼠,±SD)。器官从左到右依次为:心脏、肺、脾、胰腺、肝脏、肠和肾脏。(c)注射后24小时的IVIS图像及基于内源性维生素的FLuc mRNA ENDO LNP池总通量的图形表示,靶向胰腺的选择性C12-200 ENDO LNP按维生素A(视黄醇)、B2(核黄素)、D3(胆钙化醇)、E(生育酚)、K1(叶绿醌)分批处理后静脉注射,SM-102和MC3作为对照(n=2只生物学独立小鼠,±SD)。器官从左到右依次为:心脏、肺、脾、胰腺、肝脏、肠和肾脏
(3)ENDO LNP、C-CholF2 和 C-CholF3 的效果验证
使用微流控装置制备了C12-200胆钙化醇F2(C-CholF2)和C12-200胆钙化醇F3(C-CholF3)LNPs。C-CholF2和C-CholF3的粒径和包封率(EE%)测量结果显示,两者粒径相似且EE%较高,表明mRNA包封效果良好(图4A)。将C-CholF2和C-CholF3以0.5 mg·kg⁻¹的剂量静脉注射到C57BL/6小鼠体内,C-CholF3和C-CholF2在胰腺表现出选择性表达,C-CholF3的平均总通量为1.04×10⁸,是C-CholF2(2.29×10⁷)的4.5倍,表明C-CholF3能够以更高的效率靶向胰腺(图4B)。通过腹腔注射途径评估了C-CholF3的效率,平均总通量降低到5.94×10⁶(约为静脉注射信号的12%),但对胰腺的选择性仍超过99%。C-CholF3 ENDO LNPs的低温电子显微镜(cryo-EM)图像显示其呈球形,具有多层膜壳包裹的非晶态核心(图4D)。将0.25、0.5和1 mg·kg⁻¹的C-CholF3 LNPs静脉注射到C57BL/6小鼠体内,观察到明显的剂量依赖性转染效率提升。
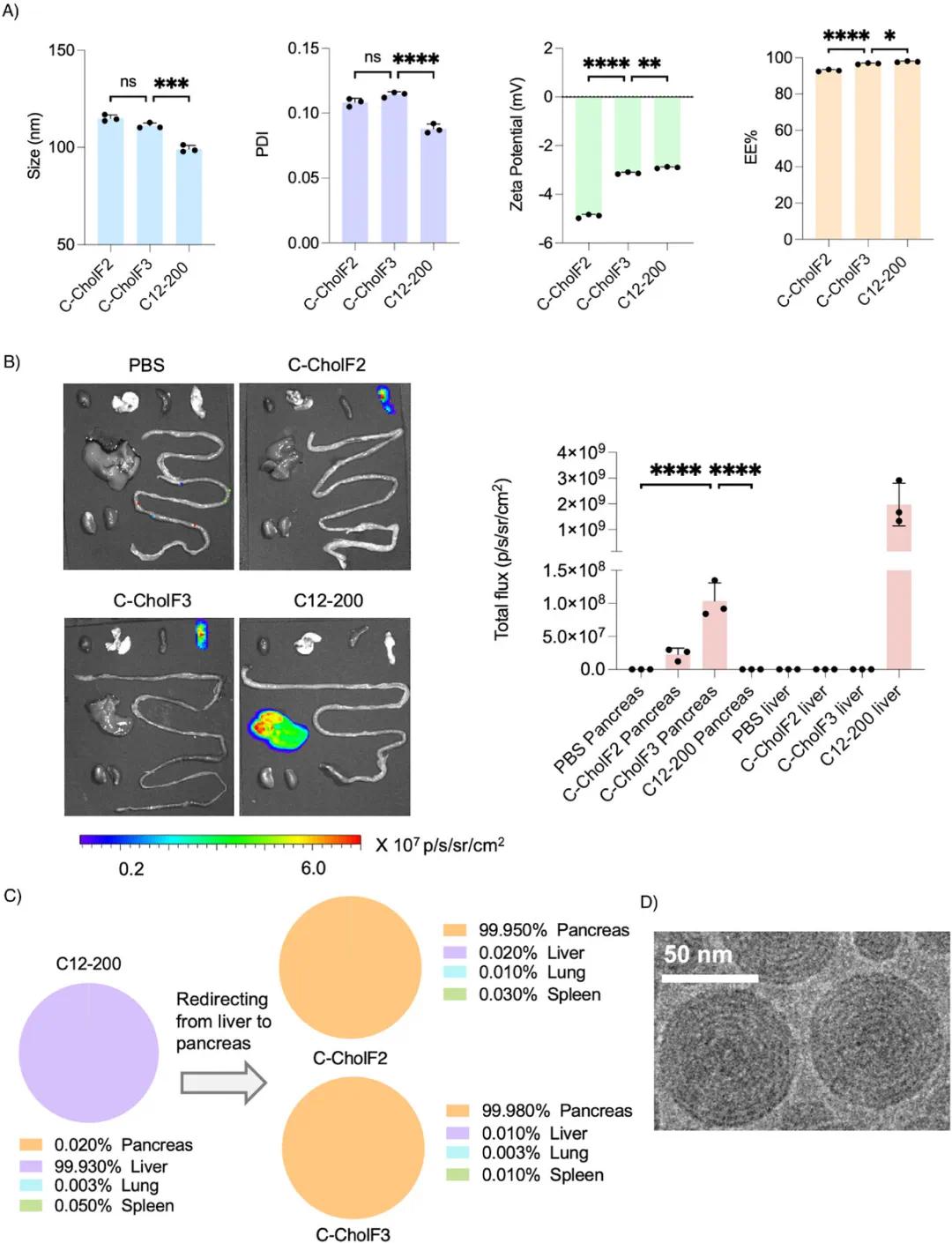
图4 顶级ENDO LNP(C-CholF2和C-CholF3)的验证。(a)C-CholF2和C-CholF3及对照(C12-200)的物理化学特性,包括尺寸、PDI、ζ电位和mRNA包封效率(n=3,±SD,*p<0.05,**p<0.01,***p<0.001,****p<0.0001,NS表示不显著,采用单因素方差分析及Bonferroni事后分析)。(b)注射后24小时的代表性IVIS图像及静脉注射0.5 mg·kg⁻¹的C-CholF2和C-CholF3 ENDO LNP总通量的图形表示,PBS和C12-200作为对照(n=3只生物学独立小鼠,±SD,*p<0.05,**p<0.01,***p<0.001,****p<0.0001,NS表示不显著,采用单因素方差分析及Bonferroni事后分析)。器官从左到右依次为:心脏、肺、脾、胰腺、肝脏、肠和肾脏。(c)饼图显示静脉注射C12-200(传统四组分)并重定向至胰腺后,C-CholF2和C-CholF3 LNPs在各器官的蛋白表达百分比(n=3只生物学独立小鼠)。(d)C-CholF3 LNPs的代表性低温电子显微镜图像,比例尺为50纳米
(4)C-CholF3 ENDO LNPs的毒性和安全性评估
C-CholF3的体内生物相容性研究显示,其处理的胰腺组织在24小时和48小时后H&E染色未见形态学损伤或炎症反应(图5A),胰岛细胞保持完整,无坏死或退行性变化;肝脏组织在48小时后H&E染色也未见显著差异。连续监测21天体重和血液学参数发现,小鼠体重无显著下降,肝酶(ALT、AST、碱性磷酸酶)水平正常,未观察到肾脏毒性(图5B)。注射后24小时检测的促炎细胞因子(IL-1β、IL-6、TNF-α)水平与PBS对照组相当,表明LNP低免疫原性(图5C),其他免疫生物标志物水平也与对照组相当,适合LNP的重复给药。这些结果表明,C-CholF3 ENDO LNPs具有更高的生物相容性和更低的毒性,优于传统C12-200 LNPs。
C-CholF3 LNPs在4℃和-20℃下储存1、3、7和21天后,物理化学性质变化极小,粒径、PDI、ζ电位和EE%等参数保持一致。即使在无冷冻保护剂的情况下储存21天,LNPs仍能保持稳健的荧光素酶(FLuc)表达,表明其具有卓越的稳定性,适合长期储存和运输。此外,静脉注射C-CholF3 LNPs到C57BL/6小鼠体内后,生物发光信号在72小时内保持稳健(图S14,补充信息),表明其在体内具有较长的稳定性和表达时间。
通过TNS实验发现,靶向胰腺的C-CholF3 LNPs的表观pKa值为7.31,高于靶向肝脏的C12-200 LNPs的pKa值6.71。C-CholF3 LNPs能够递送多种核酸载荷,包括质粒DNA和环状mRNA。静脉注射含有环状mRNA或质粒DNA的C-CholF3 LNPs后,环状mRNA的平均总通量为8.41×10⁷,质粒DNA为1×10⁸,且两者的选择性均超过99%,表明其对不同核酸具有广泛的兼容性。质粒DNA可实现长期基因表达,环状mRNA则具有更高的稳定性和更低的免疫原性。总体而言,C-CholF3 LNPs是一种安全且高效的胰腺靶向核酸治疗递送方法,对胰腺癌和糖尿病治疗具有重要意义。
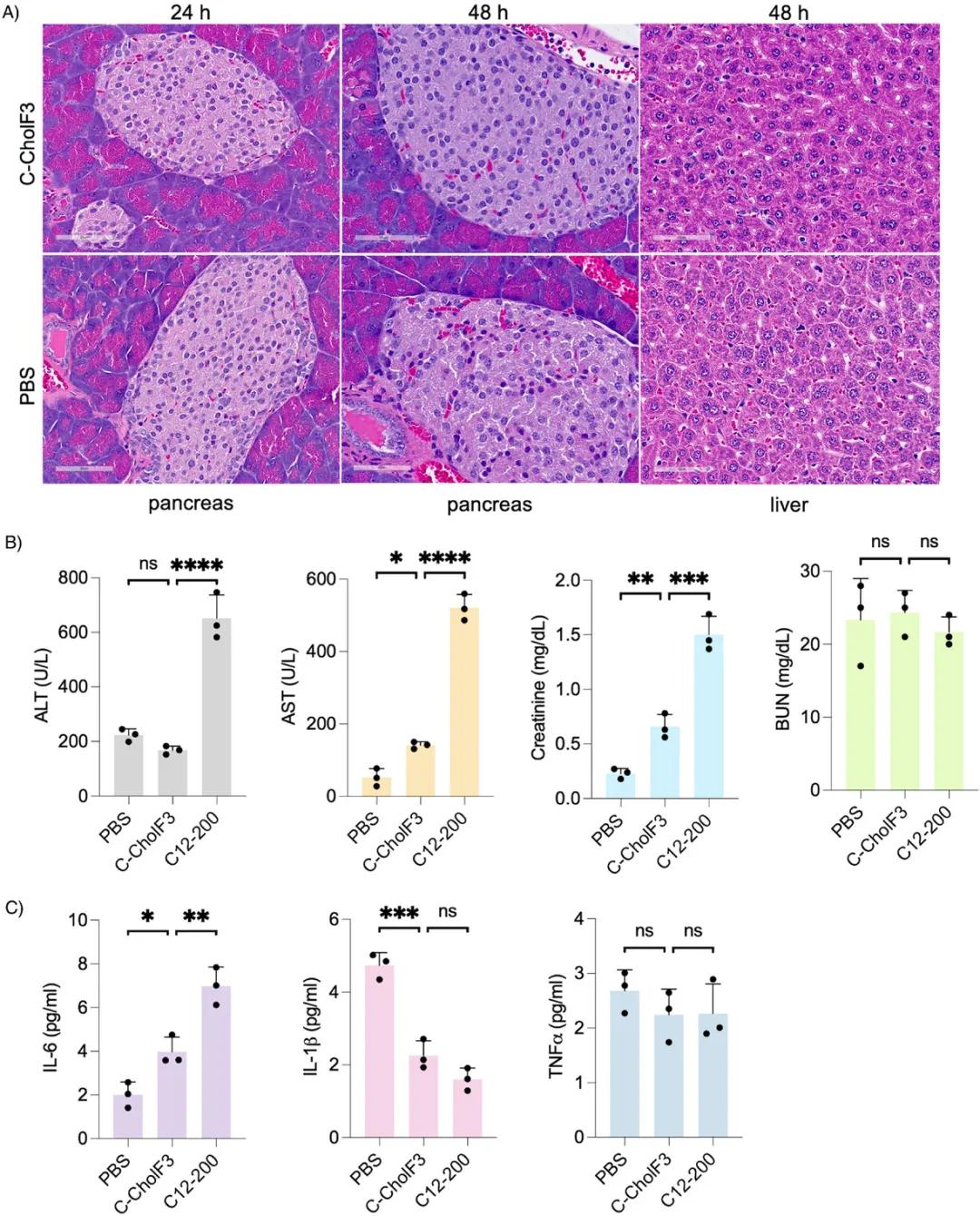
图5 C-CholF3 ENDO LNPs的毒性和安全性评估。(a)C57BL/6小鼠静脉注射包裹FLuc mRNA的C-CholF3和PBS(对照,剂量0.5 mg·kg⁻¹)后,胰腺(处理后24和48小时)和肝脏切片(处理后48小时)的代表性组织学图像,苏木精-伊红(H&E)染色,放大倍数40倍,比例尺60 µm(n=3只生物学独立小鼠)。(b)静脉注射PBS、C-CholF3和C12-200 LNPs(剂量0.5 mg·kg⁻¹)后24小时,血清肝酶(丙氨酸氨基转移酶ALT和天冬氨酸氨基转移酶AST)、肾脏参数(血尿素氮BUN和肌酐)水平(n=3,±SD,*p<0.05,**p<0.01,***p<0.001,****p<0.0001;NS表示不显著,采用单因素方差分析和Bonferroni事后分析)。(c)以0.5 mg·kg⁻¹剂量静脉注射C-CholF3和C12-200 LNPs的小鼠体内IL-6、IL-1β和TNFα水平(n=3只生物学独立小鼠,±SD,*p<0.05,**p<0.01,***p<0.001;NS表示无显著性,采用单因素方差分析和Bonferroni事后分析),以注射PBS的小鼠作为对照组
(5)C-CholF3 ENDO LNPs 内源性靶向胰腺的机制探究
C-CholF3 ENDO LNPs实现胰腺选择性递送的机制研究结果如下:共聚焦显微镜观察显示,DiO标记的C-CholF3 LNPs在BxPC-3细胞中处理2小时后与LysoTracker标记的内体/溶酶体明显共定位,表明其有效内化和内质网运输(图6A)。C-CholF3处理的细胞DiO荧光强度显著高于MC3处理的细胞,提示其细胞摄取能力更强,推测与受体介导的内化途径有关。由于C-CholF3配方中含有胆钙化醇作为第五组分,推测其可能通过与维生素D受体(VDR)的相互作用实现胰腺细胞的选择性摄取。
在体内研究中,使用VDR的拮抗剂MeTC7预处理C57BL/6小鼠(50 mg·kg⁻¹),12小时后静脉注射包裹Fluc mRNA的C-CholF3 ENDO LNPs(0.5 mg·kg⁻¹)(图6B)。注射后24小时的IVIS成像显示,PBS处理的小鼠胰腺中荧光素酶表达强烈,证实了C-CholF3的胰腺靶向性(图6C),而MeTC7预处理的小鼠胰腺信号完全消失,表明功能性VDR对组织选择性递送至关重要,MeTC7破坏了VDR与C-CholF3 LNPs的相互作用。此外,MC3 LNPs在MeTC7处理的小鼠中仍表现出强烈的肝脏蛋白表达,符合ApoE介导的肝脏靶向机制。
进一步验证VDR的作用,将MeTC7作为第五组分替代胆钙化醇,制备了靶向胰腺的LNPs。以0.5 mg·kg⁻¹的剂量静脉注射MeTC7 LNPs后,24小时的IVIS成像显示胰腺中选择性且强烈的荧光素酶表达(图6D),表明MeTC7嵌入LNP后可与VDR相互作用,类似于胆钙化醇,从而促进高效的胰腺靶向。这进一步证实了LNP与VDR之间的直接相互作用,支持了一种新的VDR介导的递送机制。
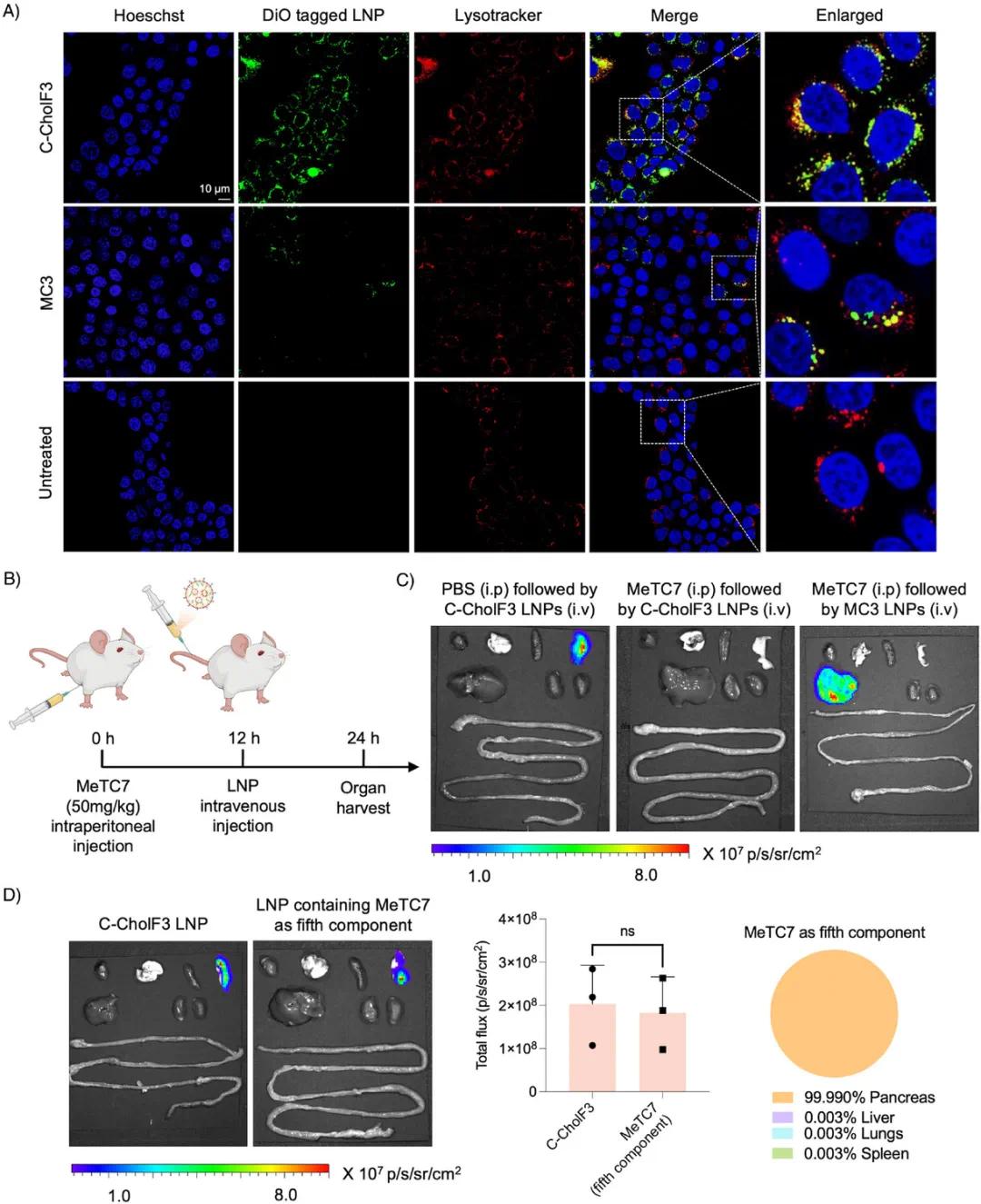
图6 C-CholF3 ENDO LNPs内源性靶向胰腺的机制探究。(a)共聚焦显微镜图像显示DiO标记的C-CholF3和MC3 LNPs在BxPC-3细胞中的摄取和细胞内运输情况。细胞用LysoTracker Red(内体/溶酶体)和Hoechst 33342(细胞核)染色,处理后2小时成像以观察纳米颗粒定位,比例尺10 µm,放大60倍(n=3)。(b)使用MeTC7阻断VDR的示意图。小鼠腹膜内注射50 mg·kg⁻¹ MeTC7,12小时后静脉注射mRNA LNPs。(c)为研究VDR作用,小鼠在注射LNP前12小时预先注射VDR拮抗剂MeTC7或PBS(对照)。C57BL/6小鼠静脉注射LNP(0.5 mg·kg⁻¹)后24小时的代表性IVIS图像(n=4只生物学独立小鼠)。器官从左到右依次为:心脏、肺、脾、胰腺、肝脏、肾脏和肠道。(d)代表性IVIS图像、总通量的图形表示和饼图,说明注射C-CholF3 LNP(以MeTC7代替胆钙化醇作为第五种成分)后24小时各器官的蛋白表达百分比。小鼠接受静脉注射,剂量为0.5 mg·kg⁻¹(n=3只生物学独立小鼠,±SD,*p<0.05,**p<0.01,***p<0.001,NS表示不显著,采用双尾非配对t检验)。器官从左到右依次为:心脏、肺、脾、胰腺、肝脏、肾脏和肠道
(6)利用 C-CholF3 ENDO LNPs 在胰腺中高效且组织特异性地表达 tdTomato
利用Ai14小鼠模型评估了C-CholF3 LNPs的组织特异性基因编辑能力。该模型含有Cre介导基因编辑的构建,CAG启动子下游有LoxP-stop-LoxP盒,成功递送Cre重组酶后可激活tdTomato荧光(图7A)。将包裹Cre重组酶mRNA的C-CholF3 LNPs以1.5 mg·kg⁻¹的剂量静脉注射到Ai14小鼠体内,120小时后荧光成像显示胰腺中tdTomato表达强烈,选择性超过99%(图7B、图7C),而其他组织荧光不显著。免疫荧光分析显示,胰岛素抗体染色的β细胞中出现tdTomato荧光,表明C-CholF3 ENDO LNPs在胰腺β细胞中实现了有效的基因编辑(图7D),但这种递送并非仅限于β细胞。这些结果表明,该递送系统能够调节胰腺主要细胞类型的基因表达,有望用于胰腺疾病的靶向治疗。
为了评估C-CholF3 LNPs的临床转化潜力,将其安全性与已获批的MC3配方(Onpattro)进行了比较。在注射后4小时和24小时评估了C-CholF3和MC3的体内转染效率和毒性特征。IVIS成像显示,C-CholF3在4小时时已在胰腺积累,平均总通量为3.52×10⁶,且在肝脏清除后未发生再分布;而MC3主要在肝脏积累,平均总通量为2.26×10⁷。24小时时,IVIS图像显示C-CholF3在胰腺的转染效率高于MC3,平均总通量分别为3.47×10⁷和3.24×10⁷。安全性评估表明,C-CholF3的血清肝酶ALT和AST水平低于MC3,两者对肾脏功能参数影响相似,且C-CholF3的细胞因子谱更优,其中IL-6水平显著低于MC3,而IL-1β水平高于MC3,总体支持C-CholF3具有更优的安全性。
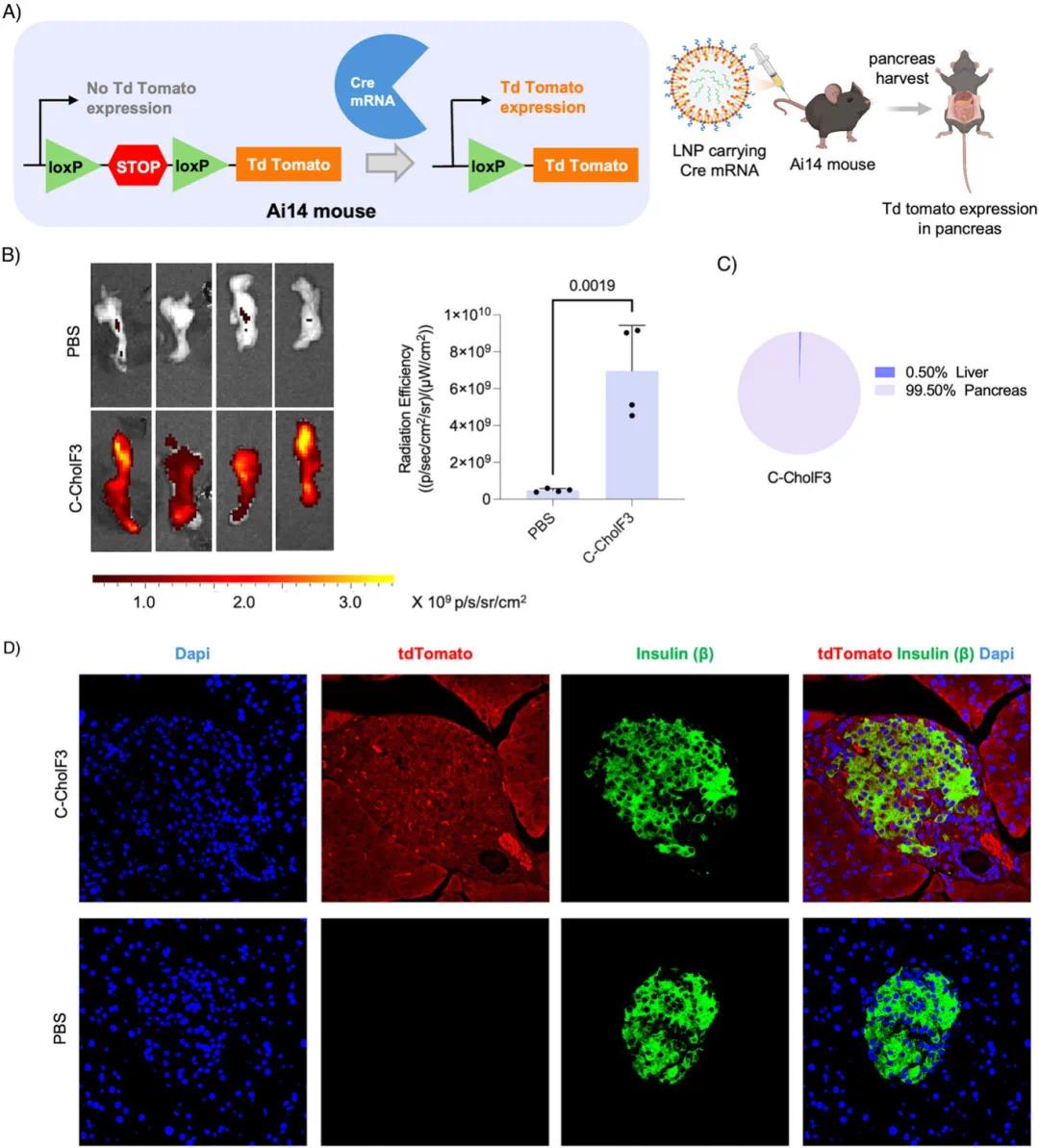
图7 利用C-CholF3 ENDO LNPs在胰腺中高效且组织特异性地表达tdTomato。(a)Cre mRNA递送及Cre介导的终止盒移除示意图,激活Ai14 Cre-loxP小鼠模型中的tdTomato表达,通过静脉注射含Cre mRNA的LNPs并使用IVIS成像胰腺。(b)注射后120小时胰腺中tdTomato的代表性表达及含Cre mRNA的C-CholF3 LNPs总通量的图形表示,以及以1.5 mg·kg⁻¹剂量静脉注射到Ai14小鼠的PBS处理对照(n=4只生物学独立小鼠,±SD,*p<0.05,**p<0.01,***p<0.001,NS表示不显著,采用双尾非配对t检验)。(c)饼图说明静脉注射含Cre mRNA的C-CholF3 LNPs后胰腺和肝脏中蛋白表达的百分比(n=4只生物学独立小鼠)。(d)Ai14小鼠静脉注射1.5 mg·kg⁻¹剂量的包裹Cre mRNA的C-CholF3 LNPs和PBS(对照)后120小时胰腺切片的代表性免疫荧光图像,使用胰岛素抗体对β细胞染色,DAPI标记细胞核,图像采集自三只生物学独立小鼠,放大40倍
本研究通过在传统四组分C12-200脂质纳米颗粒(LNPs)中加入内源性胆钙化醇作为第五组分,成功实现了从肝脏到胰腺的靶向重定向。通过全面的筛选,发现C-CholF3 LNPs(含有胆钙化醇作为第五组分)在胰腺中表现出超过99%的选择性蛋白表达,并且具有较低的毒性。研究推测其胰腺靶向机制可能涉及维生素D受体(VDR)介导的内源性靶向机制。此外,C-CholF3 LNPs能够实现质粒DNA和环状mRNA的胰腺选择性递送,展现了其多功能性和治疗潜力。 在Ai14转基因小鼠模型中,C-CholF3 LNPs还实现了胰腺β细胞中特异性的tdTomato表达,进一步证实了其在基因编辑中的高效性。这些发现表明,通过合理设计内源性第五组分,可以实现LNPs对肝脏外器官(如胰腺)的靶向递送,且具有较低的毒性,有望推动胰腺疾病基因治疗或个性化医疗的发展,并具备重复给药的潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

