
天然产物来源广泛,具备多种治疗潜力,已用于抗疟疾(青蒿素)、抗肿瘤(紫杉醇)、镇痛(吗啡)和抗炎(阿司匹林)等药物开发。然而,其低溶解性和生物利用度限制了临床转化,约90%的候选天然化合物因药代动力学问题被淘汰。
为克服上述限制,已开发包括纳米粒、胶束、脂质体和高分子水凝胶在内的多种药物递送系统。其中,基于天然产物或其衍生物构建的自组装水凝胶因其良好的生物相容性、高药物负载能力和可控释放特性,成为炎症治疗、创面修复、抗菌和肿瘤治疗等领域的潜在平台。当前,自组装水凝胶的理性设计仍面临挑战,主要原因在于缺乏对其分子结构和组装机制的理解。水凝胶通常以纳米纤维或纳米管等形式呈现多级结构,其形成依赖疏水/亲水作用力的精确平衡。传统结构表征手段如负染电镜(TEM)和原子力显微镜(AFM)虽可观察纳米尺度形貌,但无法解析分子间精细相互作用。
冷冻电镜(cryo-EM)作为新兴手段,已被用于蛋白质结构解析、肽-蛋白互作和超分子组装研究,具备原子级分辨率,但在天然产物自组装体系中的应用仍较少,相关结构机制研究尚不充分。

针对上述问题,湖南大学史俊峰/澳门大学宋贺团队合作发现姜皂苷R1(ZR1)可自发组装形成分子水凝胶。冷冻电镜结果显示,该水凝胶由ZR1单体通过氢键驱动形成纳米原纤维结构,具备疏水性核心和亲水性表面。相比游离态ZR1,水凝胶形式显著增强其对白色念珠菌的抑制能力,表现为破坏菌体膜结构并导致细胞内容物泄漏。ZR1水凝胶可负载乳酸杆菌,在体外共培养体系中表现出对白色念珠菌的协同抑制作用。结构分析显示,ZR1水凝胶可通过分子间作用与念珠菌细胞壁葡聚糖结合,实现靶向识别。在小鼠VVC模型中,ZR1-乳酸杆菌复合水凝胶处理组菌落数显著降低,阴道组织炎症程度减轻,菌群结构恢复趋于正常,表明该材料具备联合抗真菌与调节阴道菌群的治疗潜力。ZR1分子结构中稳定的氢键网络为水凝胶构建提供组装基础,水凝胶平台兼具抗真菌活性与益生菌递送能力,为VVC治疗提供新型干预策略,并为其他难溶天然产物的水凝胶化设计提供示范。该文章于2025年5月6日以《Atomic Insights lnto Self-Assembly ofZingibroside Rl andits Therapeutic Action Against Fungal Diseases》为题发表于《Advanced Materials》上(https://doi.org/10.1002/adma.202503283)。
(1)ZR1凝胶的制备与表征
ZR1在PBS中可通过加热-冷却法自组装形成透明自支撑水凝胶,最低凝胶化浓度为2.0 wt%(图1a)。负染TEM显示水凝胶由宽度约5 nm的均一纳米原纤维构成,SEM观察到内部为多孔结构(图1b)。XRD分析显示水凝胶具有明显衍射峰,表明分子排列有序,而ZR1粉末中未见该结构(图1c)。FT-IR光谱显示羧基O─H伸缩振动增强,C═O不对称与对称伸缩振动红移,提示氢键参与自组装过程(图1d)。ZR1水凝胶的zeta电位为 -38.3 ± 0.47 mV,显示其稳定性优于游离态ZR1(图1e)。流变学分析表明其具备典型的剪切稀化行为和良好的储能模量恢复能力,表现出优异的粘弹性能和自愈合特征(图1f)。上述结果表明ZR1可自组装形成结构稳定、力学性能良好、具有良好生物相容性和附着性的水凝胶,具备进一步生物医学应用潜力。
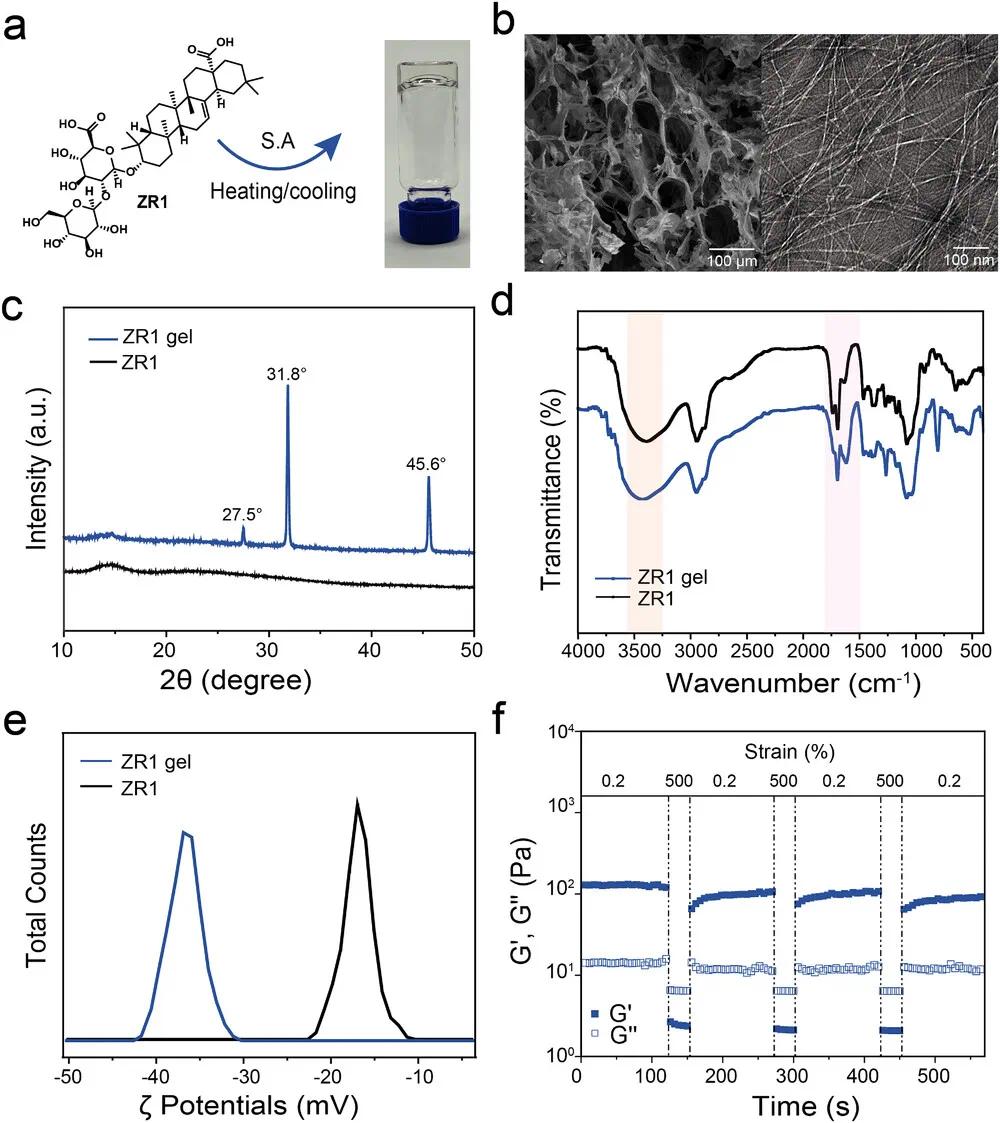
图1. ZR1凝胶的形貌与凝胶性能表征。(a)加热-冷却法制备ZR1水凝胶的示意图;(b)ZR1凝胶的SEM图像(左)和TEM图像(右);(c)ZR1凝胶的XRD图谱;(d)ZR1凝胶的FTIR光谱;(e)ZR1凝胶的Zeta电位测定结果;(f)ZR1凝胶在0.2%至500%应变循环下的储能模量(G′)恢复性能,频率为1 Hz,凝胶浓度为2.0 wt.%
(2)ZR1纳米纤维的低温电子显微镜结构
低温电子显微镜(cryo-EM)结果显示,ZR1分子可自组装形成直径约50 Å的管状纳米原纤维(图2a)。2D分类显示纤维片段具有约40 Å的周期性高分辨特征,宽度约为45.8 Å,提示其具备有序螺旋排列(图2b)。功率谱分析观察到延伸至4.3 Å分辨率的弱层线,第一层线与赤道间距对应的螺旋重复单元为38.6 Å(图2c),与2D图像中重复结构一致。根据功率谱索引结果构建三维密度图,初步解析ZR1纳米纤维的螺旋结构。因小分子缺乏典型二级结构,手性识别困难。通过分别在左手与右手螺旋模型中进行原子构建与实空间拟合,仅左手螺旋模型可容纳ZR1手性结构,确认其为左手螺旋。进一步基于最佳拟合模型重构获得分辨率为2.5 Å的三维密度图,其螺旋上升步长为1.7 Å,扭转角为−93.4°,形成螺距为154.4 Å的四股螺旋结构,投影重复单元为38.6 Å(图2d,e)。该结构清晰显示出三萜核心与双糖侧链的电子密度,可构建可靠原子模型(图2f)。每个不对称单元包含两个ZR1分子,四个不对称单元环绕纳米纤维周向形成完整螺旋周期(图2g)。
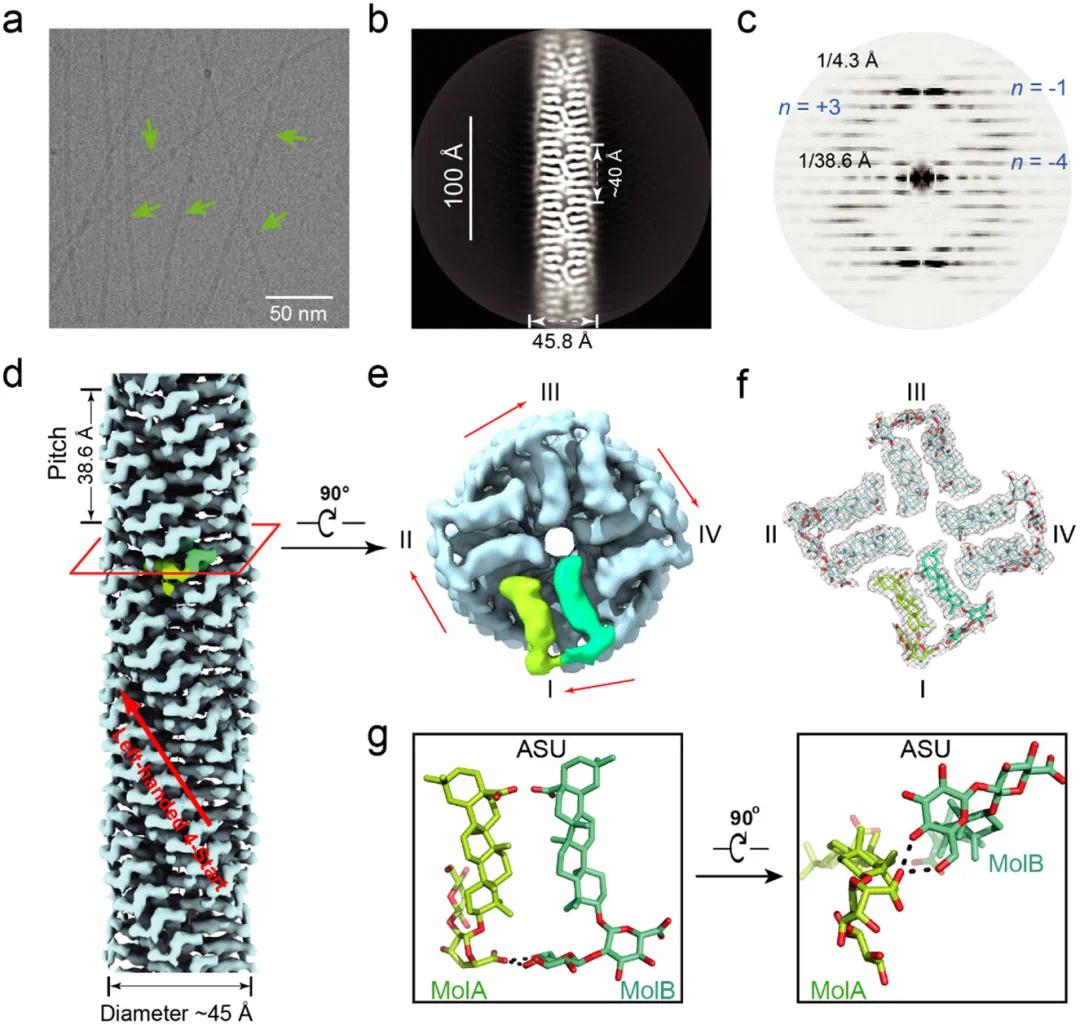
图2. ZR1纳米纤维的高分辨率冷冻电镜结构表征。(a)ZR1纳米纤维的代表性cryo-EM图像,箭头指示其形貌;(b)2D分类图像显示具有约45.8 Å宽度的螺旋组装结构;(c)功率谱图及对应的贝塞尔函数阶数标注,用于计算螺旋扭转与上升步长;(d,e)从侧视图与顶视图观察的ZR1纳米纤维密度图,标注纤维宽度与重复节距;(f)拟合左手螺旋结构的ZR1原子模型(顶视图);(g)不对称单元内的ZR1分子结构,包括两个分子MolA和MolB
(3)ZR1凝胶体外表现出抗真菌活性
ZR1凝胶对白色念珠菌表现出显著抗真菌活性。平板计数结果显示,2.0% ZR1凝胶组菌落形成单位(CFUs)显著低于同浓度溶液组,二者均低于未处理组(图3a)。在接种密度为1×10²至1×10⁷ CFUs的系列测试中,ZR1凝胶在高密度条件下仍可有效抑制菌落生长,抑制效果优于ZR1溶液(图3b)。SEM观察显示,ZR1凝胶处理后白色念珠菌细胞形态破坏明显,表现为细胞膜凹陷、破裂或变形;而未处理组细胞呈完整卵圆状(图3c,左)。TEM进一步显示,ZR1凝胶处理组细胞膜与细胞壁分离,胞质物质泄漏;对照组细胞结构完整、胞质均匀(图3c,中、右)。共聚焦激光显微镜下的PI和Syto 9双染结果表明,ZR1凝胶处理组细胞PI荧光显著增强,Syto 9荧光减弱,提示膜通透性增加,细胞膜完整性受损(图3d)。上述结果说明ZR1凝胶通过破坏白色念珠菌细胞膜结构,增强其膜通透性,导致细胞死亡,从而发挥抗真菌作用。
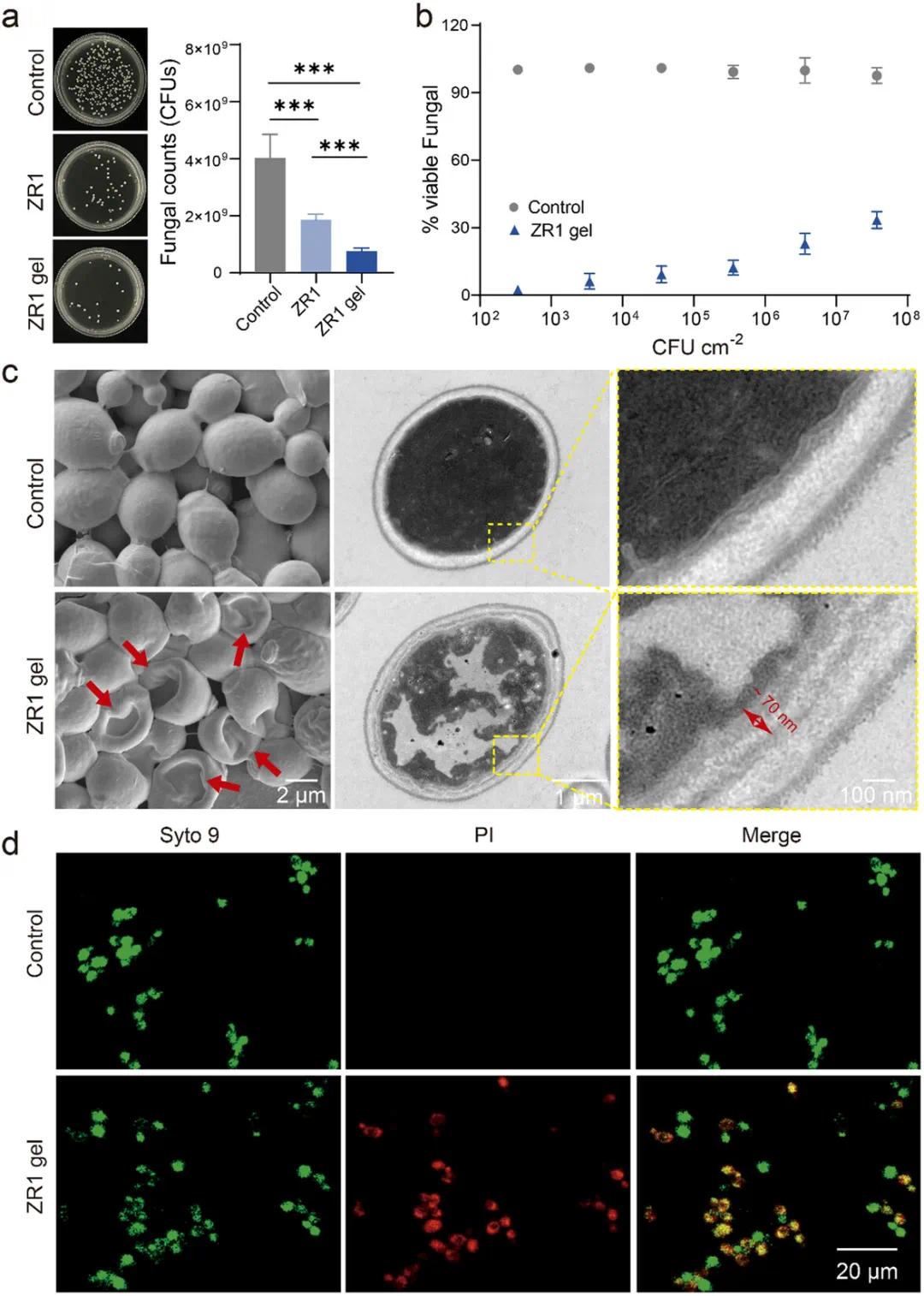
图3. ZR1凝胶的体外抗真菌性能。(a)ZR1凝胶处理后白色念珠菌的平板计数结果(n = 3);(b)不同初始接种量条件下ZR1凝胶对白色念珠菌生长的抑制效果评估(n = 3);(c)ZR1凝胶作用4 h后白色念珠菌的SEM图像(左)及TEM图像(中、右);比例尺分别为2 µm、1 µm和100 nm;(d)ZR1凝胶处理30 min后白色念珠菌经碘化丙啶和Syto 9染色的共聚焦激光显微镜图像,比例尺为20 µm;*p < 0.05,**p < 0.01,***p < 0.001,ns表示差异无统计学意义
(4)ZR1凝胶抗真菌特性的分子洞察
ZR1凝胶对白色念珠菌细胞膜的破坏效应优于游离态溶液,提示其纳米纤维结构可能在该过程中发挥关键作用。3D结构分析显示,ZR1分子沿螺旋轴方向通过羧基与羟基间的氢键稳定排列(图4a,b),三萜骨架朝向纤维内核,表面暴露亲水性双糖基团(图4c),促进纤维间氢键作用(图4d),实现内疏水、外亲水的构型(图4e),有利于与细胞膜接触与干扰。密度泛函理论(DFT)与独立梯度模型(IGMH)分析显示,ZR1与β-1,3-葡聚糖之间存在稳定氢键,作用能为约−0.76 eV,表明其对白色念珠菌细胞壁具有较高亲和力(图4f)。分子动力学模拟显示,ZR1纳米纤维可与POPC磷脂发生显著相互作用(图4g,h)。结果表明,ZR1纳米纤维通过识别并结合细胞壁葡聚糖,将其锚定于真菌膜表面,进而通过膜结构扰动实现抗真菌活性,呈现细胞壁识别与膜破坏的双重作用机制。
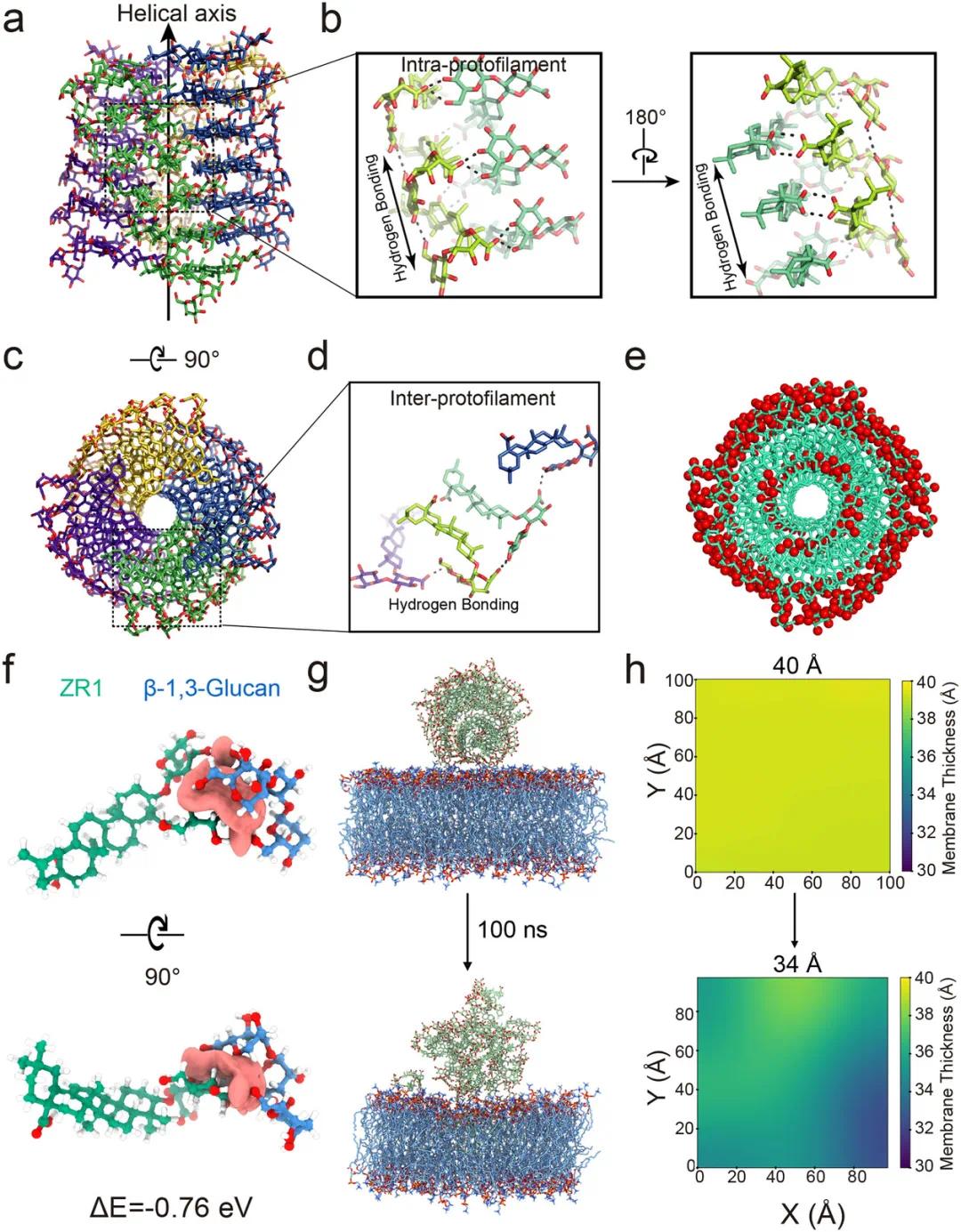
图4. ZR1纳米纤维组装在抗真菌活性中的分子机制。(a)ZR1纳米纤维结构模型侧视图;(b)螺旋轴方向上的分子间相互作用;(c)ZR1纳米纤维顶视图;(d)相邻原原纤维间的分子作用模式;(e)ZR1结构模型顶视图,疏水原子以棒状表示,极性原子以红球表示;(f)ZR1纳米纤维与β-1,3-葡聚糖相互作用的DFT计算结果;(g)分子动力学模拟中ZR1凝胶与细胞膜相互作用的初始状态与最终状态;(h)细胞膜在初始与最终状态下的空间分布投影图,X轴与Y轴表示膜模型的长度(单位:纳米)
(5)LGG@ZR1 可在小鼠体内抑制 VVC
在小鼠外阴阴道念珠菌病(VVC)模型中,ZR1凝胶和LGG@ZR1复合物展现出良好治疗效果。雌性BALB/c小鼠经雌激素预处理后阴道接种2 × 10⁷ CFUs白色念珠菌建立VVC模型,感染确认后连续9天给予不同治疗,包括LGG、ZR1凝胶、LGG@ZR1复合物和伊曲康唑(对照药物)(图5a)。外阴观察显示,LGG@ZR1组在第5天炎症显著缓解,分泌物减少,红肿消失明显,优于其他组(图5b)。H&E和PAS染色显示,LGG@ZR1组阴道上皮结构完整,炎症反应及真菌残留较轻,近似于健康对照组;PBS组表现为上皮结构破坏和中性粒细胞大量浸润(图5c,d),其他处理组仍存在真菌残留,提示LGG@ZR1具备良好组织修复与抗真菌能力。16S rDNA测序结果显示,LGG@ZR1组阴道微生态多样性(OTU数、α-及β-多样性)显著高于伊曲康唑组,接近健康组水平(图5e,f)。菌群组成上,LGG@ZR1处理显著增加厚壁菌门(Firmicutes)比例,降低变形菌门(Proteobacteria)丰度(图5g),恢复至更接近健康状态的微生态结构。综上,LGG@ZR1在体内表现出优于伊曲康唑的抗VVC疗效,具有抗真菌、抗炎、免疫调节及阴道微生态修复的多重功能,具备潜在临床应用前景。
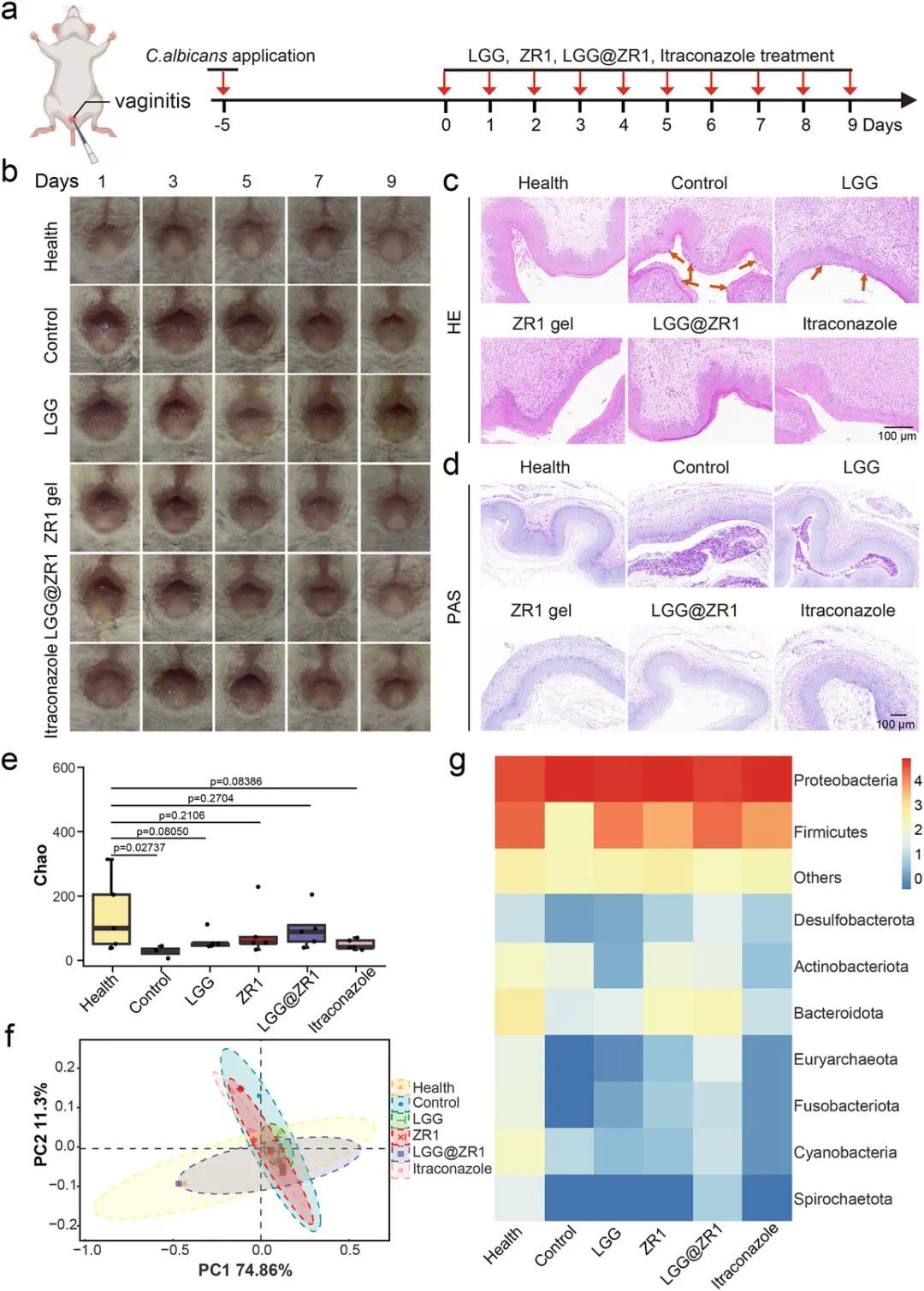
图5. LGG@ZR1对小鼠VVC模型的体内治疗效果。(a)VVC建模、治疗与检测的实验流程图及不同处理组小鼠阴道外观图;(b)健康组、VVC模型组及LGG、ZR1凝胶、LGG@ZR1、伊曲康唑治疗组小鼠的外观图像(n = 5);(c,d)各组小鼠阴道组织的H&E染色与PAS染色图像,比例尺:100 µm;(e,f)各组阴道菌群的α多样性(Chao)与β多样性(PCoA)指数,数据以几何均值 ± SEM 表示(n = 5),P值采用Student’s t检验计算;(g)各处理组在门水平的菌群相对丰度热图
本研究以低溶解性、低生物利用度的三萜皂苷类天然产物姜皂苷R1(ZR1)为模型,发现其无需结构修饰即可自组装形成水凝胶。采用冷冻电镜解析了其纳米原纤维的原子结构,分辨率达2.5 Å,为目前已报道的首个由天然产物自组装形成并经cryo-EM解析的纳米纤维结构。 ZR1自组装后的三维结构显著增强其抗真菌活性,该构象可富集有效分子,提升其与真菌膜的作用效率。纤维表面暴露的亲水基团促进其附着于细胞膜,通过分子相互作用破坏真菌膜结构。此外,ZR1水凝胶可负载益生菌乳酸杆菌,实现抗真菌与微生态修复的双重功能。ZR1与益生菌协同抑制白色念珠菌,同时促进阴道菌群恢复,降低VVC复发风险,提供更全面的治疗策略。该水凝胶系统在治疗口腔念珠菌病和真菌性肠炎等方面亦具有潜在应用价值。 综上,ZR1水凝胶是一种兼具抗真菌与益生菌递送能力的多功能治疗平台,其独特的纳米纤维结构在生物活性增强中发挥关键作用,为天然产物在水凝胶构建与药物开发中的应用提供了新思路,拓展了其在临床干预中的潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

