
T-cell急性淋巴细胞白血病(T-ALL)是一种高度侵袭性的血液系统恶性肿瘤,具有高复发率和较差的预后。Notch1基因突变是T-ALL中最常见的遗传改变,导致细胞不受控增殖。虽然γ-分泌酶抑制剂(GSI)可阻断Notch1信号通路,但其抗白血病活性短暂且毒性较大。
Dihydroartemisinin(DHA)是天然化合物青蒿素的半合成衍生物,已被报道能够抑制急性髓系白血病(AML)、胶质母细胞瘤和肝癌的生长。DHA含有一个内过氧化物桥,可被Fe(II)裂解,产生有毒的自由基。DHA主要通过铁死亡(一种由脂质过氧化触发的调节性细胞死亡形式)诱导细胞死亡。值得注意的是,DHA的抗肿瘤效果部分归因于其对ROS的高敏感性,使其能够对癌细胞产生选择性细胞毒性。鉴于GSI处理后半静止T-ALL细胞中ROS水平升高,以及DHA对ROS的敏感性,DHA有望克服T-ALL中降低的GSI敏感性。然而,GSI和DHA都存在局限性,如水溶性低、血浆半衰期短和分布非特异性,限制了它们的治疗潜力。

针对上述问题,山东大学齐鲁医学院药学院张志岳教授团队开发了一种ROS响应型药物纳米载体(PHD/G-NPs),由聚合物-药物缀合物自组装而成,能够包裹GSI。该载体在T-ALL细胞内化后,通过ROS敏感桥的降解,快速释放GSI和DHA。GSI抑制Notch1信号通路,抑制细胞增殖,而DHA则通过铁死亡进一步增强细胞毒性。此外,铁死亡过程中释放的损伤相关分子模式(DAMPs)与αPD-1联合使用,可激活免疫反应,增强抗肿瘤效果。为了降低GSI的副作用,研究人员进一步用CD38抗体修饰纳米载体,提高了治疗效果和安全性(图1)。相关研究在2025年5月31日以《A ROS-Responsive Dual-Targeting Drug Nanocarrier Serving as a GSI Synergist and Ferroptosis Sensitizer for T-Cell Acute Lymphoblastic Leukemia》为题发表于《Advanced Science》(DOI: 10.1002/advs.202505087)上。
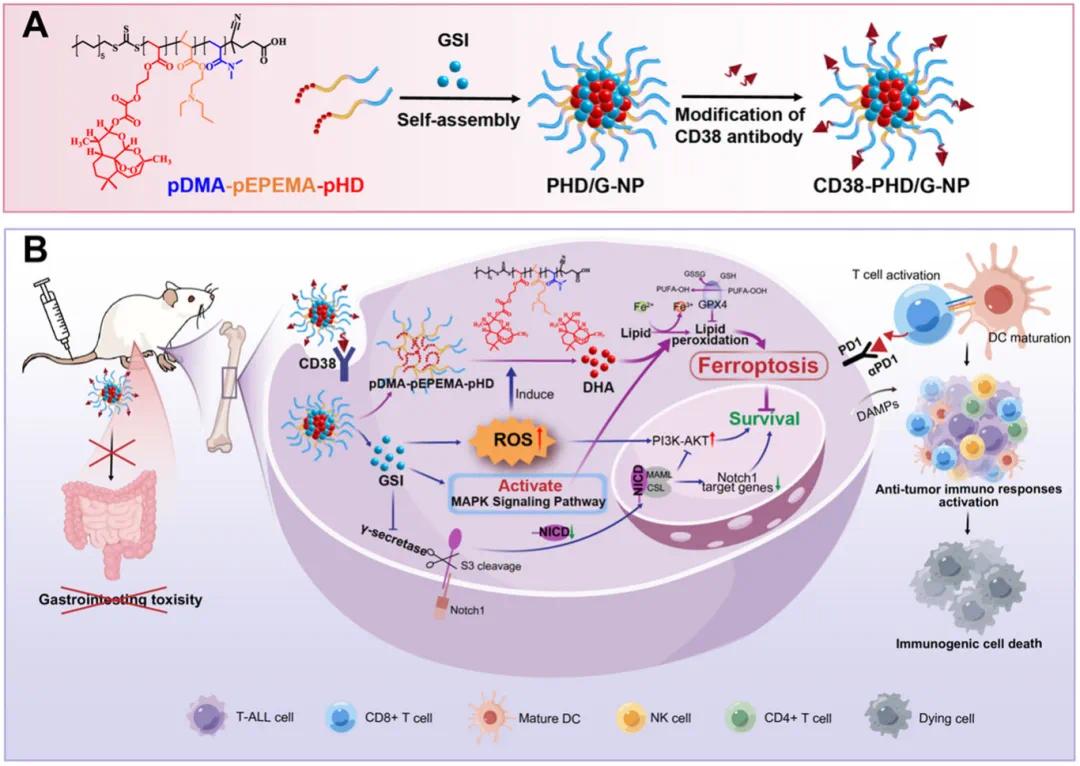
图1 研究示意图
(1)DHA增强GSI对T-ALL细胞的细胞毒性
在T-ALL细胞系中,单独使用GSI对细胞增殖的抑制效果不显著(图2A),这可能是由于其水溶性低。通过DCFH-DA监测GSI处理的Molt4和Jurkat细胞内ROS水平,发现ROS水平随时间逐渐升高(图2B、C)。在GSI处理后,联合使用DHA显著增强了对T-ALL细胞的细胞毒性。在最大测试浓度下,GSI单独处理时Molt4和Jurkat细胞的抑制率分别为17.9%和33.9%,而DHA单独处理时Molt4的抑制率为41.8%,其在Jurkat中的半抑制浓度(IC50)为28.78 µm。然而,GSI与DHA联合使用时,GSI的IC50在Molt4和Jurkat中分别降低至14.2 µm和19.83 µm(图2D、E),表明DHA显著增强了GSI的细胞毒性。进一步实验表明,T-ALL细胞先用GSI预处理,再联合DHA处理时,细胞存活率进一步降低,IC50值分别降至10.07 µm(Molt4)和12.36 µm(Jurkat)。这表明GSI预处理比同时给药更有效地增强T-ALL细胞对DHA的敏感性。推测GSI通过抑制Notch1激活诱导T-ALL细胞短暂生长停滞,部分ROS水平高的半静止细胞在GSI处理后存活,其ROS水平升高,从而增强DHA的细胞毒性(图2F)。
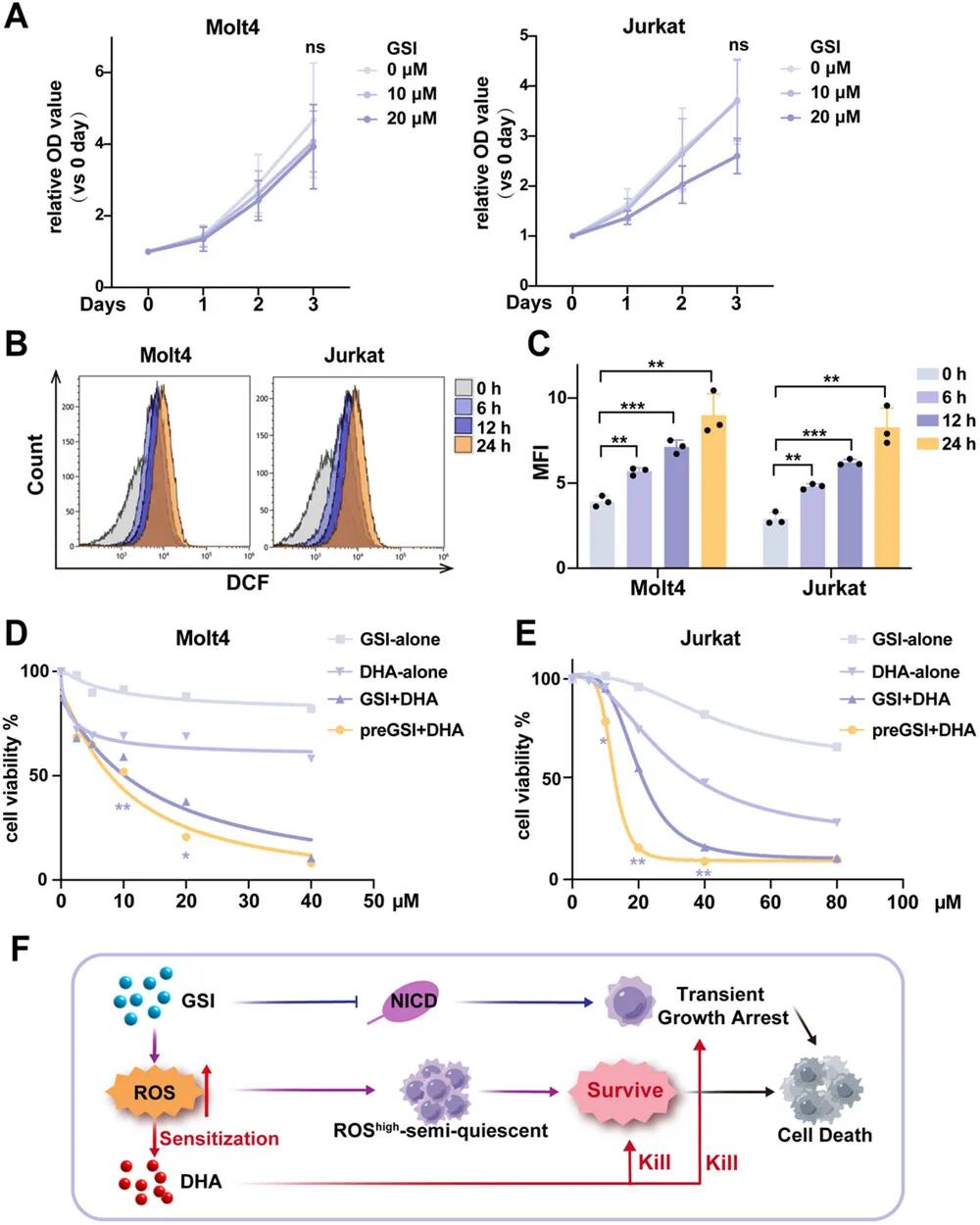
图2 DHA增强GSI对T-ALL细胞的细胞毒性。(a) 不同浓度GSI处理T-ALL细胞的增殖活性;(b) GSI(20 µm)处理T-ALL细胞不同时间点的ROS水平流式细胞术分析;(c) (b)中ROS检测的平均荧光强度(MFI)定量;(d, e) Molt4(d)和Jurkat(e)细胞经不同处理后的细胞活性(CCK8法):单独GSI处理24小时、单独DHA处理24小时、GSI+DHA联合处理24小时、先GSI预处理24小时再与DHA共处理24小时;(f) DHA与GSI协同作用机制示意图
(2)ROS响应性NP的成功制备
基于pDMA-pEPEMA-pHD聚合物的ROS响应性,通过纳米沉淀法制备了ROS响应型纳米颗粒(PHD/G-NPs),如图3A所示。利用动态光散射(DLS)测得PHD/G-NPs的平均粒径为134.7 ± 2.1 nm,分布均匀(PDI:0.25 ± 0.014),zeta电位为−3.16 ± 0.52(图3B、D、E)。透射电子显微镜(TEM)观察结果显示,纳米颗粒呈球形且分散良好,证实纳米颗粒成功制备(图3C)。为评估ROS响应性,将纳米颗粒置于含1 mM H₂O₂的磷酸盐缓冲液(PBS,pH 7.4)中孵育,结果显示纳米颗粒结构被破坏,zeta电位发生变化,表明其对ROS具有响应性(图3E、F)。此外,采用动态膜透析法研究DHA的体外释放行为,结果显示在含1 mM H₂O₂的PBS中,DHA的累积释放率达到82.16 ± 3.43%,而在不含H₂O₂的PBS中仅为46.94 ± 1.9%(图3G),证实了纳米颗粒的ROS触发释放特性(图3H)。
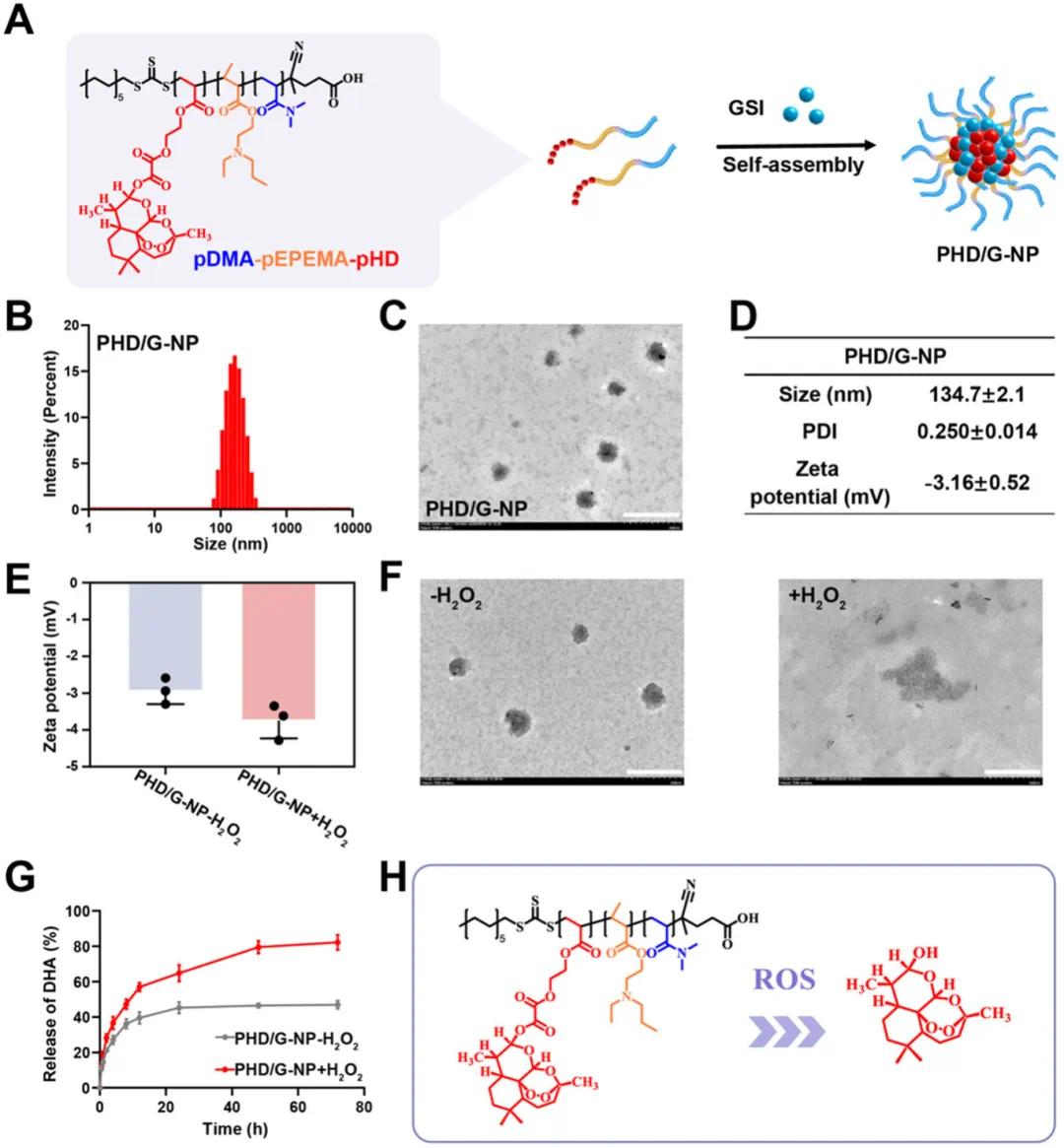
图3 PHD/G-NPs和CD38-PHD/G-NPs的制备与表征。(a) PHD/G-NPs制备示意图;(b) PHD/G-NPs的粒径分布(DLS检测);(c) PHD/G-NPs的代表性TEM图像;(d) PHD/G-NPs的粒径、PDI和zeta电位值;(e) PHD/G-NPs在pH 7.4 PBS(含或不含1 mM H₂O₂)中孵育后的zeta电位变化;(f) PHD/G-NPs在pH 7.4 PBS(含或不含1 mM H₂O₂)中孵育后的TEM图像;(g) PHD/G-NPs在pH 7.4 PBS(含或不含1 mM H₂O₂)中孵育后DHA的体外释放曲线;(h) PHD/G-NPs的ROS响应性DHA释放示意图
(3)PHD/G-NPs体外抗白血病作用
在10 µm浓度下处理6小时后,纳米颗粒对细胞内ROS水平的影响显示,GSI-NPs的ROS水平显著高于BLANK-NPs,与游离GSI相当;PHD-NPs的ROS水平高于BLANK-NPs,与DHA诱导的氧化应激增强机制一致;PHD/G-NPs组的ROS水平最高,表明DHA与GSI的协同作用显著提升了ROS水平(图4A)。体外抗白血病活性评估结果显示,GSI-NPs对两种T-ALL细胞系的细胞毒性显著高于游离GSI,而PHD/G-NPs的抑制效果最强,其IC50值在Molt4细胞中为5.6 µm,在Jurkat细胞中为8.6 µm(图4B)。20 µm浓度的PHD/G-NPs处理后,两种T-ALL细胞系的细胞存活率最低(图4C–E)。此外,PHD/G-NPs诱导的细胞死亡主要表现为坏死而非早期凋亡(图4F、G),提示DHA的细胞毒性可能主要通过非凋亡机制发挥作用。
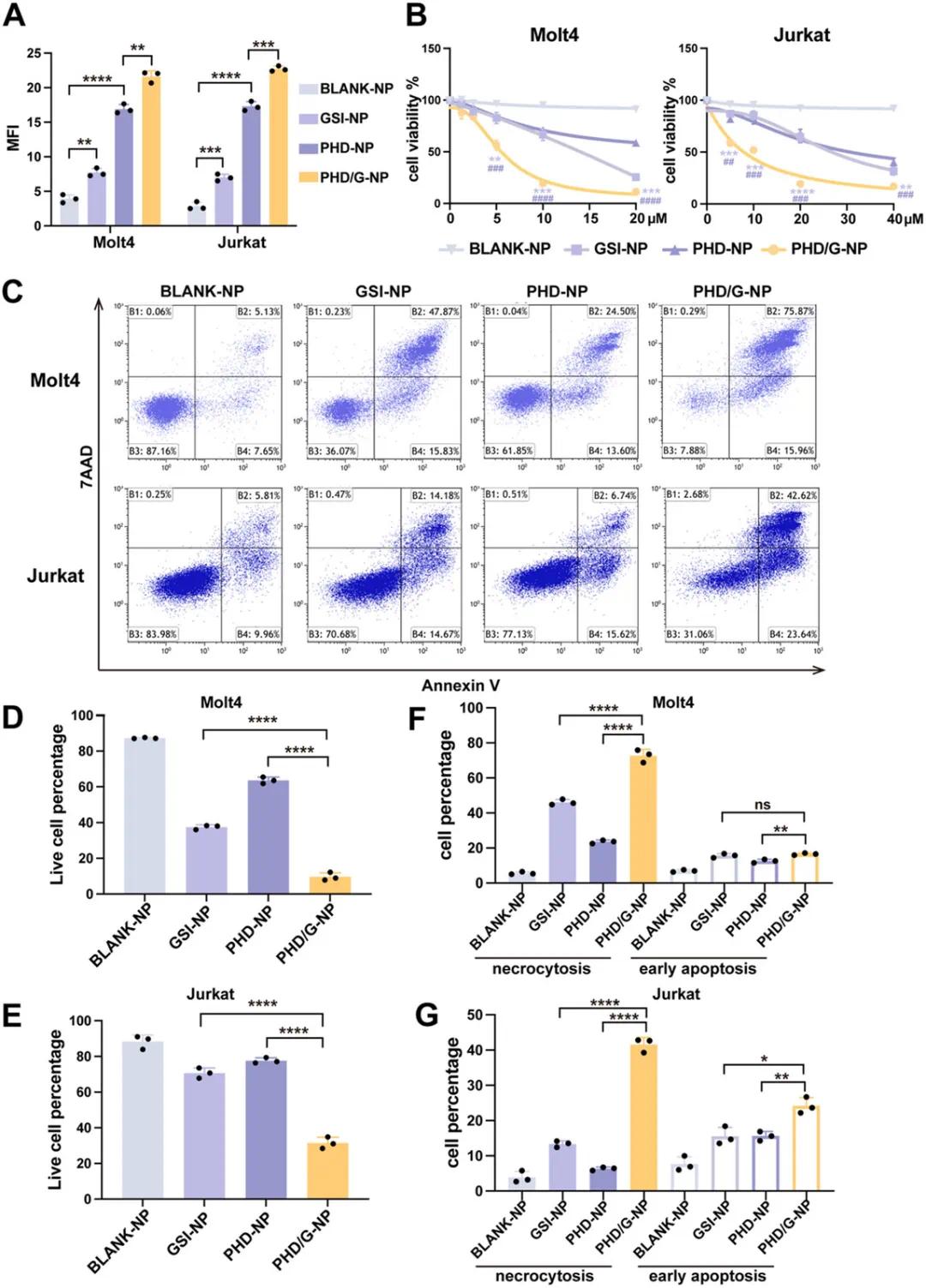
图4 PHD/G-NPs 在体外诱导细胞死亡的作用。(A) 通过流式细胞分析对 ROS 检测的 MFI 进行量化。(B) 通过 CCK8 分析测量用不同纳米粒子处理的 Molt4(左)和 Jurkat(右)细胞的细胞活力。*,与 GSI-NP 组相比。#,与 PHD-NP 组相比。(C) 用不同配方 (20 µ m ) 处理后对 T-ALL 细胞系进行代表性细胞死亡分析。(D,E) 统计直方图显示 (C) 中 Molt4 (D) 和 Jurkat (E) 细胞的活细胞百分比。(F,G) 统计直方图显示 (C) 中 Molt4 (F) 和 Jurkat (G) 细胞中坏死和早期凋亡的百分比
(4)PHD/G-NPs诱导促进性铁死亡的机制
为阐明PHD/G-NPs诱导细胞死亡的机制,对经PBS、GSI、GSI-NPs或PHD/G-NPs处理的Molt4细胞进行了RNA-Seq分析。结果显示,与PBS对照组相比,GSI、GSI-NPs和PHD/G-NPs组中Notch信号通路的正向调控基因(KAT2A、NOTCH1等)表达下调,而负向调控基因(DVL3、NUMB等)表达上调(图5A),表明GSI有效抑制了Notch1激活。KEGG通路富集分析显示,GSI-NPs组中PI3K-AKT信号通路被激活,而GSI-NPs和PHD/G-NPs组中MAPK信号通路富集,且PHD/G-NPs组中特异性富集铁死亡相关基因(图5B)。这表明DHA通过促进铁死亡增强GSI的细胞毒性,而GSI通过激活MAPK信号通路(铁死亡的已知调控因子)增强细胞对DHA诱导的铁死亡的敏感性。进一步实验中,用MAPK抑制剂(SB202190)处理PHD/G-NPs组的T-ALL细胞,透射电镜观察到典型的铁死亡超微结构特征,如线粒体体积缩小、膜密度增加和嵴消失,这些变化在PHD/G-NPs处理的细胞中更为显著,而MAPK抑制剂则使线粒体形态恢复至接近正常状态(图5C)。此外,PHD/G-NPs显著增加了细胞内脂质ROS水平(BODIPY-C11染色,图5D)和脂质过氧化产物丙二醛(MDA)水平(图5E),而MAPK抑制剂则显著降低了这两者的水平。铁离子(Fe²⁺)水平的免疫荧光分析结果也与上述发现一致(图5F)。这些结果证实,GSI通过激活MAPK信号通路增强DHA诱导的铁死亡,从而弥补其自身细胞毒性不足。

图5 PHD/G-NPs诱导T-ALL细胞的细胞毒性机制。(a) 不同处理组(PBS、GSI、GSI-NPs、PHD/G-NPs)处理Molt4细胞后的Notch信号通路相关基因表达热图;(b) GSI、GSI-NPs和PHD/G-NPs处理组与对照组相比的差异基因KEGG通路富集分析结果;(c) 经PHD/G-NPs处理及MAPK抑制剂(SB202190)预处理后的T-ALL细胞的透射电镜图像,显示线粒体形态变化;(d) PHD/G-NPs处理及MAPK抑制剂预处理后的T-ALL细胞内脂质ROS水平检测(BODIPY-C11染色);(e) PHD/G-NPs处理及MAPK抑制剂预处理后的T-ALL细胞内MDA水平检测; (f) PHD/G-NPs处理及MAPK抑制剂预处理后的T-ALL细胞内Fe²⁺水平免疫荧光分析
(5)PHD/G-NPs体内抗白血病作用
在Notch1诱导的T-ALL小鼠模型中,通过尾静脉注射给药(GSI 30 mg/kg,GSI与DHA摩尔比为1:1),评估了纳米颗粒的抗白血病活性(图6A)。结果显示,游离GSI和DHA联合治疗显著减小了脾脏的体积和重量,而PHD/G-NPs在抑制脾肿大方面效果优于单独的GSI-NPs或PHD-NPs(图6B、C)。此外,PHD/G-NPs处理后,脾脏和骨髓中GFP⁺白血病细胞的比例显著降低(图6D、E),表明PHD/G-NPs具有最高的抗白血病活性。对主要器官进行H&E染色的组织形态学分析显示,与对照组相比,心脏、肝脏、脾脏、肺和肾脏均未观察到明显异常或病理变化(图6F),表明PHD/G-NPs具有良好的体内安全性。通过H&E和PAS染色分析T-ALL小鼠的回肠组织,发现GSI组分诱导了明显的肠道分泌化生,表现为杯状细胞数量显著增加(图6G)。所有接受GSI、GSI+DHA、GSI-NPs和PHD/G-NPs处理的小鼠均表现出杯状细胞数量升高,提示PHD/G-NPs需要靶向递送机制以选择性地作用于T-ALL细胞,减少非靶向效应。在Notch1诱导的T-ALL小鼠模型中,通过骨髓活检的免疫组化分析MDA和GPX4(铁死亡标志物),结果显示PHD-NPs和PHD/G-NPs处理的小鼠表现出显著的铁死亡活性,其中PHD/G-NPs组的铁死亡水平最高(图6H)。这些结果表明,PHD/G-NPs具有强大的抗白血病活性和铁死亡诱导能力,且在体内具有可接受的安全性,但无法预防GSI相关的肠道上皮损伤。
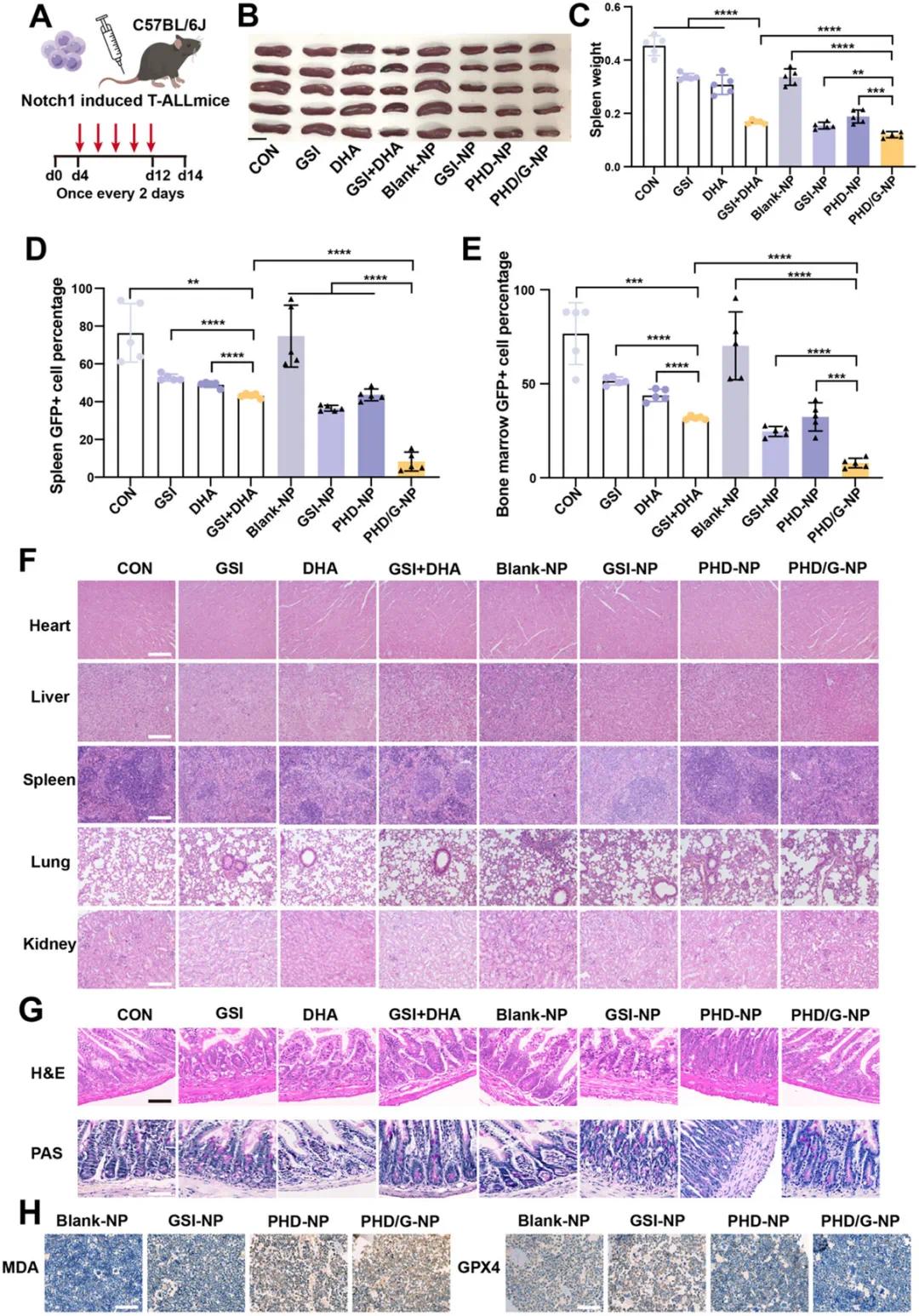
图6 PHD/G-NPs的体内抗白血病活性及安全性评估。(a) Notch1诱导的T-ALL小鼠模型给药方案示意图;(b) 不同处理组小鼠脾脏体积比较;(c) 不同处理组小鼠脾脏重量比较;(d) 不同处理组小鼠脾脏中GFP⁺白血病细胞比例;(e) 不同处理组小鼠骨髓中GFP⁺白血病细胞比例;(f) 主要器官(心、肝、脾、肺、肾)的H&E染色结果;(g) 不同处理组小鼠回肠组织的H&E和PAS染色结果;(h) 不同处理组小鼠骨髓中MDA和GPX4的免疫组化分析
(6)PHD/G-NPs与αPD-1联合在体内协同激活抗肿瘤免疫反应
文献曾报道PD-1表达与T-ALL的恶性进展呈正相关,且PD-1阻断可显著清除T-ALL干细胞并抑制肿瘤进展。铁死亡过程中释放的损伤相关分子模式(DAMPs)可重塑肿瘤微环境,而PHD/G-NPs已被证实能有效诱导铁死亡。因此,假设将PHD/G-NPs与PD-1抗体(αPD-1)联合使用可协同增强抗肿瘤效果。为此,建立了Notch1诱导的T-ALL小鼠模型,评估不同处理的抗白血病和免疫激活效果。小鼠通过尾静脉注射给予PBS、αPD-1、PHD/G-NPs或PHD/G-NPs+αPD-1联合治疗,共5次(图7A)。结果显示,联合治疗显著减小了脾脏体积,降低了脾脏和骨髓中GFP⁺白血病细胞的比例,效果优于PBS、αPD-1和PHD/G-NPs单独治疗组(图7B–E)。
进一步通过流式细胞术分析骨髓和脾脏中T细胞的激活情况。PHD/G-NPs+αPD-1组中,骨髓和脾脏中GFP⁻细胞的CD8⁺ T细胞比例显著高于其他各组(图7F、G、I、M),而CD4⁺ T细胞水平在各组间无显著差异(图7H、L)。此外,PHD/G-NPs+αPD-1治疗显著增强了体内树突状细胞(DC)的成熟,表现为GFP⁻细胞中成熟DC的比例高于其他组(图7J、N;)。同时,PHD/G-NPs+αPD-1处理还增加了骨髓和脾脏中自然杀伤(NK)细胞的积累(图7K、O)。

图7 PHD/G-NPs联合αPD-1在体内的抗肿瘤免疫反应。(A) Notch1诱导的T-ALL小鼠中不同治疗的实验方案:1,PBS(CON);2,αPD-1;3,PHD/G-NP;4,PHD/G-NP联合αPD-1。(B,C) 四组脾脏大小照片(B)和脾脏重量对应的统计直方图(C)。(D) 流式细胞术分析脾脏中GFP+ T-ALL细胞百分比。E) 流式细胞术分析骨髓样本中GFP+细胞百分比。(F,G) 流式细胞术分析脾脏(F)和骨髓(G)中GFP-细胞中CD3+CD8+ T细胞百分比。 (H–K) 统计直方图显示脾脏中 GFP- 细胞中 CD3+CD4+ T 细胞 (H)、CD3+CD8+ T 细胞 (I)、CD86+CD80+ DC (J) 和 NK1.1+ NK 细胞 (K) 的百分比。L-O) 统计直方图显示骨髓中 GFP- 细胞中 CD3+CD4+ T 细胞 (L)、CD3+CD8+ T 细胞 (M)、CD86+CD80+ DC (N) 和 NK1.1+ NK 细胞 (O) 的百分比
(7)CD38-PHD/G-NPs在T-ALL CDX模型中的综合作用
为减轻GSI引起的严重胃肠道副作用,通过将CD38抗体与PHD/G-NPs结合进行修饰(图8A)。透射电镜(TEM)观察显示,修饰后的CD38-PHD/G-NPs呈球形且分散良好(图8B)。动态光散射(DLS)测量结果显示,CD38-PHD/G-NPs的平均粒径为153.4 ± 2.9 nm(图8C、E),分布均匀(PDI:0.238 ± 0.008,图8E),zeta电位为−1.99 ± 0.19 mV(图8F)。与未修饰的PHD/G-NPs相比,粒径和zeta电位的差异初步证实了CD38抗体的成功结合。红外光谱分析显示,CD38-PHD/G-NPs在1519 cm⁻¹处出现新的吸收峰,归属于CD38抗体的N–H弯曲振动(酰胺II带),进一步证实了纳米颗粒表面的CD38抗体修饰成功(图8D)。
为了评估CD38抗体修饰是否增强T-ALL细胞的体外摄取效率,使用荧光染料Cy5.5标记纳米颗粒并进行荧光显微镜和流式细胞术分析。结果显示,与未修饰的Cy5.5-NPs相比,CD38-Cy5.5-NPs处理的T-ALL细胞荧光强度显著增强,表明CD38修饰显著促进了T-ALL细胞的靶向摄取(图8G)。在体内分布方面,通过生物发光成像技术在T-ALL小鼠中监测CD38-Cy5.5-NPs的摄取情况,结果表明CD38-Cy5.5-NPs的摄取率显著高于其他配方(图8H),证实了其在体内的靶向效率更高。此外,体外成像研究显示,CD38-Cy5.5-NPs在T-ALL小鼠的骨髓和脾脏(白血病细胞富集部位)中的摄取更为显著(图8I)。流式细胞术分析显示,CD38-Cy5.5-NPs组骨髓细胞的平均荧光强度(MFI)显著高于其他组(图8J),表明CD38-Cy5.5-NPs优先靶向体内的白血病细胞。
在体内抗白血病效果方面,NSG小鼠移植Molt4细胞后,分别给予CD38-Blank-NPs、PHD/G-NPs和CD38-PHD/G-NPs处理,共5次(图8K)。结果显示,CD38-PHD/G-NPs在抑制脾肿大和降低脾脏及骨髓中GFP⁺白血病细胞比例方面效果最佳(图8L、M),且各组间体重无显著差异(图8N)。值得注意的是,接受CD38-PHD/G-NPs治疗的小鼠显示出接近正常的杯状细胞计数和保留的肠道上皮结构(图8O),表明减轻了GSI相关的胃肠道副作用。此外,生存监测显示,接受CD38-PHD/G-NPs治疗的Molt4荷瘤小鼠生存期最长(图8P)。这些数据证实,CD38-PHD/G-NPs通过抑制白血病进展和减轻严重胃肠道毒性,显著增强了联合治疗效果。由于NSG小鼠缺乏抗肿瘤免疫反应,与Notch1诱导的小鼠相比,CD38-PHD/G-NPs在Molt4荷瘤小鼠中的抗白血病效果有所降低。
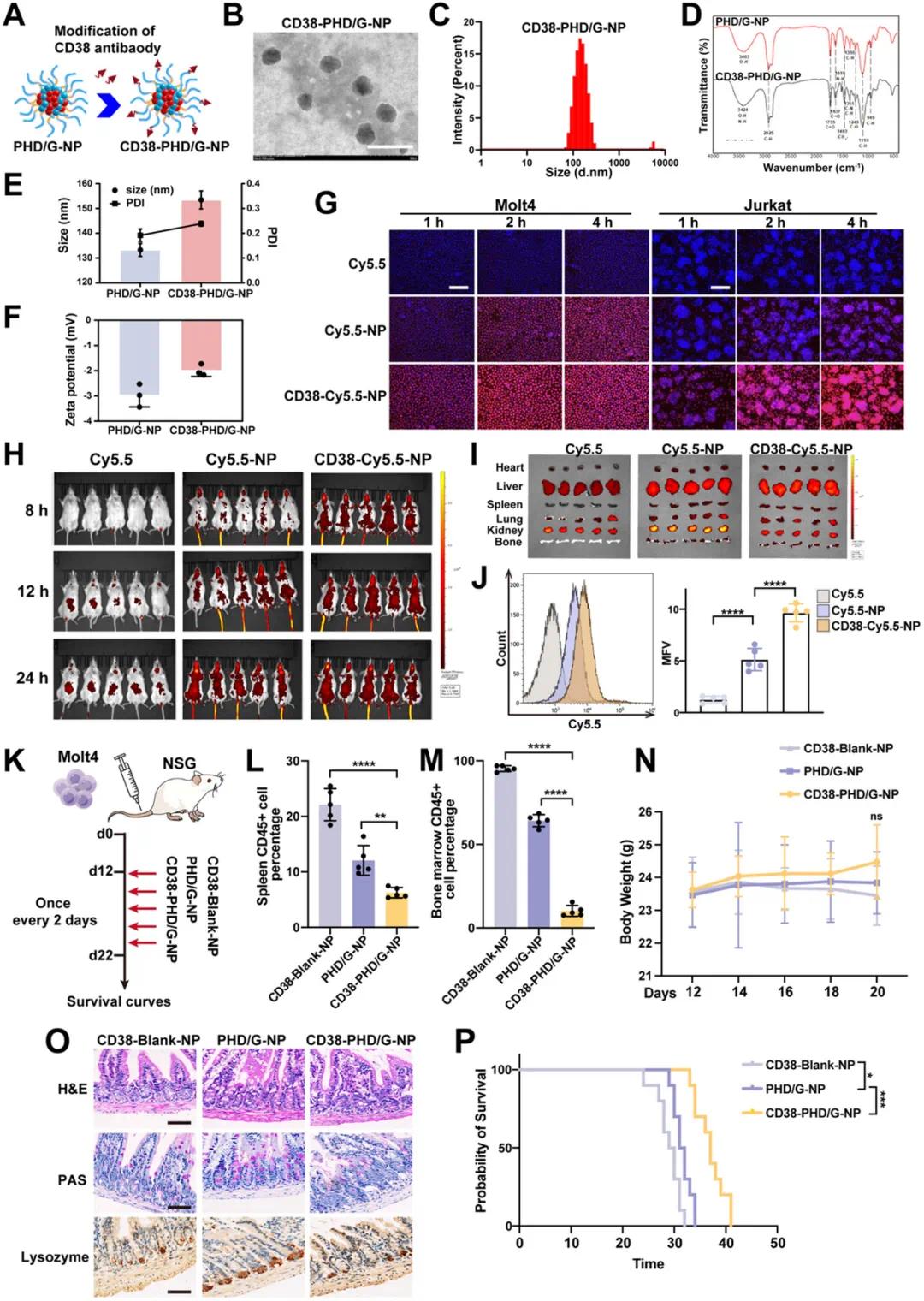
图8 CD38-PHD/G-NPs的靶向递送效果评估。(a) CD38抗体修饰PHD/G-NPs的示意图;(b) CD38-PHD/G-NPs的TEM图像;(c) CD38-PHD/G-NPs的粒径分布;(d) CD38-PHD/G-NPs的红外光谱分析;(e) CD38-PHD/G-NPs的粒径和PDI值;(f) CD38-PHD/G-NPs的zeta电位值;(g) T-ALL细胞摄取CD38-Cy5.5-NPs的荧光显微镜图像;(h) T-ALL小鼠体内CD38-Cy5.5-NPs的生物发光成像结果;(i) 小鼠主要器官和骨髓的体外成像结果;(j) 骨髓细胞的流式细胞术分析结果;(k) NSG小鼠给药方案示意图;(l) 不同处理组小鼠脾脏体积比较;(m) 不同处理组小鼠脾脏和骨髓中GFP⁺白血病细胞比例;(n) 不同处理组小鼠体重变化;(o) 不同处理组小鼠回肠组织的H&E染色结果;(p) 不同处理组小鼠的生存曲线
本研究开发了一种自组装纳米治疗策略,该策略基于纳米颗粒介导的GSI增效剂和铁死亡增敏剂的共递送,以克服T-ALL靶向治疗的挑战。在本研究中,PHD/G-NP被设计为首先释放GSI,然后响应ROS水平升高而自适应地释放DHA。这种受控的顺序释放策略最大限度地发挥了两种作用机制不同的药物的协同抗白血病功效——同时靶向Notch1突变的T-ALL细胞并弥补彼此的局限性。这些发现为开发融合纳米治疗方法以克服当前T-ALL靶向治疗的瓶颈提供了良好的前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

