
糖尿病伤口(DWs)愈合是一个复杂而艰巨的过程,常因高血糖、氧化应激、反复感染和血管病变等因素导致炎症反应加剧,难以顺利过渡到增殖期,进而延迟愈合甚至形成慢性溃疡。糖尿病伤口中炎症细胞(如巨噬细胞)的极化失衡,M1型巨噬细胞比例过高且持续存在,分泌大量促炎因子,抑制了M2型巨噬细胞的极化,不利于伤口的修复和组织再生。同时,糖尿病伤口愈合过程中血管生成受阻,导致伤口部位营养和氧气供应不足,进一步延缓伤口愈合进程。此外,糖尿病患者伤口局部免疫功能受损,容易发生细菌感染,且感染后难以控制,进一步加重炎症反应,形成恶性循环,阻碍伤口愈合。
细胞外囊泡(EVs)在加速伤口愈合方面具有潜力,但它们在体内会被快速清除,且分散性差,难以在伤口部位有效沉积,限制了其治疗效果。同时,生物活性玻璃(BGs)虽然具有良好的生物相容性和免疫调节能力,但其离子溶出性有限,难以被细胞有效内化,从而限制了其生物学效应的发挥。因此,如何克服这些局限性,开发一种能够有效促进糖尿病伤口愈合的综合治疗系统,是当前研究的重要方向。

针对上述问题,华南理工大学曹晓东教授团队提出了一种新的概念设计,通过在聚多巴胺(PDA)和聚-L-赖氨酸(PLL)修饰的镁掺杂生物活性玻璃(MgBG)界面上,对来自骨髓间充质干细胞(BMSCs)的细胞外小囊泡(sEVs)进行自组装编程,成功构建了一种新型的sEVs@PPMB(EPPM)囊泡簇,该囊泡簇在增强内吞作用方面具有非凡的效率。通过将温和的席夫碱反应与氧化葡聚糖(OD)和季铵化壳聚糖(QCS)相结合,开发了一种多功能水凝胶(EPPMO),可以快速促进糖尿病伤口愈合。该文章于2025年4月3日以《A multifunctional hydrogel loaded with magnesium-doped bioactive glass-induced vesicle clusters enhances diabetic wound healing by promoting intracellular delivery of extracellular vesicles》为题发表于《Bioactive Materials》(DOI:10.1016/j.bioactmat.2025.03.025)。
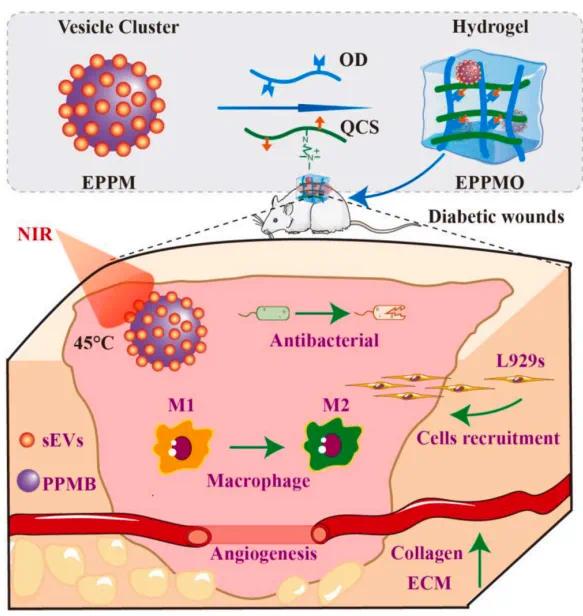
图1. EPPMO水凝胶制备工艺示意图
(1)PPMO水凝胶的表征
如图2a所示,利用聚多巴胺(PDA)和聚-L-赖氨酸(PLL)修饰MgBG来合成PPMB,再由PPMB和QCS与OD通过席夫碱反应制备得到了PPMO水凝胶。Zeta电位分析(图2b)表明PP0.5-MB电位为4.75 ± 4.11 mV。 PPMO水凝胶的制备过程如图2c所示,PPMB和QCS侧链上的氨基与OD侧链上的醛基通过席夫碱反应结合,凝胶化时间约为120秒,席夫碱键的动态可逆性赋予了PPMO水凝胶良好的可注射性、自愈合性和组织粘附性。PPMO水凝胶的可注射性如图2d所示,它可以通过1毫升注射器均匀挤出,形成完整的星形或圆形。PPMO水凝胶的自愈合特性如图2e所示,当两块红色和蓝色的PPMO水凝胶接触并融合时,它们会形成一个没有明显边界的单一实体。PPMO水凝胶的组织界面粘附特性如图2f所示,水凝胶可以粘附在猪皮表面,在旋转或折叠后仍能保持其形状。具有光热效应的水凝胶敷料在近红外(NIR)光激发下可以产生局部高温,有效破坏细菌生物膜,PDA修饰的PPMB的加入使这些水凝胶具有将光能转化为热能的能力。使用808 nm NIR在不同功率水平下测试了5% PPMO水凝胶的光热效应,如图2g和h所示。经过10分钟的照射后,随着NIR强度从0.5 W/cm²逐渐增加到2 W/cm²,5% PPMO水凝胶的最大光热温度从39.7 ℃上升到64.3 ℃。随后,评估了在1 W/cm²的NIR强度下不同PPMB含量的水凝胶的光热性能,如图2i和j所示。与OQ水凝胶相比,PPMO水凝胶的最大光热温度随着PPMB含量的增加而呈梯度增加,显示出浓度依赖性关系。然而,超过50 ℃的温度可能会导致sEVs中的miRNA和其他活性成分降解。因此,后续实验采用1 W/cm²的NIR强度、6分钟的照射时间和45 ℃的目标温度。
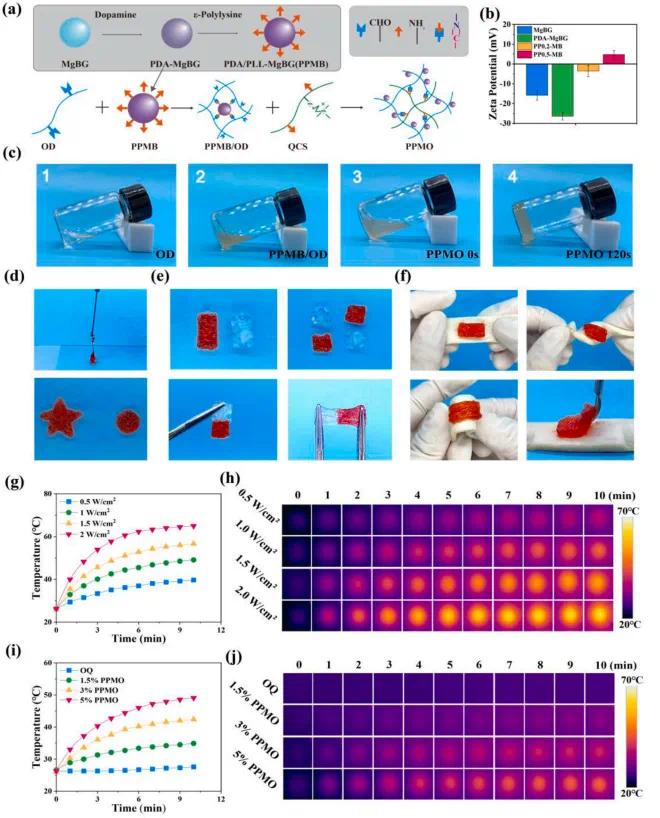
图2. PPMO水凝胶的表征。(a)水凝胶制备示意图。(b)纳米粒子的Zeta电位分析结果。(c)水凝胶的制备工艺。(d)水凝胶的可注射性。(e)水凝胶的自愈合性能。(f)水凝胶的皮肤粘附性能。(g)5% PPMO水凝胶在不同近红外强度下的温度变化曲线。(h)5% PPMO在不同近红外强度下的温度变化图像。(i)近红外强度为1 W/cm²时水凝胶的温度变化曲线。(j)近红外强度为1 W/cm2时水凝胶的温度变化图像
(2)EPPMO水凝胶的表征
如图3a所示。首先,从骨髓间充质干细胞(BMSCs)中提取sEVs,通过sEVs与PPMB的蛋白吸附和静电相互作用成功制备EPPM囊泡簇,TEM和粒径分析显示sEVs呈球形或盘状,平均直径为63.1 ± 4.12 nm(图3b和c)。通过将sEVs与PPMB共孵育来制备EPPM囊泡簇,结果如图3d所示,sEVs用绿色细胞膜绿色荧光标记染色,与未修饰的MgBG相比,PDA-MgBG、PP0.2-MB和PP0.5-MB的sEVs荧光强度显著更高。如图3e所示,未处理的MgBG的sEVs负载率为4.4 ± 0.40%,而仅用PDA修饰的PDA-MgBG显示出一定的负载能力,PP0.5-MB(用PDA和PLL修饰)的sEVs负载率为66.5 ± 0.46%,显著高于其他纳米颗粒。为了验证sEVs与PP0.5-MB之间的结合模式,进行了zeta电位分析(图3f),表明通过PDA介导的蛋白吸附和静电相互作用实现了sEVs的负载。通过Western blot分析(图3g),与sEVs相比,负载在EPPM上的sEVs以及经过EPPMO NIR(+)处理的sEVs的CD9、CD63和TSG101相对蛋白水平下降了,处理之间没有显著差异,这些结果表明,经过一系列处理后制备的EPPMO中的sEVs保持了良好的生物功能。如图3h所示,当sEVs直接负载在OQ水凝胶上时,EO水凝胶在pH = 6.5时3天内快速释放,释放率约为70.8%。相比之下,EPPMO水凝胶在pH = 6.5时3天内仅释放了47.5%的sEVs。糖尿病伤口(DWs)的治疗周期通常较长。EPPMO水凝胶的长期持续释放sEVs可以有效延长sEVs在伤口部位的作用时间,从而促进伤口愈合。
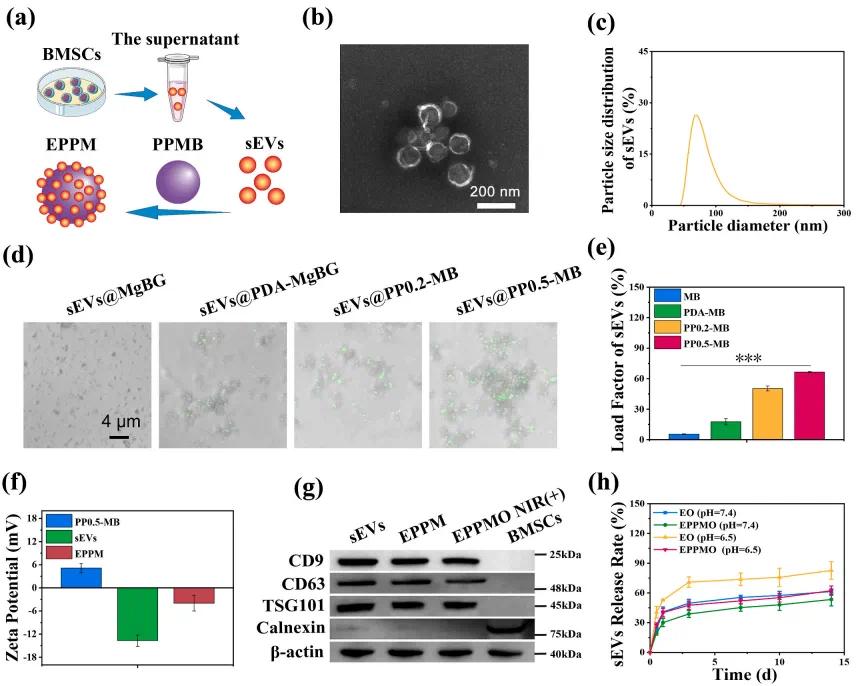
图3.EPPMO水凝胶的表征。(a)EPPM制备示意图。(b)sEVs的透射电镜图像。(c)sEVs的纳米颗粒粒径分布。(d)复合纳米颗粒的荧光图像:sEVs(绿色)和PPMB(灰色)。(e)sEVs的装载效率。(f)Zeta电位分析。(g)Western blot结果。(h)在pH 7.4和6.5条件下,水凝胶中sEVs的累积释放结果
通过Transwell共培养系统评估了EPPMO水凝胶的细胞活性(图4a)。细胞接种在孔板底部,将50 μL水凝胶放置在Transwell上层室中进行后续细胞实验。通过3D成像(图4b)证实sEVs(红色)、PPMB(绿色)和EPPM在水凝胶中均匀分布,表明实现了纳米颗粒的成功负载。持续性炎症是糖尿病伤口愈合的主要挑战之一,因此免疫调节和抗炎作用对于糖尿病伤口修复至关重要。RAW 264.7细胞对囊泡簇的内化作用分析(图4c)表明,在12 h时,未修饰的MgBG组未观察到明显的绿色荧光,而PPMB被细胞内化但荧光强度较低。与自由释放的sEVs相比,EPPM的细胞内化增加了约8.2倍(图4d)。在糖尿病伤口的增殖阶段,血管化对于营养运输和伤口愈合至关重要。人脐静脉内皮细胞(HUVECs)是血管生成的关键参与者,研究了其对囊泡簇的内化作用(图4e)。HUVECs对纳米颗粒摄取的荧光成像与RAW 264.7细胞的结果相似,EPPM显示出显著更高的细胞内化效率,比单独的sEVs高约16.7倍(图4f)。将囊泡簇加载到EPPMO水凝胶中保留了sEVs的活性,增强了生物利用度,并促进了MgBG的细胞内递送和积累,有效调节了细胞的生物学功能。
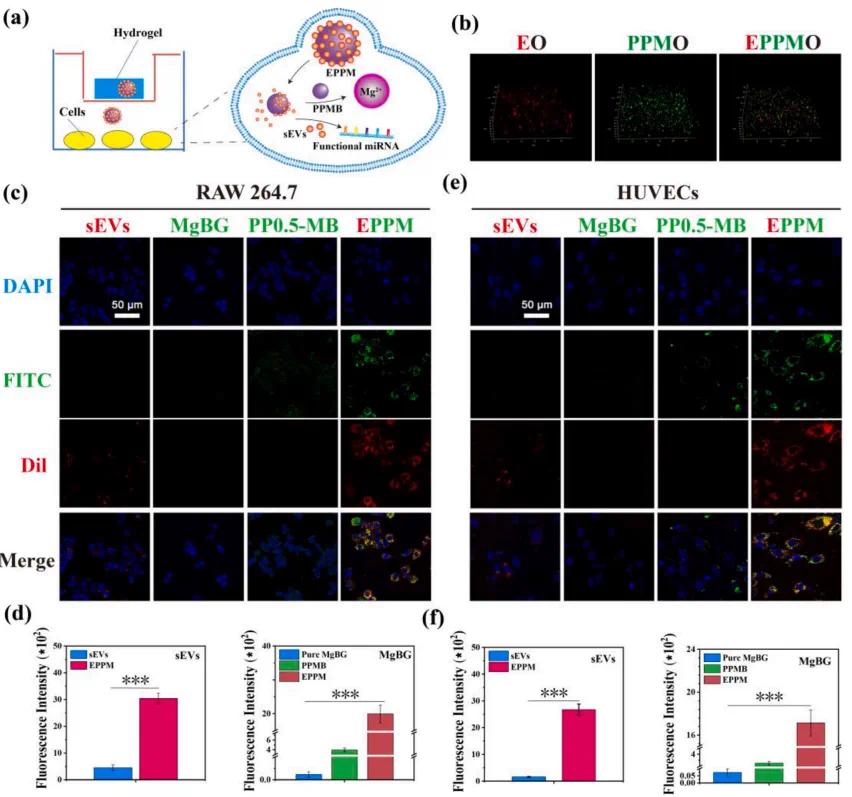
图4. EPPM囊泡簇的细胞内化检测。(a)细胞与EPPMO水凝胶共培养的示意图。(b)水凝胶内纳米颗粒的分布情况。(c)水凝胶释放的纳米颗粒被RAW 264.7细胞摄取图像和(d)定量荧光面积结果。(e)水凝胶释放的纳米颗粒被HUVECs摄取图像和(f)定量荧光面积结果
(3)水凝胶的抗菌性能
在细菌感染会引发慢性炎症,进一步阻碍伤口愈合。图5a展示了水凝胶对革兰氏阴性菌大肠杆菌的抗菌效果。在未使用近红外光(NIR)处理的情况下,所有OQ水凝胶对大肠杆菌的抗菌率均超过90%。在使用NIR处理的情况下,PPMO和EPPMO水凝胶的光热特性实现了约99.9%的抗菌率,琼脂平板上的菌落计数结果(图5b)与基于吸光度的抗菌结果一致。此外,图5c展示了水凝胶对革兰氏阳性菌金黄色葡萄球菌的抗菌效果,所有水凝胶在NIR处理和未处理的情况下,对金黄色葡萄球菌的抗菌率均超过95%,琼脂平板结果(图5d)也证实了这一点。这些结果表明,EPPMO水凝胶系统的光热效应可以有效杀死细菌,增强抗菌剂的疗效,从而促进糖尿病伤口愈合。
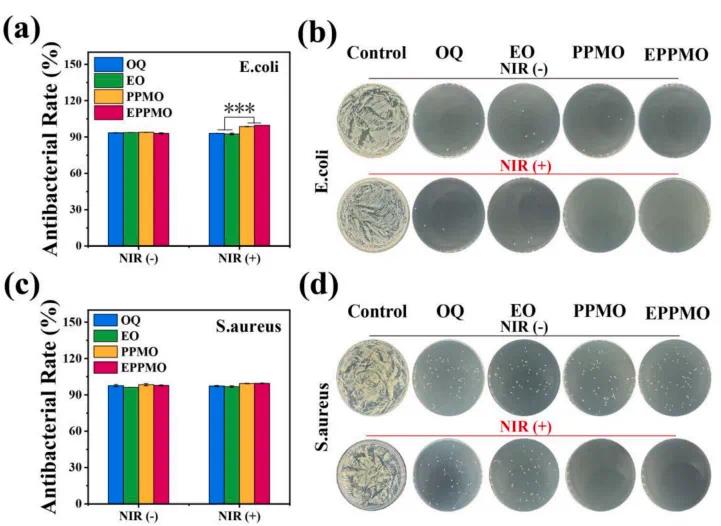
图5.在808纳米近红外(1 W/cm²)下的光热抗菌效果水凝胶的抗菌性能。(a)水凝胶对大肠杆菌的抗菌率。(b)大肠杆菌菌落存活情况。(c)水凝胶对金黄色葡萄球菌的抗菌率。(d)金黄色葡萄球菌菌落存活情况。NIR(−)表示未进行近红外处理,NIR(+)表示进行了近红外处理
(4)水凝胶的生物相容性和细胞招募能力
为了评估水凝胶对L929成纤维细胞(L929)和HUVECs的细胞活性,采用CCK8实验进行检测。结果表明,含有sEVs的EO和EPPMO水凝胶不仅展现出良好的生物相容性,还能显著促进细胞增殖(图6a-d)。这种促进作用归因于sEVs携带的多种促进细胞增殖的营养物质。为了评估水凝胶的细胞招募能力,进行了12小时的Transwell实验及其定量分析(图6e-f),结果显示,对照组和OQ水凝胶组没有细胞招募能力。然而,添加了sEVs和MgBG的EO、PPMO和EPPMO水凝胶显著增强了L929的招募能力,其中EPPMO水凝胶表现最为显著。此外,通过划痕实验评估了水凝胶促进L929迁移的能力(图6g),24小时后,对照组的迁移率为46.1 ± 10.96%,而EPPMO水凝胶组的迁移率达到了92.7 ± 4.07%,在EPPMO水凝胶组中,划痕区域完全消失,表明其显著促进了L929的迁移(图6h)。
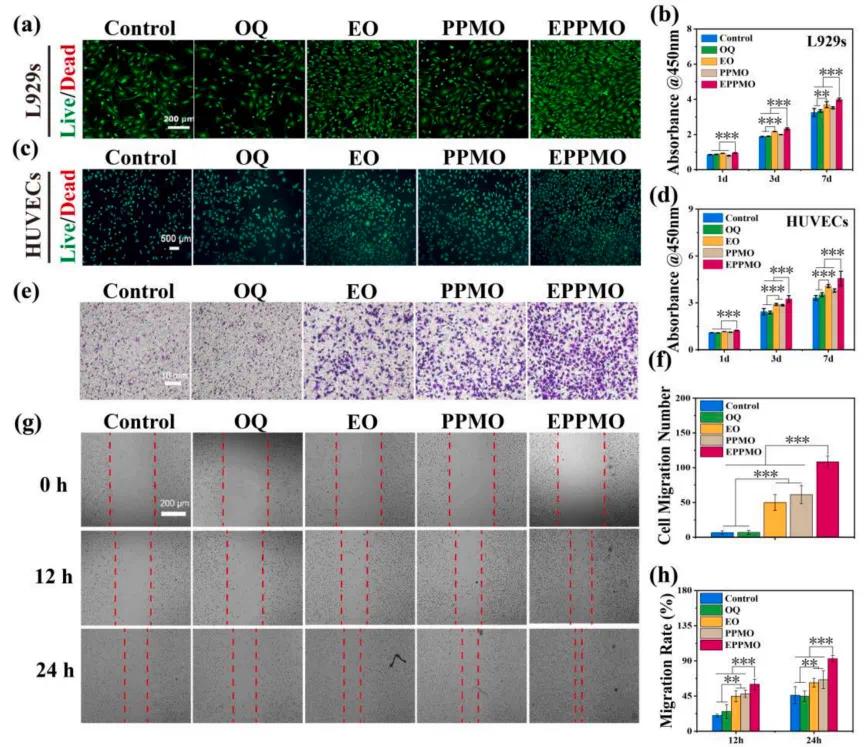
图6.水凝胶的生物相容性和细胞招募性能。(a) L929细胞经水凝胶处理后的活/死细胞染色结果。(b)经水凝胶处理的L929细胞CCK8检测结果。(c)通过水凝胶对人脐静脉内皮细胞进行活/死细胞染色。(d)水凝胶处理后HUVECs的CCK-8检测结果。(e-f)Transwell实验及其半定量分析L929细胞与水凝胶的实验结果。(g-h)划痕试验及其半定量分析结果
(5)巨噬细胞的M2表型极化
为了评估水凝胶对巨噬细胞极化的影响,使用RT-qPCR检测了RAW 264.7巨噬细胞中炎症相关基因的表达(图7a),与未处理的对照组相比,LPS处理的M0巨噬细胞极化为促炎的M1型,表现为促炎因子TNF-α和iNOS表达升高,而抗炎因子Arg-1和IL-10表达降低。与LPS处理相比,EO、PPMO和EPPMO水凝胶组显著降低了促炎因子TNF-α和iNOS的表达,同时显著增加了抗炎因子Arg-1和IL-10的表达。此外,通过免疫荧光染色检测了M1型巨噬细胞标记物iNOS和M2型巨噬细胞标记物IL-10的表达,结果由图7b-e所示,与对照组、LPS组和OQ组相比,EPPMO水凝胶组的iNOS表达显著降低,而IL-10表达显著增加。此外,还对NF-κB信号通路中的p65蛋白进行了免疫荧光染色(图7f),在未激活的NF-κB信号通路中,p65蛋白(红色)保留在细胞质中,核转位受到抑制(对照组),经LPS处理的巨噬细胞显示出NF-κB信号通路的激活,极化为M1型巨噬细胞,p65转移到细胞核(LPS组和OQ组)。与这些组相比,EPPMO水凝胶组显示出最显著的p65核转位抑制,这是因为EPPMO水凝胶释放的EPPM被细胞有效内化,EPPM携带的miR-199a、miR-146等免疫调节miRNA与MgBG释放的Mg²⁺协同作用,有效抑制了NF-κB信号通路的激活,从而防止了p65的核转位,并促进了M1到M2型巨噬细胞的极化,实现了联合抗炎效果。
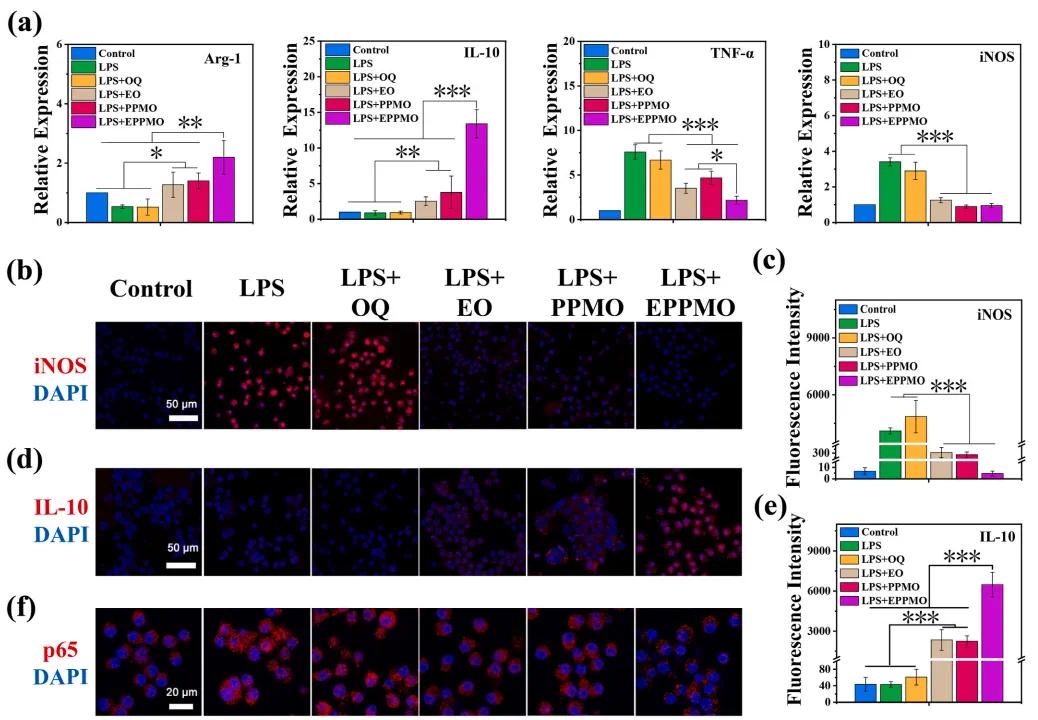
图7.水凝胶调节巨噬细胞极化的能力。(a)通过RT-qPCR检测巨噬细胞中的抗炎基因Arg-1和IL-10以及促炎基因TNF-α和iNOS的表达。(b-c)iNOS蛋白表达的免疫荧光染色及半定量分析。(d-e)免疫荧光IL-10蛋白表达的染色及半定量分析。(f) p65蛋白的免疫荧光染色
(6)水凝胶的促血管生成能力
在糖尿病伤口(DWs)的增殖阶段,血管化对于营养运输和伤口愈合至关重要。通过RT-qPCR检测了人脐静脉内皮细胞(HUVECs)中血管生成相关基因的表达(图8a-d),结果显示,EPPMO水凝胶组显著上调了HIF-α和VEGF基因的表达,同时VEGF受体KDR的表达也显著增加,促进血管生成的eNOS基因在EPPMO水凝胶组中也表现出显著上调。为了进一步评估水凝胶对HUVECs血管生成性能的影响,采用免疫荧光检测了血管生成标记蛋白CD31的表达(图8e-f),结果显示,EO、PPMO和EPPMO水凝胶组均能促进CD31的表达,其中EPPMO水凝胶组的增加最为显著。此外,还进行了基质胶形成的管状结构实验,结果如图8g所示,呈现出与免疫荧光染色相似的趋势。这些结果表明,EPPMO水凝胶通过促进血管生成相关基因的表达,增强了血管生成能力,从而在糖尿病伤口愈合过程中发挥了重要作用。
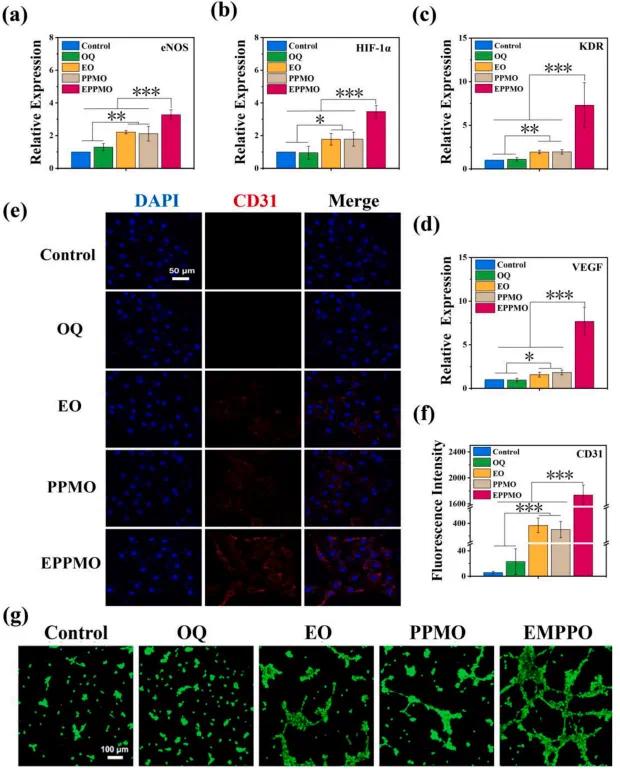
图8.水凝胶血管生成性能的评价。(a-d)通过rt-qpcr检测的huvec中血管生成相关基因hif-α,VEGF,KDR和eNOS的表达。(e-f)免疫荧光法测定CD31 蛋白的表达及其半定量分析结果。(g)基质胶基质形成血管的钙黄素AM染色
(7)动物实验
使用SD大鼠的糖尿病感染性全层皮肤缺损模型(图9a)来评估水凝胶在体内促进伤口愈合的能力。在术后3天,空白组(Blank)的伤口尚未结痂且有化脓现象(图9b),而OQ和EO水凝胶组的伤口没有显著的化脓。此外,由于纳米簇的温和光热效应和QCS的抗菌特性,PPMO和EPPMO组的伤口迅速结痂,没有明显的感染和溃疡迹象。值得注意的是,EPPMO组的伤口开始显示出愈合的初步迹象。在术后14天,EPPMO组的伤口几乎完全愈合,其他水凝胶组的伤口愈合情况良好,而空白组的伤口仍未完全结痂。对组织形态进行半定量分析(图9c和d)显示,EPPMO水凝胶组的伤口愈合率显著高于其他组。
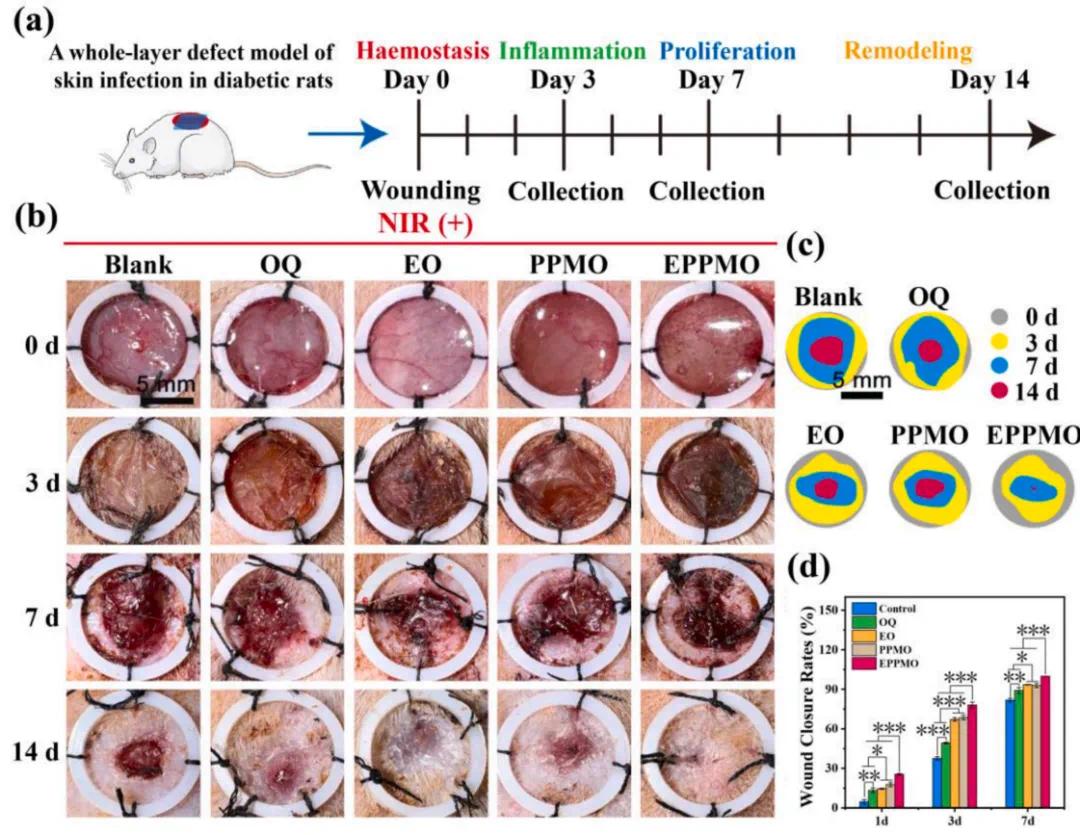
图9.水凝胶系统结合近红外辐射对促进糖尿病皮肤缺损愈合效果的评价。(a)糖尿病皮肤伤口模型的构建过程示意图。(b)用不同水凝胶样品处理的皮肤伤口区域的宏观图像。(c)术后第3天、第7天及第14天的皮肤伤口闭合情况。(d)术后第3、7和14天的伤口闭合率定量数据
为了进一步研究SD大鼠的炎症微环境和血管生成,对伤口组织进行了免疫组化染色,检测抗炎标志物IL-10(绿色,图10a,d)和促炎标志物TNF-α(红色,图10a,e),在第3天,空白组和OQ组显示出显著的TNF-α阳性表达,而IL-10表达为阴性。然而,在加入抗炎剂后,EO和PPMO组显示出促炎因子的显著减少和抗炎因子IL-10的阳性表达,在sEVs和PPMB的协同作用下,EPPMO组显示出促炎因子的显著减少和IL-10的阳性表达,表明其具有卓越的抗炎能力。使用免疫组化染色检测α-SMA(绿色)和CD31(红色)来评估DWs中的血管生成(图10b,f),空白组和OQ组CD31表达较低,而含有sEVs的PPMO组增加了相关蛋白的表达,得益于sEVs和PPMO的协同作用,EPPMO组显示出显著增强的表达,血管生成有助于维持细胞代谢和增殖,从而促进糖尿病伤口愈合。 采用Masson染色来分析皮肤修复中的胶原沉积,如图10c所示,在第3天和第7天,空白组仅表现出少量胶原表达(蓝色)。EO和PPMO水凝胶组已经开始胶原沉积,而EPPMO水凝胶显示出显著的胶原沉积。在第14天,空白组和OQ组均显示出胶原表达,而含有活性物质的EO、PPMO和EPPMO水凝胶显示出更显著的胶原表达,且EPPMO组的胶原排列紧密且成熟。
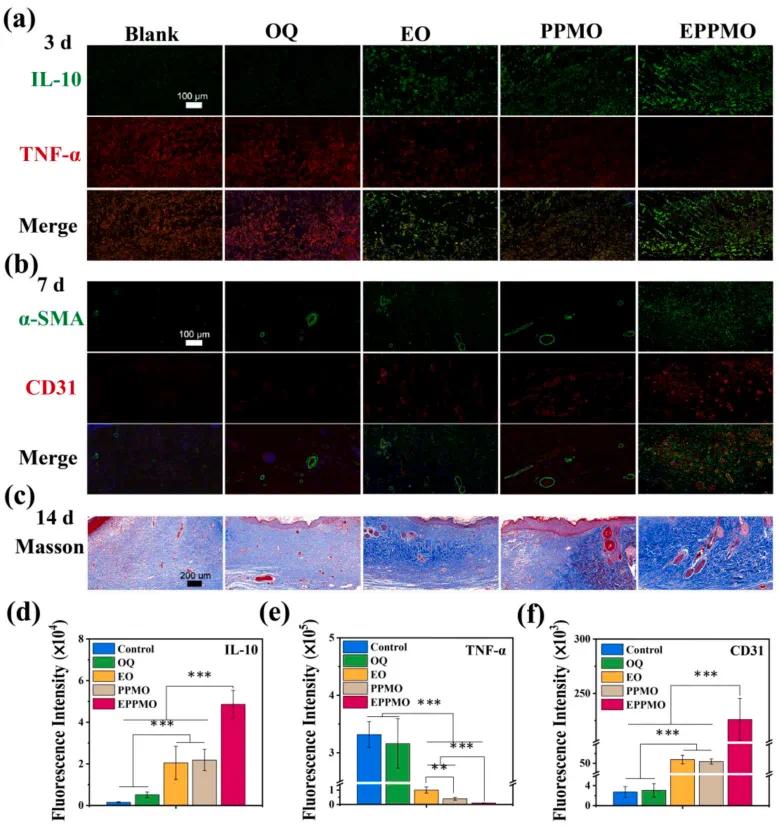
图10. 组织学免疫荧光和Masson染色。(a)IL-10和TNF-α的免疫荧光染色。(b) α-SMA和CD31的免疫组化染色。(c)Masson染色。(d)IL-10免疫荧光染色的荧光面积的半定量结果。(e)TNF-α免疫荧光染色的荧光面积的半定量结果。(f)CD31免疫荧光染色的荧光面积的半定量结果
该研究团队采用掺镁生物活性玻璃(MgBG)将sEVs自主编程为囊泡簇(EPPM),随后将其掺入水凝胶中,以创建一个全面的修复系统,增强sEVs和MgBG的递送,从而促进糖尿病伤口的快速愈合。这种水凝胶表现出优异的可注射性、自愈性和生物粘附性,使其成为DWs的理想物理屏障。此外,水凝胶还具有促进其杀菌活性的光响应特性。释放的EPPM显著增加了sEV的细胞内摄取和积累,巨噬细胞中的sEV增强了约8.2倍,内皮细胞中的sEVs增强了16.7倍。EPPM簇有效地诱导巨噬细胞M2极化,减少伤口部位的炎症反应,并招募细胞,从而促进血管生成和胶原蛋白沉积。这种综合修复系统为糖尿病伤口的综合治疗提供了新的平台。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

