
脑损伤(TBI)是工业化国家中造成长期残疾的主要原因,影响全球约5000万人,并造成巨大的经济损失。TBI的初期阶段直接影响神经元和胶质细胞,随后引发炎症和神经退行性等延迟性二次过程,进一步阻碍恢复。
在漫长的过程中,某些miRNA的上调会进一步恶化神经修复。miR-21和miR-155的过表达与凋亡和炎症信号通路相关,加剧神经毒性。其他与小胶质细胞浸润和星形细胞激活相关的miRNA会加重炎症,导致胶质瘢痕和脑萎缩,破坏细胞再生,形成神经损失的恶性循环,加剧长期神经损伤。尽管神经工程领域最近取得了进展,但由于细胞异质性、基因调控效率低下以及TBI的复杂性,神经元再生的挑战依然存在。

针对以上问题,国立清华大学Eric Hwang、朱麗安和胡尚秀教授团队提出了一种原位磁电生成针对miR6236的海绵(miS)和通过导电颗粒支架(cGRAS)进行无线电刺激的策略,用于TBI中的神经再生。cGRAS由带正电的聚乙胺(PEI)/MXene(MX)和带负电的微珠组成,可以促进miRNA海绵的形成和三维多孔支架的构建。在外置交变磁场(AMF)照射下,“电磁信使”诱导电刺激以恢复大脑功能,并促进时间电穿孔。这种机制结合cGRAS的机械转导效应,增强了体内基因输送,用于形成miRNA海绵,有效减少了miR-6263的过表达,miR-6263是与神经损伤相关的凋亡和炎症通路中的关键介质。这种策略减少了炎症,促进了新生神经元向受损区域的浸润,并恢复了多巴胺神经传递。此外,它还促进了血管生成。这些通过原位磁电miRNA海绵形成和无线电刺激实现的结果,改善了大脑功能和行为恢复。因此,cGRAS代表了一种潜在的变革性和多功能工具,用于临床神经再生工程应用。该文章于2025年5月29日以《In Situ Magnetoelectric Generation of miRNA Sponges and Wireless Electric Stimulus by Conductive Granular Scaffolds for Nerve Regeneration》为题发表于《Advanced Material》(DOI: 10.1002/adma.202500650)。
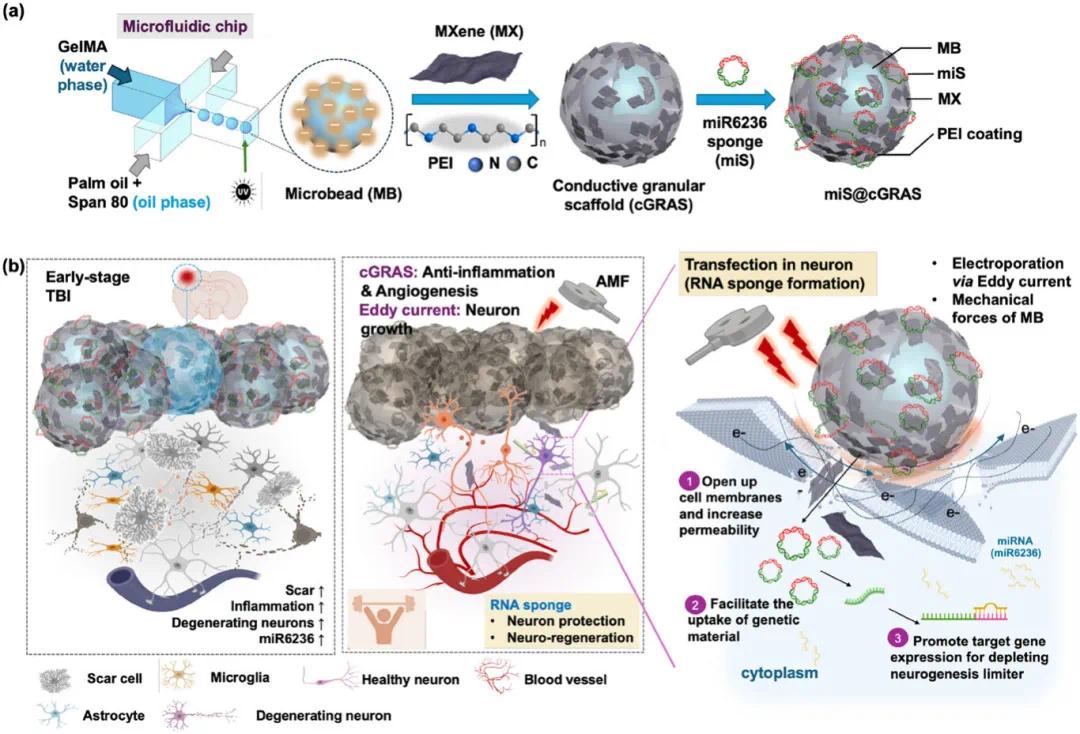
图1 miS@cGRAS的表征。(a)miS@cGRAS结构的示意图,其由包裹PEI-MX纳米片和pDNA(miR6236靶向海绵)的可注射微珠构成;(b)注入TBI伤口后的miS@cGRAS在AMF刺激下,通过水凝胶的机械应力信号通路实现靶向、按需递送核酸药物和电子转移,促进TBI治疗中的血管生成、神经再生和功能恢复
(1)PEI-MX的合成与表征
该 cGRAS 通过将载有 miRNA 海绵的电磁 PEI - MX 涂覆于明胶微珠制备而成。MX 采用蚀刻剂插层剥离法制备,从 MAX 相前驱体选择性去除 A 层得到多层 MX。随后,带正电的 PEI 与带负电且表面含活性基团的 MX 结合,通过静电吸附和氢键作用形成 PEI-MX 复合物,其构成致密聚氢键网络,增强材料机械强度并作为非病毒基因递送系统。SEM 图像显示 MX 和 PEI - MX 纳米片层厚约 2.5nm,PEI - MX 层间距更大;TEM 图像中 PEI - MX 表面有聚合物壳;EDS 分析表明 PEI - MX 含 Ti、N 元素,MX 几乎不含 Al 元素(图 2a - e)。XRD 分析显示 PEI 的引入使 PEI - MX 的 2θ 值减小,d 间距增大,且 MX 晶格结构和片层取向发生轻微变化(图 2f)。HRXPS 分析发现,Ti 2p 光谱显示 MX 和 PEI - MX 的特征峰,PEI - MX 的 C 1s 光谱出现 C - N 键,N 1s 光谱出现季氮和N - Ti 键,证实 PEI 与 MX 成功结合形成 N - Ti 键(图 2g、h)。在细胞膜通透性研究中,以 DAPI 为标志物,通过 CLSM 分析发现,PEI - MX 因其正电荷与细胞膜负组分的静电相互作用,较 MX 显示更强 DAPI 信号,经 AMF 刺激后,细胞膜破坏更显著,可能是原位电穿孔作用所致(图 2i)。DNA 结合实验表明,PEI - MX 的 DNA 结合能力随 PEI - MX/DNA 比例升高而增强,且仅 PEI 涂层纳米粒因静电吸引显示出强 DNA 结合力;其形貌在 miR6236 海绵修饰后无明显变化(图 2j)。
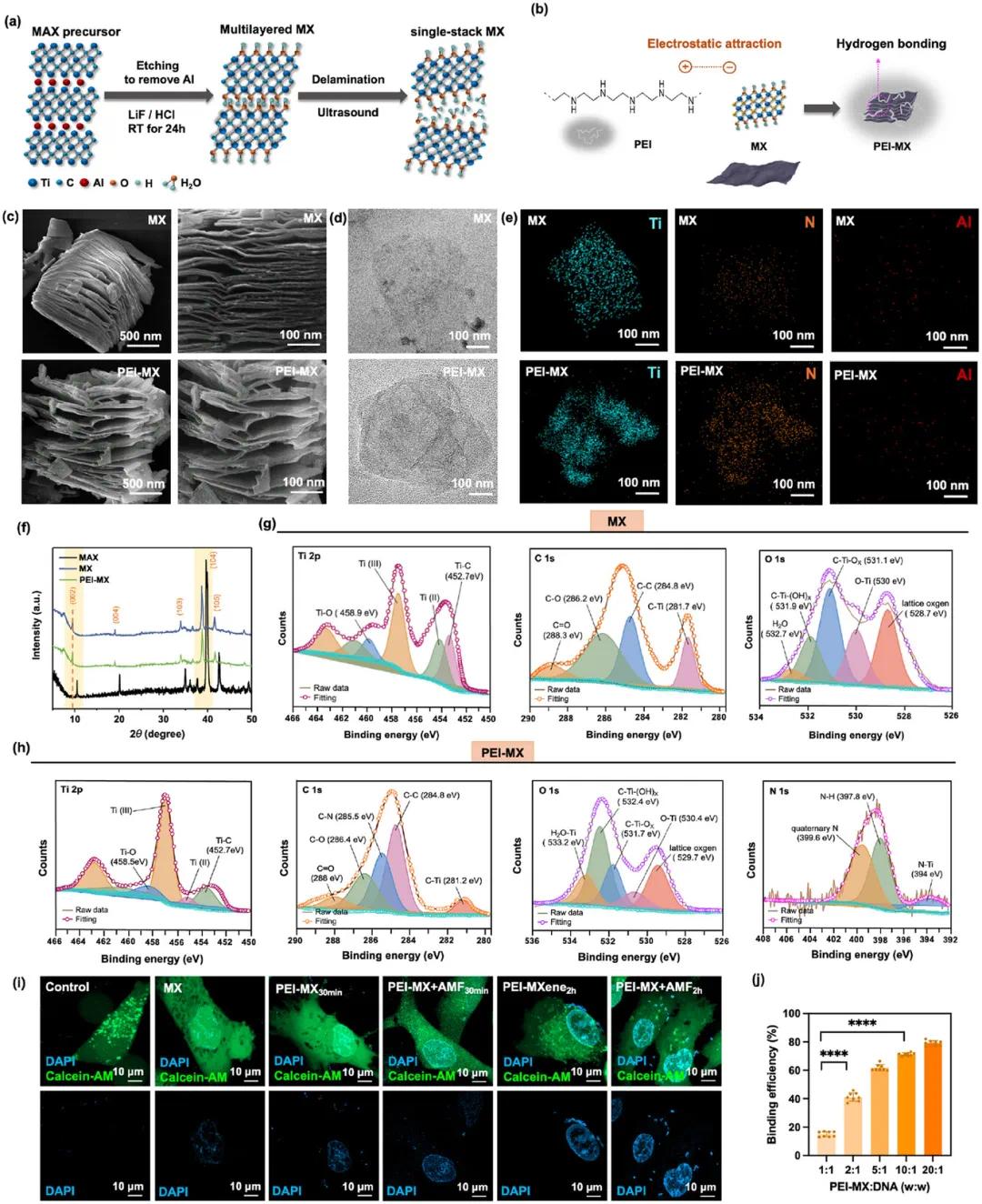
图2 MXene(MX)和 PEI-MX 的合成和表征。a、B)MX 和 PEI-MX 合成的示意图。c)MX 和 PEI-MX 的 SEM 图像。d)MX 和 PEI-MX 的 TEM 图像。e)MX 和 PEI-MX 的 EDS 映射。f)MX 和 PEI-MX 的 XRD 分析。g,h)MX 和 PEI-MX 的高分辨率 X 射线光电子能谱。i)显示在 AMF 照射下膜破裂和增加的渗透性的代表性图像。DAPI 染色细胞核,而钙黄绿素-AM 表示活细胞。j)PEI-MX 的 DNA 结合能力
(2)cGRAS 的制备和表征
使用微流控芯片制备 cGRAS 核心部分,即单分散微珠(MB)。将 GelMA 溶液(水相)与甲基丙烯酰氯酐(MA)反应,制得 GelMA,其取代度(DS)约为 85%。在 T 形微流控连接处,GelMA 溶液形成层流,被油相剪切形成水包油乳液。液滴经毛细管并在紫外线(365 nm,1500 系列,OmniCure)照射下交联成微凝胶(图 3a)。得到的 MB 在明视野显微镜下呈现均匀的尺寸、圆形形状和光滑表面(图 3b)。PEI-MX 涂覆后,微凝胶表面变黑且粗糙(图 3c、f),CLSM 图像显示滴液外表面有明显的导电涂层壳(图 3c、f),表明成功吸附了纳米颗粒。与未涂覆的 MB 相比,PEI - MX 涂覆的 MB 或 miS@PEI - MX 涂覆的 MB 表面粗糙(图 3g - i),表明 miS/PEI - MX 在 MB 表面致密均匀结合,可能利于 AMF 照射后的电刺激以促进神经再生。miS@cGRAS 的平均直径约为 150 μm(图 3j),适合注射且对组织再生理想。通过在含胶原酶的条件下进行降解实验评估其稳定性,结果显示其可生物降解(图 3k)。测量了大块微凝胶表面的孔隙率(图 3l),表明 cGRAS 内有相互连接的通道。此外,miS@cGRAS 在水溶液中表现出轻微的溶胀和分散能力(图 3m)。对 miS@cGRAS 施加 AMF 刺激以产生电流,通过微凝胶相互连接网络内的电子转移改善基因传递和神经分化(图 3n、o)。将 cGRAS 放置在 FTO 基底上并暴露于 AMF 下,结果证明可按需产生电流(图 3o),确认导电材料在诱导电流方面的有效性。cGRAS 的流变和自修复性能归因于非共价颗粒间键的可逆性。随着时间的推移,cGRAS 可聚集成大块凝胶,形成更硬的水凝胶并增加内部交联密度(图 3p)。cGRAS 在外部机械应力下保持结构完整性的能力至关重要,可确保水凝胶的功能性和耐用性。如图 3q 所示,大块 cGRAS 凝胶在承受机械切割力并经紫外线交联后可恢复原始形状,还可重塑成其他形状。
关于生物材料与脑组织之间的生物屏障和支架整合,材料的储能模量(G')至关重要,因其显著影响组织-材料相容性。MB、cGRAS 和 miS@cGRAS 的自修复性能源于非共价颗粒间键的可逆性,有助于在整合过程中保持材料完整性,从而在保持支架功能的同时允许适当的细胞浸润和组织修复。在施加 100% 应变后,MB、cGRAS 和 miS@cGRAS 的储能模量(G')和损耗模量(G'')均恢复到原始值。值得注意的是,由于密集氢键网络的增强作用,cGRAS 和 miS@cGRAS 的储能模量(G')更高,并且表现出凝胶特性(G' > G'')(图 3r)。这些发现表明,miS@cGRAS 在机械力作用下具有强大的自修复能力和重塑特性,并且这种可适应的水凝胶可作为注射生物支架,用于促进受伤大脑内的细胞增殖(图 3s)。
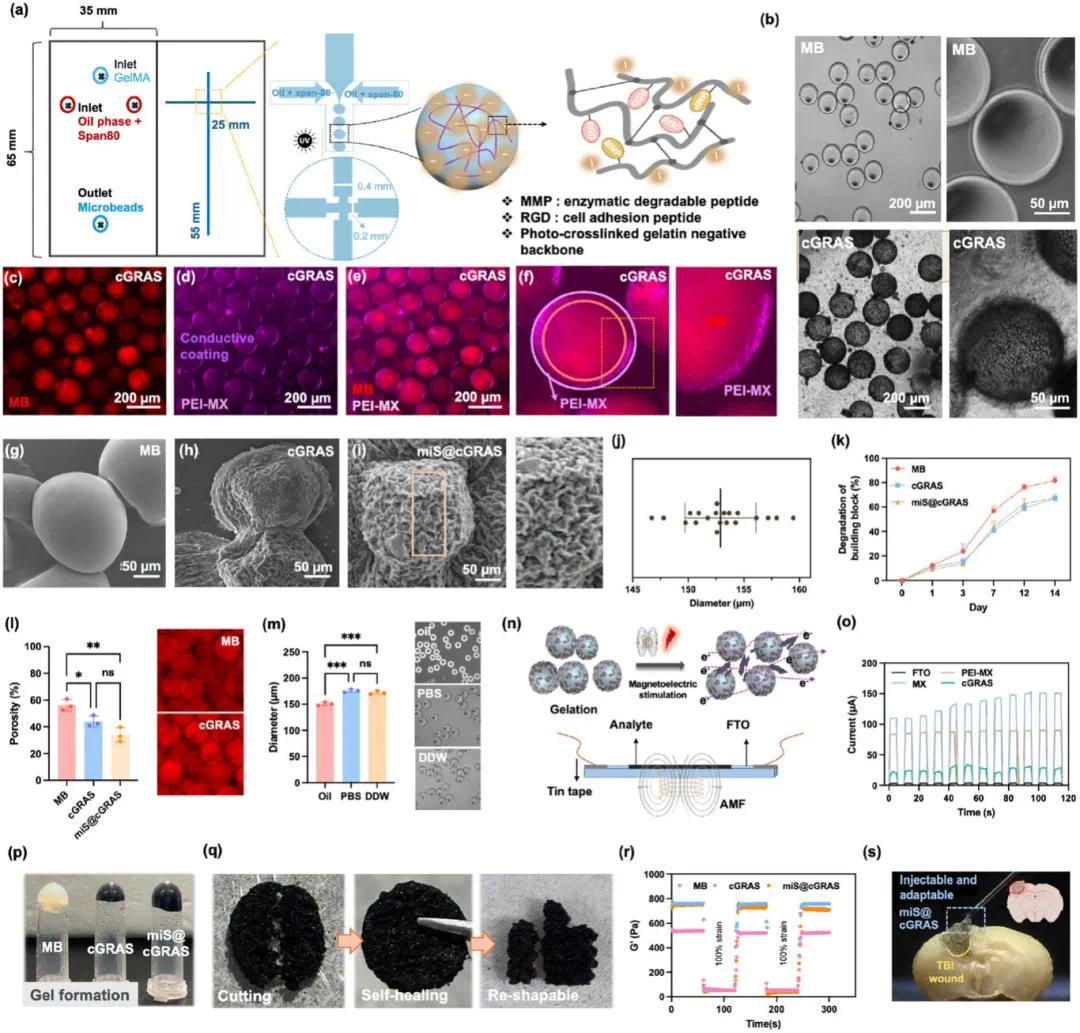
图3 可注射 miS@cGRAS 的表征。(a) 微珠制备用微流控芯片设计;(b) 微珠的明视野图像;(c - f) 微珠外 PEI - MX 涂层壳的荧光图像;(g - i) MB、cGRAS 和 miS@cGRAS 的 SEM 图像;(j) 水包油乳液微珠的直径;(k) 微珠在 37 °C PBS 中孵育两周后的降解实验;(l) 通过溶剂置换法评估的孔隙率测试;(m) 水溶液中的分散能力表明有效释放核酸药物的潜力;(n) 外部磁电刺激下微珠的示意图及检测工具;(o) 在间歇应用 AMF(3.2 kW 和 1 MHz)下,导电纳米复合材料和微珠凝胶的 I - T 曲线,其中 AMF 以 5 秒激活和 5 秒停用的交替模式循环;(p) 不同涂层后微珠凝胶的凝胶化;(q) miS@cGRAS 的损伤愈合能力和重塑潜力;(r) 通过在 37°C 下连续步进应变(1% 应变 → 100% 应变 → 1% 应变)测量,展示微珠凝胶的流变自修复性能;(s) 可注射 miS@cGRAS 能适应 TBI 腔
(3) cGRAS 的生物相容性和细胞毒性
通过对 PEI 剂量的优化,在最小化细胞毒性与维持高效基因转染之间取得平衡。将 MB、cGRAS 和 miS@cGRAS 与 NIH-3T3 细胞系(源自小鼠胚胎成纤维细胞的成纤维细胞系)及神经干细胞(NSC)共孵育 24 小时,以评估其体外细胞毒性。在 NIH-3T3 细胞中评估含 PEI - MX 的 cGRAS 的细胞毒性,结果显示,当 MX 浓度低于 200 µg mL−1 且 PEI - MX 中的 PEI 浓度低于 1 µg mL−1 时,无显著细胞毒性,后续实验据此选择浓度。各种凝胶孵育后,NIH-3T3 细胞的活性保持在 80% 以上(图 4a)。CLSM 图像显示,MB、cGRAS、miS@cGRAS 和 miS@cGRAS + AMF 与 NIH-3T3 细胞共孵育 7 天时细胞附着良好,表明其良好的生物相容性(图 4b - e)。这种相容性归因于生物相容性肽(如 RGD 和 MMPs)具有良好的细胞亲和力。水凝胶的粘附特性使其能够弥合生物材料表面与细胞之间的间隙。GelMA 基水凝胶通过明胶的羟基和胺基与甲基丙烯酸酐反应合成,保留了用于细胞粘附和酶切的生物活性基序。值得注意的是,miS@cGRAS 在不同导电层浓度下,无论有无 AMF 处理,均展现出良好的生物相容性,即使经过几分钟的 AMF 暴露也未显现显著毒性。
在 NIH-3T3 细胞中展现出良好的生物相容性后,还利用从 ED16 Wistar大鼠胚胎收集和分离的 NSCs 来评估细胞活性(图 4f、g)。明视野图像捕捉了 miS@cGRAS 与神经球共培养 1、3 和 7 天的情况(图 4h)。第一天,神经元开始在 miS@cGRAS 上生长神经突起,随着孵育时间的延长,神经突起变得更长,证明了其强大的生物相容性。与对照组相比,miS@cGRAS 处理组也显示出明显的神经突起萌发,表明引入 miS@cGRAS 并未引发任何不良反应(图 4i)。为了监测神经突起的生长,使用 βIII - 筒蛋白(Tuj1)对神经突起进行染色,以在凝胶上可视化它们。培养一周后,神经突起在微珠周围生长,表明这些材料可以作为合适的生物支架,并在水凝胶表面提供大量的细胞粘附肽(图 4k、l)。此外,在 AMF 刺激下,观察到围绕 miS@cGRAS 延伸的长而密集的神经突起,表明外部电流的产生可以增强神经细胞的增殖并建立神经突起连接(图 4l、m)。AMF 促进神经生长的机制可以解释为:外部电刺激能有效传递电信号,促进神经冲动的及时传递,并支持生物信息的交流。此外,非侵入性的无线远端电刺激显著减少了与神经组织的接触,最小化了通常与植入电极相关的界面效应和炎症反应。
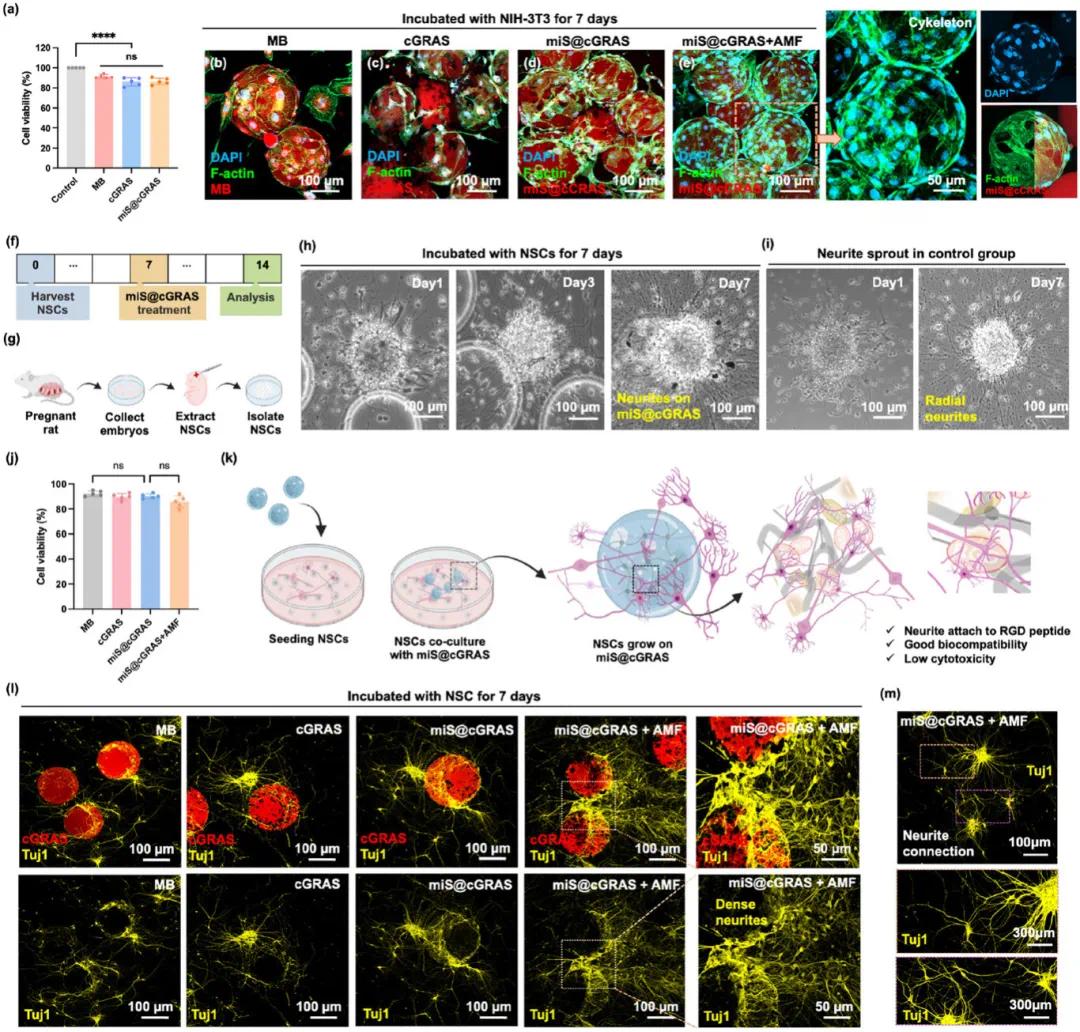
图4 miS@cGRAS的生物相容性及细胞毒性。(a)NIH-3T3细胞与MB、cGRAS及miS@cGRAS共孵育后的细胞活性;(b-e)NIH-3T3细胞与不同微珠共培养的共聚焦图像,AMF照射促进细胞增殖且无明显毒性;(f-i)原代培养的神经干细胞实验时间表、取材过程及与miS@cGRAS共培养的明亮视野图像,显示微珠上显著的神经突生长且无细胞毒性,其生长模式与对照组相似;(j)NSCs与MB、cGRAS及miS@cGRAS共孵育后的细胞活性;(k-m)NSCs在微珠上的神经突生长示意图、共聚焦图像及其神经突连接的代表性图像,显示微珠培养时NSCs的强健生长现象及优异的生物相容性
(4)原子力显微镜下质子海绵效应和电穿孔介导的溶酶体逃逸
带正电的 PEI - MX 通过质子海绵效应实现内质-溶酶体逃逸,使 miR6236 海绵进入细胞质,AMF 刺激结合质子海绵效应可增强膜电穿孔,提高基因载体货物进入细胞的效率(图 5a)。CLSM 图像显示,PEI-MX 因其阳离子特性较纯MX逃逸效率更高,AMF 应用可改变膜电位,增强电穿孔和溶酶体排除,组合方式的溶酶体逃逸效率最高(图 5b、c)。在体外转染实验中,将 miR6236 海绵(miS)应用于 cGRAS,miS 配备了两个强启动子和双报告基因(编码 d2EGFP 和 mCherry)。miS 通过靶向在早期受损神经微环境中高丰度的 miR6236 来促进神经再生。在 NIH - 3T3 细胞系中,miS@cGRAS 的转染效率优于 ctS@cGRAS,且 AMF 诱导的电穿孔与质子海绵效应协同作用可增强转染效率。在原代神经元中,miS@cGRAS 处理后,EGFP 表达降低,表明 miS 成功表达且 miR6236 与海绵结合并耗尽 EGFP 表达(图 5e、f、g)。流式细胞仪分析进一步确认了转染效率。miS@PEI - MX 组的转染效率相较于游离 miS 有所提高,这归因于转染剂涂层有助于 miS 的高效细胞内递送(图 5i、j、k)。此外,AMF 刺激使 ctS@cGRAS 或 miS@cGRAS 的转染效率提高至 1.6 倍(图 5h),荧光定量数据表明 AMF 有效促进细胞对基因载体的摄取,转染效率提升至 1.36 倍(图 5h),与荧光强度测量结果一致。这些发现证实了 miR6236 海绵的功能,表明 miS@PEI - MX 与 AMF 刺激联合应用有望优化基因递送,推动神经再生治疗的发展。

图5 miS@PEI-MX的溶酶体逃逸能力及体内转染效果。(a)基因载体载体货物(miS@PEI-MX)溶酶体逃逸的示意图;(b-c)共聚焦图像显示溶酶体信号(绿色)与颗粒(红色)的共定位及Pearson系数比较量化;(d)通过无线电穿孔和机械力在cGRAS上发生转染,miS@PEI-MX通过溶酶体逃逸转录双mRNA以表达功能,mCherry为指示基因,EGFP为目标基因用于测量miR6236水平;(e-f)用对照海绵(ctS)或miR6236海绵(miS)处理后神经元转染信号的放大CLSM图像及成功转染miS至神经元后的伪彩色基因表达信号图像;(g-i)EGFP/mCherry比值量化分析,流式细胞术评估miR6236海绵功能(通过测量双报告基因表达水平)及不同纳米复合物配方(对照、PEI-MX、仅miS、miS@PEI-MX、miS@PEI-MX+AMF)的转染能力;(j-k)流式细胞术评估不同纳米复合物处理细胞的转染能力及相应实验的平均荧光强度
(5)体外刺激 NSC 分化和功能恢复
在评估 NSC 海绵效应后,通过 CLSM 图像评估了 miS@cGRAS 对 NSC 分化的影响(图 6a)。AMF 处理组每天使用 3.2 kW 功率、1 MHz 频率的 AMF 辐照 3 分钟,直至 NSC 固定。到第 7 天,CLSM 图像显示 NSC 分化和神经突起生长明显(图 6a)。通过分析神经标志物 Tuj1 和胶质纤维酸性蛋白(GFAP,星形细胞标志物)的表达来评估分化结果。与 ctS@cGRAS 相比,miS@cGRAS 处理的 NSC 显著萌发,类似于 miRNA 海绵效应(图 6b)。AMF 暴露可有效促进神经元分化,Tuj1 阳性神经元数量显著增加,但对星形细胞分化无明显影响(图 6c)。此外,AMF 刺激促进 ctS@cGRAS 或 miS@cGRAS 中的神经突起延长,表明实现了电流诱导的 NSC 神经分化(图 6d)。AMF 诱导的电刺激激活了促进神经萌发和神经生长的多条细胞内信号通路,包括钙信号通路、cAMP 和 MAPK 通路,这些通路共同协调细胞反应,刺激神经萌发,促进神经连接形成和突触可塑性。
鉴于神经突起延长与神经再生的密切关系,降低 miR6236 水平可能有助于增强损伤后的神经再生。为了在体外模拟损伤后的环境,将 NSC 种植在用硫酸软骨素蛋白多糖(CSPG)包被的表面上(图 6e),CSPG 在中枢神经系统损伤后的星形胶质细胞瘢痕中积累。假设 miR6236 会在 CSPG 抑制性基质上积累,耗尽 miR6236 将导致神经突起长度增加。通过电穿孔将表达 miR6236 海绵的质粒转染到 NSC 中,立即进行接种,以克服 CSPG 基质对神经生成的限制(图 6g)。转染后,神经元在 CSPG 包被的表面上培养 7 天,然后固定并分析以评估 miR6236 耗尽对神经再生的影响。与未处理组相比,CSPG 表面的 NSC 培养显示出受损神经突起的不健康模式(图 6f)。预测在 CSPG 包被的表面上,表达 miR6236 靶向海绵的神经元比表达对照海绵的神经元延伸出显著更长的神经突起(图 6h,i)。CLSM 图像显示,对照海绵组的神经突起生长不连续且呈珠状,而 miR6236 海绵组显示连续的神经突起生长,支持 miR6236 耗尽增强神经再生的观点。此外,AMF 刺激进一步增强了神经突起生长,在对照海绵组中神经突起长度增加了 1.8 倍,在 miR6236 海绵组中增加了 1.4 倍(图 6j)。鉴于 miRNA 在脊髓损伤、创伤性脑损伤和中风中的新兴作用,miR6236 可能在中枢神经系统损伤后上调。这些发现表明,miR6236 耗尽有潜力增强损伤中枢神经元的再生。
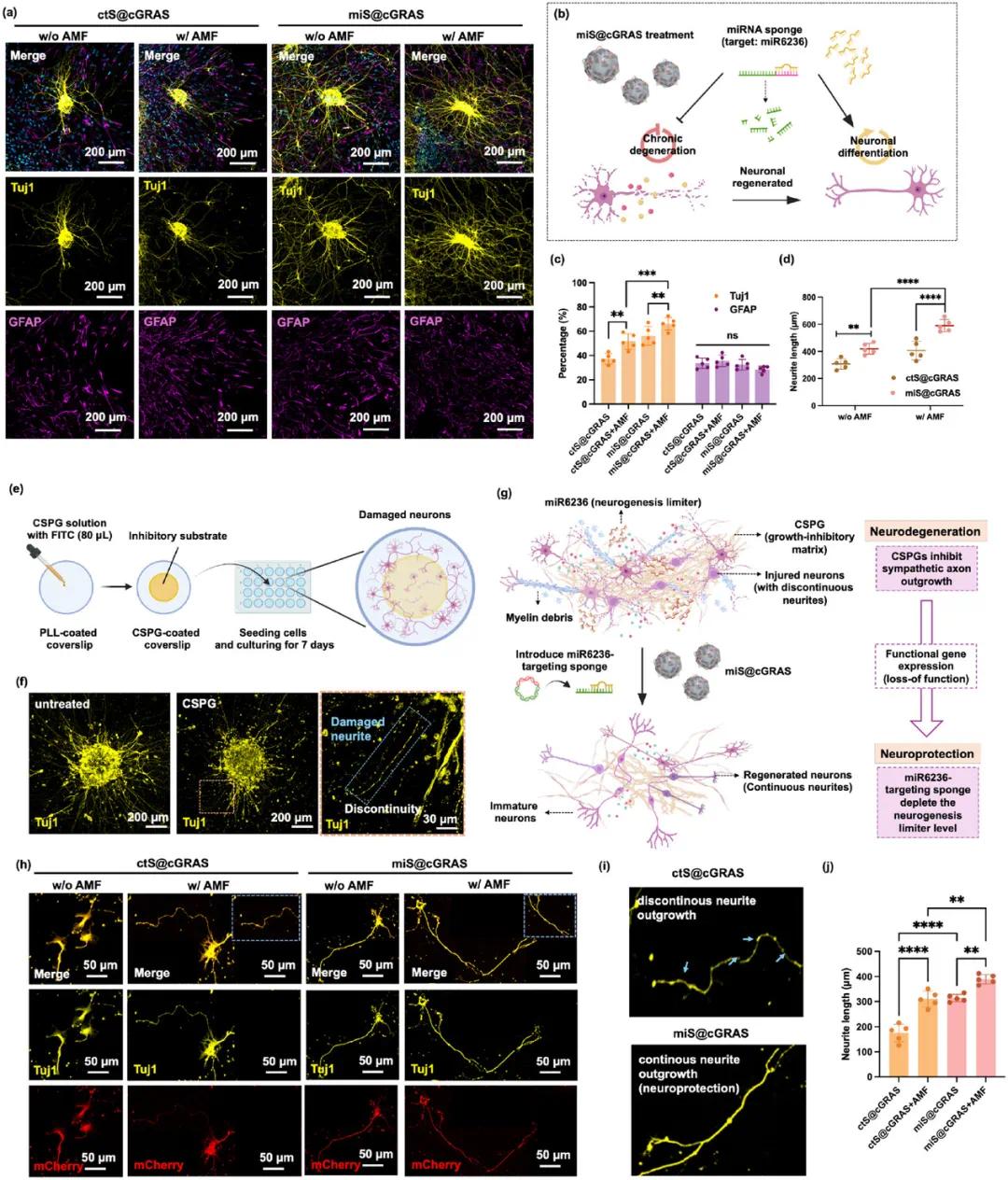
图6 TBI动物研究。(a)TBI实验时间线、处理过程及牺牲/免疫染色分析示意图;(b)展示TBI手术过程的图片;(c)体内转染过程及治疗后48小时TBI腔周围的CLSM图像,放大图像显示绿色荧光(EGFP)相对于红色荧光(mCherry)减少,部分细胞仅显示mCherry,表明miR6236完全耗尽及EGFP表达抑制;(d)有无AMF照射的转染效率量化;(e)TBI生物响应总结及miS@cGRAS治疗效果,未处理组出现严重神经营炎性,miS@cGRAS治疗组炎症减轻、神经营退因子抑制及神经修复能力增强;(f)伤后7天拍摄的CLSM图像,显示损伤部位邻近区域的小胶质细胞/巨噬细胞(绿色,Iba1染色)、星形胶质细胞(紫色,GFAP染色)和神经丝阳性细胞(黄色,NF200染色),细胞核呈蓝色,DAPI染色;(g-i)免疫响应、瘢痕边界和NF200浸润面积的定量分析
(6)miS@cGRAS 对 TBI 的体内研究
在小鼠 TBI 模型中评估 miS@cGRAS 的体内效应。7 周龄雌性 C57BL/6 小鼠每组 5 只,通过从运动皮层去除脑组织至 1.5 mm 深度建立损伤模型,miS@cGRAS 在损伤后立即注射到受影响区域,并在植入后一天开始 AMF 刺激直至处死小鼠。结果显示,miS@cGRAS 促进 TBI 中的基因传递和转染。植入 miS@cGRAS 并应用 AMF 后,治疗后 48 小时的大脑 CLSM 图像显示 TBI 腔周围有强烈的基因表达(图 7c)。AMF 暴露 3 分钟提高了转染效率,从约 18% ±5% 提高到 32% ±5%(图 7d),表明磁电刺激改善了电穿孔并促进了基因货物进入细胞质。
第 7 天处死的小鼠观察到伤口的短期变化,分为 5 组:1)假手术组,2)cGRAS 组,3)ctS@cGRAS 组,4)miS@cGRAS 组,5)miS@cGRAS + AMF 组。miS@cGRAS + AMF 处理后,大脑的炎症较弱且 TBI 腔较小。IVIS 图像显示 TBI 位点的水凝胶植入。miS@cGRAS 治疗通过平衡免疫反应、调节瘢痕边界、恢复神经可塑性和保护大脑完整性,显示出减轻 TBI 不良影响的潜力(图 7e)。第 7 天评估 miS@cGRAS 在促进抗炎方面的作用。假手术组显示出大量的巨噬细胞 / 小胶质细胞,而 cGRAS 处理组的 Iba - 1 水平显著降低,表明 ECM 样 cGRAS 减少了病变体积和炎症(图 7f、g)。与假手术组相比,cGRAS 和 miS@cGRAS + AMF 处理组的星形胶质细胞更少且排列更松散(图 7f - h),这可能归因于微凝胶的微孔结构,有助于细胞渗透到创伤部位,为再生和愈合创造更有利的环境。
使用 NF200 标记的 CLSM 图像评估受累区域的轴突浸润,虚线标示浸润区域(图 7f、i)。量化结果显示,假手术组显示约 15.4% 的 NF200 阳性浸润,miS@cGRAS + AMF 组的 NF200 浸润面积进一步增加至 36.7%,分别是假手术组和 miS@cGRAS 组的 2.4 倍和 1.3 倍。术后 14 天通过 CD31 标记评估血管恢复,miS@cGRAS + AMF 组显示出明显的血管形成,部分血管超过 100 µm 并在 miS@cGRAS 内部通道增殖。这些发现表明,miS@cGRAS 通过促进神经发生和血管生成,为神经损伤后的有效组织再生提供了有利的微环境。
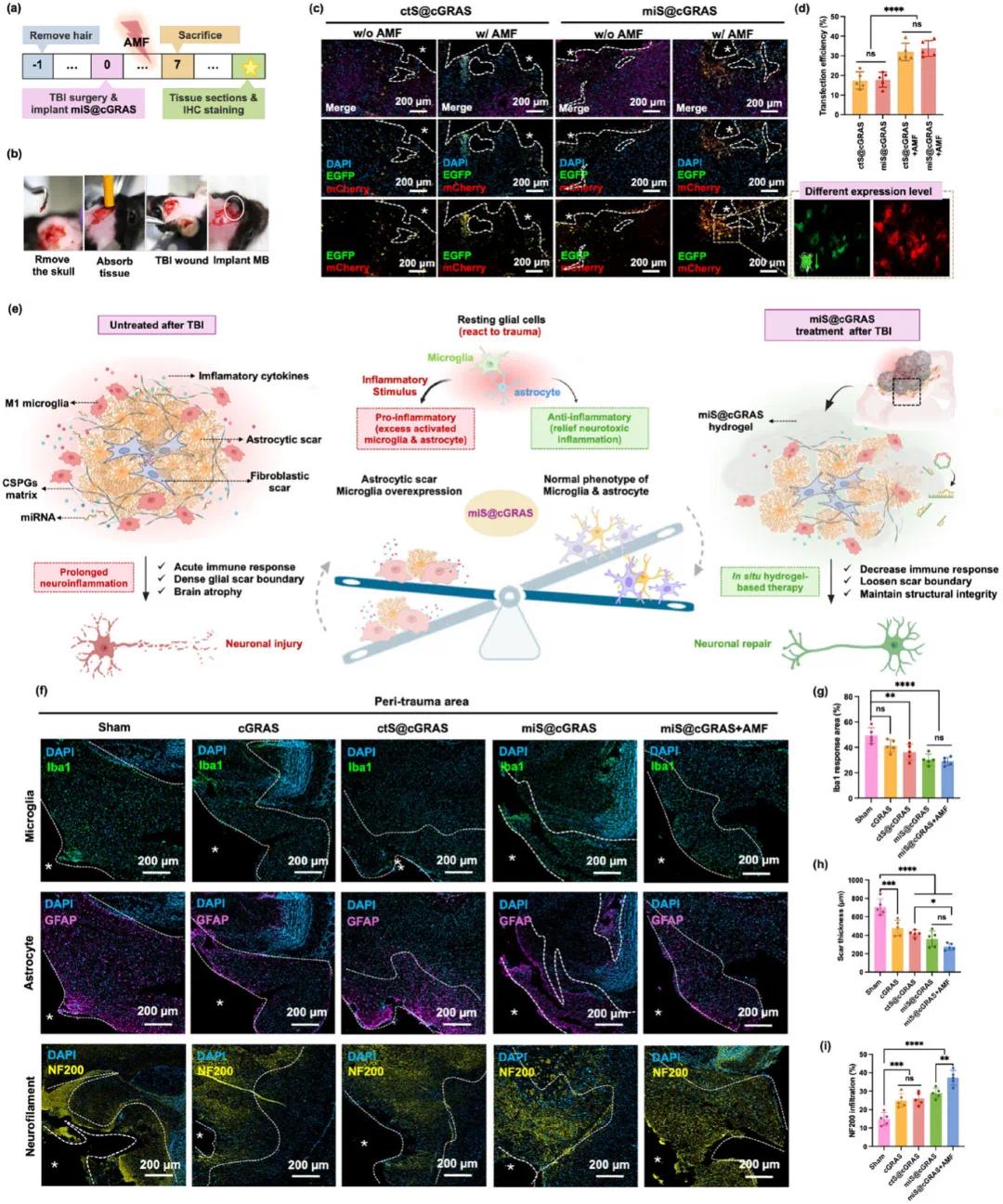
图7 TBI动物研究。(a)TBI实验时间线、处理过程及牺牲/免疫染色分析示意图;(b)展示TBI手术过程的图片;(c)体内转染过程及治疗后48小时TBI腔周围的CLSM图像,放大图像显示绿色荧光(EGFP)相对于红色荧光(mCherry)减少,部分细胞仅显示mCherry,表明miR6236完全耗尽及EGFP表达抑制;(d)有无AMF照射的转染效率量化;(e)TBI生物响应总结及miS@cGRAS治疗效果,未处理组出现严重神经营炎性,miS@cGRAS治疗组炎症减轻、神经营退因子抑制及神经修复能力增强;(f)伤后7天拍摄的CLSM图像,显示损伤部位邻近区域的小胶质细胞/巨噬细胞(绿色,Iba1染色)、星形胶质细胞(紫色,GFAP染色)和神经丝阳性细胞(黄色,NF200染色),细胞核呈蓝色,DAPI染色;(g-i)免疫响应、瘢痕边界和NF200浸润面积的定量分析
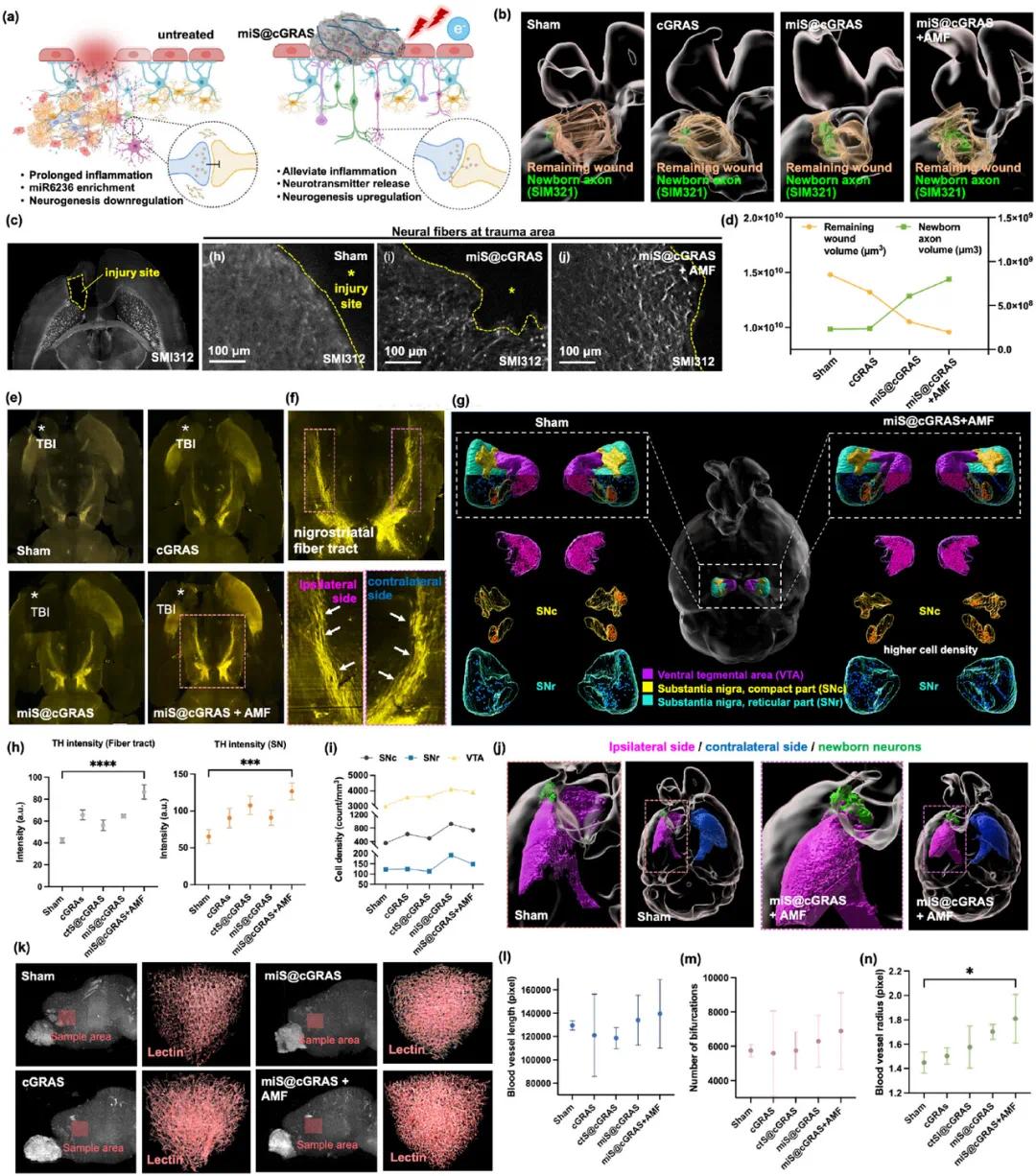
图8 TBI后不同治疗对神经恢复的全脑成像分析及行为评估。(a)未治疗TBI与miS@cGRAS有效治疗对比示意图;(b)不同材料治疗TBI的全鼠脑重建3D图像,突出SMI312(轴突标志,绿色)和剩余损伤区域(橙色);(c)显示损伤部位周围新生轴突纤维再生的图像,miS@cGRAS+AMF组新生神经元密度最高;(d)各组剩余损伤体积和新生轴突体积量化(n=3);(e)显示多巴胺神经传递的全鼠脑3D图像,酪氨酸羟化酶(TH)染成黄色;(f)miS@cGRAS+AMF组放大图像显示TH标志及受损侧(紫色)清晰的黑质纹状体纤维束,与正常侧(蓝色)对比;(g)多巴胺能脑区TH细胞密度比较;(h-i)多巴胺能脑区TH阳性细胞强度和密度量化;(j)纹状体对称性评估,受损侧(左脑,紫色)和未受损侧(右脑,蓝色);(k)创伤周边区域血管成像的凝集素染色脑图像;(l-n)血管长度、表面积和分支量化
(7)miS@cGRAS 处理后全脑中的新生神经元
脑损伤(TBI)会延长炎症反应,促进miR6236富集,并降低大脑中的多巴胺神经传递(图8a)。研究使用3D全鼠脑清除和免疫染色技术,发现miS@cGRAS与AMF联合治疗显著减少残留损伤体积,增强神经再生,表现为SMI312标记的新神经元数量最多(图8b,d)。神经纤维向损伤部位延伸,AMF照射进一步促进神经再生和组织修复。治疗后新生神经元区域显著增加,形成密集的神经纤维网络,归因于miR6236的下调。外部涡流场的应用使新生神经元体积比对照组增加3.63倍,比单独miS@cGRAS治疗增加1.33倍,显示协同促进神经发生和组织修复的潜力。
在多巴胺神经传递方面,通过分析酪氨酸羟化酶(TH)的分布和活性,发现miS@cGRAS+AMF组的TH强度在黑质和黑质纹状体纤维束中显著高于其他组(图8i),表明治疗刺激了多巴胺合成。该组黑质纹状体纤维束大小几乎对称,纹状体形态对称性恢复,左右脑平衡改善(图8j)。此外,miS@cGRAS+AMF治疗使创伤周边区域血管生成增加约128%(图8k,l,n),增强组织修复和恢复。
行为测试显示,miS@cGRAS+AMF组在圆柱测试、网格测试和生面条测试中表现最佳,表明运动功能和精细动作技能恢复。生物可降解性和H&E染色评估表明,水凝胶植入物在14天内降解,无毒性副产物,具有良好的生物相容性。
电子信号和 miRNA 调控对决定神经细胞命运及促进大脑恢复至关重要,但临床应用受限于缺乏有效的工具。本研究介绍了一种导电颗粒支架(cGRAS),它兼具天线和神经基因输送剂功能,能靶向调控 miRNA 以促进 TBI 神经修复。其独特性质可减轻小胶质细胞和星形细胞激活,减少炎症和胶质瘢痕。 在外置交变磁场(AMF)下,“电磁信使”诱导电刺激,促进大脑功能恢复并增强时间电穿孔。cGRAS 介导的机械转导改善了 miRNA 海绵输送,减少促神经损伤的 miR6263 过表达。全脑成像分析显示炎症减轻、TBI 腔周边血管生成增加以及新生神经元向损伤区浸润增强,最终改善大脑功能和行为恢复。总体而言,cGRAS 是推进临床神经再生工程的有前景且多功能的工具。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

