
腰痛是与椎间盘退变(IVDD)相关的慢性问题,是全球致残的主要原因之一。传统治疗方法如手术切除无法恢复椎间盘原始功能,还可能增加邻近椎间盘负担。纤维环(AF)是椎间盘外层结构,维持髓核稳定性。外伤或慢性劳损导致AF撕裂,引发ECM降解(胶原蛋白减少、MMPs升高)、慢性炎症和能量代谢紊乱,AF退变伴随线粒体自噬功能障碍(如PINK1/Parkin通路异常),进一步加剧ECM破坏和细胞凋亡。椎间盘无血管特性导致全身给药效果差,退变微环境(低氧、低pH、炎症)限制药物驻留和细胞存活。因此,需开发适用于IVDD治疗的新型纳米药物平台。

针对上述问题,浙江大学张宁、贺永团队开发了基于螺旋微针贴片(T-MN@EXO@miR-378)的药物缓释递送系统,用于治疗IVDD的纤维环损伤。研究制备了负载 EXO@miR-378 的螺纹微针,其基于 SiIMA 复合层粘连蛋白。SiIMA 的高硬度使微针贴片紧密贴合受损纤维环,层粘连蛋白可吸附并缓慢释放外泌体。T-MN 递送 EXO@miR-378 能恢复 AF 细胞的线粒体自噬功能和 ECM 稳态,展现出修复受损纤维环的独特优势。该研究为基于线粒体自噬恢复的长期治疗策略提供新思路,为 IVDD 临床治疗带来新可能。相关成果于 2024 年 3 月 13 日以《Thread-structural microneedles loaded with engineered exosomes for annulus fibrosus repair by regulating mitophagy recovery and extracellular matrix homeostasis》为题发表于《Bioactive Materials》。(DOI:10.1016/j.bioactmat.2024.03.006)。
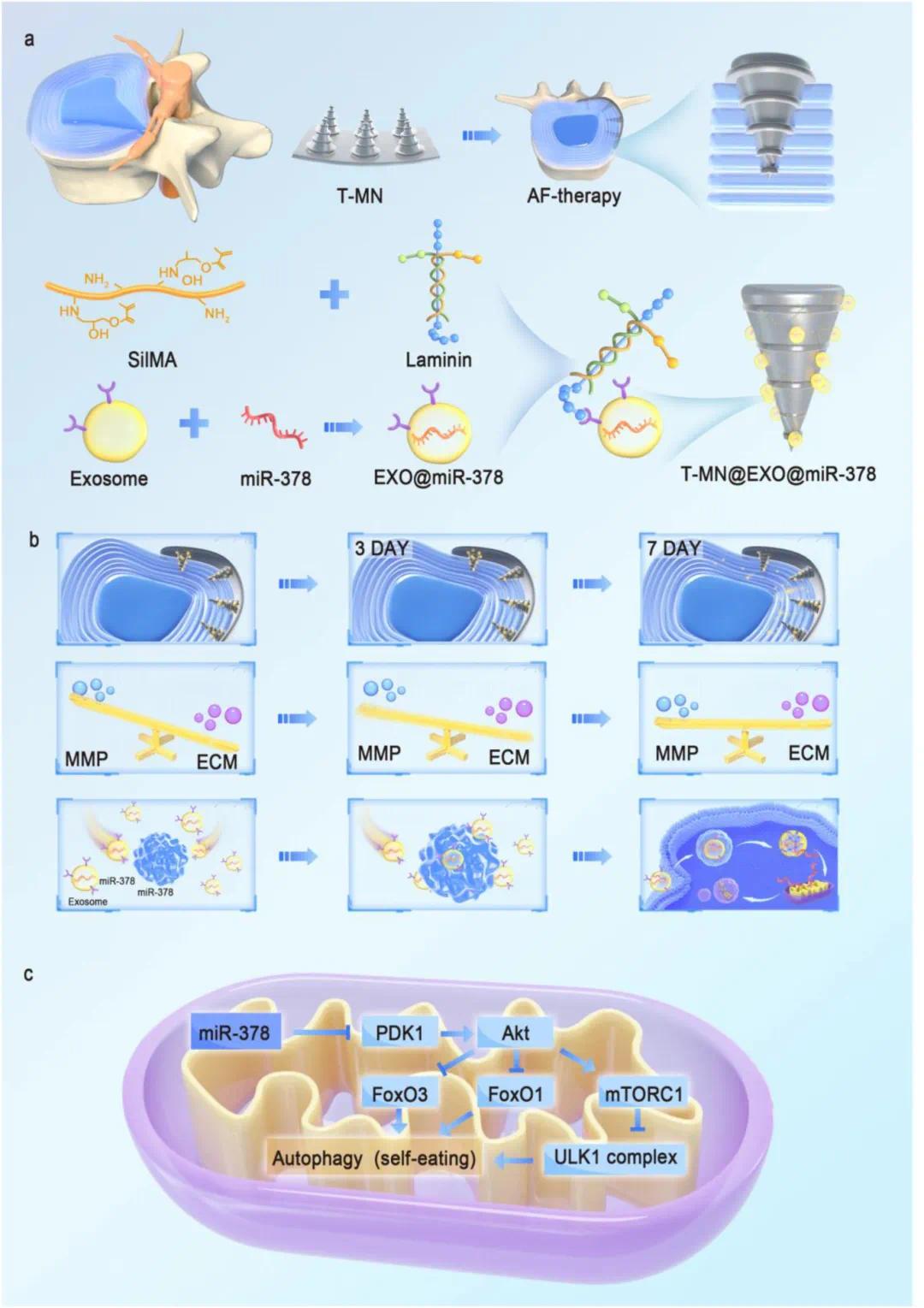
图1 T-MN@EXO@miR−378的制备与作用机制。(a)T-MN@EXO@miR−378和工程化外泌体制备示意图;(b)T-MN@EXO@miR−378可持续释放外泌体,调节ECM和线粒体自噬;(c)miR-378调控线粒体自噬途径
(1)纤维环线粒体自噬在椎间盘退变中起保护作用
纤维环(AF)破坏在椎间盘退变(IVDD)中起着至关重要的作用(图2A)。分析GEO数据库单细胞RNA测序数据集GSE199866,比较人类退变AF细胞与正常AF细胞差异表达基因(DEGs)(图2B)。KEGG分析显示,差异基因涉及自噬(SQSTM1/BNIP3/WDR45B/CTSL/UBC/CTSD)和线粒体自噬(SQSTM1/BNIP3/UBC/ATF4)通路(图2C)。推测自噬和线粒体自噬在椎间盘保护中重要。
以IL-1β诱导大鼠AF细胞退变模型为实验组,未处理大鼠AF细胞为对照组。RNA测序分析显示,有7个自噬相关差异基因:Foxo1、Tsc1、Em1、Dlc1、Wdfy3、Fos和Map1lc3a(图2D-F)。KEGG分析(图2G)和GO注释分析(图2H)发现,这些自噬相关基因调控细胞过程和生物调节功能,与细胞膜成分密切相关。结果表明,退变AF细胞因自噬损伤导致线粒体膜受损。检测退变AF细胞线粒体自噬水平,发现其显著降低,抑制线粒体自噬的蛋白PINK1表达增加35%,促进线粒体自噬的蛋白Parkin和LC3II/I分别减少25%和20%。Fundc1是编码选择性自噬和线粒体自噬相关蛋白的基因,实验组中Fundc1蛋白表达水平下降49%(图2I和J)。表明AF退变模型中,AF细胞线粒体自噬功能受损。
为研究自噬对IVDD影响,构建Fundc1敲除(KO)小鼠,通过尾椎穿刺疾病模型验证其作用(图2K)。HE染色显示,Fundc1-KO受伤组椎间盘结构损伤更明显,椎间盘高度下降更显著(图2L)。SO染色显示,Fundc1-KO受伤组AF软骨成分减少更明显(图2M)。结果证明,线粒体自噬在退变AF细胞中起关键保护作用。
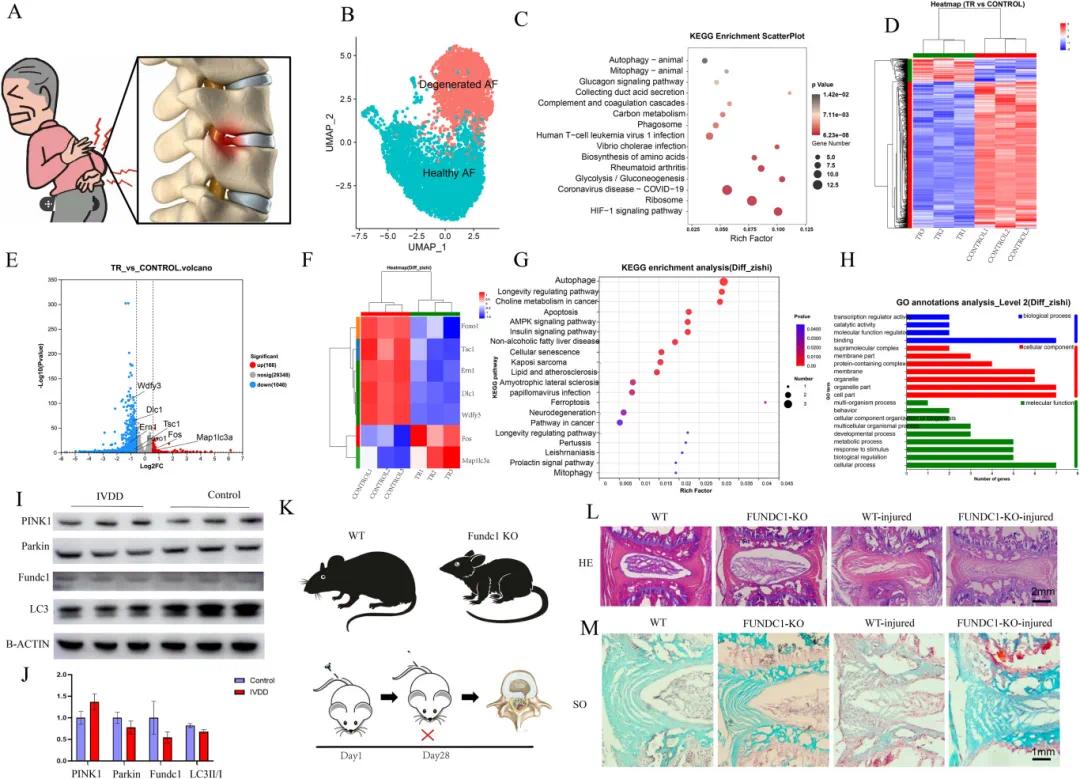
图2 线粒体自噬相关基因在变性纤维环细胞中的变化及其在IVDD中的保护作用。(A)IVDD示意图;(B)人体IVD数据集Umap;(C)人IVD中变性AF细胞与正常AF细胞DEG的KEGG富集分析;(D)体外大鼠IVD对照组与实验组mRNA转录谱热图;(E)实验组与对照组DEG火山图;(F)对照组与实验组参与自噬DEG的mRNA转录谱热图;(G)对照组与实验组参与自噬DEG的mRNA转录谱KEGG富集分析;(H)对照组与实验组参与自噬DEG的mRNA转录谱GO注释图;(I)实验组与对照组线粒体自噬特征蛋白蛋白表达;(J)蛋白表达定量;(K)Fundc1 KO小鼠、IVDD模型及采样过程示意图;(L)各组HE染色图像;(M)各组番红O染色图像
(2)T-MN@EXO@miR-378的制备与表征
为将药物递送至纤维环深层组织,设计微针(MN)结构并采用3D打印技术制作模具,选择甲基丙烯酰化丝素蛋白(SiIMA)作为微针主要材料以贴合纤维环刚性结构(图3A)。设计类似锥形螺纹的螺纹结构微针,可增加摩擦力,使微针贴片牢固固定在组织上,防止髓核渗漏,同时增大与纤维环接触面积,增加药物释放面积(图3B)。为提高T-MN持续释放外泌体能力,引入层粘连蛋白吸附外泌体,其长臂末端可与外泌体上整合素和生长因子相互作用(图3C)。层粘连蛋白吸附作用和水凝胶内部多孔结构使外泌体渗透到T-MN内部并附着在表面(图3D)。傅里叶变换红外光谱(FTIR)证实层粘连蛋白与SiIMA成功混合,SiIMA酰胺I、II和III带峰分别出现在1637、1515和1237 cm⁻¹处,与β折叠构象一致,混合后SiIMA酰胺带转变为α螺旋构象,层粘连蛋白使SiIMA峰蓝移并增强峰强度,利于吸附外泌体。如图3D-F所示,25% SiIMA溶胀率最低,因高浓度下交联度高,孔隙小。应选孔隙率最高浓度确保药物/因子释放,但溶胀过大易使T-MN移位或突出,引发局部炎症。测试四种不同浓度水凝胶的拉伸和压缩模量,随SiIMA浓度增加,模量均上升(图3G和H)。综合考虑溶胀性能和机械性能,选20% SiIMA作为主要成分。T-MN针尖强度重要,检测单根针断裂力(图3I),20% SiIMA T-MN可承受超0.4 N力,能刺入纤维环表层。为验证T-MN贴片粘附效果,进行剥离实验(图3J),T-MN贴片最大剥离粘附力为0.47 N,是无微结构贴片的1.6倍。
验证外泌体和EXO@miR-378表征,通过超声震荡法将miR-378加载到外泌体中。超声震荡法使外泌体膜轻微形变(图3K),外泌体尺寸约100 nm(图3L),表面蛋白CD81和TSG101阳性,阴性蛋白Calnexin未表达,证明外泌体纯度(图3M)。将EXO@miR-378与DID染料溶液共染色1小时后,与T-MN针尖部分孵育24小时,共聚焦显微镜扫描显示EXO@miR-378吸附在T-MN表面(图3N)。研究人员成功构建适应纤维环结构并携带EXO@miR-378的T-MN@EXO@miR-378系统。
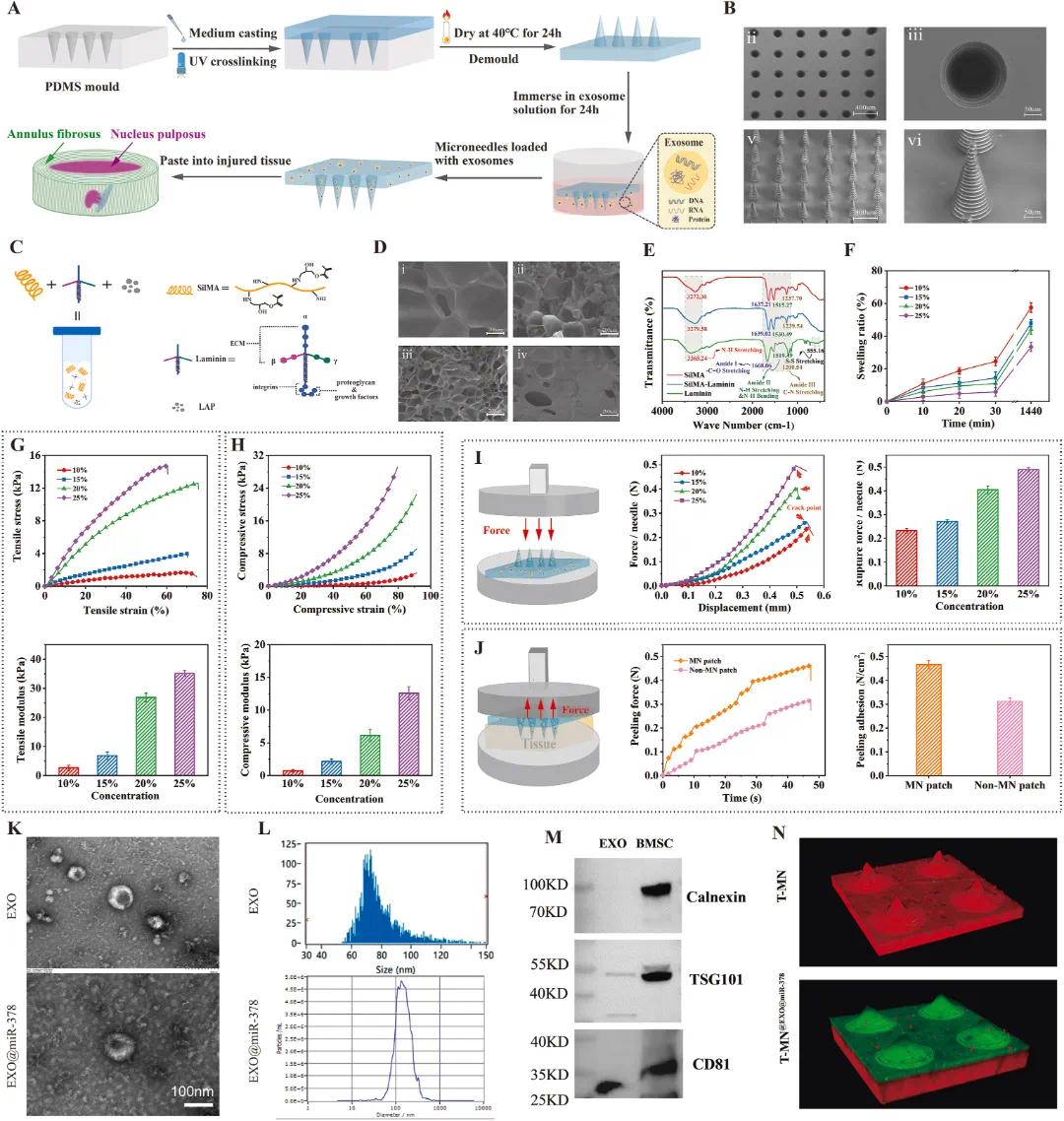
图3 T-MN@EXO@miR−378的制备和表征。(A)制备程序;(B)(i)PDMS模具微孔SEM图像,(ii)单个微孔SEM图像,(iii)miR−378处T-MN@EXO的SEM图像,(iv)单个T-MN@EXO@miR−378的SEM图像;(C)SilMA-层粘连蛋白水凝胶溶液制备;(D)不同浓度(i)10%,(ii)15%,(iii)20%,(iv)25%的SilMA水凝胶微观孔SEM图像;(E)SilMA、层粘连蛋白和SilMA-层粘连蛋白的FTIR光谱;(F)不同浓度SilMA水凝胶随时间的溶胀率;(G)不同浓度SilMA水凝胶的拉伸应力-应变曲线和模量;(H)不同浓度SilMA水凝胶的压缩应力应变曲线和模量;(I)不同浓度SilMA水凝胶单根微针的力-位移曲线和断裂力;(J)具有T-MN结构和不具有MN结构的贴片的剥离力和剥离粘附力;(K)外泌体(EXO)和EXO@miR-378的TEM分析;(L)外泌体和EXO@miR-378的NTA分析;(M)通过蛋白质印迹法对钙调蛋白、TSG 101和CD 81的外泌体表征;(N)T-MN和T-MN@EXO@miR−378的荧光图像(红色:T-MN;绿色:外泌体)
(3)T-MN@EXO@miR-378调控细胞外基质代谢和纤维环细胞迁移
将T-MN@EXO@miR-378倒置于培养基中,使EXO@miR-378释放并被纤维环细胞摄取(图4A)。分别用T-MN、T-MN@EXO和T-MN@EXO@miR-378预处理纤维环细胞后与IL-1β共培养24小时。结果显示,T-MN@EXO组使纤维环细胞MMP13表达降低42%,T-MN@EXO@miR-378组降低49%(图4B),表明二者均能抑制细胞对细胞外基质的降解。T-MN@EXO和T-MN@EXO@miR-378分别使Col I表达增加72%和150%(图4C),证明T-MN@EXO@miR-378在退变环境下促进细胞外基质合成的能力优于T-MN@EXO,免疫荧光检测结果一致(图4D和E)。为验证T-MN@EXO@miR-378对纤维环细胞迁移的影响,在培养皿底部划线模拟细胞缺损,观察12小时和24小时后细胞迁移距离。结果显示,T-MN@EXO和T-MN@EXO@miR-378组迁移距离较IL-1β组增加近三倍(迁移率提高35%)(图4F-H)。
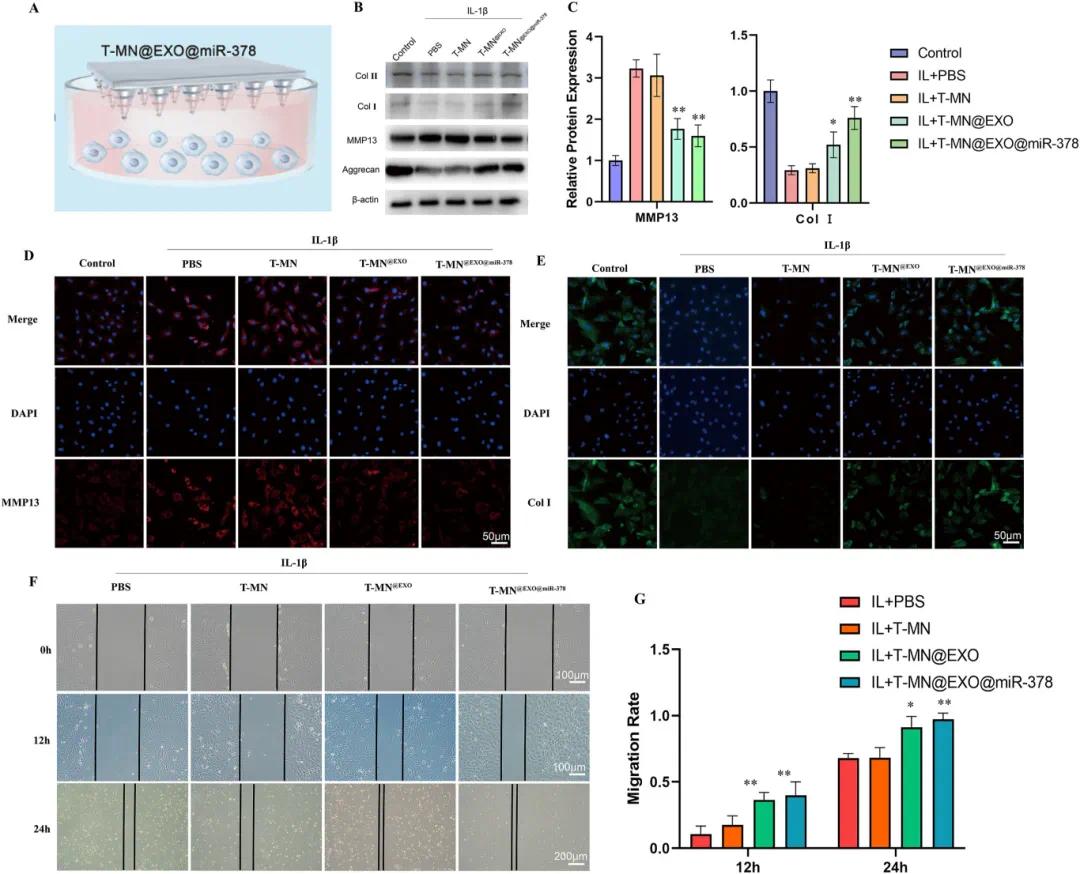
图4 T-MN@EXO@miR−378对细胞外基质(ECM)合成与分解及纤维环(AF)细胞迁移的影响。(A)T-MN@EXO@miR−378对AF细胞作用的示意图;(B)各组Col I、Col II、聚集蛋白聚糖和MMP13的蛋白表达;(C)Col I和MMP13蛋白表达的定量分析;(D)各组MMP13的荧光图像;(E)各组IL-1β刺激后Col I的荧光图像;(F)各组的迁移实验;(G)各组12小时和24小时迁移率的定量分析,数据以均数±标准差(n=3)表示,与IL-1β+PBS组相比,*p<0.05,**p<0.01
(4)T-MN@EXO@miR-378促进纤维环细胞线粒体自噬
采用JC-1试剂盒检测发现,T-MN@EXO使退变纤维环细胞JC-1聚集体/单体比值提高275%,T-MN@EXO@miR-378可恢复至对照组水平的92%(图5A)。线粒体形态观察显示,退变纤维环细胞线粒体嵴空泡化,T-MN@EXO@miR-378处理后部分恢复至正常形态(图5C)。Western blot结果显示,T-MN@EXO@miR-378使线粒体自噬抑制蛋白p62和PINK1表达降低,促进蛋白Fundc1表达增加(图5B)。免疫荧光染色显示,T-MN@EXO和T-MN@EXO@miR-378均降低p62蛋白表达水平(图5D),增加LC3蛋白表达水平(图5E)。研究还发现,T-MN@EXO@miR-378通过PDK1-Akt通路影响自噬激活(图5F),可降低PDK和pAkt蛋白表达水平,促进FoxO1和FoxO3蛋白表达(图5G)。
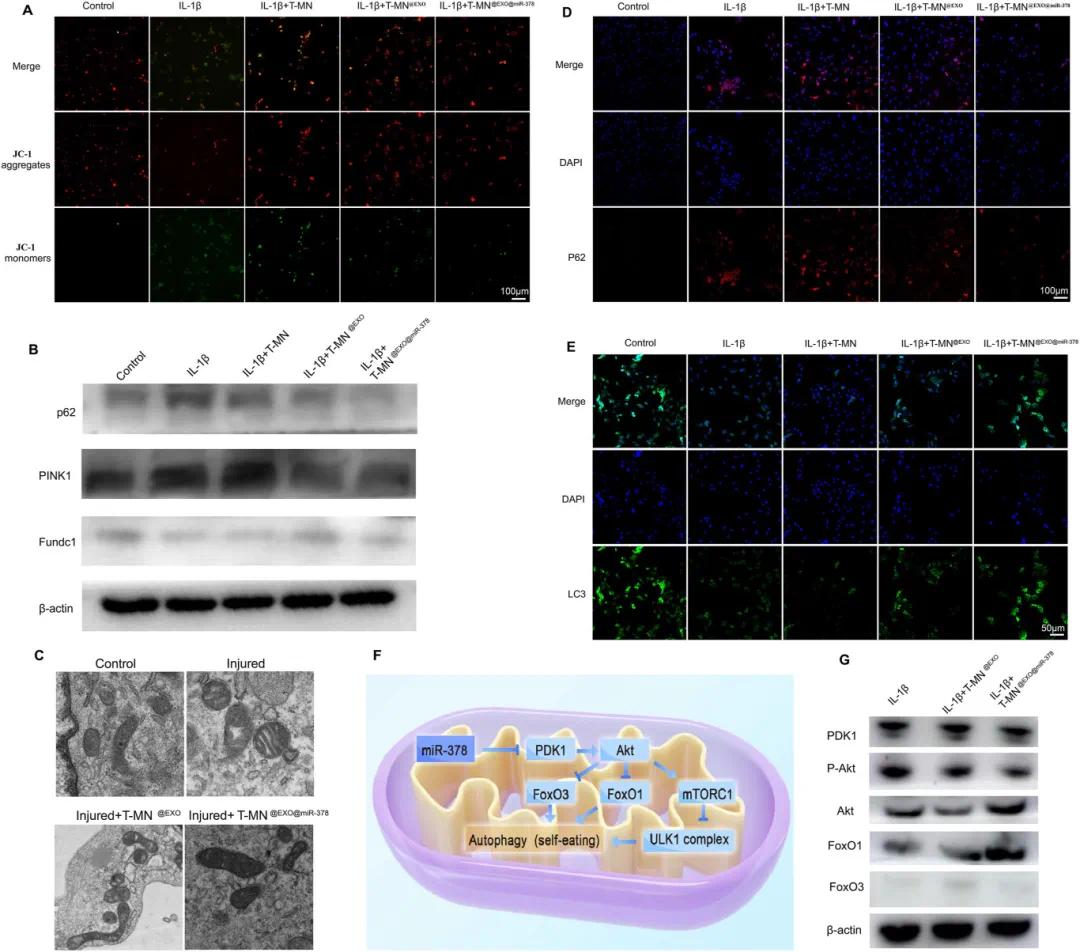
图5 T-MN@EXO@miR−378对AF细胞线粒体自噬和功能的影响。(A)各组JC-1荧光图;(B)各组p62、PINK1、Fundc1蛋白表达;(C)各组线粒体透射电镜观察;(D)各组IL-1β刺激后p62的荧光图像;(E)各组IL-1β刺激后LC3的荧光图像;(F)miR-378恢复自噬途径的示意图;(G)各组PDK1、p-Akt、Akt、FoxO1、FoxO3蛋白表达,数据以均数±标准差(n=8)表示,与对照组相比,*p<0.05,**p<0.01
(5)T-MN@EXO@miR-378持续释放EXO@miR-378促进纤维环修复的体内研究
在大鼠尾椎节段建立纤维环损伤模型,分别给予T-MN、T-MN@EXO和T-MN@EXO@miR-378处理后进行肌皮缝合(图6A和B)。结果显示,受损椎间盘高度随时间降低,术后4周T-MN@EXO@miR-378组椎间盘高度指数(DHI%)较损伤组保留率提高28%,8周时优势更显著(图6D-E)。大体观察显示T-MN@EXO@miR-378组椎间盘形态保持最佳(图6F)。DID荧光标记检测外泌体缓释特性,负载层粘连蛋白的T-MN组第1天外泌体滞留能力显著,7天后含量仍高于无层粘连蛋白组(图6G)。安全性评估显示,T-MN@EXO@miR-378长期滞留未引起心、肝、脾、肾等器官炎症反应(图6H),血液生化指标检测表明该治疗系统对重要器官功能无显著影响(图6I)。
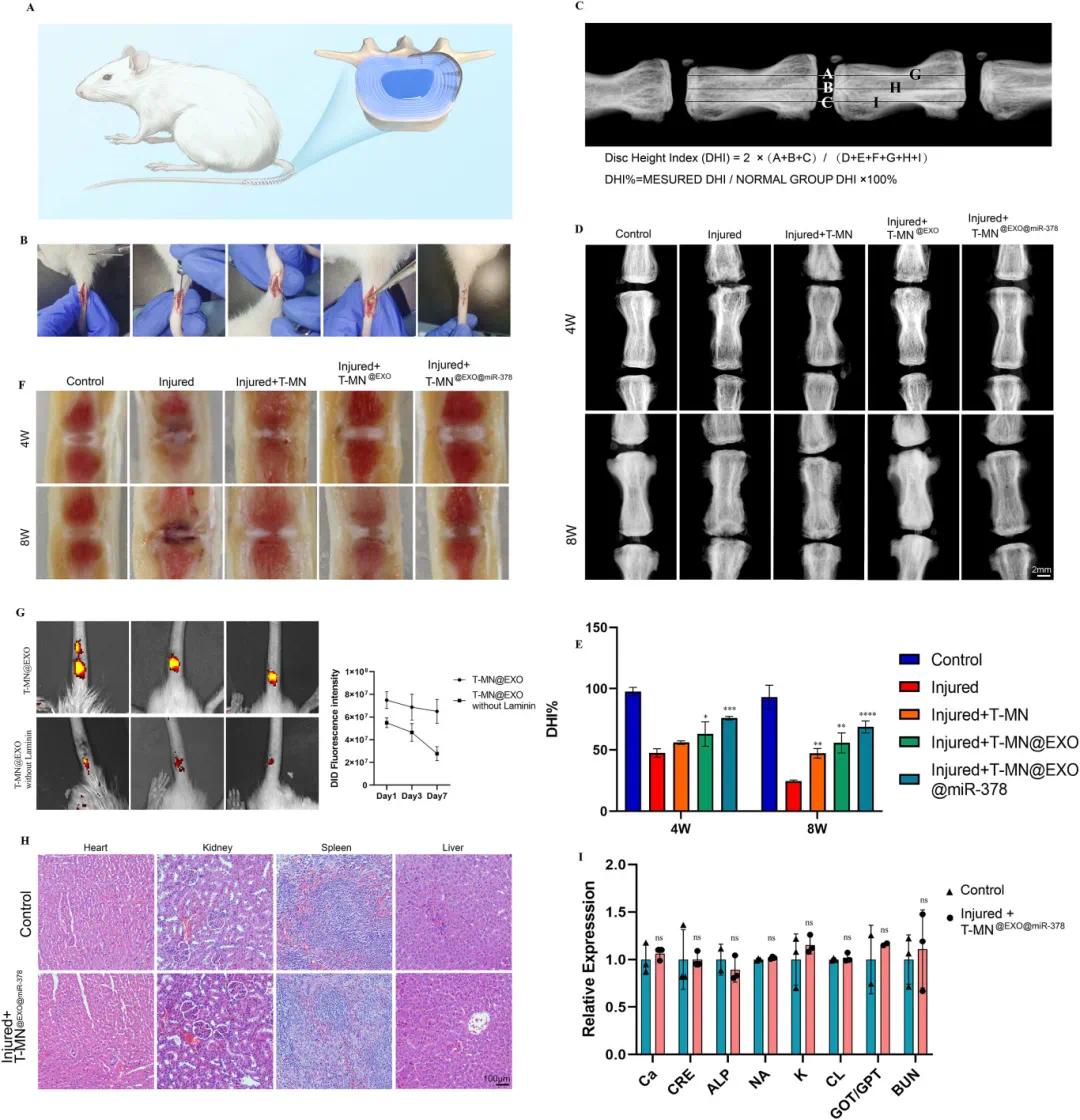
图6 T-MN@EXO@miR−378对椎间盘高度的保护作用及体内外泌体释放特性。(A)大鼠椎间盘退变(IVDD)修复中T-MN@EXO@miR−378的示意图;(B)手术示意图;(C)椎间盘高度指数(DHI)的计算方法;(D)各组4周和8周时的椎间盘X线图像;(E)4周和8周时DHI的评估;(F)各组椎间盘的外观视图;(G)DID标记的外泌体在第1、3、7天的体内外泌体荧光强度;(H)对照组和T-MN@EXO@miR−378组的心脏、肾脏、脾脏和肝脏的HE染色图像;(I)血生化指标(Ca、CRE、ALP、Na、K、Cl、GOT/GPT、BUN)与对照组的相对表达
(6)T-MN@EXO@miR-378恢复纤维环细胞外基质稳态和线粒体自噬的体内研究
对各组进行苏木精-伊红(HE)和番红O-固绿(SO)染色。组织学分析显示,SO染色中T-MN@EXO@miR-378组能更好地保护内层纤维环和髓核的软骨成分(红色区域)(图7A),HE染色结果显示各组椎间盘状态的变化(图7B)。免疫组化(IHC)染色分析证实,损伤组中线粒体自噬促进蛋白(Fundc1、Parkin)表达较低,而线粒体自噬抑制蛋白(PINK1)表达较高,T-MN@EXO@miR-378能促进线粒体自噬促进蛋白的表达,同时抑制线粒体自噬抑制蛋白的表达,从而调节ECM稳态(图7C和D)。在Fundc1基因敲除(KO)小鼠中建立椎间盘穿刺模型,结果显示,纤维环受损的Fundc1 KO小鼠的线粒体自噬功能受损更严重,ECM损伤也更显著(图7E和F)。
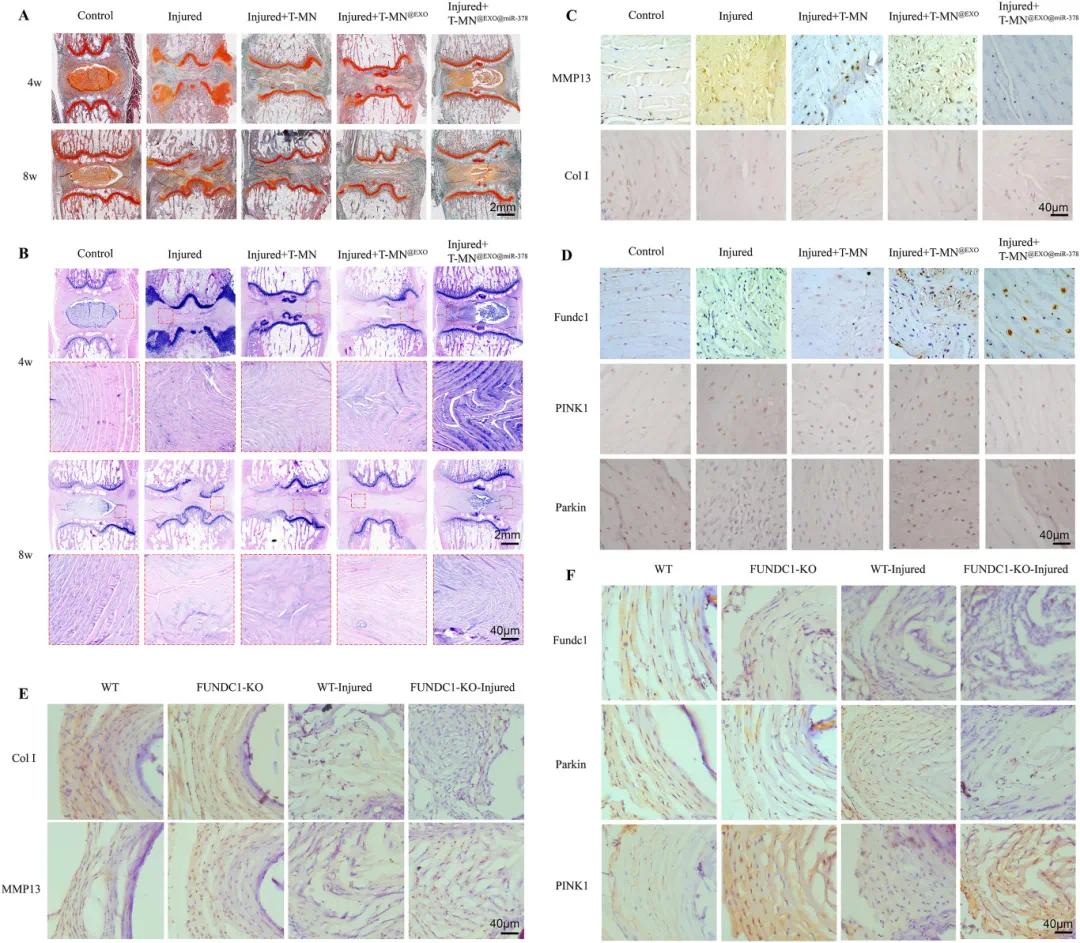
图7 T-MN@EXO@miR−378对ECM合成、分解及体内线粒体自噬的影响。(A)各组番红O染色图像;(B)各组HE染色图像;(C)各组MMP13和Col I的免疫组化检测;(D)各组Fundc1、Parkin和PINK1的免疫组化检测;(E)WT、FUNDC1 KO、WT-损伤和FUNDC1-KO-损伤组的MMP13和Col I的免疫组化检测;(F)WT、FUNDC1-KO、WT-损伤和FUNDC1-KO-损伤组的Fundc1、Parkin和PINK1的免疫组化检测
本研究开发的螺纹微针系统(T-MN@EXO@miR-378)通过3D打印的螺纹微针负载miR-378修饰的外泌体,匹配纤维环结构,恢复线粒体自噬功能(调控PDK1-Akt通路),显著改善细胞外基质稳态。动物模型证实该系统能长期维持椎间盘高度且无毒性,突破了椎间盘药物递送障碍,为椎间盘退变的非手术治疗提供了新策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

