
全球人口老龄化趋势的加剧导致慢性非愈合性伤口的流行率显著上升,这些伤口已成为导致残疾的主要因素,并对医疗体系构成沉重负担。糖尿病伤口作为慢性难愈性伤口的典型代表,其复杂病理机制涉及微血管病变导致的血液供应不足、持续性炎症微环境引发的氧化应激,以及反复感染形成的恶性循环,使得糖尿病伤口的修复面临“炎症-纤维化”困难,难以突破现有治疗手段的瓶颈。
生物工程皮肤替代品、高压氧治疗、干细胞疗法和外泌体治疗虽展现出一定潜力,但高昂成本与临床转化的不确定性限制了其广泛应用。传统清创术与敷料管理虽仍是主流方案,但其被动修复模式难以主动调控免疫微环境,难以从根本上解决微循环障碍与炎症失控问题。

针对上述问题陆军军医大学张庆/罗高兴团队从大鲵皮肤分泌物中提取糖胺聚糖(SAGs),开发了基于SAGs的复合微球(Gel-SAGs MPs),并揭示了SAGs如何通过调控巨噬细胞的代谢重编程来促进糖尿病伤口愈合。该文章于2025年02月18日以《Andrias davidianus Derived Glycosaminoglycans Direct Diabetic Wound Repair by Reprogramming Reparative Macrophage Glucolipid Metabolism》为题发表于《Advanced Materials》(DOI:10.1002/adma.202417801)。
(1)SAGs通过促进血管生成促进糖尿病伤口愈合
图1A展示了从大鲵皮肤分泌物中提取糖胺聚糖(SAGs)的过程,并通过化学分析鉴定其独特的结构。体外实验验证了SAGs对内皮细胞增殖和管状形成的影响,发现其能显著促进血管生成。图1B表明,在糖尿病小鼠模型中,SAGs组的伤口愈合率显著高于SSAD蛋白组和对照组。具体而言,SAGs组在伤后第7天的愈合率为40.13 ± 7.12%,第10天为68.2 ± 2.97%,而SSAD蛋白组和对照组的愈合率显著较低。图1C-D的H&E染色和Masson染色结果显示,SAGs组在第10天表现出更厚的表皮层(图1F)、更高的胶原沉积量(图1G)以及更完整的再上皮化,而SSAD蛋白组和对照组的伤口修复不完全,胶原沉积稀疏,再上皮化不充分。图1E的免疫荧光染色显示,SAGs组在第7天的CD31(红色)和α-SMA(绿色)表达显著增加,表明新生血管形成更为显著(图1H)。图1I-J的单糖组成和1H NMR分析进一步确认了SAGs的结构特征。
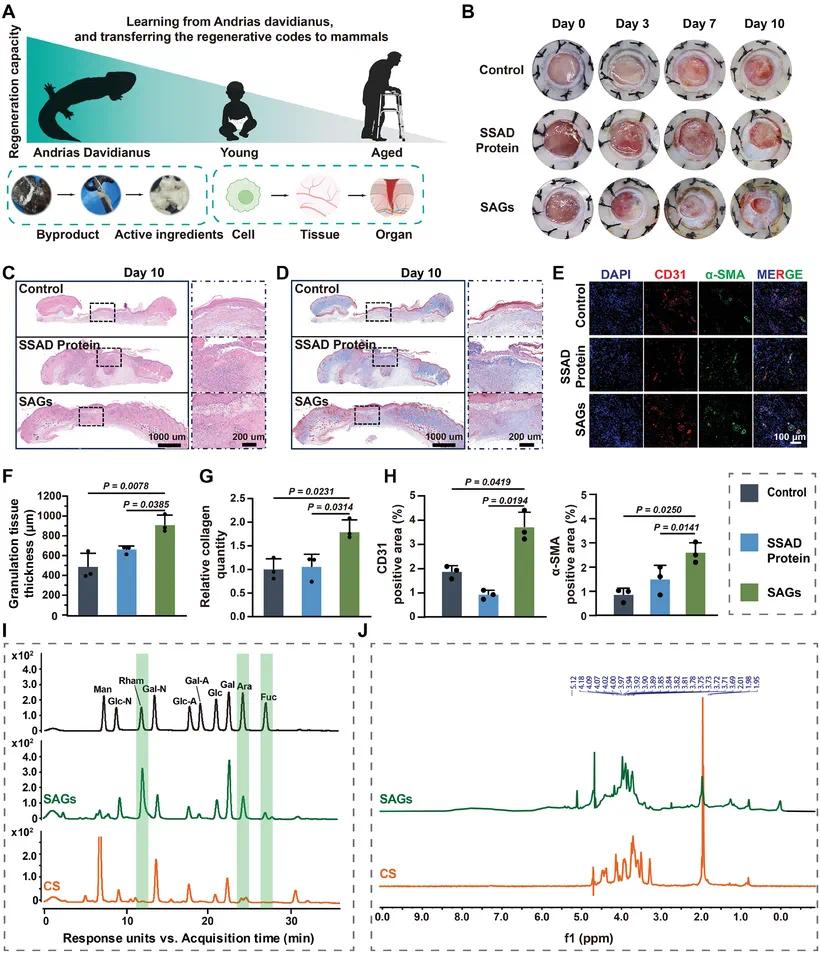
图1 大鲵再生信号的转化应用及糖尿病伤口修复效果评估。(A)从大鲵学习并转移再生密码至哺乳动物组织再生与修复;(B)不同治疗组糖尿病伤口照片(不同天数);(C)HE 染色;(D)Masson 染色;(E)免疫荧光染色;(F)上皮层厚度;(G)胶原沉积量;(H)CD31 和 α-SMA 表达量;(I)单糖组成;(J)¹H NMR 分析
(2)SAGs诱导修复性巨噬细胞极化促进血管生成和创面愈合
单细胞转录组测序(图2A)显示,在糖尿病伤口中,巨噬细胞是主要的细胞类型,并且SAGs处理显著增加了修复性巨噬细胞亚群(Arg1+/IL10+/S100a4+)的比例,同时减少了炎症性巨噬细胞亚群(Nos2+/IL6+/Cd68+)的比例。图2B的细胞间通讯分析表明,巨噬细胞与内皮细胞之间存在密切的相互作。图2C-2D的基因表达分析显示,在SAGs处理后,糖尿病伤口中炎症相关基因(如Nos2和IL6)的表达被抑制,而修复性基因(如Arg1和IL10)的表达显著上调。共培养实验(图2E-2F)表明,SAGs显著增强了巨噬细胞刺激内皮细胞形成管状结构的能力,且这种作用在0.1 mg/mL的SAGs浓度下达到最佳效果。图2G进一步证实了SAGs在不同浓度下对IL-6、IL-10和VEGF表达的影响,表明0.1 mg mL−1是促进修复的最佳浓度。免疫荧光分析(图2H-2I)显示,与LPS/IFNγ组相比,SAGs刺激显著增加了抗炎巨噬细胞(ARG1+)的比例,同时减少了炎症性巨噬细胞(NOS2+)的比例。RT-qPCR分析(图2J)确认了SAGs对巨噬细胞极化的调控作用,表现为炎症标志物(NOS2和IL6)的下调和抗炎及修复性细胞因子(IL10、ARG1和VEGFA)的上调。这些结果共同表明,SAGs通过促进巨噬细胞从炎症表型向修复表型转变,从而诱导血管生成并加速糖尿病伤口愈合(图2K)。
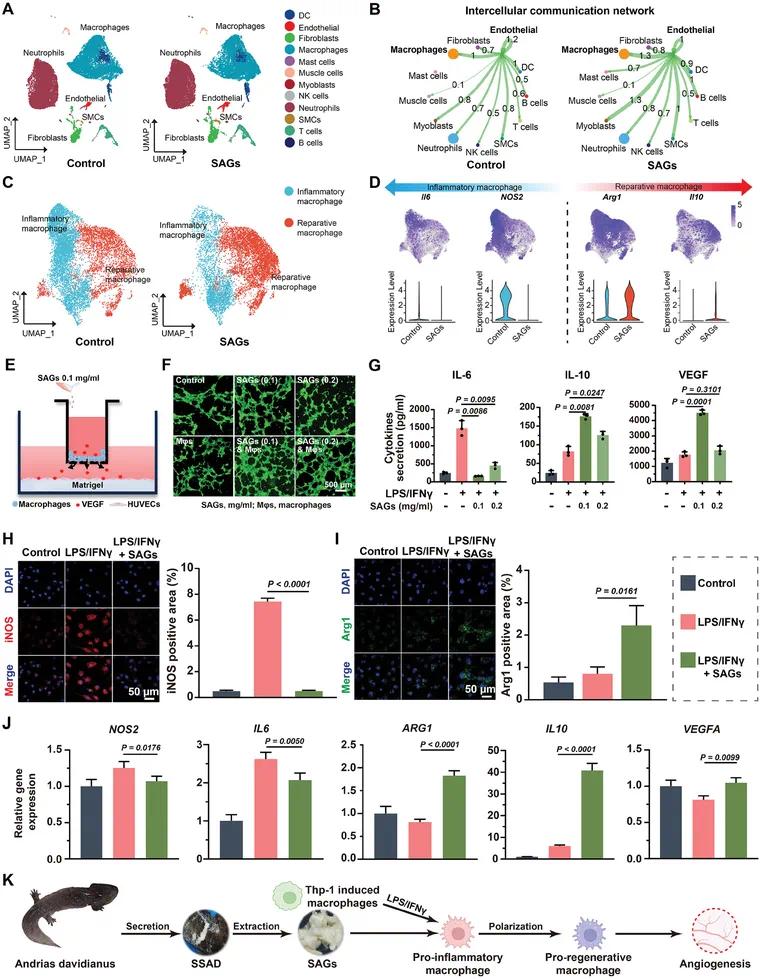
图2 SAGs诱导的血管生成与巨噬细胞状态转变。(A)scRNA-seq;(B)内皮细胞与其他细胞群体的配体-受体相互作用强度;(C)糖尿病伤口中炎性和修复性巨噬细胞亚群(不同处理);(D)炎性和修复性基因表达;(E)巨噬细胞与HUVEC共培养示意图;(F)成管图像;(G)SAG浓度对巨噬细胞IL-6/IL-10/VEGFA表达的影响;(H, I)不同处理后iNOS+(H)和Arg-1+(I)巨噬细胞表型的荧光图像及定量分析;(J)不同巨噬细胞表型标志物基因的RT-qPCR分析;(K)SAGs通过促进巨噬细胞状态转变促进血管生成
(3)SAGs引导代谢适应协调巨噬细胞的表型转变
韦恩图分析(图3A)显示,与LPS/IFNγ组相比,LPS/IFNγ + SAGs组的差异表达基因(DEGs)显著变化,表明SAGs处理对巨噬细胞的基因表达具有广泛影响。热图(图3B)进一步揭示了SAGs处理后,与炎症相关的基因(如NLRP3、IL1β、IL6等)表达下调,而与脂质代谢和修复相关的基因(如CD36、PPARG等)表达上调。图3C和3D的相对表达量分析显示,SAGs显著抑制了糖酵解相关基因(HK1、HK2、PFKP、GLUT1等)的表达,同时增强了脂质代谢相关基因的表达。KEGG通路分析(图3E和3F)表明,SAGs处理显著下调了炎症信号通路(如NOD样受体、TNF、Toll样受体等),并上调了脂质代谢相关通路(如脂肪消化与吸收、PPAR信号通路等)。基因集富集分析(GSEA)结果(图3G–K)进一步证实了SAGs对糖酵解/糖异生、脂肪酸代谢和mTOR信号通路的显著影响,表明SAGs通过代谢重编程促进巨噬细胞从炎症表型向修复表型转变。
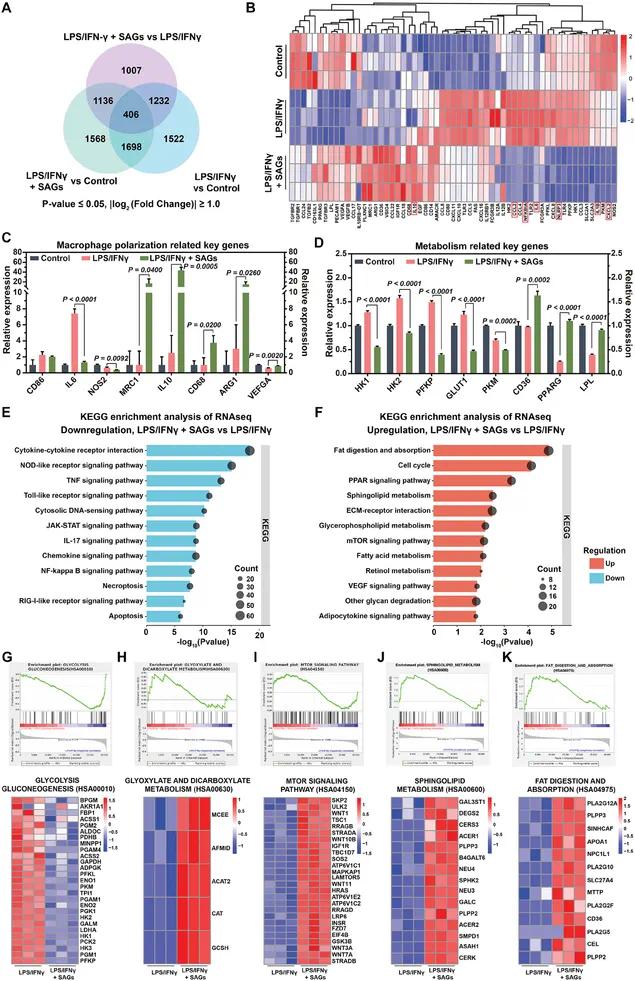
图3 SAGs诱导巨噬细胞炎症和代谢模式的改变。(A)韦恩分析;(B)基因热图;(C)巨噬细胞极化关键基因表达;(D)代谢相关基因表达;(E)LPS/IFNγ + SAG组下调的KEGG途径分析;(F)LPS/IFNγ + SAG组上调的KEGG途径分析;(G-K)糖酵解/糖异生、乙醛酸和二羧酸代谢、mTOR信号传导、鞘脂代谢、脂肪消化吸收途径的GSEA及核心富集符号热图
RT-qPCR分析(图4A)显示,与LPS/IFNγ刺激组相比,SAGs处理显著抑制了糖酵解相关基因(HK1、HK2、PFKP和GLUT1)的表达,同时显著增强了脂质代谢相关基因(PPARG)的表达。Western blotting分析(图4B)进一步确认了代谢相关蛋白表达的变化,表明SAGs处理促进了巨噬细胞向氧化代谢的转变。实时测量巨噬细胞外酸化(图4C)显示,与LPS/IFNγ刺激的巨噬细胞相比,LPS/IFNγ + SAGs处理组的细胞外酸化率降低,证实了代谢向氧化代谢的转变。流式细胞术(图4D和4E)显示,PPARγ抑制剂GW9662逆转了SAGs促进骨髓来源巨噬细胞(BMDMs)从炎症表型向修复表型转变的效果。Seahorse通量分析(图4F)进一步表明,SAGs增强了巨噬细胞的线粒体氧化磷酸化,增加了基础和最大氧耗率(OCR),而GW9662显著逆转了这种增加。RT-qPCR(图4G)和Western blotting分析(图4H)证实了PPARγ敲低后,SAGs介导的Arg1上调和Nos2下调显著减弱,表明PPARγ在SAGs诱导的巨噬细胞极化中发挥关键作用。
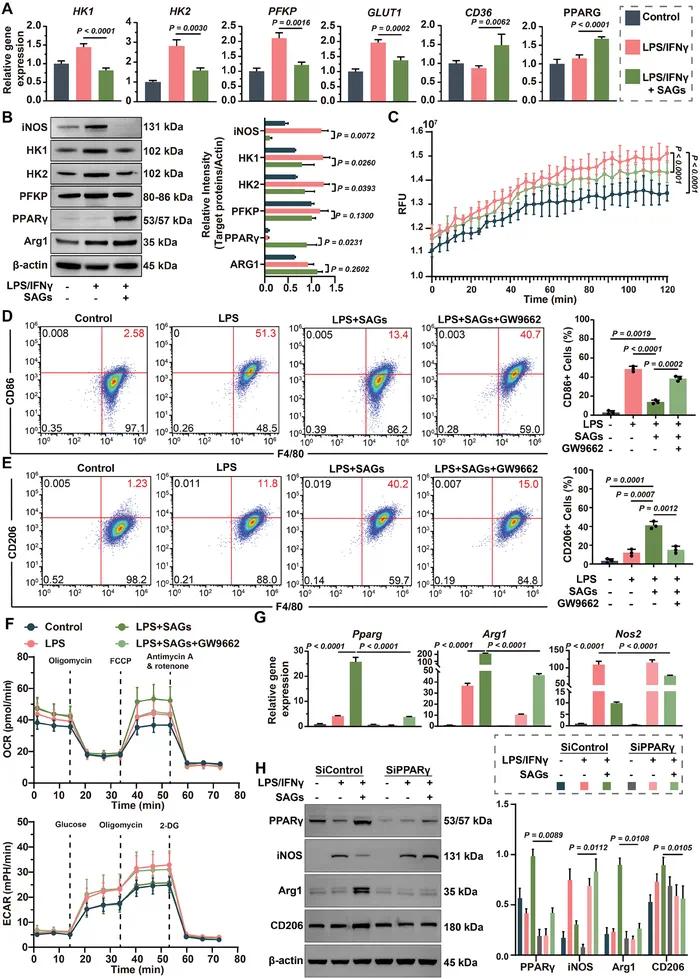
图4 SAG 通过代谢重编程将巨噬细胞群从促炎状态转变为抗炎和促再生状态。(A)参与糖脂代谢的关键基因的 RT-qPCR 分析;(B)WB 分析相关蛋白表达水平;(C)细胞外酸化的实时测量;(D,E)不同处理的骨髓来源的巨噬细胞(BMDM)中 CD68(D)和 CD206(E)的流式细胞分析和定量;(F)不同处理的 BMDM 中细胞代谢的海马通量分析;(G)PPARγ 敲低 BMDM 中 Pparg、Arg-1 和 Nos-2 的 RT-qPCR 分析;(H)PPARγ 敲低 BMDM 中 CD206、Arg-1、iNOS 和 PPARγ 的 WB 分析
(4)SAGs对糖尿病伤口的修复
图 5A 的示意图展示了通过微流控方法制备 Gel-SAGs MPs 的过程,成功将 GelMA 和 SAGs 结合。图 5B 的 FTIR 结果确认 GelMA 与 SAGs 之间形成了酰胺键,且 Gel-SAGs MPs 的酰胺 II 与酰胺 I 比值显著高于单独的 SAGs 或 GelMA。图 5C 的 zeta 电位分析显示 Gel-SAGs MPs 的 zeta 电位值为 −6.41 ± 5.31 mV,介于未改性 GelMA(−0.46 ± 1.07 mV)和 SAGs(−21.46 ± 2.47 mV)之间,表明其具有负电荷特性,有利于与正电荷蛋白相互作用。图 5D 的 SEM 图像显示 Gel-SAGs MPs 保留了与 GelMA MPs 相似的完整多孔结构,平均粒径为 325 ± 14 μm,孔径在 5 到 10 μm 之间,且更均匀。图 5E 和 5F 的降解行为分析表明,Gel-SAGs MPs 在 48 小时后开始破坏球体完整性,72 小时内累积释放 SAGs 达约 80%,降解率逐渐达到 50%,其降解行为与 SAGs 释放密切相关。图 5G 展示了 Gel-SAGs MPs 在大鼠皮下植入模型中的降解情况,与壳聚糖粉末(CHP)相比,Gel-SAGs MPs 在第 10 天几乎完全降解,降解周期与理想伤口愈合时间一致。图 5H 的 H&E 染色显示 Gel-SAGs MPs 处理的组织中炎症细胞逐渐减少,表明其具有较低的炎症反应。图 5I 的肝脏创伤模型显示 Gel-SAGs MPs 显著缩短了止血时间(71.33 ± 8.02 秒)并减少了血液损失(205.93 ± 22.24 毫克),与商业壳聚糖粉末(CHP)相当。图 5J 的 H&E 染色图像进一步证实了 Gel-SAGs MPs 在促进肝脏损伤修复方面的有效性。图 5K 的免疫荧光分析显示,与 CHP 和其他对照组相比,Gel-SAGs MPs 显著降低了 CD11b+ 巨噬细胞和中性粒细胞的表达,表明其具有抗炎特性。这些结果表明,Gel-SAGs MPs 作为一种新型伤口愈合增强剂,具有良好的生物相容性、生物降解性和止血性能,能够有效调节炎症反应,促进组织修复。
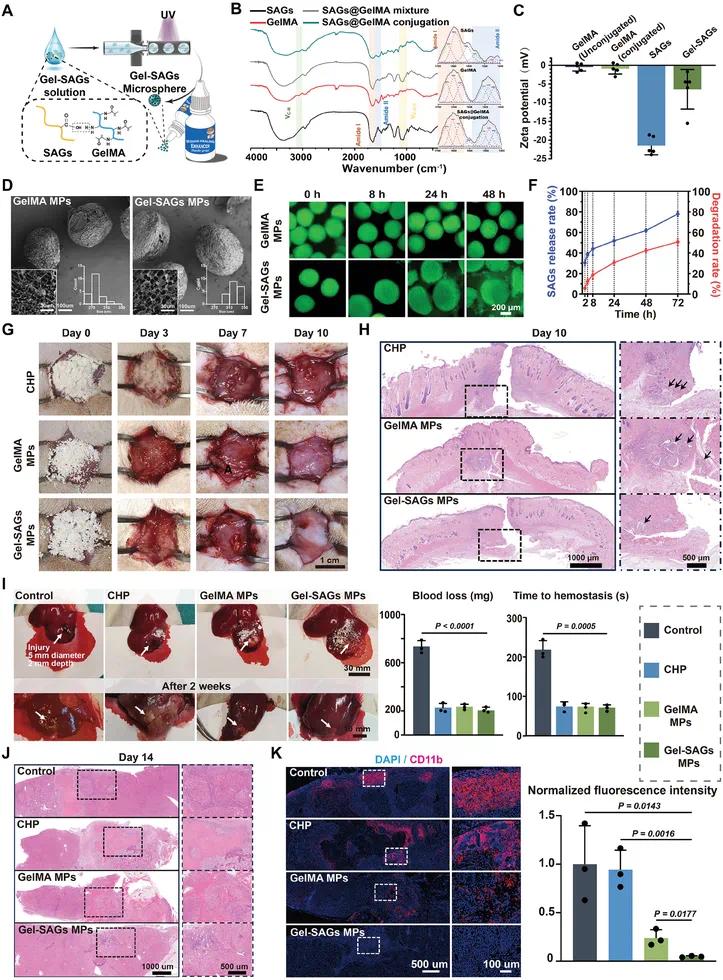
图5 基于SAGs的伤口愈合促进剂的构建与表征。(A)微流控方法制备Gel-SAGs MP;(B)FTIR光谱;(C)电位;(D)SEM图像;(E, F)SAG释放与GelMA-SAG降解的定性和定量分析;(G)Gel-SAGs MP在大鼠皮下植入模型中的降解图像;(H)H&E染色;(I)肝创伤模型中出血的定量分析;(J)H&E;(K)免疫荧光
图 6A 的 ELISA 分析显示 Gel-SAGs MPs 对炎症趋化因子 MCP-1、IL-6 和 IL-8 具有较强的亲和力,能够有效捕获这些因子。图 6B 的巨噬细胞迁移实验进一步证实了 Gel-SAGs MPs 的这种能力,其显著减少了 MCP-1 诱导的巨噬细胞迁移(p = 0.0445),与阳性对照组相比,迁移减少更为显著(p = 0.0016)。图 6C 的免疫荧光图像显示,在皮下植入后的第 3 天,Gel-SAGs MPs 周围和内部有显著的炎症细胞浸润,但到了第 7 天,这种浸润减少,且巨噬细胞表现出抗炎表型(Arg1+),表明 Gel-SAGs MPs 能够促进巨噬细胞从炎症状态向抗炎和修复状态转变。
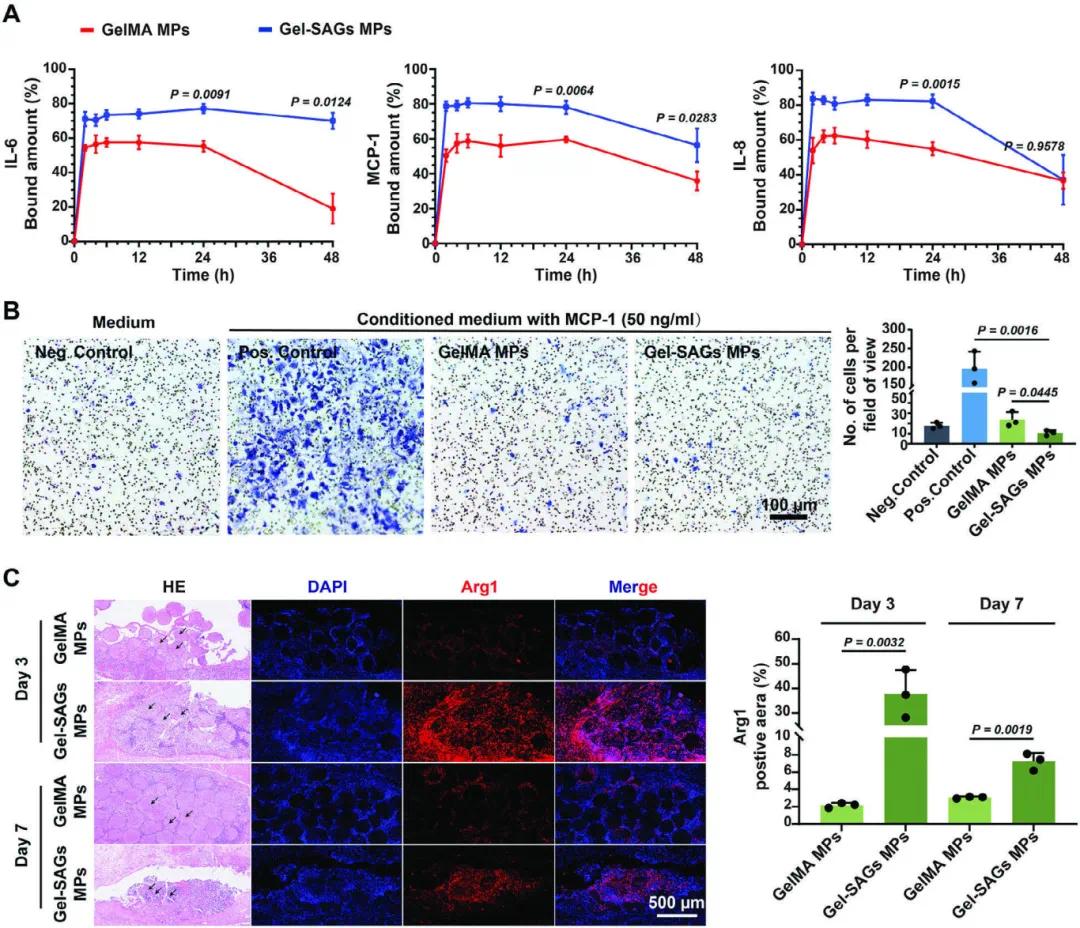
图6 Gel-SAGs MPs 通过与炎症趋化因子和巨噬细胞相互作用来募集并促进炎症转化。(A)ELISA 定量分析;(B)巨噬细胞迁移评估;(C)第3天和第7天由皮下包埋的微球募集的抗炎巨噬细胞(Arg-1⁺)的荧光图像及定量分析
(5)Gel-SAGs MPs通过效应控制、炎症微环境调节和血管化促进糖尿病伤口愈合
图7A总结了Gel-SAGs MPs在糖尿病伤口愈合中的多方面作用,包括快速止血、分泌物管理以及激活内源性修复阶段,显著改善了糖尿病伤口的愈合过程。图7B的代表性数字图像显示,与对照组、GelMA MPs和商业壳聚糖粉末(CHP)相比,Gel-SAGs MPs处理组在伤后第14天的伤口闭合率最高,达到86.41 ± 3.69%,显著高于其他组。图7C的定量分析进一步证实了这一结果,表明Gel-SAGs MPs在所有观察时间点均显著促进伤口闭合。图7D的实时血流灌注图像显示,Gel-SAGs MPs显著改善了伤口区域的血流供应,这对于糖尿病伤口的慢性愈合至关重要。图7E和7F的H&E和Masson染色结果表明,Gel-SAGs MPs显著促进了肉芽组织的形成和增厚。
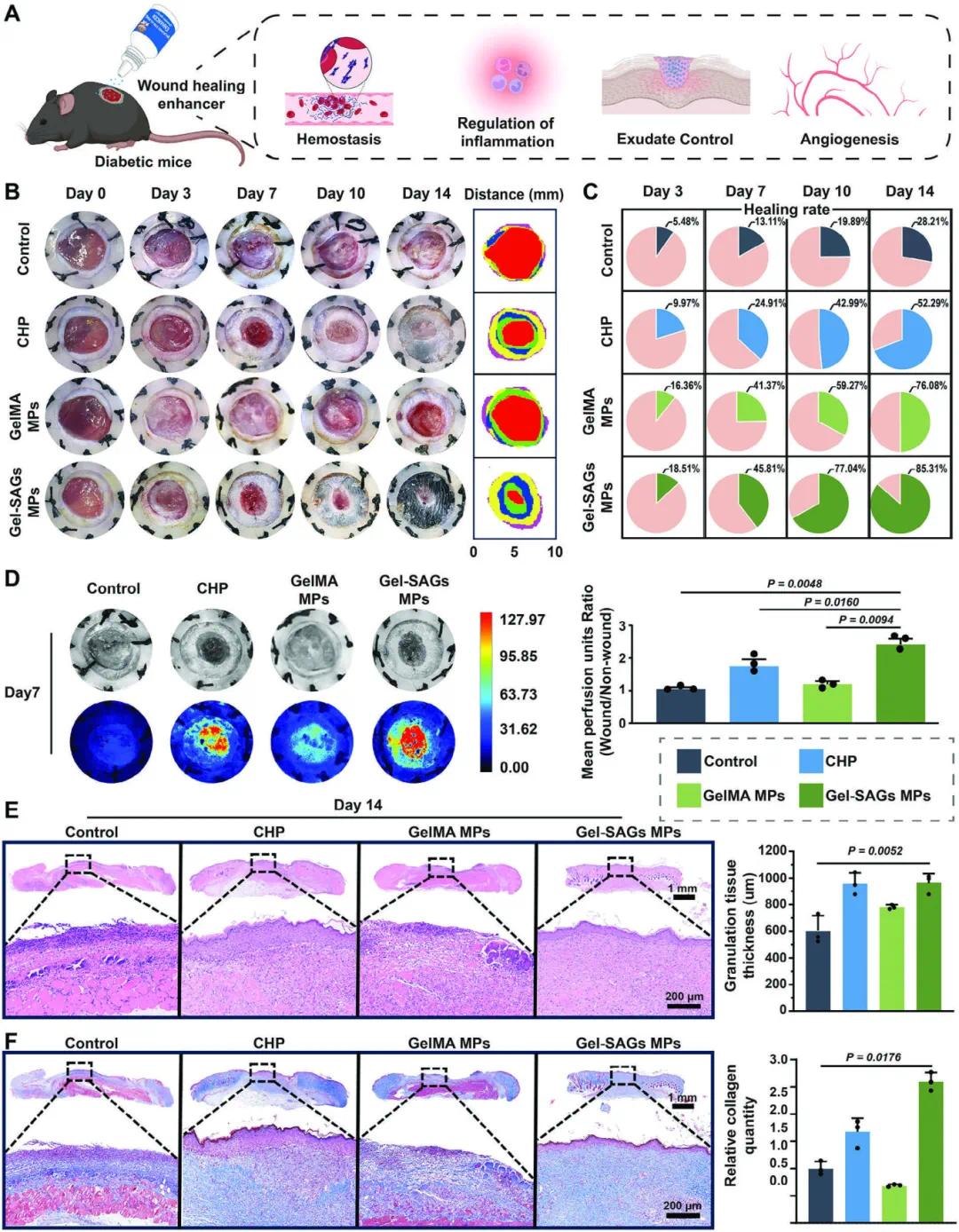
图7 基于 SAGs 的伤口愈合促进剂可促进糖尿病小鼠的伤口修复。(A)Gel-SAGs MP 对慢性伤口愈合的多方面影响;(B)第 0、3、7 和 10 天不同处理后的伤口图像;(C)第 3、7 和 10 天不同处理下的伤口愈合情况;(D)第 7 天伤口中血流的图像及定量分析;(E)H&E 染色及定量分析;(F)Masson 染色及定量分析
图8A和8B的免疫荧光图像显示,在伤后第3天,Gel-SAGs MPs处理组的炎症巨噬细胞标志物iNOS的荧光强度较低(图8D),而抗炎巨噬细胞标志物CD206的荧光强度较高(图8E),表明Gel-SAGs MPs促进了巨噬细胞从炎症表型向抗炎表型的转变。图8C和8F的CD31和α-SMA免疫荧光染色显示,在伤后第7天和第10天,Gel-SAGs MPs组的新生血管形成显著增加。图8G和8H的天狼星红染色和α-SMA免疫荧光分析显示,在伤后第21天,Gel-SAGs MPs处理的伤口中,胶原纤维网络特征更接近正常皮肤,表现为胶原纤维更短、排列更随机,且α-SMA+成纤维细胞数量显著减少,表明Gel-SAGs MPs减少了纤维化和瘢痕形成。
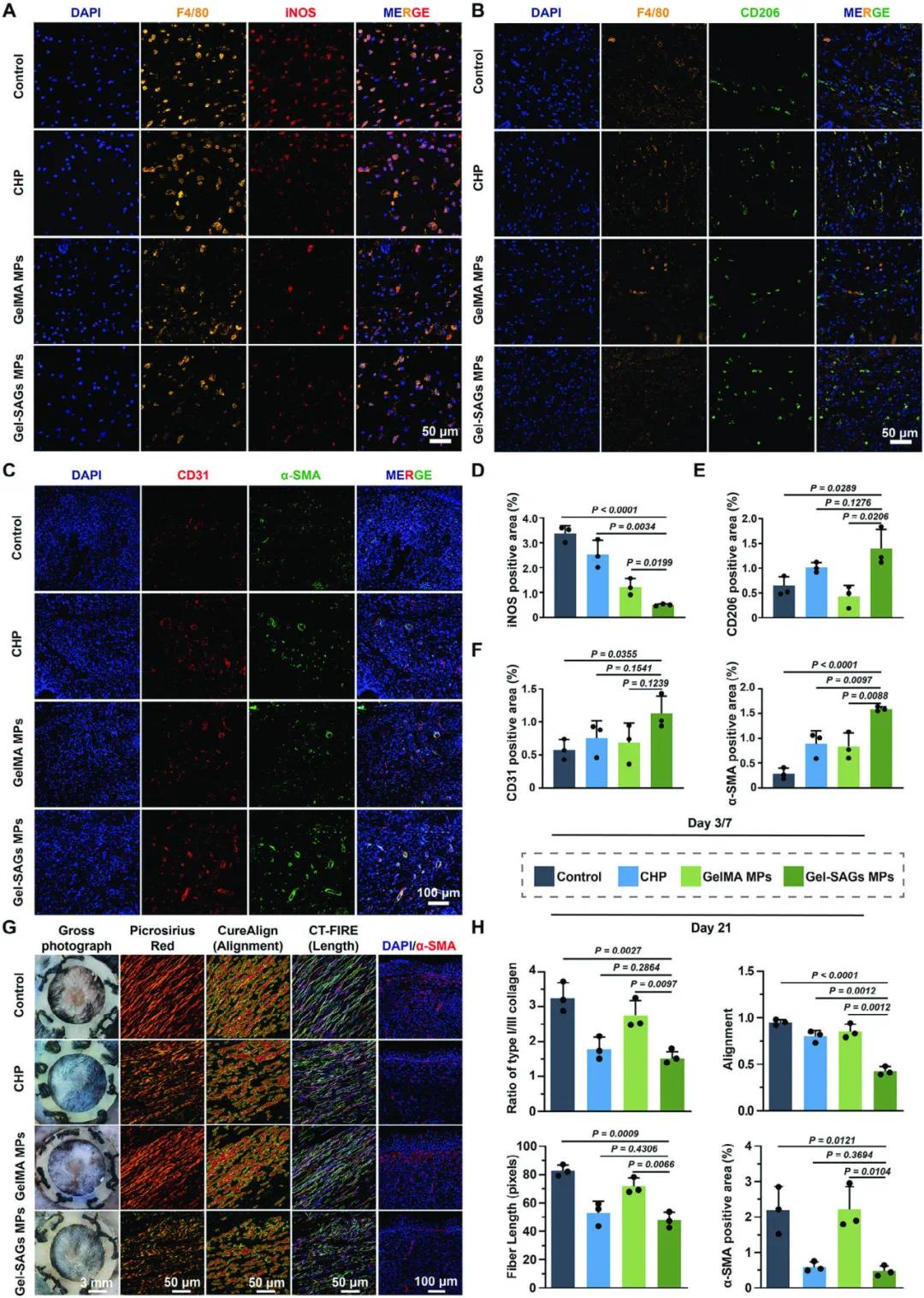
图8 评估 Gel-SAGs MPs 治疗后糖尿病伤口中巨噬细胞极化、新生血管形成和纤维化情况。(A-C)不同处理组免疫荧光染色;(D-F)免疫荧光染色的定量分析;(G, H)不同处理后天狼星红染色和 α-SMA 免疫荧光的图像及定量分析
图9A的图像显示,Gel-SAGs MPs在促进糖尿病伤口愈合方面显著优于碘伏、MepILex Lite泡沫敷料和藻酸盐敷料。图9B的定量分析表明,Gel-SAGs MPs处理组的伤口闭合率显著高于其他商业产品,表明其在愈合速度上的优势。图9C的H&E染色和Masson染色结果显示,Gel-SAGs MPs显著加速了伤口愈合并改善了愈合质量,表现为更完整的上皮化和更密集的胶原沉积,而其他材料的效果相对较弱。图9D的治疗模式比较热图进一步揭示了Gel-SAGs MPs在免疫调节和代谢调节方面的独特优势,表明其能够通过多维度调节伤口微环境来促进组织再生。
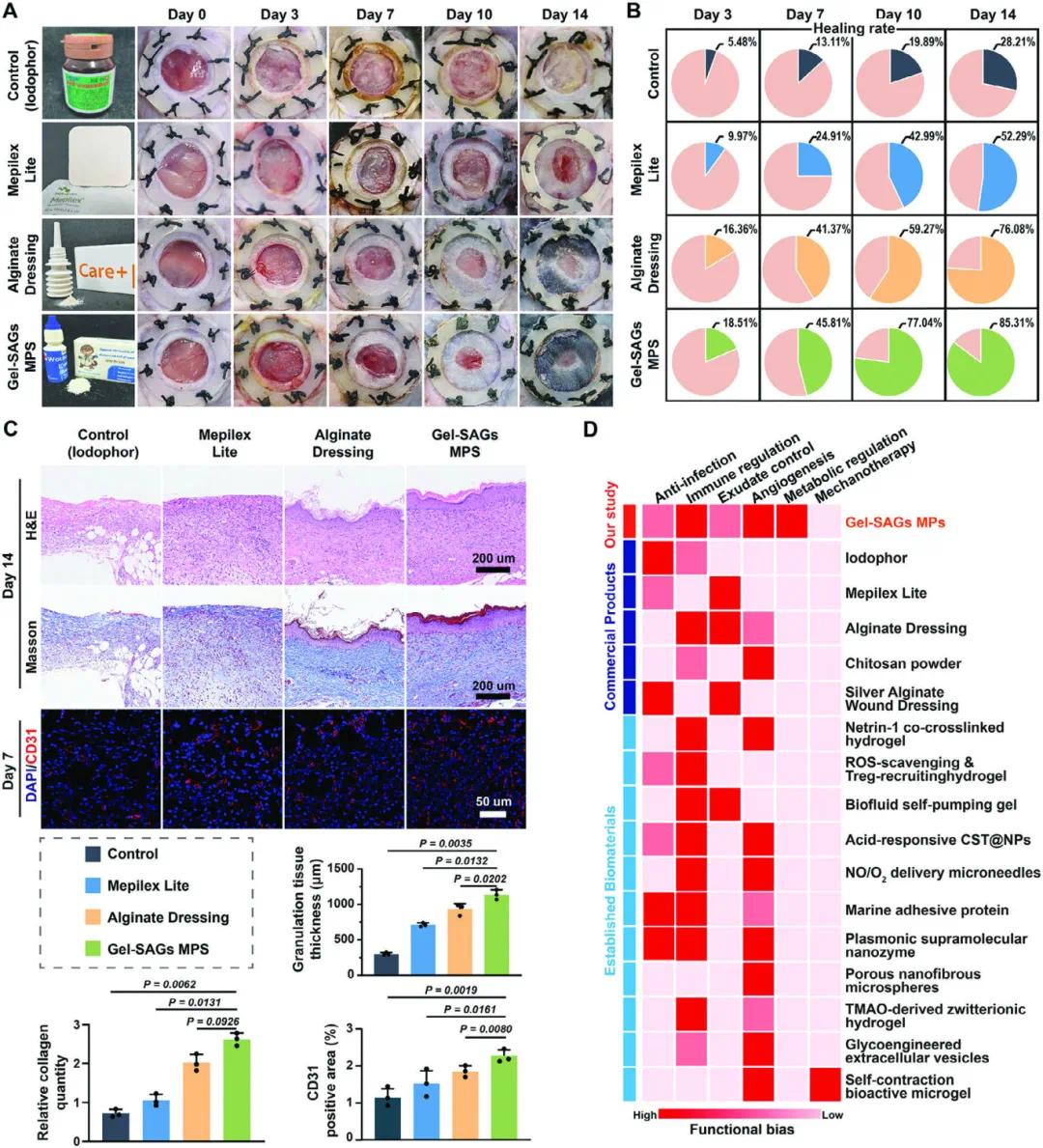
图9 Gel-SAGs MPs 与其他常用伤口处理材料的比较。(A)Gel-SAGs MP 与市售产品之间的比较图像;(B)伤口愈合百分比;(C)不同处理下的 H&E 染色、Masson 染色及定量分析;(D)Gel-SAGs MP 治疗组与常见商业伤口治疗产品的热图比较
本研究针对慢性伤口修复中的关键问题,特别是糖尿病伤口的复杂病理机制和现有治疗局限性,提出了一种创新策略。研究发现,两栖类动物(如大鲵)皮肤分泌物中的糖胺聚糖(SAGs)可显著促进血管生成和炎症重塑,通过调控巨噬细胞极化,实现从促炎到促修复的转变。基于此,研究开发了Gel-SAGs复合微球(Gel-SAGs MPs),用于糖尿病伤口的多阶段修复。实验表明,该材料可快速止血、管理渗出液、激活内源性再生程序,显著提高伤口愈合效率和质量,改善微循环,并诱导巨噬细胞向抗炎和促修复表型转变。
然而,研究仍有局限性,如SAGs的精细结构和与巨噬细胞的相互作用机制尚未完全明确。未来需优化材料设计,结合大动物模型和临床试验,提高临床适用性,并探索SAGs与其他治疗策略(如干细胞疗法、外泌体治疗)的协同作用,以实现更广泛的突破。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

