
在口腔修复领域,调节拔牙后微环境以促进牙槽骨再生是关键难题。牙周病、外伤、颌面肿瘤等常致牙齿缺失,引发牙槽骨吸收,影响口腔功能及种植治疗效果。传统再生技术依赖骨移植材料,但自体骨移植有额外创伤,同种异体骨和异种骨移植易引发免疫反应。细胞组织工程疗法虽为新兴策略,但口腔颌面部复杂微环境和高炎症发生率使移植细胞存活困难,单细胞悬液移植技术细胞存活率低,限制修复效果。拔牙创伤会引发炎症,口腔病原体侵入牙支持组织,触发以活性氧(ROS)过度产生为特征的免疫反应,过量ROS会加剧炎症、减缓骨缺损愈合。

针对上述问题,华中科技大学张志平教授等人合成了用于止血和伤口愈合且具有抗菌、抗氧化和强大湿粘附特性的原位超快自胶凝包衣粉末。这种粉末通过血液触发的原位自凝胶化实现止血,迅速形成强粘附性水凝胶,密封伤口界面。这种机制在颈动脉出血、肝出血和脾损伤的猪模型中显示出强大的止血功效。此外,这种多功能凝胶还可用作局部药物缓释系统。将富含血小板的血浆(PRP,富含多种生长因子)和凝胶粉末同时涂抹在伤口部位,凝胶粉末就能在原位转化为富含多种生长因子的生物活性凝胶(P@TCP-凝胶),从而实现生长因子的持续释放,并防止其被伤口中的酶迅速降解。同时,通过进一步负载促进血管生成的小分子药物去铁胺(DFO,DP@TCP-gel),其促进伤口愈合的能力得到进一步增强,在正常伤口、糖尿病慢性伤口和感染性伤口等各种伤口模型中都表现出卓越的促进愈合能力。相关成果以In Situ Ultrafast Self-gelling Coacervate Powder with Antibacterial, Antioxidant, and Robust Wet Adhesion Properties for Hemostasis and Wound Healing为题于2025年4 月 7 日发表在 Advanced Functional Materials(DOI:10.1002/adfm.202502577)。
·
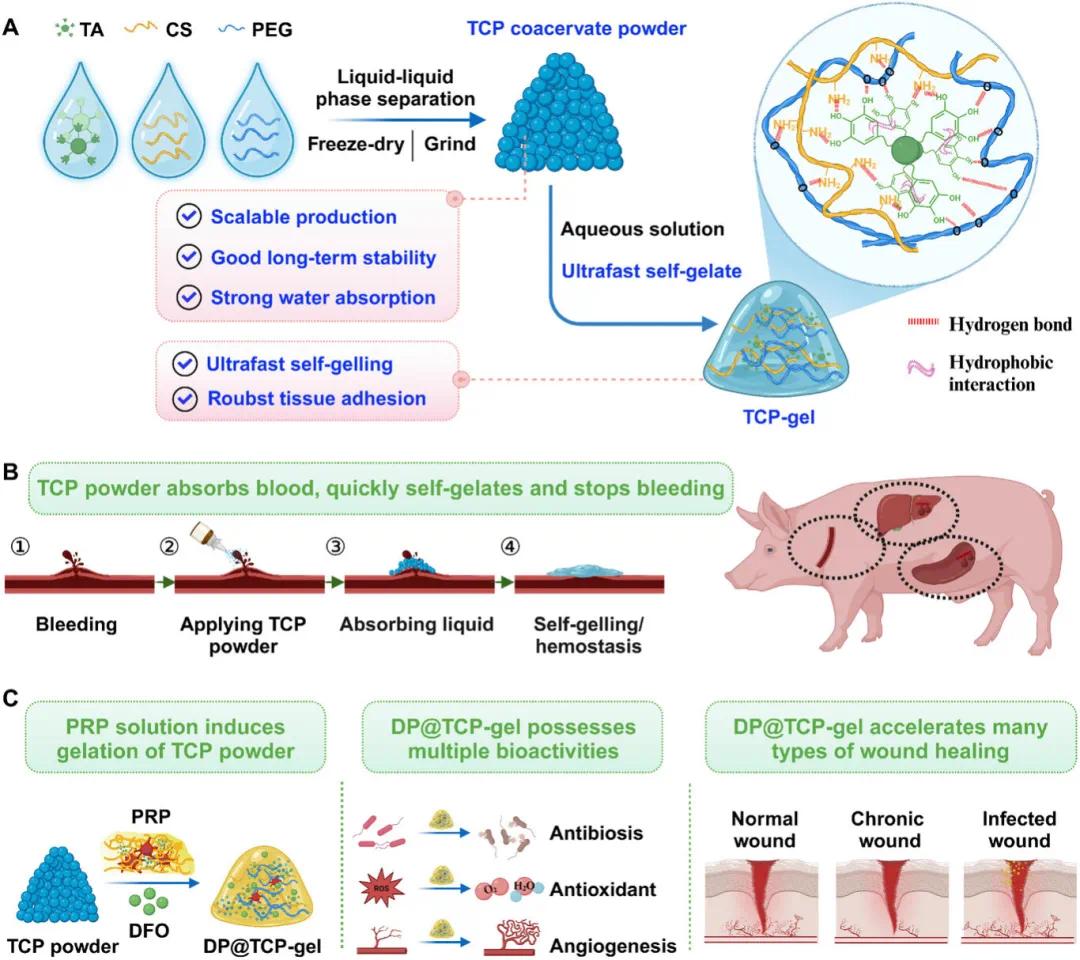
研究示意图
(1)TCP 凝聚层水凝胶(TCP)的配方和形成
如图 1B 所示,TA 对液 - 液分相过程至关重要,含 TA 的体系均观察到沉淀,而 TA 和 CS 二元体系形成的凝聚层不均匀,TA 和 PEG 二元体系及 TCP 三元体系可形成均匀凝聚层,命名为 TP 和 TCP。如图 1C、D 所示,TCP 的剪切模量和粘度明显高于 TP,CS 的存在增强了凝聚层水凝胶内部的内聚力,降低了凝聚层的流动性,提高了水凝胶的机械强度和粘附性。如图 1E、F、G、H 所示,TCP 凝胶在宏观粘附和拉伸实验中表现出比 TP 更优异的粘附性和拉伸性,能提起 500g 不锈钢砝码并密封塑料瓶出水口,其在猪皮上的粘附强度明显高于 TP,平均爆破压力也高于 TP 凝胶及正常血压,这证实加入 CS 增强了凝胶的内聚力和机械强度,从而提高了其粘附性。如图 1I、J、K 所示,TCP 凝聚层水凝胶的形成过程为随着时间推移形成越来越多不同大小的凝聚层液滴,逐渐相互靠近形成致密的液滴交联结构,CLSM 图像和 SEM 图像均显示水凝胶内存在圆形凝聚层液滴结构。如图 1L、M、N 所示,FTIR 光谱显示 TCP 中没有新峰出现,其模量受频率影响,表明 TCP 主要是通过氢键和疏水相互作用等物理相互作用形成;凝聚层在 DMSO 中迅速被破坏,在 Tween 20 中逐渐被破坏,而在 NaCl 溶液和去离子水中长时间保持完整,说明氢键相互作用在 TCP 形成中起主导作用,其次是疏水相互作用,TA 中丰富的酚羟基作为主要的氢键供体,与 PEG 中的氧原子和 CS 中的氨基形成分子间氢键主导凝聚层形成,TA 苯环之间的疏水相互作用也促进了凝聚过程。
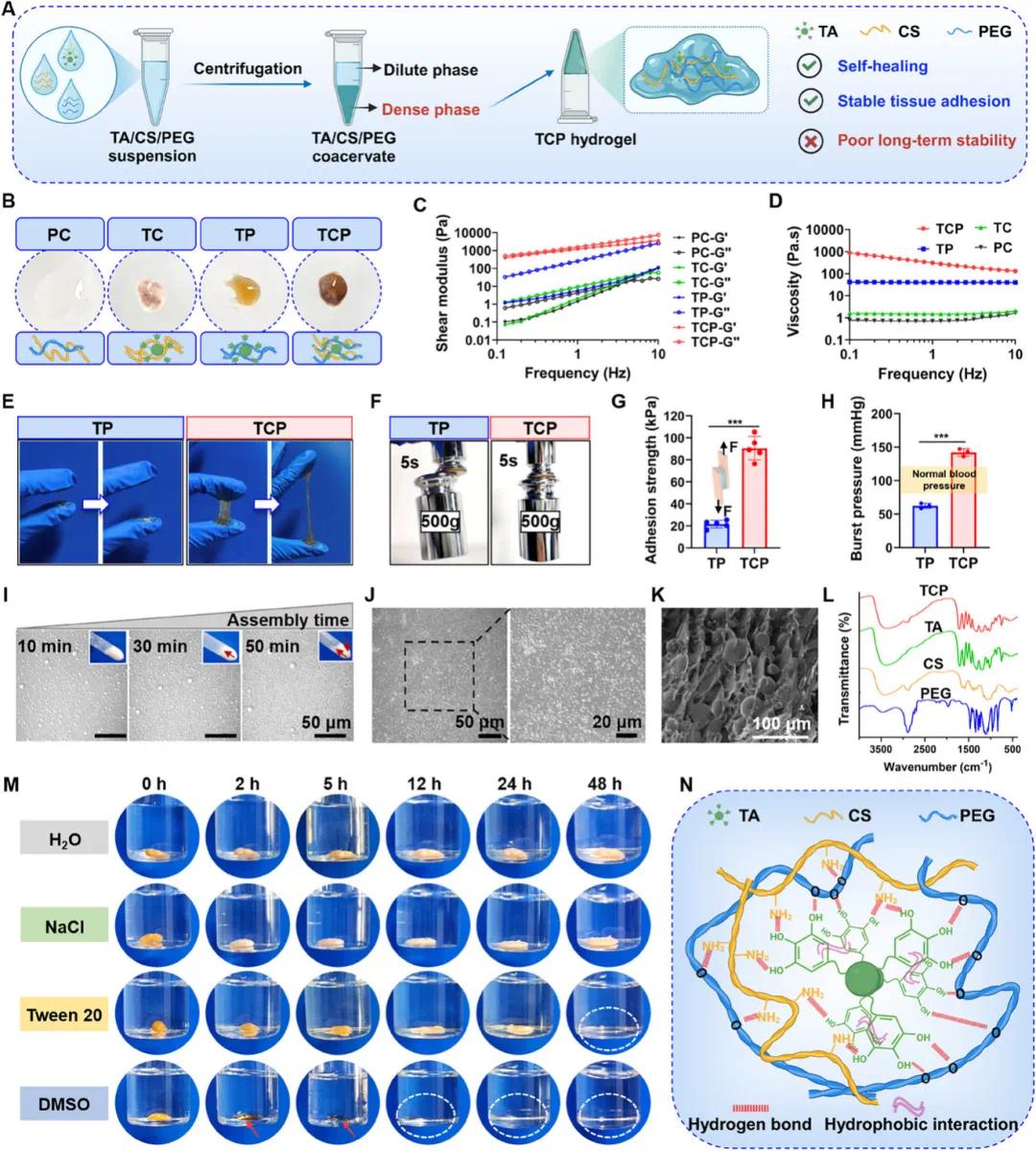
图1. TCP 共凝胶衍生凝胶的制备及形成机理。(A)制备过程及特性;(B)不同成分混合形成的共凝胶外观;(C)共凝胶的 G′和 G″;(D)凝聚态粘度;(E)粘附力与拉伸性能照片;(F)举起 500 克重物;(G)TP 和 TCP 在猪皮上的平均粘附强度(n=5);(H)爆破压力(n=3);(I)形成过程的光学显微镜及照片图像,箭头指示沉淀的凝聚凝胶;(J)光学显微镜照片;(K)SEM 图像;(L)FTIR 光谱;(M)TCP 在不同溶剂中的降解情况;(N)分子相互作用示意图
(2)TCP 具有强大的粘附力和卓越的体内止血能力
随着剪切速率或温度的增加,TCP 水凝胶的粘度逐渐降低,这是由于在剪切力或加热作用下物理相互作用被破坏(图 2A、B)。振荡剪切测试证实了 TCP 的自愈合能力,在大气和水下环境中,两个单独的水凝胶片段融合成一个完整的单元,进一步证明了这一点。这种自愈合能力主要归因于水凝胶表面基团之间形成的氢键(图 2C-E)。此外,TCP 水凝胶在空气中和水下均表现出优异的粘附性,能紧密粘附在玻璃、金属、塑料、橡胶和猪皮等各种材料表面(图 2F)。这种强大的粘附力主要归因于水凝胶与各种底物之间形成的共价或非共价键相互作用。具体而言,TCP 水凝胶表面保留的邻苯二酚基团通过氢键、阳离子 -π 相互作用、配位键、金属螯合和 π-π 相互作用,有助于实现强大的粘附(图 2G)。即使在流水冲洗 60 秒或在 PBS 溶液中浸泡 21 天后,TCP 水凝胶仍继续与猪皮保持紧密粘附(图 2I、J)。此外,TCP 能在包括大鼠心脏、肾脏、肝脏和脾脏在内的各种离体组织上实现紧密粘附和牢固的切口闭合(图 2K)。
失血过多是手术或创伤后导致死亡的主要原因,因此快速有效的止血策略至关重要。使用 18G 针头在小鼠肝脏诱导出血,然后立即应用 TCP 水凝胶。图 2L-N 中的结果显示,TCP 治疗组在约 13 秒内实现止血,明显短于未治疗的对照组(约 120 秒)。此外,TCP 治疗组的失血量约为 16.6mg,远低于对照组的约 50.2mg。同样,TCP 水凝胶在小鼠断尾模型中也表现出优异的止血能力,应用于出血部位后几乎立即止血(图 2O-Q)。
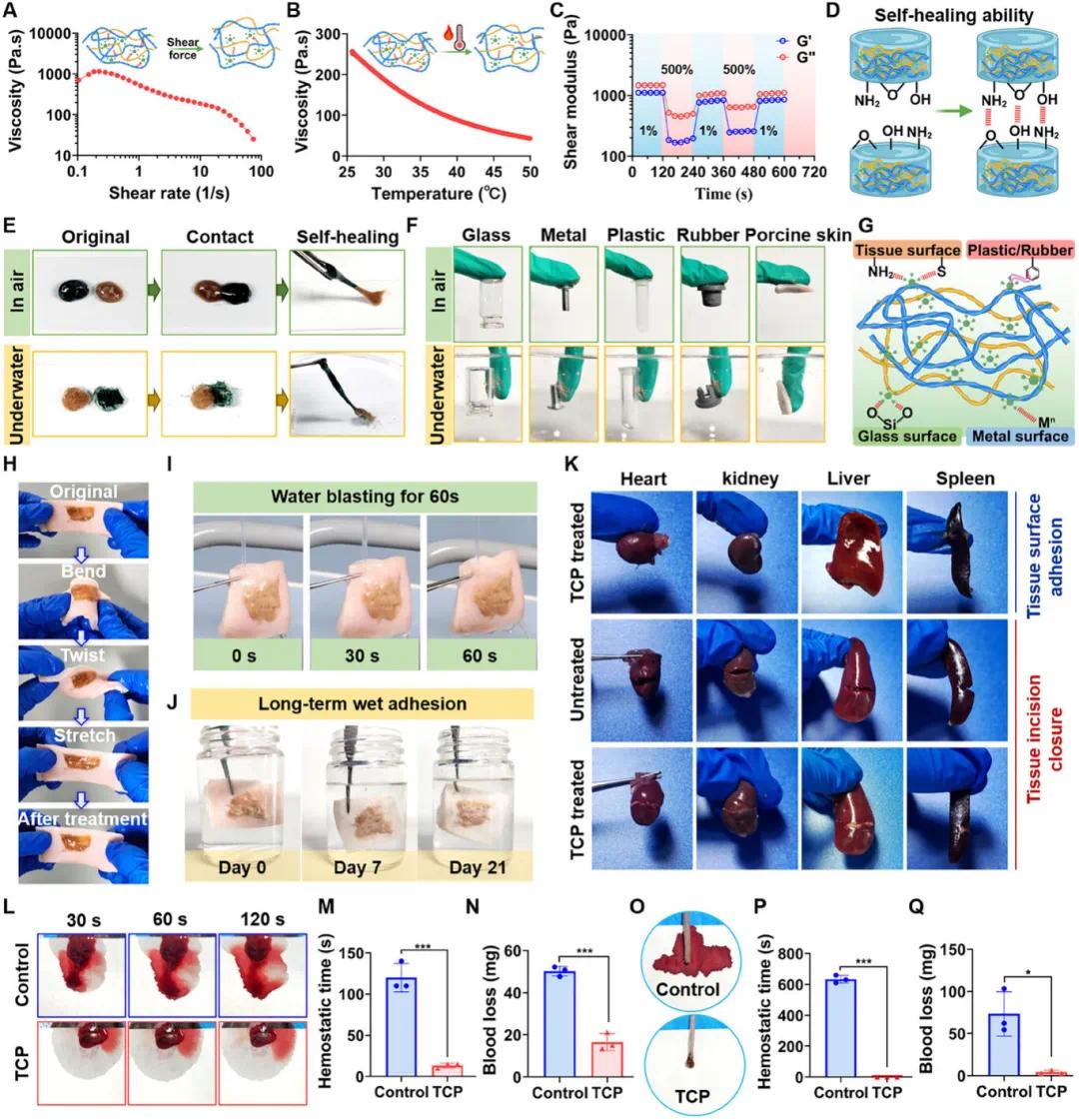
图2.TCP 的粘合特性及体内止血能力。(A)粘度曲线(剪切速率扫描);(B)不同温度下的粘度;(C)1%-500%剪切应变循环下的 G′和 G″;(D)自愈能力示意图;(E)自愈行为图像(空气/水下);(F)TCP 水凝胶与多种基底的粘附性照片;(G)与不同基底的粘附机理;(H)与湿猪皮组织的紧密粘附;(I)持续水流下与猪皮肤的粘附;(J)长期湿粘附特性;(K)体外组织粘附及切口闭合性能;(L-N)对小鼠肝脏出血模型的止血效果(n=3);(O-Q)对小鼠断尾模型的止血效果(n=3)
(3)TCP 凝聚层粉末可快速原位自凝胶化,具有强大的粘附力和长期储存稳定性
TCP 粉末遇水可迅速重构为 TCP-gel,这一过程在光学显微镜下也得到了直观展示(图 3A)。TCP 粉末遇水能迅速膨胀并相互连接形成块状水凝胶(图 3B)。重新水化形成的 TCP 凝胶内部保留了球形凝聚层结构(图 3C)。TCP 粉末和 CS 粉末因含大量亲水基团,在界面处表现出优异亲水性,能迅速吸收液体,且吸液能力显著优于 YNBY 粉末(图 3D)。在吸血方面,TCP 粉末甚至超过了 CS 粉末,这可能与 TA 的存在使其能捕获更多红细胞有关(图 3E)。TCP 粉末倒入 PBS 溶液或血液中时,会迅速吸收部分液体并自凝胶化,紧紧粘附在试管壁上形成屏障阻止液体流动,而 YNBY 粉末和 CS 粉末缺乏此自凝胶化能力(图 3F)。TCP 粉末易于粘附在湿组织上(图 3G)。TCP 粉末涂抹在猪皮潮湿表面后迅速吸收界面水并在 30 秒内转变为凝胶(图 3H)。TCP 粉末吸收 FITC-BSA 溶液后原位转变为绿色荧光水凝胶,与猪皮组织紧密粘附无间隙(图 3I)。原位形成的 TCP 凝胶具有动态粘附能力,能抵抗拉伸等外力(图 3J)。TCP 粉末应用于受损猪肚时可原位形成凝胶有效密封出水孔(图 3K)。搭接剪切测试表明 TCP 凝胶在猪皮上的平均粘附强度显著超过纤维蛋白密封剂(图 3L)。
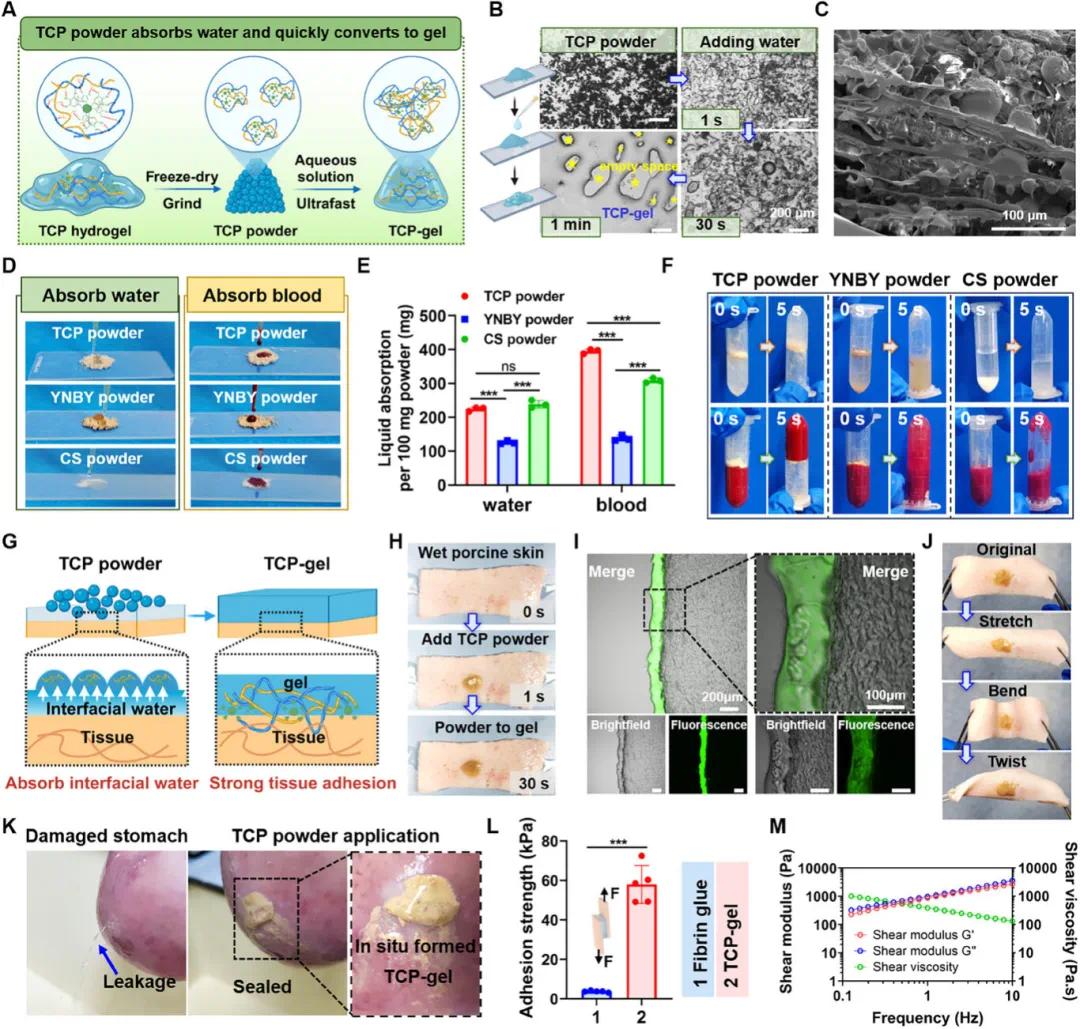
图3. TCP 共凝胶衍生粉末的制备及快速胶凝化过程。(A)制备及快速凝胶化示意图;(B)从粉末到块状水凝胶的转变过程光学显微镜图像;(C)TCP 凝胶的 SEM 图像;(D)TCP 粉末与商用粉末的液体吸收照片;(E)液体吸收能力对比;(F)TCP 粉末在 PBS 和血液中的自胶凝效果(倒管法);(G)吸收界面水并自胶化的示意图;(H)TCP 粉末在湿猪皮表面的自胶化;(I)原位形成水凝胶并紧贴猪皮的显微图像;(J)形成的凝胶与猪皮紧密结合;(K)密封猪胃损伤的照片;(L)TCP 凝胶与纤维蛋白胶在猪皮肤上的粘附强度(n=5);(M)TCP 凝胶的 G′、G″和粘度
(4)TCP 粉末相较于商业止血材料展现出更优异的止血效果
TCP 粉末出色的吸液能力、自凝胶化特性以及强大的湿组织粘附性,表明其有望成为一种杰出的止血材料。如图 4A - C 所示,TCP 粉末能在约 20 秒内诱导重新激活的抗凝全血中形成稳定的血栓,这明显快于对照组(约 7.7 分钟)、云南白药组(约 3.7 分钟)和壳聚糖组(约 3.3 分钟 )。此外,当该材料与重新激活的抗凝全血共同孵育 1 分钟时,TCP 粉末的凝血指数(BCI)约为 14.1%,远低于云南白药组(约 28.2%)、壳聚糖组(约 29.0%)和对照组(约 86.9%)(图 4D)。随后,利用大鼠肝出血和股动脉出血模型评估 TCP 粉末的体内止血效果。除云南白药和壳聚糖粉末外,临床上常用的明胶海绵也被用作对照。如图 4E - H 所示,在由手术刀造成的大鼠肝出血模型中,由于出血迅速且量大,云南白药粉末和壳聚糖粉末因缺乏自凝胶化能力和有限的吸血能力,几乎没有止血效果。相比之下,TCP 粉末具有出色的吸血和自凝胶化特性,它迅速吸收血液并原位转化为具有强粘附性的 TCP 凝胶,有效封闭出血部位,展现出最佳的止血性能。临床上常用的明胶海绵在该模型中也显示出一定的止血效果。如图 4I - L 所示,在大鼠股动脉出血模型中,TCP 粉末仍然表现出最佳的止血效果,在约 10 秒内实现止血,失血量仅约 16 mg,明显少于对照组约 649 mg 的失血量。上述结果充分证明,自凝胶化的 TCP 粉末是一种极具前景的止血材料。
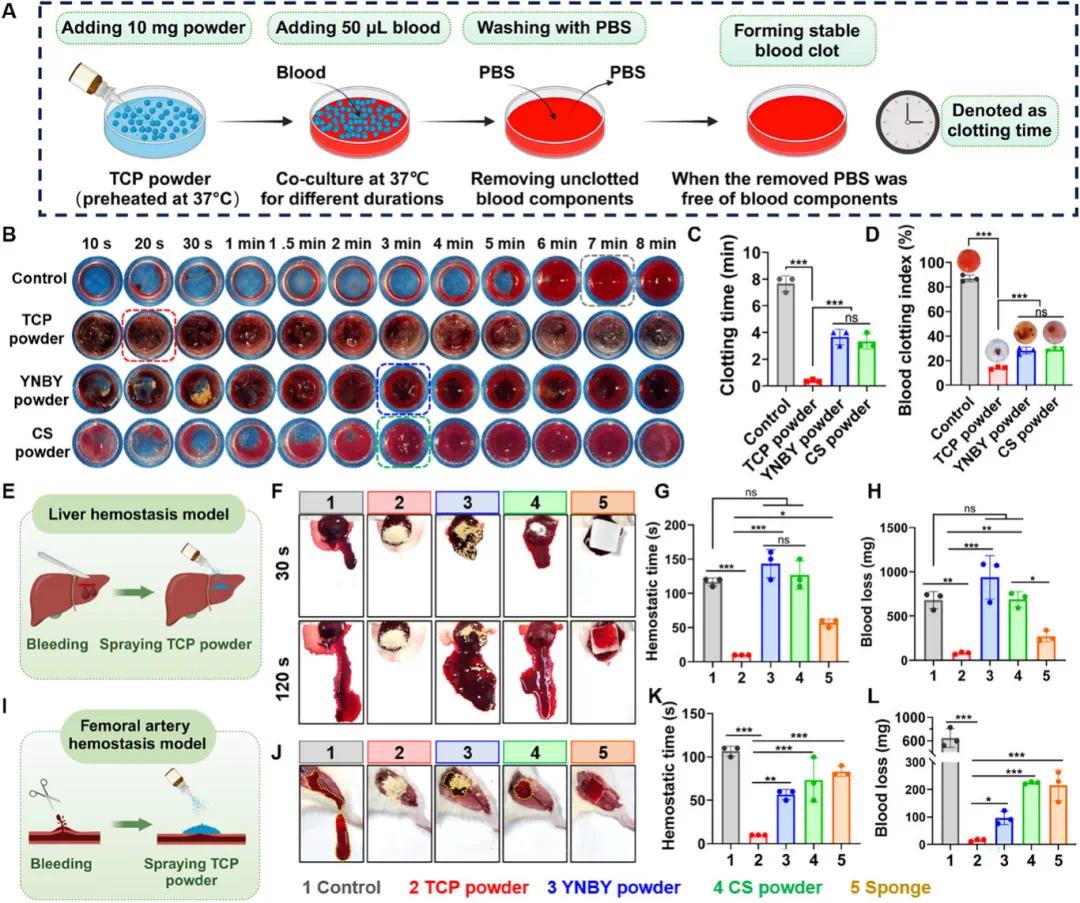
图4. TCP 粉末的体内外止血能力。(A)体外凝血时间示意图;(B)TCP 粉末处理大鼠全血的凝血照片;(C)TCP 粉末处理的凝血时间(n=3),商用粉末(YNBY 粉和 CS 粉)作为对照;(D)TCP 粉末组和对照组的 BCI(n=3);(E)大鼠肝脏出血及 TCP 粉末止血示意图;(F)TCP 粉末止血的大鼠肝脏照片;(G, H)肝脏出血模型的止血时间和失血量分析(n=3);(I)大鼠股动脉出血及 TCP 粉末止血示意图;(J)TCP 粉末止血的股动脉模型照片;(K, L)股动脉出血模型的止血时间和失血量分析(n=3)
(5)TCP 粉末在猪模型中的止血验证
为了进一步评估 TCP 粉末的体内止血效果,并验证其临床应用潜力,在猪严重出血模型中进行了临床前功能评估。如图 5A 所示,用 2mm 的针头在猪颈动脉上制造出血伤口,然后立即应用 1g TCP 粉末或商业壳聚糖粉末。图 5B 中的结果表明,壳聚糖粉末未能实现有效止血,在水冲洗后迅速崩解。相比之下,TCP 粉末吸收血液并粘附在伤口部位,实现了快速止血。用水冲洗后,可以观察到 TCP 粉末完全转化为具有强大湿粘附性的凝胶,保持紧密的界面结合,没有二次出血(支持信息视频 S15)。在猪内脏器官出血模型中进行了进一步的临床前评估。在猪肝和脾脏上通过手术制造线性缺损(长 15mm× 深 10mm)(图 5C)。观察到伤口处有活动性出血后,立即应用 3g TCP 粉末或商业壳聚糖粉末。TCP 粉末在应用后 2 分钟内实现了出血控制。用水冲洗后,TCP 粉末形成的凝胶紧密粘附在肝脏或脾脏组织上,有效封闭了出血部位(图 5D、E)。相比之下,虽然壳聚糖粉末在肝脏模型中显示出暂时的止血效果,但冲洗会破坏其血凝块,导致再次出血(图 5D)。这些发现证实了 TCP 粉末卓越的粘附性能和止血效果,突出了其在处理动脉出血和不可压缩的内脏器官损伤方面的临床应用潜力。
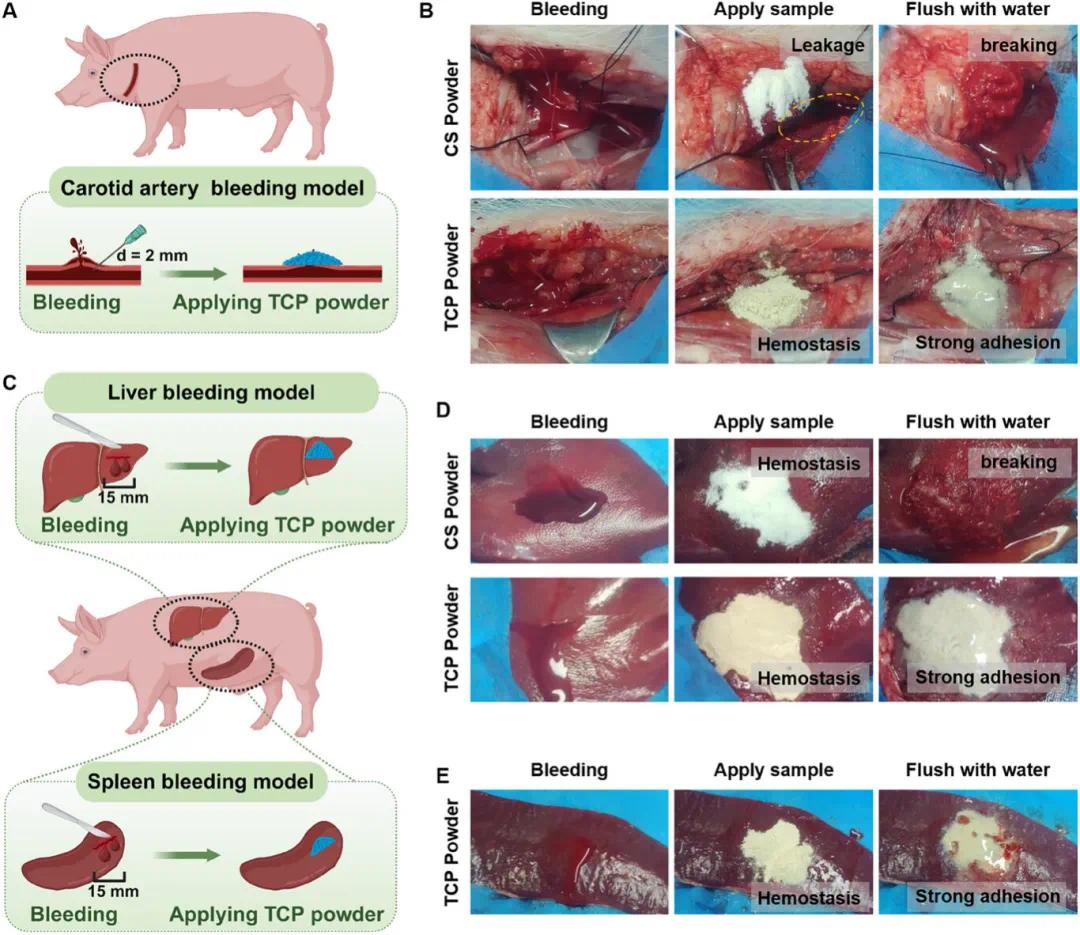
图5. TCP 粉末在猪模型中的止血验证。(A)猪颈动脉出血模型示意图;(B)TCP 粉末和 CS 粉末在猪颈动脉出血模型中的止血过程;(C)猪肝和脾出血模型示意图;(D)TCP 粉末和 CS 粉末在猪肝脏出血模型中的止血过程;(E)TCP 粉末在猪脾脏出血模型中的止血过程
(6)与富血小板血浆(PRP)和去铁胺(DFO)协同作用,DP@TCP 凝胶展现出优异的生物活性
TCP 粉末的自凝胶化特性使其具有作为伤口敷料材料的潜力,但单独的 TCP 粉末生物活性不显著,可能会限制其促进伤口愈合的能力。PRP 因富含多种生长因子在伤口愈合领域受到重视,将 TCP 粉末与含有 DFO 的 PRP 溶液混合制备 DP@TCP 凝胶(图 6A)。研究确定了有效负载 50μL PRP 所需的 TCP 量,且对 DFO 的封装效率可达约 80%。DP@TCP 凝胶在 72 小时内实现了 DFO 和 PRP 中总蛋白质的持续释放(图 6B),这主要归因于 TA 的羟基与 DFO 中的酰胺键以及蛋白质中的肽键形成氢键的能力,这种局部持续递送特性有利于确保 PRP 的疗效,并避免因 DFO 局部浓度过高而产生的副作用。检测结果表明,TCP 凝胶与人类脐静脉内皮细胞(HUVEC)和小鼠成纤维细胞(L929)均具有良好的细胞相容性,并且 TCP 凝胶的溶血特性几乎可以忽略不计(图 6C - F),在溶血实验中,TCP 凝胶处理组上清液在 570nm 处的吸光度计算得出的溶血率显著低于 PBS 组,这可能是由于 TA 和 CS 对红细胞的吸附作用。在研究不同载药水凝胶促进细胞增殖、迁移和血管生成能力的实验中,由于 PRP 中富含生长因子,负载 PRP 的 TCP 凝胶组(P@TCP 凝胶)、同时负载 DFO 和 PRP 的 TCP 凝胶组(DP@TCP 凝胶)以及 DFO 和 PRP 混合溶液组(DP)在促进 L929 细胞增殖方面表现出相当的能力(图 6G)。在划痕实验和管形成实验中,DP@TCP 凝胶在所有凝胶组中表现出最佳的促迁移和促管形成能力,与 DP 组相当(图 6H - M),这表明 DFO 和 PRP 的组合赋予了凝胶敷料最佳的生物活性,且 TCP 凝胶载体对 DFO 和 PRP 的生物活性没有显著影响。
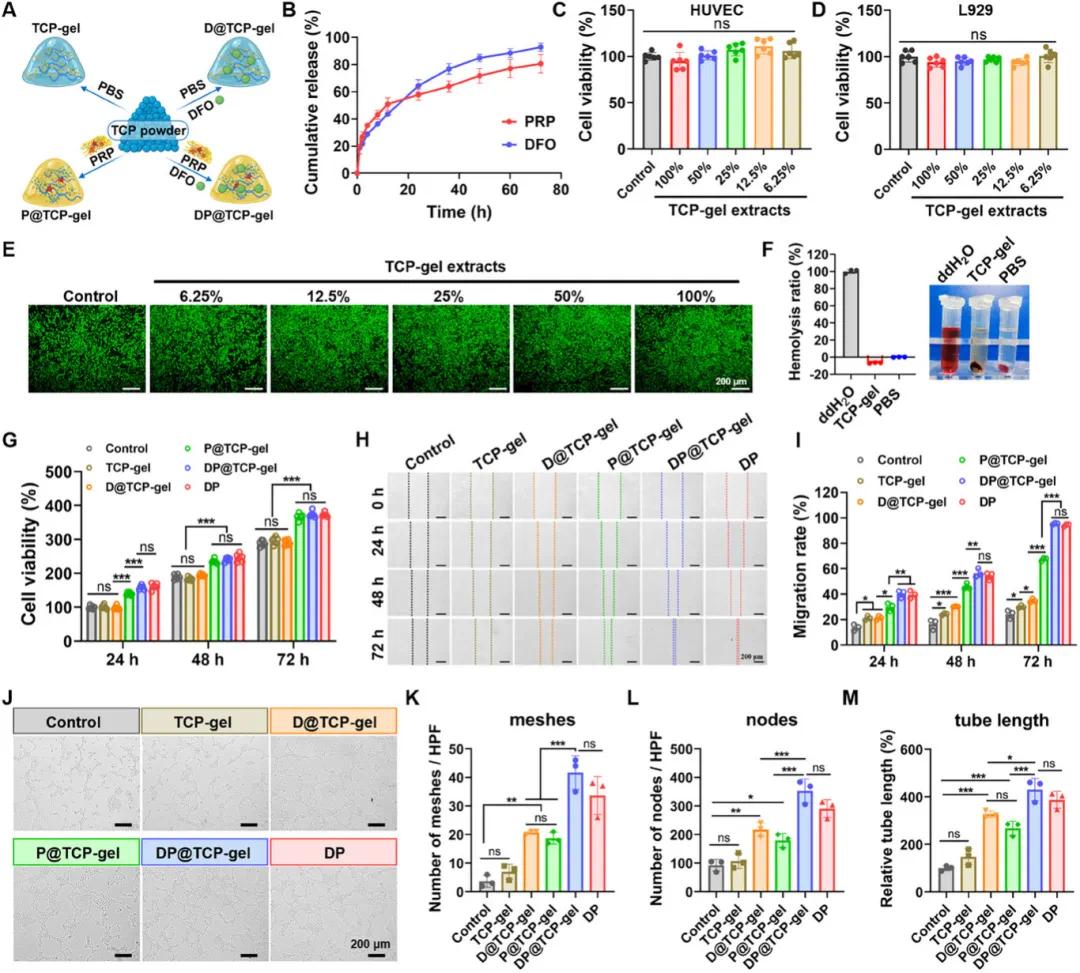
图6. DP@TCP 凝胶的制备及生物活性研究。(A)TCP 粉末衍生生物活性水凝胶的制备示意图;(B)DFO 和 PRP 的释放曲线(n=3);(C)不同浓度 TCP 凝胶提取物处理 HUVEC 的细胞活力(n=6);(D)处理 L929 的细胞活力(n=6);(E)L929 细胞的活/死染色;(F)TCP-gel 的溶血率及 RBC 上清液成像(n=3);(G)L929 细胞增殖率(n=6);(H)不同凝胶处理的 L929 细胞划痕实验图像;(I)划痕实验中伤口闭合率分析(n=3);(J)不同凝胶处理的 HUVEC 细胞管形成图像;(K-M)管形成试验中网状结构、节点和相对管长度分析(n=3)
(7)利用 TCP 固有的抗菌和抗氧化特性,DP@TCP 凝胶展现出出色的抗菌和抗氧化功能
实验研究了 TCP 凝胶的抗菌效果,结果表明 0.5mg/mL 的 TCP 凝胶提取物展现出良好的抗菌性能,而当浓度提升至 1mg/mL 时,对两种细菌的抑制率接近 100%(图 7A-D)。进一步的实验检测了 1mg/mL 的各种载药凝胶提取物的抗菌效果,结果显示所有 TCP 凝胶组对细菌的抑制率均接近 100%。DP 组也显示出一定的抗菌效果,这主要归因于 PRP 中存在的抗菌物质,如血小板活化因子(PAF)、血小板因子 4(PF4)、人 β - 防御素 - 3(HBD - 3)和巨噬细胞炎性蛋白(MIP - 1α)等(图 7E-G)。实验评估了 TCP 凝胶的抗氧化能力,在 ABTS + 自由基清除实验中,10μg/mL 的 TCP 凝胶提取物对 ABTS + 自由基的清除率达到 100%,药物的负载并未显著影响 TCP 凝胶的抗氧化能力(图 7H-K)。DPPH・自由基清除实验的结果也呈现出类似的趋势,充分证明了 TCP 凝胶出色的抗氧化能力(图 7L-O)。此外,细胞水平的实验研究了 TCP 凝胶对经 H₂O₂处理的 HUVEC 或 L929 细胞的保护作用。结果显示,经 H₂O₂处理后细胞活力显著下降,但在同时用 H₂O₂和 TCP 凝胶提取物处理的组中,细胞活力明显高于仅用 H₂O₂处理的细胞。当凝胶提取物的浓度达到 20μg/mL 时,L929 细胞的活力与未处理的正常细胞相当,表明 TCP 凝胶可以有效保护细胞免受氧化应激损伤(图 7P、R)。
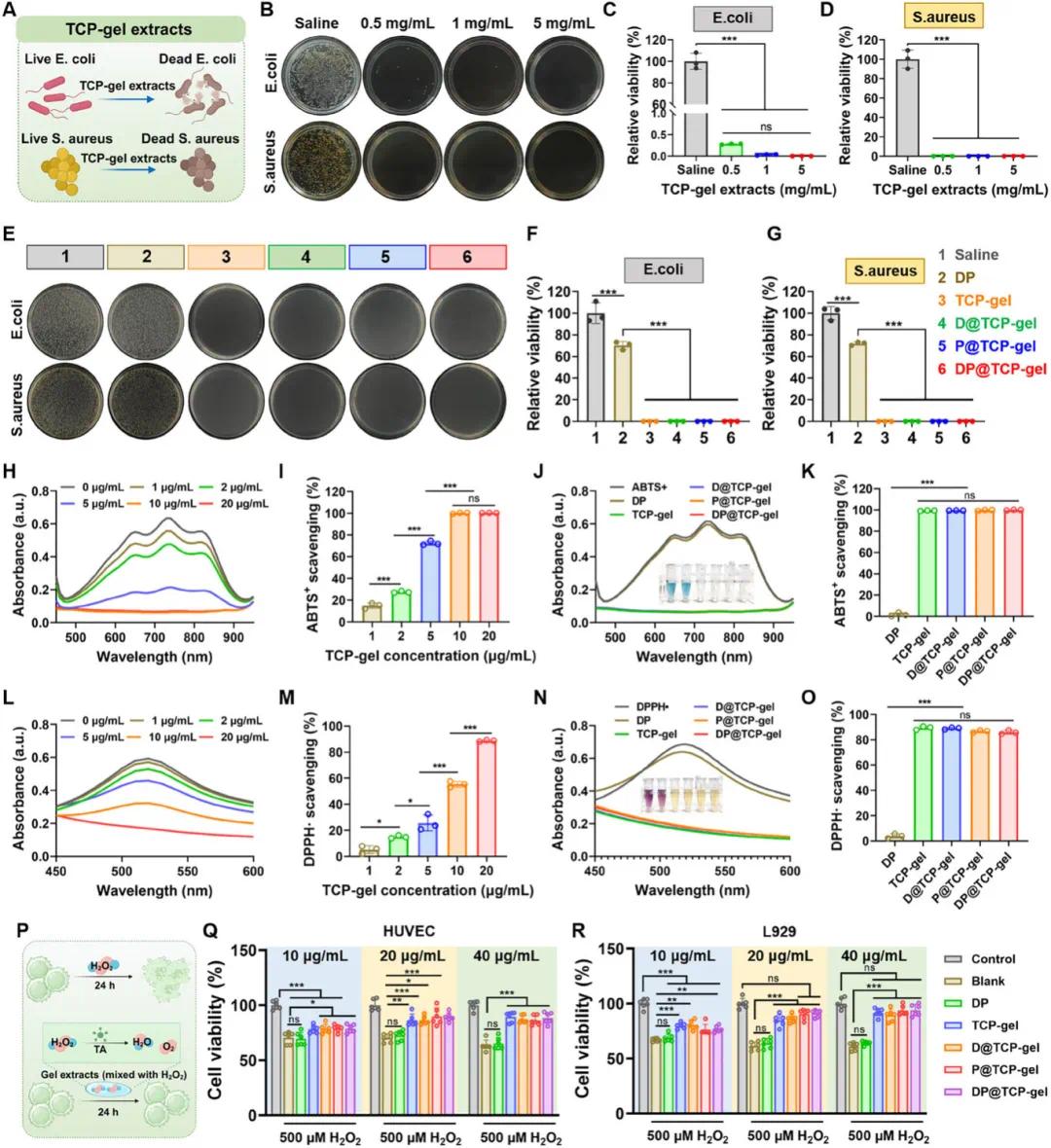
图7. 多功能 TCP 凝胶的抗菌和抗氧化特性。(A)抗菌效果示意图;(B)TCP 凝胶提取物处理后的大肠杆菌和金黄色葡萄球菌菌落照片;(C, D)相应细菌的相对存活率(n=3);(E)不同水凝胶处理后的菌落照片;(F, G)相应细菌的相对存活率(n=3);(H, I)基于 ABTS 法的 TCP 凝胶提取物抗氧化活性(n=3);(J, K)基于 ABTS 法的不同凝胶提取物抗氧化活性(n=3);(L, M)基于 DPPH 法的 TCP 凝胶提取物抗氧化活性(n=3);(N, O)基于 DPPH 法的不同凝胶提取物抗氧化活性(n=3);(P)TCP 凝胶在氧化应激下保护细胞活性的示意图;(Q)不同凝胶提取物对 H₂O₂ 处理的 HUVEC 的细胞保护作用(n=6);(R)对 H₂O₂ 处理的 L929 细胞的细胞保护作用(n=6)
(8)多功能 DP@TCP 凝胶加速慢性伤口愈合
糖尿病是导致难愈合慢性伤口的主要原因之一,其关键在于伤口部位血管再生的障碍。为此,研究利用糖尿病大鼠全层皮肤缺损模型,评估 DP@TCP 凝胶对慢性伤口愈合的促进作用。结果显示,DP@TCP 凝胶显著加速伤口愈合,在第 9 天愈合率约为 90.5%,远高于对照组的 52.9%;到第 12 天,愈合率接近 97.7%,优于其他处理组(图 8B - D)。H&E 染色表明,第 6 天伤口形成明显肉芽组织,第 12 天 DP@TCP 凝胶组伤口几乎完全闭合,且皮肤附属器再生良好(图 8E)。Masson 染色显示,DP@TCP 凝胶组伤口部位胶原蛋白沉积显著增加,且第 12 天胶原纤维更加成熟,排列规则(图 8F - H)。
进一步分析其机制发现,糖尿病伤口愈合障碍主要源于高糖环境中 HIF - 1α 稳定性受损,导致血管生成紊乱。免疫组织化学(IHC)检测显示,第 6 天对照组和 TCP 凝胶组 HIF - 1α 表达水平低,而载药水凝胶组(尤其是 DP@TCP 和 DP 组)表达显著增加,这主要归因于 DFO 稳定 HIF - 1α 的能力(图 8I、J)。到第 15 天,DP@TCP 和 DP 组 HIF - 1α 表达下降,可能是由于身体自我调节机制的作用。免疫荧光(IF)分析表明,第 6 天 DP@TCP 凝胶组血管再生最显著,这归因于 DFO 稳定 HIF - 1α 以及 DP@TCP 凝胶释放 VEGF 等生长因子的双重作用(图 8K)。到第 12 天,该组血管数量减少,这是由于伤口进入重塑期,不成熟血管逐渐退化。
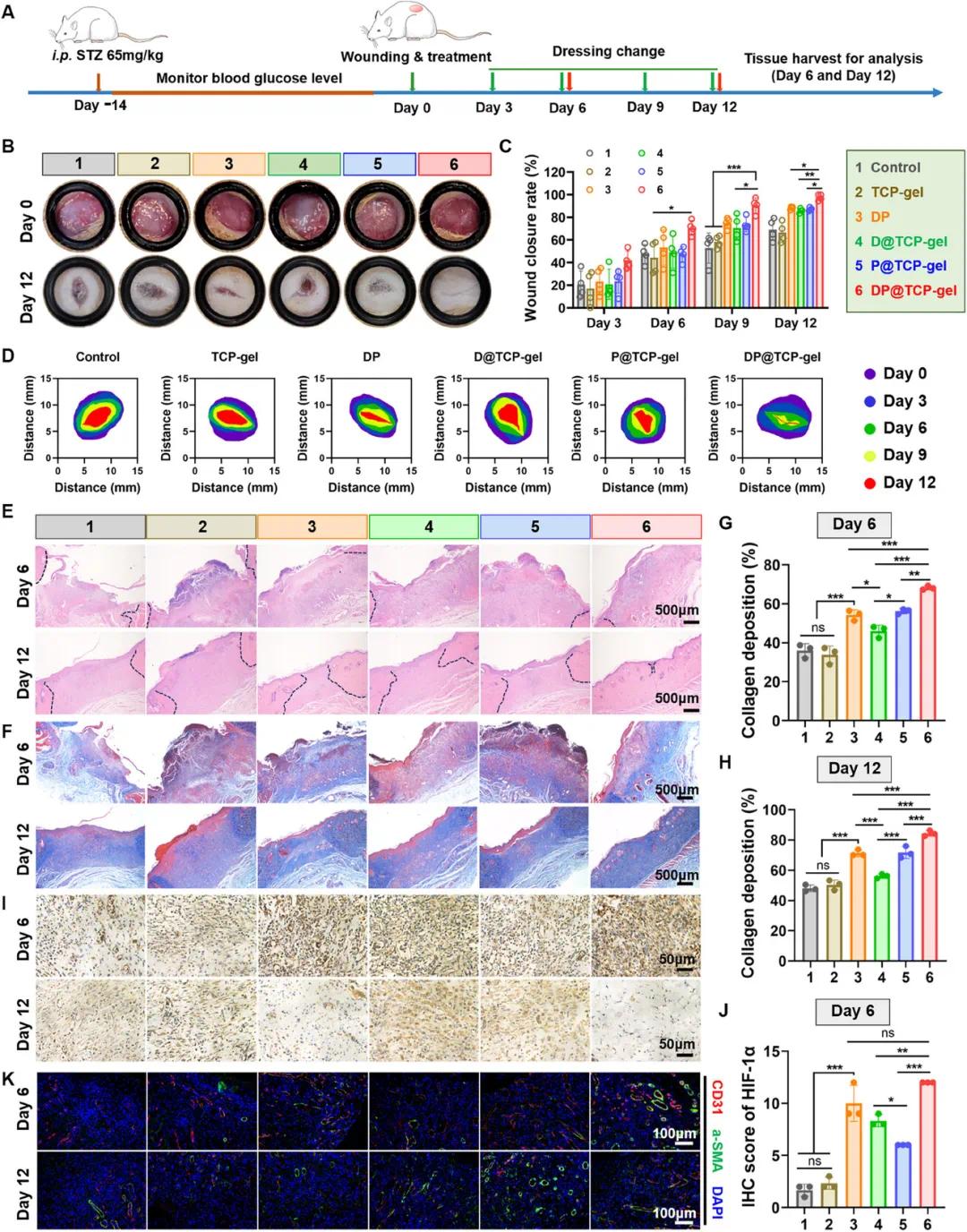
图8. DP@TCP 凝胶加速糖尿病大鼠全厚皮肤缺损模型的伤口愈合。(A)伤口及治疗方案示意图;(B)伤口愈合过程照片;(C)伤口愈合率(n=4);(D)伤口区域示意图;(E)第 6 天和第 12 天伤口切片的 H&E 染色图像;(F)第 6 天和第 12 天伤口切片的 Masson 三色染色图像;(G, H)第 6 天和第 12 天伤口胶原沉积分析(n=3);(I)HIF-1α 的 IHC 染色;(J)第 6 天 HIF-1α IHC 染色分析(n=3);(K)α-SMA 和 CD31 的 IF 共染色
(9)多功能 DP@TCP 凝胶加速慢性伤口愈合
DP@TCP 凝胶在体外表现出优异的抗菌、抗氧化和血管再生能力,因此进一步研究了其在感染伤口模型中的促愈合能力。实验在正常大鼠背部构建了金黄色葡萄球菌感染的伤口模型,并进行各种处理。结果显示,DP@TCP 凝胶在促进感染伤口愈合方面效果最佳,其次是 DP 组,TCP 凝胶也表现出一定的促愈合效果(图 9B - D)。在治疗后的第 3 天和第 12 天,从伤口部位收集肉芽组织提取细菌并进行培养计数。结果显示,在第 3 天,DP@TCP 凝胶和 TCP 凝胶显著抑制了伤口部位的细菌生长,相对细菌计数均小于 1%;在第 12 天,DP@TCP 凝胶组的伤口部位几乎没有细菌生长(图 9E - G)。H&E 染色结果显示,DP@TCP 凝胶组的表皮完整,上皮层较薄,且有大量皮肤附属器再生(图 9H)。Masson 染色结果表明,在第 6 天,DP@TCP 凝胶组的胶原纤维沉积比其他组更多;在第 12 天,DP@TCP 凝胶组和 DP 组均有丰富且致密的胶原纤维,排列有序,而其他组的胶原纤维较少且排列紊乱(图 9I - J)。这些结果表明,多功能 TCP 粉末由于其固有的抗菌和抗氧化特性,与生物活性物质(如 PRP、DFO)结合时,可成为伤口修复领域极具前景的水凝胶敷料。
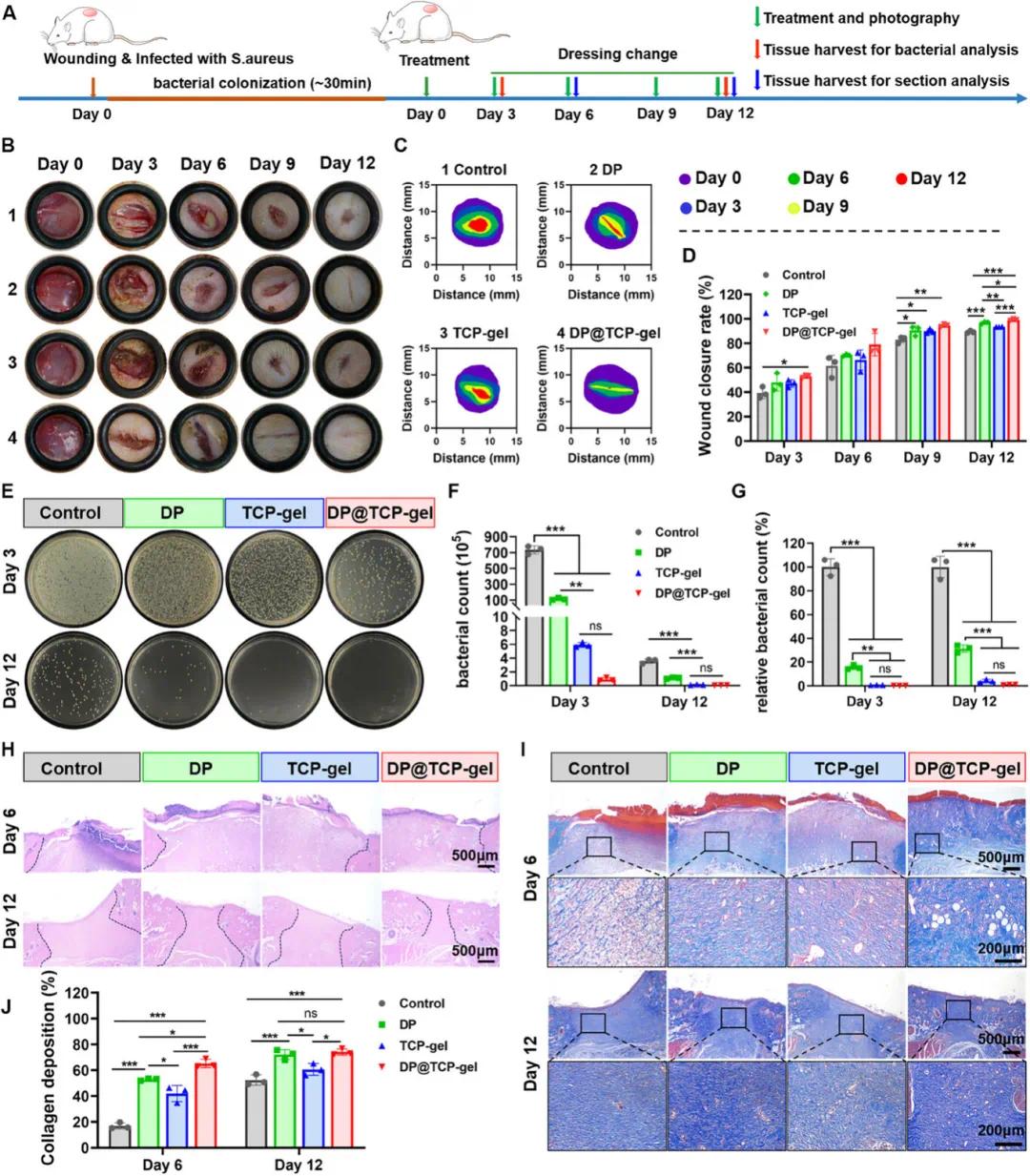
图9. DP@TCP 凝胶加速金黄色葡萄球菌感染大鼠全厚皮肤缺损模型的伤口愈合。(A)伤口及治疗方案示意图;(B)伤口愈合过程照片;(C)伤口面积示意图;(D)伤口愈合率(n=3);(E)第 3 天和第 12 天伤口处细菌生长情况(展平板法);(F, G)伤口细菌数量及相对细菌数量分析(n=3);(H)第 6 天和第 12 天伤口切片的 H&E 染色图像;(I)第 6 天和第 12 天伤口切片的 Masson 三色染色图像;(J)第 6 天和第 12 天伤口胶原沉积分析(n=3)
研究受贻贝粘合机制的启发,利用富含儿茶酚基团且广泛存在于植物中的 TA 来模拟贻贝蛋白的功能。根据共凝结机理,研制出了由 TA、CS 和 PEG 组成的多功能 TCP 共凝胶粉末。
TCP 共凝胶粉末具有多重优势,是止血和伤口愈合领域极具竞争力的候选材料。首先,基于 TA 中的羟基、PEG 中的醚基和 CS 中的氨基之间形成的强分子间氢键,共水合物可自发组装,避免了复杂的化学合成和有毒交联剂的引入,确保了体系良好的生物相容性。其次,共水合物粉末的制备采用一步混合法,结合冷冻干燥和研磨工艺,成本低、规模化、可长期保存,为临床转化提供了显著优势。此外,TCP 共凝胶粉末还具有吸水性强、自凝胶特性和较强的湿组织粘附性等特点,是止血材料的理想候选材料。最后,基于其固有的抗菌和抗氧化能力,通过与生物活性成分 PRP 和 DFO 的进一步结合,它在慢性伤口和感染伤口的愈合方面显示出了可喜的治疗效果,证明它在组织再生领域具有广阔的应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

