
冠状动脉疾病(CAD)是临床常见的缺血性心脏病心力衰竭的主要原因之一,死亡率逐年上升,通过经皮冠状动脉介入治疗(PCI)及时恢复缺血心肌血流是挽救垂死心肌细胞、最大限度减少心肌梗死(MI)范围、降低死亡率的有效手段。然而,心肌缺血-再灌注损伤(MIRI)涉及多种病理生理过程,例如细胞凋亡、线粒体损伤、氧化应激和内皮细胞功能障碍,因此,探索有效减轻心肌细胞凋亡、氧化应激、促进缺血性血管新生的综合治疗策略,对损伤后心肌组织的修复具有重要意义。

针对上述问题,暨南大学附属第一医院(华侨医院)的罗良平教授团队设计了一种可注射的导电水凝胶,该水凝胶响应于缺血损伤的弱酸性微环境,能够智能释放二甲双胍和外泌体,以增强MIRI后的心脏修复。这种多功能水凝胶具有自我修复特性,在细胞水平上,该水凝胶系统表现出显著的抗氧化、抗凋亡、改善电生理特性、线粒体保护和血管生成作用,转录组测序显示了PI 3 K/AKT、VEGF,体内研究进一步证实,水凝胶治疗减少了梗死面积、心脏纤维化和心律失常的发生率,同时改善了心室射血分数并促进了MIRI后心脏功能的恢复。为增强心脏修复和治疗MIRI提供了一种有前途的新型治疗方法。该文章于2025年2月18日以《Injectable pH Responsive Conductive Hydrogel for Intelligent Delivery of Metformin and Exosomes to Enhance Cardiac Repair after Myocardial Ischemia-Reperfusion Injury》为题发表于《Advance Science》(DOI::10.1002/advs.202410590)。
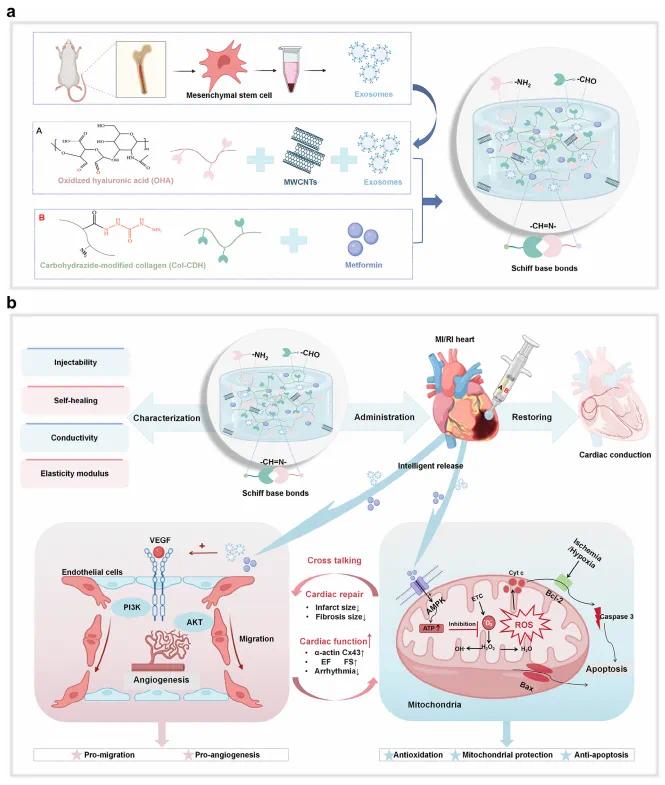
摘要图 | 研究示意图
(1) 水凝胶的制备与表征
该研究从骨髓间充质干细胞(MSCs)中提取外泌体(Exos),并将其与二甲双胍(Met)、氧化透明质酸(OHA)、肼化胶原(Col-CDH)以及多壁碳纳米管(MWCNT)共同构建可注射水凝胶(图1a)。TEM图显示Exos呈典型双层膜结构,粒径集中在125.1 nm(图1b, 1c),Western blot证实其表达CD9、CD63和TSG101(图1d)。共孵育实验显示Exos可被心肌细胞和内皮细胞摄取。材料方面,OHA由高碘酸氧化HA得到,FTIR中1730 cm-1峰证实了醛基形成。Col-CDH通过NHS/EDC法修饰胶原蛋白,引入肼基,FTIR与¹H NMR均证实修饰成功(图1e, 1f)。OHA与Col-CDH交联形成水凝胶,并通过席夫碱键加载药物与Exos。SEM观察到凝胶结构多孔且致密(图1g)。凝胶时间随组分浓度升高而缩短,10%浓度条件下约为20秒,适合注射应用(图1h)。药物释放实验表明,该水凝胶在pH 6.8与7.4环境下均有快速起始释放,后期趋于稳定(图1i, 1j)。在酸性心肌缺血微环境中,席夫碱键易解离,促进Met和Exos智能释放。Met释放更快,利于早期抗氧化抗凋亡,Exos持续释放,有助于后期血管生成与修复。动物实验结果显示,包载Exos的水凝胶在体内具有良好的滞留性和稳定性,14天后仍可检测到生物发光信号(图1k),远优于裸Exos组。
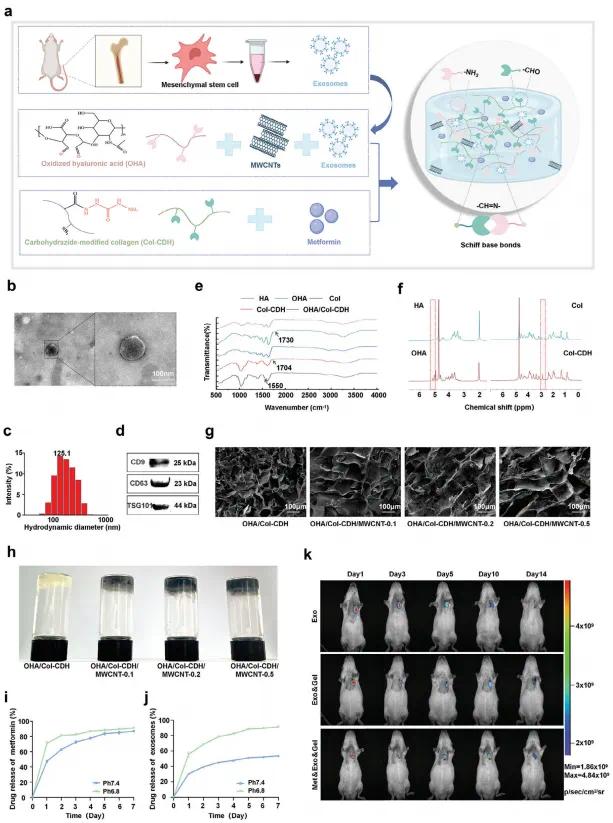
图1.(a)骨髓间充质干细胞外泌体提取及水凝胶系统合成的示意图;(b)MSC-Exos的透射电镜(TEM)图像;(c)MSC-Exos的粒径分布图;(d)外泌体中CD9、CD63和TSG101蛋白表达的Western blot图像;(e)HA、OHA、Col、Col-CDH和OHA/Col-CDH的傅里叶变换红外光谱(FTIR);(f)HA、OHA、Col和Col-CDH的氢核磁共振(¹H NMR)谱图;(g)水凝胶的扫描电镜(SEM)图像;(h)“试管倒置法”展示的水凝胶成型图示;(i)水凝胶中二甲双胍释放曲线;(j)水凝胶中外泌体释放曲线;(k)通过生物发光成像技术追踪外泌体在体内的分布轨迹
(2)水凝胶的多功能性质
图2a显示,所有水凝胶在48小时内达到吸水平衡,MWCNT浓度越高,膨胀率越低。其中,OHA/Col-CDH膨胀率最高,OHA/Col-CDH/MWCNT-0.5最低。适度的膨胀行为有助于其在体内封闭空间中的应用。图2b表明,所有水凝胶在含胶原酶的PBS(pH 7.4)中21天内可完全降解,有利于药物和外泌体的持续释放。流变性能方面(图2c–f),水凝胶在低应变下结构稳定,当应变超过临界点,储能模量G′低于损耗模量G″,网络结构崩解,表现出剪切变稀特性(图2d),这有利于注射。交替应变测试显示水凝胶具良好的自愈性能(图2e)。时间扫描结果(图2f)显示G′始终大于G″,说明水凝胶可迅速形成稳定交联网络。导电性方面,MWCNT的引入显著提高水凝胶导电率(图2g)。OHA/Col-CDH/MWCNT-0.1与-0.2的导电性(约10⁻⁴ S/cm)与天然心肌相当。电化学测试(图S3)显示MWCNT增强了红氧对峰及电容性,表明其有利于心脏电信号传导。图2h显示,水凝胶弹性模量随交联密度升高而增强,其中OHA/Col-CDH/MWCNT-0.2的弹性模量(38 kPa)处于天然心肌(11.9–46.2 kPa)范围内。综合考虑力学、流变与导电性能,OHA/Col-CDH/MWCNT-0.2被选为后续体内外实验用水凝胶。

图2.(a)水凝胶的溶胀曲线.(b)水凝胶的降解曲线. c)水凝胶在不同振荡应变下的储能模量(G′)和损耗模量(G″).(d)水凝胶中粘度和剪切速率之间的关系. (e)水凝胶在经受交替应变时的自修复能力. (f)在时间上进行的流变学评估-水凝胶的扫描模式。(g)水凝胶的电导率。(h)水凝胶的弹性模量
(3)水凝胶处理系统的抗凋亡、抗氧化和线粒体保护作用
图3a展示了二甲双胍与MSC外泌体联合构建的水凝胶在缓解心肌缺血再灌注损伤(MIRI)中的作用机制。通过构建H/R体外模型,评估了不同处理对细胞凋亡与ROS水平的影响。流式细胞术与荧光成像结果(图3c,d,e,f)显示,Met+Exo+Gel组可显著抑制心肌细胞凋亡,表现为TUNEL阳性率降低,Bcl-2上调、Bax下调(图3b)。同时,该水凝胶还显著降低ROS水平。DCFH-DA检测与共聚焦显微镜观察显示,Met+Exo+Gel组绿荧光强度最低(图3g–j),表明ROS生成被显著抑制。水凝胶通过减少氧化应激,有效缓解MIRI过程中的细胞损伤。线粒体保护方面,JC-1染色结果显示,Met+Exo+Gel组能显著恢复H/R诱导的线粒体膜电位丧失(图3k,l);TEM图像亦显示该组线粒体结构保存良好,肿胀和嵴破坏现象显著减少(图3m)。进一步的Western blot分析发现,Met+Exo+Gel显著激活AMPK/PGC1α通路,促进线粒体生物合成,并上调融合蛋白MFN2,抑制裂变蛋白DRP1(图3b),有助于线粒体动态平衡和功能恢复。值得注意的是,Exo+Gel组也上调了PGC1α、MFN2和AKT,说明MSC外泌体中含有多种活性成分,具有促进细胞间通讯和增强线粒体修复的潜力。综上,Met与Exos协同构建的水凝胶在抑制凋亡、降低氧化应激及保护线粒体方面表现出显著治疗效果,适用于MIRI治疗。
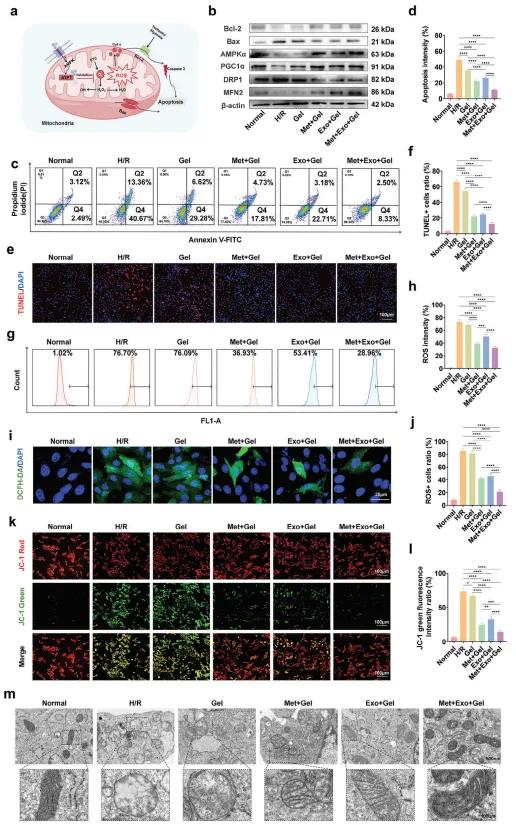
图3.(a)水凝胶系统在抗凋亡、抗氧化及线粒体保护机制方面的示意图;(b)各组中Bcl-2、Bax、AMPKα、PGC1α、DRP1和MFN2蛋白的表达水平;(c)各组细胞凋亡的流式细胞术图像;(d)各组细胞凋亡程度的定量分析(流式细胞术);(e)各组TUNEL染色图像,通过荧光显微镜观察;(f)各组TUNEL阳性细胞比例的定量分析(荧光成像);(g)各组DCFH-DA探针检测ROS的流式细胞术图像;(h)各组细胞ROS水平的定量分析(流式细胞术);(i)各组DCFH-DA荧光探针检测ROS的共聚焦显微镜图像;(j)各组ROS阳性细胞比例的定量分析(共聚焦成像);(k)各组JC-1染色线粒体膜电位的代表性荧光图像;(l)JC-1绿荧光强度比值的定量分析;(m)不同处理组线粒体的透射电镜(TEM)图像
(4)水凝胶处理系统改善心肌细胞电生理特性的研究
新生大鼠心肌细胞(NRCMs)依赖细胞内钙信号节律性收缩。为评估导电水凝胶对其收缩和电生理功能的影响,采用Fluo-4荧光钙探针检测瞬时胞内Ca2+变化。结果显示,H/R组缺乏明显电活动和收缩,而Met+Exo+Gel组显著增强Ca2+传播,表现为峰值上升时间缩短和频率提高(图4a, e, f),表明水凝胶可改善钙信号传导,促进心肌电活动恢复。α-actin是心肌成熟的关键蛋白,Cx43是介导心肌细胞间信号传导的主要缝隙连接蛋白。免疫荧光和Western blot检测显示,导电水凝胶组心肌细胞中α-actin肌节更密集,Cx43表达增强,且定位于细胞膜间(图4b–d, g, h)。Met+Exo+Gel组效果尤为显著,提示其有助于细胞电耦合和同步收缩。此外,整合素信号通路也参与水凝胶介导的心肌修复。Western blot结果(图4d)显示,导电水凝胶组显著上调整合素α5、β1及下游ILK、AKT表达,尤其在含Exo组中更为明显。这可能归因于MSC-Exos激活PI3K/AKT信号通路,进而调控Cx43表达,增强细胞间电连接。综上,导电水凝胶通过增强Ca²⁺传导、激活整合素-ILK-AKT通路和上调α-actin与Cx43表达,促进心肌细胞耦合与同步收缩,展现出良好的心脏电生理修复潜力。
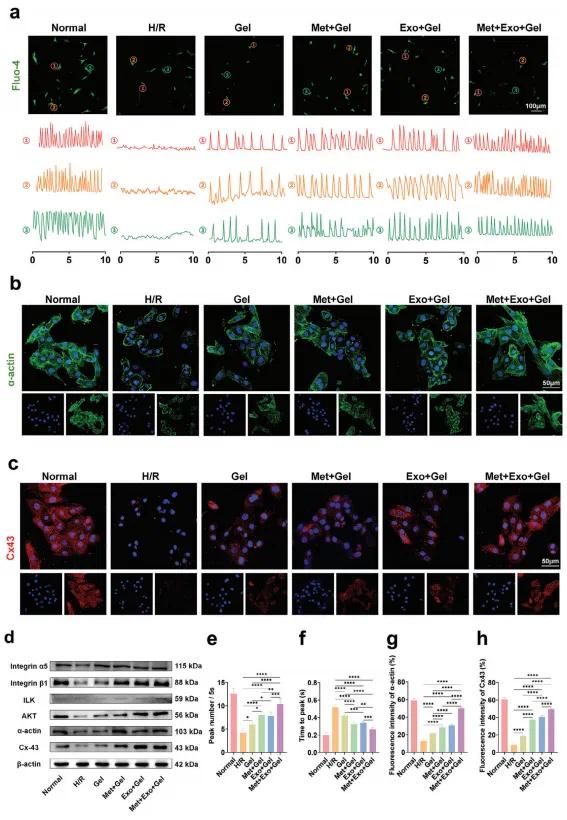
图4. (a)来自不同实验组的NRCM中钙瞬变和相应的Ca 2+频率信号的检查。(b)来自α不同实验组的NRCM中α-肌动蛋白的免疫染色。(c)来自不同实验组的NRCM中Cx 43的免疫染色。(d)整联蛋白α5、整联蛋白β1、ILK、AKT、α-肌动蛋白和Cx43的蛋白质表达水平。(e)定量分析钙瞬时参数,集中于每5秒记录的峰频率。(f)定量分析钙瞬时参数,集中于到达峰的时间。(g)定量分析-肌动蛋白的荧光强度α。(h)定量分析Cx43的荧光强度
(5)水凝胶处理体系的促渗成管效应
有效修复心肌缺血再灌注损伤(MIRI)通常需在梗死边缘启动血管新生反应,逐步向中心扩展,形成密集毛细血管网络,以满足代谢需求并防止心肌细胞进一步坏死(图5a)。该研究在HUVEC构建H/R模型,评估水凝胶系统对细胞迁移与血管生成的促进作用。划痕实验结果(图5b)显示,含MSC-Exos的水凝胶组(Exo+Gel、Met+Exo+Gel)在12小时内显著促进细胞迁移,36小时后几乎完全愈合,而不含Exos的组效果有限。细胞迁移速率定量数据(图5f)与之吻合。Transwell实验亦表明,Exo+Gel与Met+Exo+Gel组显著提升细胞迁移能力(图5c)。血管生成方面,管腔形成实验表明,含MSC-Exos的水凝胶可显著促进血管结构生成,表现为结点、分支数明显增加(图5d, g–i)。Met+Exo+Gel组的管腔生成能力优于单用Exos组,可能与二甲双胍激活AMPK、减轻内皮细胞氧化应激相关。此外,Western blot分析(图5e)显示,Exo+Gel与Met+Exo+Gel组HUVEC中AKT、CD105和VEGF蛋白水平显著升高。CD105是新生血管标志,VEGF是血管生成关键因子,AKT通路则调控内皮细胞增殖与迁移。结果表明,MSC-Exos与二甲双胍协同可激活VEGF/AKT信号通路,增强内皮细胞活性,促进新血管生成,具有良好治疗潜力。
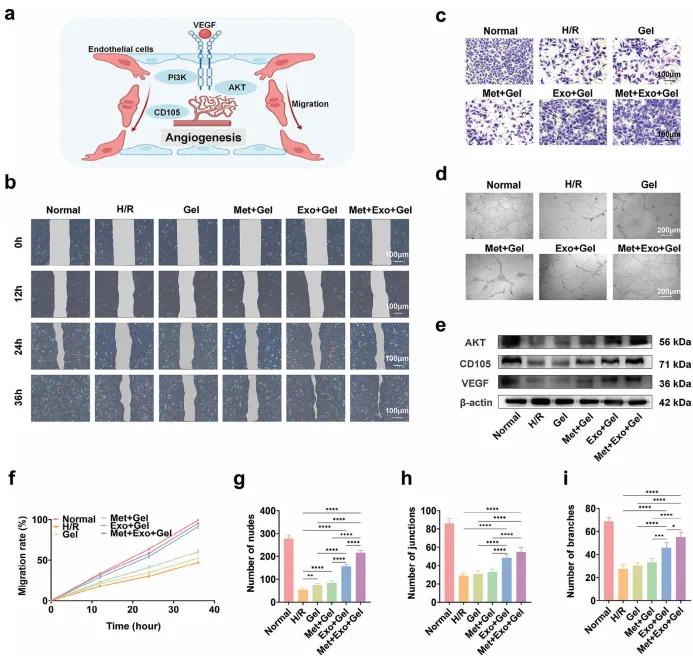
图5. (a)水凝胶系统促进迁移和血管生成的示意图。(b)与水凝胶系统的组分一起培养0、12、24和36小时的HUVEC的代表性图像。(c)与水凝胶组分一起培养的HUVEC的Transwell图像。(d)体外HUVEC形成管的图像。(e)AKT、VEGF和CD 105的蛋白表达水平。(f)12、24和36小时伤口细胞迁移率的线图。(g-i)不同水凝胶组的节点(g)、连接(h)和分支(i)的数量的定量结果
(6)通过RNA测序探索Metabolites/Exosome负载水凝胶系统的潜在机制
为进一步探究多功能水凝胶系统(含二甲双胍与外泌体)对基因转录的调控机制,研究团队对H/R处理的H9c2细胞进行了RNA测序(图6a)。结果显示,H/R组相比对照组共检出2977个差异表达基因(DEGs),其中上调1377个,下调1600个;而Met+Exo+Gel组相较H/R组有2527个DEGs,上调2084个,下调443个(图6b, 6c),说明该水凝胶系统显著调控大量基因表达。GO分析发现,H/R组上调基因与凋亡相关,下调基因涉及细胞周期与染色体分离(图S5),验证H/R促进细胞凋亡并抑制增殖。而Met+Exo+Gel组则显著富集于细胞生长、血管生成与抗氧化通路(图6d)。KEGG分析显示,H/R组基因富集于mTOR、TGF-β、ROS及凋亡等致病通路(图S6),而Met+Exo+Gel组则上调AMPK、自噬、VEGF等修复相关通路,下调凋亡与氧化应激通路(图6e),表明其具有抗凋亡、抗氧化及促血管生成的作用。GSEA进一步证实,该水凝胶系统激活多种关键通路,包括:凋亡(图6f)、内皮迁移(图6g)、细胞发育(图6h)、化学致癌/ROS(图6i)、血管生成(图6j)、PI3K-AKT(图6k)、AMPK(图S7)和VEGF(图S8)等。综上,RNA-seq结果揭示该系统通过多条机制改善心肌细胞功能、促进修复,为MIRI治疗提供了有力的生物信息学支持。
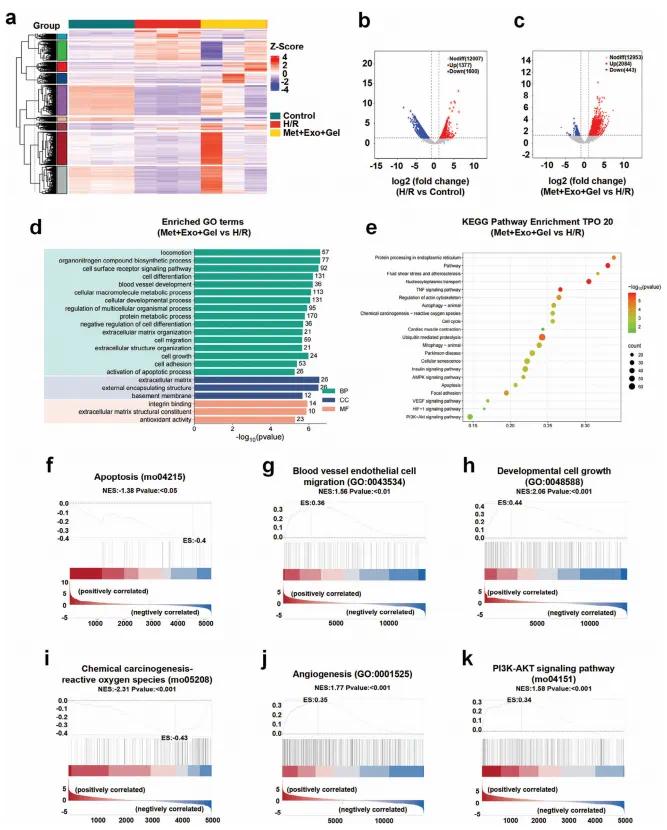
图6.(a)不同处理条件下基因表达水平的热图,每组均设有三个生物学重复;(b)对照组与缺氧复氧(H/R)组间差异表达基因(DEGs)的火山图,展示上下调基因;(c)Met+Exo+Gel组与H/R组间DEGs的火山图;d)Met+Exo+Gel组与H/R组间DEGs的GO功能富集分析;(e)Met+Exo+Gel组与H/R组间DEGs的KEGG通路富集分析;(f)Met+Exo+Gel组与H/R组之间的细胞凋亡信号通路的GSEA分析;(g)血管内皮细胞迁移相关的GSEA分析;(h)发育相关细胞生长的GSEA分析;(i)化学致癌物-活性氧相关通路的GSEA分析;(j)血管生成的GSEA分析;(k)PI3K-AKT信号通路的GSEA分析
(7)多功能水凝胶治疗系统的体内疗效评价
大鼠随机分为六组:Sham、MIRI、Gel、Met+Gel、Exo+Gel、Met+Exo+Gel。注射水凝胶4周后,通过超声M型成像检测心功能,结合HE染色进行组织分析(图7a)。超声结果显示,MIRI组EF、FS显著下降,LVIDd、LVIDs、EDV和ESV明显升高,提示心功能受损与左室重构(图7b, 7f–i)。相比之下,含水凝胶治疗组上述参数均显著改善,说明水凝胶提供了机械支撑与导电调控。其中,Met+Gel和Exo+Gel组EF与FS优于Gel组,表明二甲双胍与MSC-Exos均具独立治疗作用。Met+Exo+Gel组改善最显著,提示两者具有协同效果。组织学分析表明,MIRI组心肌萎缩、壁变薄、纤维化严重,胶原沉积明显(图7c)。水凝胶治疗组心室壁厚度增加,胶原含量减少(图7d, 7e),改善心肌结构重建。Met+Exo+Gel组表现出最厚的左心室梗死壁和最小的梗死面积,可能与其联合抗ROS和抗凋亡作用有关。综上,含二甲双胍与MSC-Exos的多功能水凝胶可显著改善心功能、减少梗死面积并促进心肌重构,具有良好的MIRI治疗潜力。
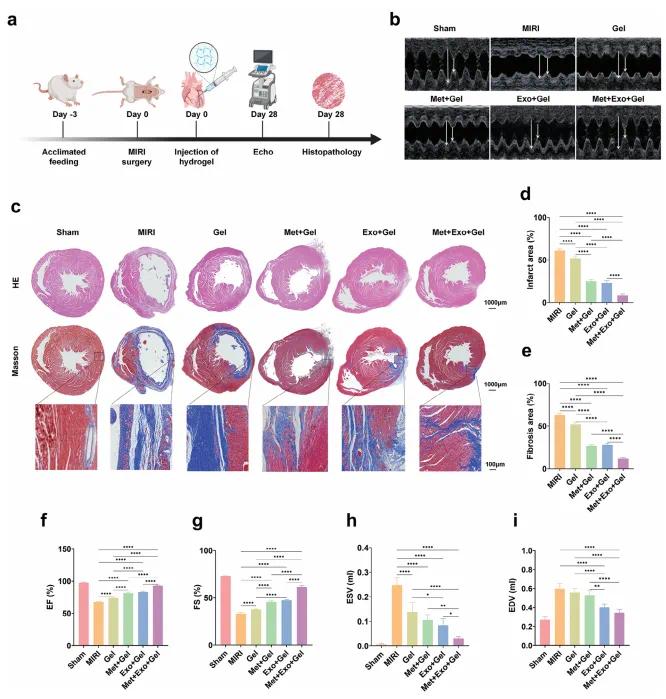
图7. ( a)显示28天过程中MIRI诱导、水凝胶注射、心脏功能评价和病理学检查的时间轴的示意图。(b)每组的代表性超声心动图图像。(c)梗塞区域的HE和Masson染色。高放大率图像取自低放大率图像的黑盒(d,e)定量分析各组治疗后梗死面积(d)和纤维化面积(e)。(f-i)治疗后超声心动图测定心功能指标,包括EF(f)、FS(g)、ESV(h)、EDV(i)
(8)多功能水凝胶在体内抗凋亡、促进细胞增殖和心脏特异性标志物表达的作用
在MIRI发病机制中,心肌微环境会产生大量活性氧(ROS),若未能及时清除,将导致心肌细胞凋亡。采用TUNEL染色检测心肌细胞凋亡。所有水凝胶处理组在术后第3天均减少了细胞凋亡,Met+Gel、Exo+Gel和Met+Exo+Gel组凋亡率显著低于MIRI组,其中Met+Exo+Gel组效果最显著(图8a, 8c)。为了评估水凝胶对心肌细胞增殖和功能恢复的促进作用,研究通过免疫荧光共定位检测cTnT(心肌特异性)、Ki67(增殖标志)与α-actin(结构蛋白)。结果发现,部分cTnT阳性细胞共表达Ki67,提示心肌细胞处于增殖状态,且这些细胞中α-actin表达水平较高,表明心肌肌节结构正在重建(图8b, 8d, 8e)。Met+Gel、Exo+Gel和Met+Exo+Gel组中Ki67与α-actin的表达水平均明显上升。综上,二甲双胍和MSC-Exos协同作用可减少ROS与心肌凋亡,同时促进心肌细胞增殖和结构重建,虽心肌再生尚需进一步验证,但其在心功能修复中具有潜在价值。
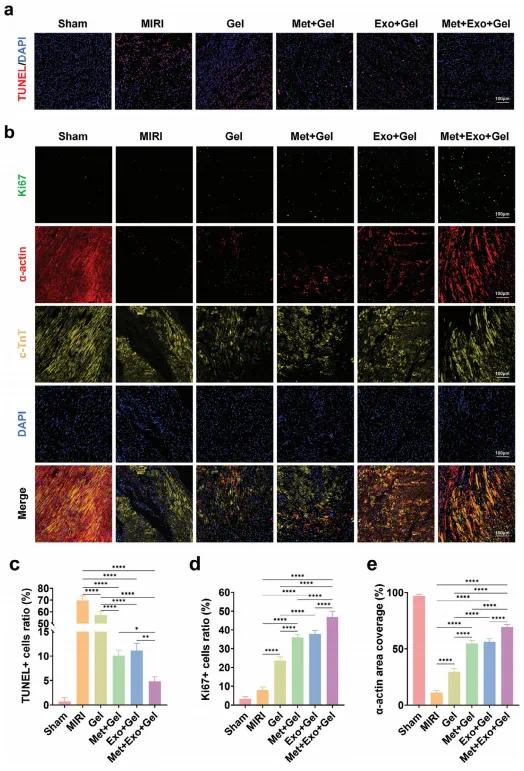
图8. (a)3天后通过不同处理的损伤区域的代表性TUNEL染色图像。(b)4周后通过不同处理的损伤区域中Ki 67、β-肌动蛋白和c-TnT三色染色的免疫荧光图像。(c-e)TUNEL(c)、Ki 67(d)和β-肌动蛋白(e)的定量分析
(9)评价多功能水凝胶在体内改善心肌传导和降低对室性心律失常的易感性的作用
Cx43 是心肌中关键的缝隙连接蛋白,负责电信号耦合,确保心肌细胞同步收缩、维持正常心功能。为评估导电水凝胶在体内对电信号传导的影响,该研究对心肌组织进行了Cx43免疫荧光染色。结果显示,所有水凝胶处理组中,受损区域的Cx43表达均显著高于MIRI组,尤以Met+Exo+Gel组最为显著(图9a, 9c),提示该联合治疗在促进电信号恢复方面具有显著优势。进一步通过程控电刺激(PES)评估水凝胶对心律失常的防治作用。4周后,MIRI组在S1刺激后即出现持续性室性心动过速(VT),而水凝胶组主要表现为短暂的室性早搏(PVC),尤其Met+Exo+Gel组仅在S4后偶发非持续性PVC(图9b, 9d)。水凝胶显著降低心律失常诱发率,说明其可改善电活动稳定性。上述效果归因于MWCNT赋予水凝胶优异导电性,有助于重建损伤区域与周围健康组织间的电信号传导网络,促进电信号在心肌组织中的快速传播,从而降低心律失常风险,恢复心脏电生理功能。
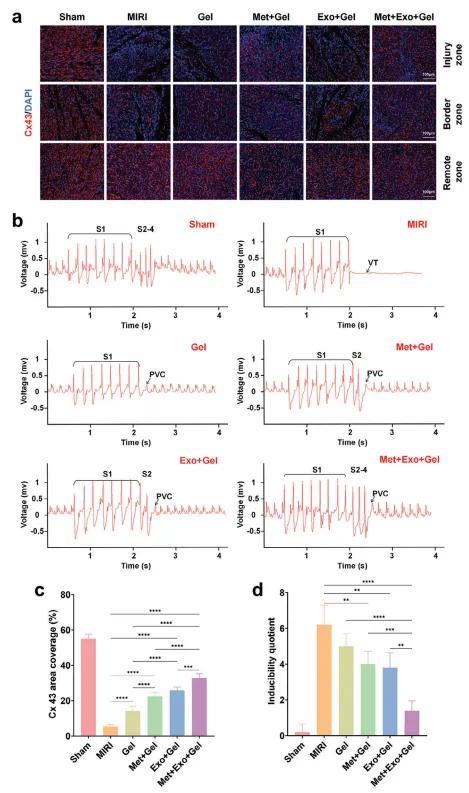
图9.(a)28天后通过不同处理的损伤、边缘和远端区域的代表性Cx43染色图像。(b)注射后4周PES诱导的心律失常的ECG。c)损伤区域中Cx43的定量分析。d)心律失常敏感性由诱发商确定。S1:8次爆发刺激; S2:单次额外刺激; S3:双次额外刺激; S4:三次额外刺激。VT:室性心动过速; PVC:室性早搏
(10)评价多功能水凝胶对体内血管生成的影响
心肌损伤后,重建受损区域的血管系统对恢复心功能至关重要。通过促进血管新生,可有效改善局部氧气与营养供应。本研究采用α-SMA(成熟小动脉标志)、vWF(微血管标志)和CD31(内皮细胞标志)对心肌组织进行免疫染色,以评估各组治疗后血管新生情况。如图10a、10b所示,术后4周,MIRI组血管新生水平较低,可能与心脏代偿机制相关。而各水凝胶处理组均表现出显著的血管生成能力,尤以含MSC-Exos组最为显著,表明外泌体在体内具有良好的促血管生成作用,这一结论与前期体外实验结果一致。进一步对CD31(图10c)、α-SMA(图10d)和vWF(图10e)阳性血管的密度进行定量分析,结果显示Met+Exo+Gel组在新血管数量上明显优于其他组,提示该水凝胶系统不仅可促进细胞增殖,还能有效募集内皮细胞至损伤区域,加速血管网络重建。综上所述,多功能水凝胶通过外泌体介导的促血管生成作用,有效增强心肌组织的血管化过程,为MIRI治疗提供了有前景的治疗策略。
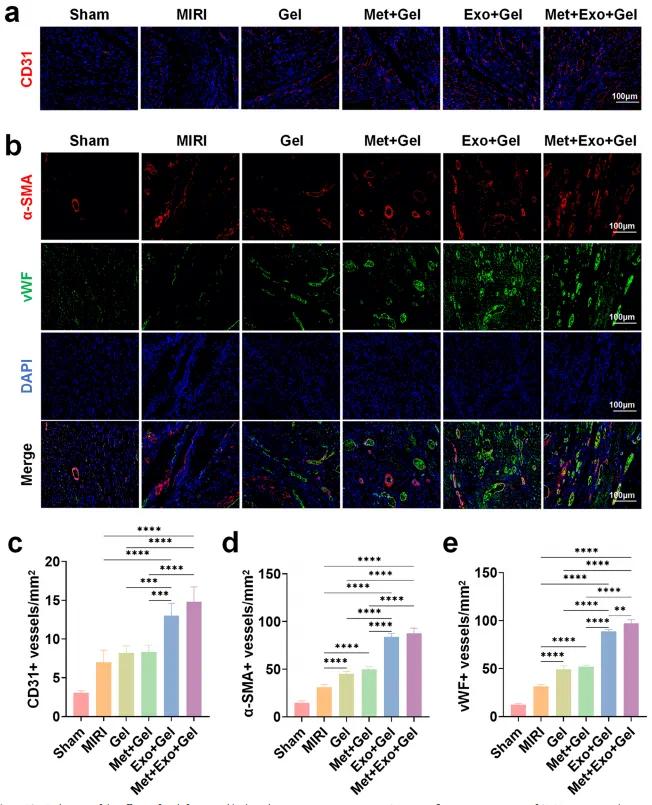
图10.(a)4周后通过不同处理的损伤区域中的CD 31染色的免疫荧光图像。(b)4α周后通过不同处理的损伤区域中的-SMA和vWF双重染色的免疫荧光图像。(c-e)损伤区域中CD 31阳性血管(c)、α-SMA阳性血管(d)和vWF阳性血管(e)的定量分析
该研究基于心肌缺血再灌注损伤(MIRI)的病理微环境特征,开发出一种新型可注射导电水凝胶,载有二甲双胍(metformin)和间充质干细胞来源外泌体(MSC-Exos),可在心肌缺血微酸性环境中实现按需释放。该水凝胶具备稳定的三维交联结构、优异的生物相容性和可注射性,其电导率和弹性模量与天然心肌组织高度匹配。 体内外实验结果显示,水凝胶协同释放的二甲双胍和外泌体能显著保护线粒体结构与功能,降低细胞ROS水平,抑制凋亡,促进细胞迁移与血管生成,改善电生理特性,并具有良好的生物相容性。转录组测序显示,该系统可激活PI3K/AKT、VEGF和AMPK等信号通路,为其抗凋亡和促血管生成作用提供了生物信息学支持。动物实验进一步证实,该水凝胶可有效减少梗死面积和心脏纤维化,降低心律失常发生率,提升射血分数,上调α-actin、Cx43、Ki67和α-SMA表达,下调TUNEL表达,从而显著改善MIRI后的心功能。 综上,研究提出了一种可注射、pH响应性导电水凝胶,实现药物与生物活性物质的智能释放,为MIRI的治疗提供了一种有前景的新型策略。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

