
肿瘤核酸疫苗(包括mRNA和DNA抗原)是一种极具前景的疫苗平台,能够快速、便捷地生产,并高效激发免疫反应。然而,传统的肿瘤核酸疫苗主要通过树突状细胞(DC)递送抗原,这些抗原通过DC的主要组织相容性复合体I(MHC-I)进行处理和呈递,从而激活细胞毒性T淋巴细胞(CTL)。激活后的CTL细胞会浸润到肿瘤组织中,特异性识别并杀死肿瘤细胞。
然而,肿瘤细胞可以通过多种机制形成免疫逃逸,例如下调肿瘤细胞表面的抗原表达,导致激活的CTL细胞无法识别肿瘤细胞。此外,传统的脂质纳米颗粒(LNPs)需要额外的佐剂(如Toll样受体激动剂或STING激动剂)来增强免疫反应,激活DC以呈递抗原并表达共刺激分子。因此,开发一种能够同时调节肿瘤细胞以锚定抗原于肿瘤细胞表面,并作为佐剂促进DC激活的肿瘤核酸疫苗平台至关重要,以实现抗原标记引导的免疫反应。

针对上述问题,山东大学齐鲁医学院第二医院张娜教授团队开发了一种基于人参皂苷Rg3的脂质纳米颗粒(Rg3-LNPs)作为自佐剂的肿瘤核酸疫苗递送系统。该系统通过靶向肿瘤细胞和淋巴结,实现抗原在肿瘤细胞表面的标记以及树突状细胞(DC)的激活,从而增强细胞毒性T淋巴细胞(CTL)对肿瘤细胞的识别和杀伤。同时,Rg3作为自佐剂,抑制免疫抑制细胞浸润和肿瘤血管生成,重塑肿瘤微环境。实验结果表明,Rg3-LNPs与GM-CSF联合应用显著提高了抗肿瘤效果,并在乳腺癌和黑色素瘤小鼠模型中诱导了强大的免疫反应,为肿瘤核酸疫苗的临床转化提供了新策略(图1)。相关研究在2025年4月26日以“Screening Natural Cholesterol Analogs to Assemble Self-Adjuvant Lipid Nanoparticles for Antigens Tagging Guided Therapeutic Tumor Vaccine”为题发表于《Advanced Materials》 (DOI: 10.1002/adma.202419182)上。
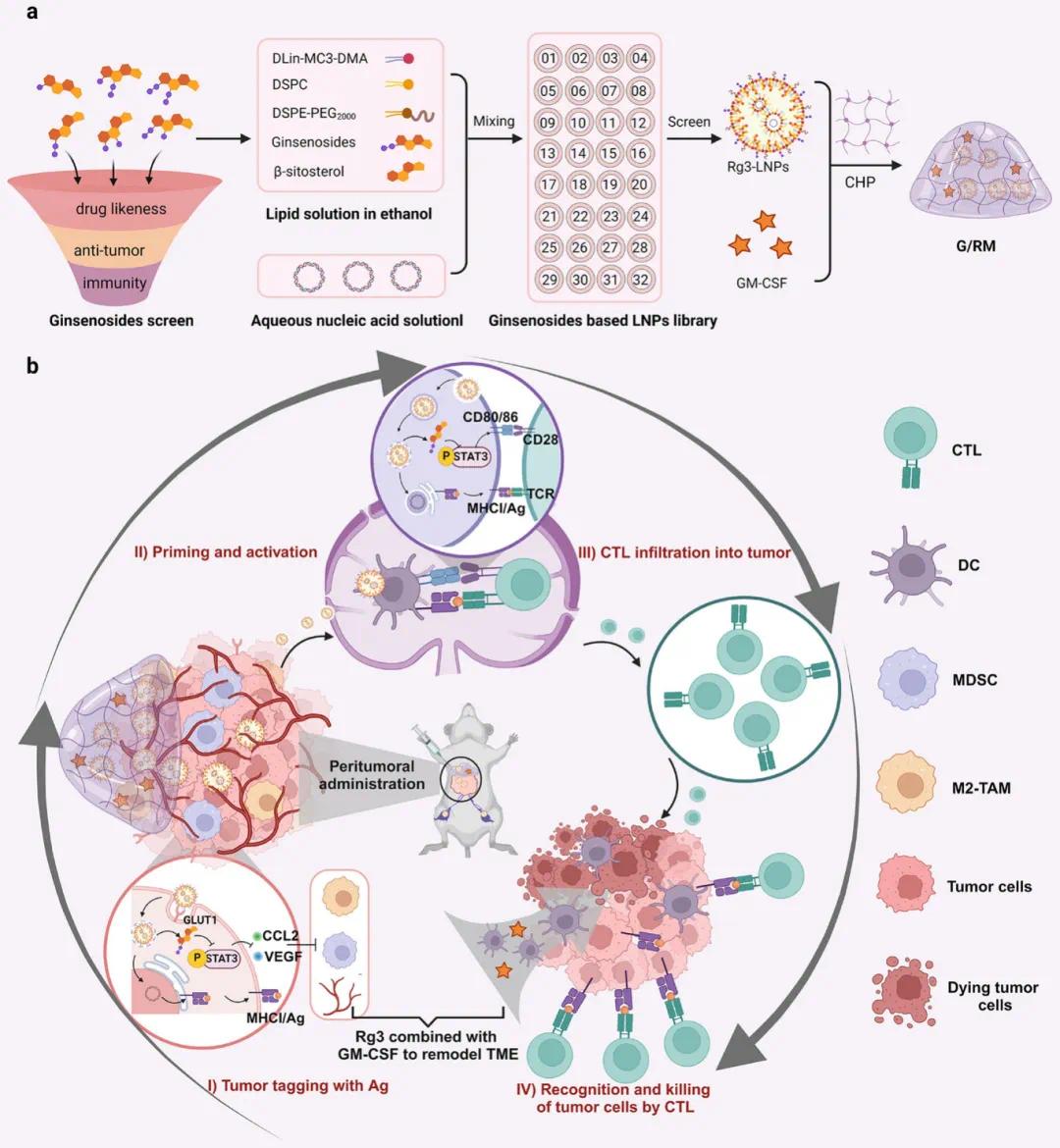
图1 Rg3-LNPs的筛选及应用。(a)Rg3-LNPs与GM-CSF共负载到大孔水凝胶中制备G/RM,用于长期免疫反应。(b)瘤周给药后,Rg3-LNPs聚集于肿瘤和淋巴结,标记肿瘤细胞为抗原并激活树突状细胞作为自辅助,促进CTL识别和杀伤肿瘤细胞,GM-CSF与Rg3协同重塑肿瘤微环境以增强抗肿瘤免疫反应
(1)人参皂苷类脂质纳米粒的建立与筛选
研究人员通过人参皂苷库筛选出26种DL值大于0.18的人参皂苷(图2b),并结合相关数据库确定49个潜在靶点,最终筛选出7种人参皂苷用于构建LNPs。当N/P比为15:1时,LNPs转染效率最高。以β-谷甾醇替代胆固醇构建人参皂苷基LNPs,摩尔比为“3”和“4”时,LNPs粒径小于100 nm且PDI小于0.3(图2e、f)。摩尔比为“3”和“4”的LNPs包封率高于50%(图2g),Rh2-LNPs和Rg3-LNPs在肿瘤细胞和树突状细胞中的转染效率高于Cho-LNPs(图2h、i),Rg3-LNPs表现最优(图2j)。分子对接显示人参皂苷与GLUT1结合位点具有良好的立体互补性,并通过多种相互作用结合,其结合能显著低于胆固醇(图2k、l)。人参皂苷基LNPs的细胞摄取实验表明,4T1肿瘤细胞中GLUT1表达高于HC11细胞,且Rh2-LNPs、Rg3-LNPs等的细胞摄取能力高于Cho-LNPs(图2m,图S1i),预饱和GLUT1后其细胞摄取能力降低,表明人参皂苷可通过GLUT1介导的内吞作用促进LNPs的细胞摄取。膜流动性研究显示,Rg1、Rg2和Rh1增加LNPs膜的流动性,而Rg3和Rh2降低膜流动性、增强膜稳定性(图2n)。分子动力学模拟表明,Rg3和Rh2的糖基可到达水相,增加LNPs膜的稳定性(图2o、p)。结果表明,人参皂苷的糖基位置影响LNPs的稳定性,Rg3通过3位糖基结合GLUT1,稳定LNPs膜并促进细胞摄取,从而提高核酸转染效率。
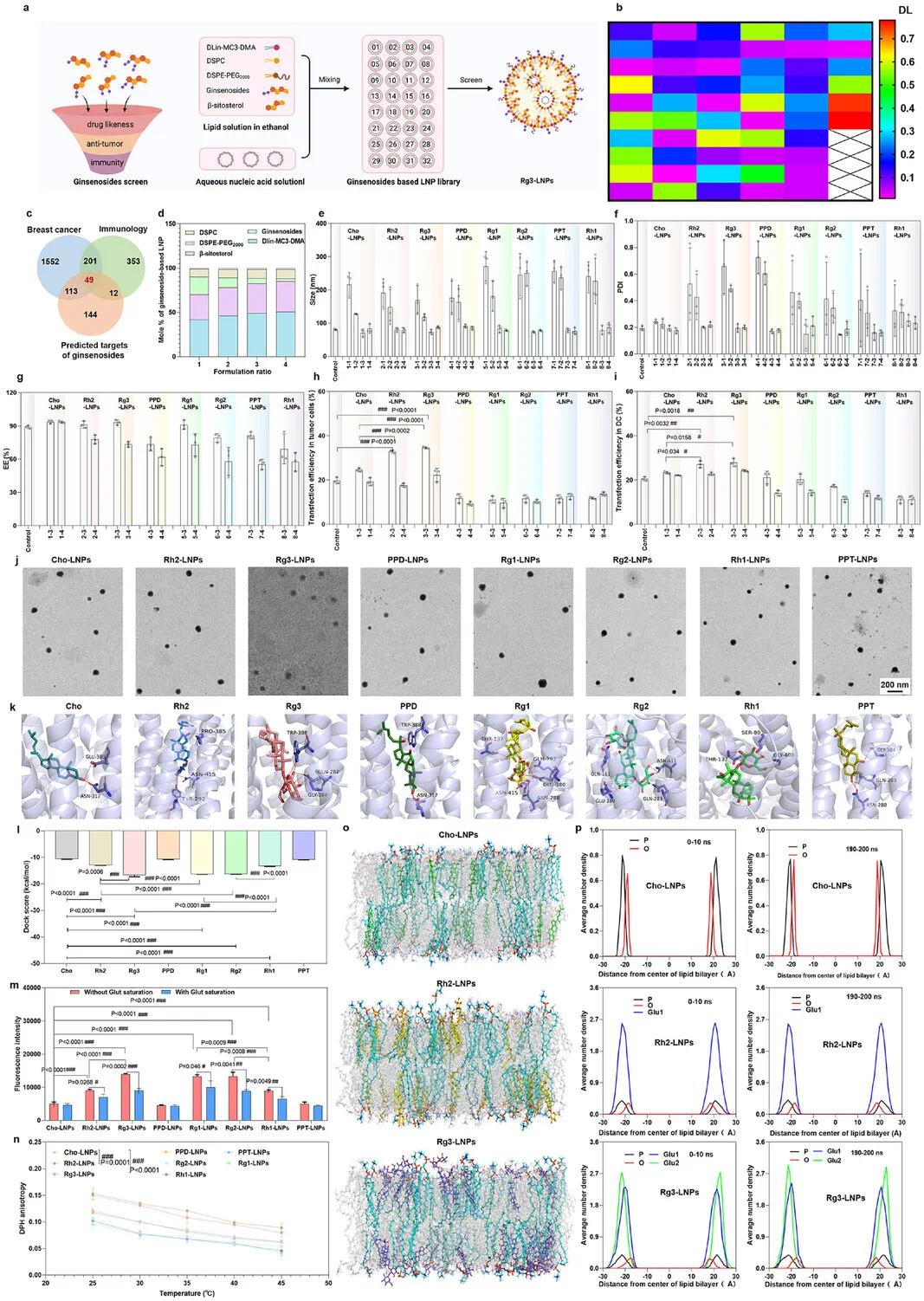
图2 Rg3-LNPs的筛选与表征。(a)Rg3-LNPs筛选示意图;(b)56种人参皂苷的药物相似性;(c)28种人参皂苷靶向抗乳腺癌和免疫相关蛋白的维恩图;(d)基于人参皂苷的LNP配方设计;(e–j)通过粒径(e)、PDI(f)、包封率(g)、肿瘤细胞(h)和树突状细胞(i)中的转染效率以及TEM(j)筛选人参皂苷基LNP;(k)人参皂苷与GLUT1的3D结合模型;(l)人参皂苷与GLUT1的结合能分析;(m)人参皂苷基LNP的细胞摄取能力;(n)人参皂苷基LNP的膜流动性分析;(o,p)分子动力学模拟分析人参皂苷对LNP膜稳定性的影响
(2)Rg3-LNPs与GM-CSF的水凝胶递送系统构建及体内行为研究
优化后的Rg3-LNPs与GM-CSF被封装在大孔水凝胶中制备成G/RM(图3a)。研究发现,空白水凝胶(B-gel)和G/RM在25℃时为液体,35℃时变为凝胶,倒置30秒不流动(图3b),且在室温下具有良好的注射性(图3c)。SEM观察到B-gel和G/RM具有孔径为50-100 µm的多孔结构,G/RM表面粗糙,可观察到嵌入的Rg3-LNPs(图3d)。流变学测量显示,G/RM在1-25℃时G′和G″无明显变化,35℃时从液态转变为半固态凝胶,温度继续升高后完全转变为固态凝胶(图3e)。Rg3-LNPs和GM-CSF从G/RM中能够持续释放,14天后分别释放了83%和89%(图3f)。
荧光染料Cy5标记的Rg3-LNPs装载到大孔水凝胶中并瘤周注射到4T1荷瘤小鼠后,体外荧光成像显示其荧光信号在15天内持续积累于淋巴结和肿瘤(图3g),且在第3天达到峰值(图3h)。以Cy5标记的BSA代替GM-CSF制备G/GM-CSF并皮下注射到小鼠后,G/GM-CSF组在肿瘤部位的荧光强度持续存在(图3i),且在第3天达到峰值,但其在淋巴结的荧光强度弱于G/Rg3-LNPs组(图3j)。自由Cy5的荧光信号在第10天几乎无法检测,而G/Rg3-LNPs和G/GM-CSF组在监测期间保持较强的荧光强度,表明大孔水凝胶提高了体内药物滞留(图3k)。CHP溶液在体内迅速形成凝胶状态,并在15天内持续降解,10天内约降解70%,15天内大部分降解完成(图3l)。HE染色分析显示CHP材料未对周围皮肤组织造成损伤(图3m),表明大孔水凝胶在体内可降解且具有良好的生物相容性。
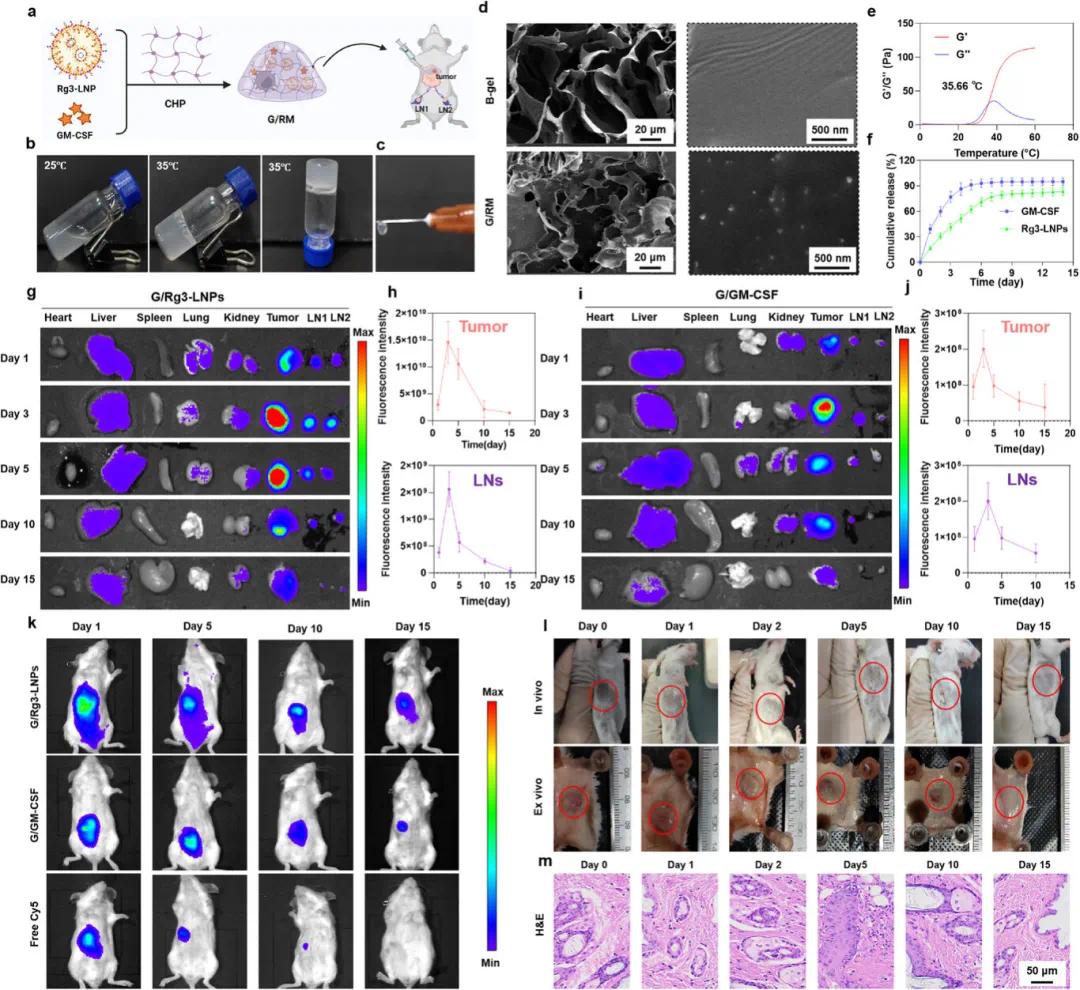
图3 G/RM的制备与性能表征。(a)G/RM制备示意图;(b)25℃和35℃下G/RM的溶胶-凝胶转变照片;(c)G/RM的可注射性;(d)G/RM的SEM图像显示多孔结构;(e)G/RM的流变特性;(f)Rg3-LNPs和GM-CSF从G/RM中的体外释放结果;(g)负载Cy5标记的Rg3-LNPs(G/Rg3-LNPs)的水凝胶处理后的离体荧光成像;(h)G/Rg3-LNPs处理后小鼠4T1肿瘤和淋巴结的荧光强度;(i)负载Cy5-BSA(G/GM-CSF)的水凝胶处理后的离体荧光成像;(j)G/GM-CSF处理后小鼠4T1肿瘤和淋巴结的荧光强度;(k)G/Rg3-LNPs、G/GM-CSF和游离Cy5的体内保留情况;(l)G/RM的降解行为;(m)皮下组织的免疫组织化学切片图像
(3)Rg3-LNPs对肿瘤细胞和树突状细胞的调节作用研究
Rg3-LNPs在肿瘤细胞表面锚定抗原的能力通过倒置荧光显微镜观察,结果显示装载MHC-I结合肽的Rg3-LNPs具有明显荧光强度(图4b)。Rg3可显著降低4T1细胞上清液中VEGF和CCL2水平(图4c、d),分子对接预测其核心靶点为STAT3和IL-2,且与STAT3的亲和力是与IL-2的2.3倍(图4e)。Transwell实验表明,Rg3和Rg3-LNPs可显著抑制M2型肿瘤相关巨噬细胞的迁移(图4f、g)。血管内皮细胞管状形成实验显示,Rg3和Rg3-LNPs可抑制肿瘤血管生成(图4h、i)。
Rg3-LNPs促进树突状细胞(DC)激活和抗原呈递的能力通过装载MHC-I结合肽的Rg3-LNPs的荧光强度证实(图4k)。流式细胞术结果显示,Rg3和Rg3-LNPs可提高成熟DC的比例(图4l、m)。这些结果表明,Rg3-LNPs作为一种自佐剂,可通过调节肿瘤细胞和DC,标记肿瘤细胞表面抗原并促进DC激活,确保CTL识别并杀伤肿瘤细胞。
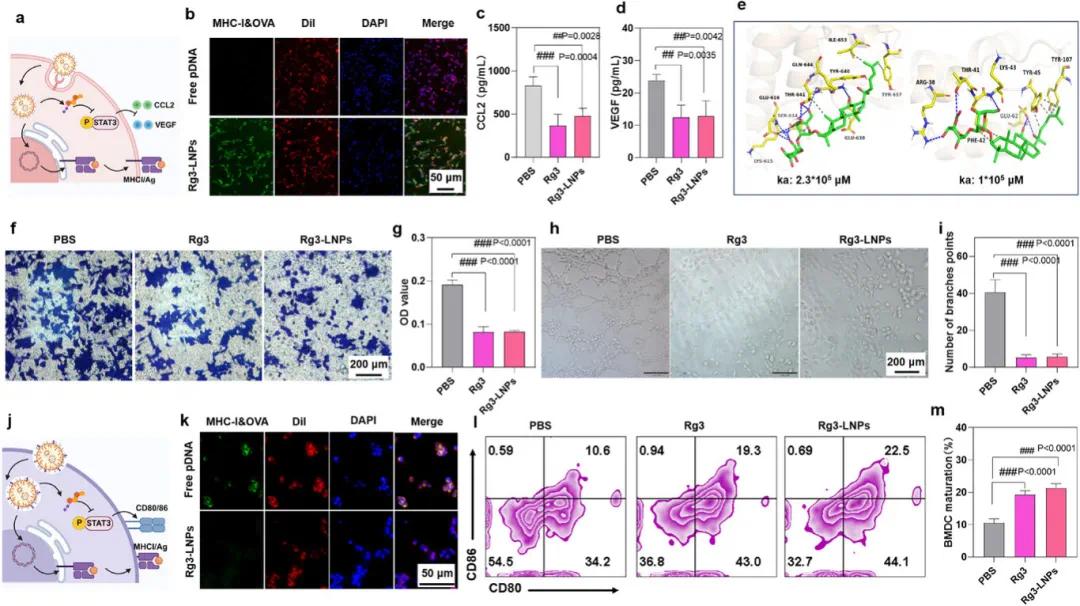
图4 Rg3-LNPs的抗原标记、免疫调节及DC激活能力。(a)Rg3-LNPs用于抗原标记肿瘤细胞及下调免疫抑制因子分泌的示意图;(b)体外荧光图像显示Rg3-LNPs可将抗原锚定于肿瘤细胞表面;(c,d)Rg3抑制肿瘤细胞CCL2(c)和VEGF(d)分泌;(e)分子对接显示Rg3与STAT3有较强的亲和力;(f,g)M2-TAM细胞迁移的显微镜分析(f)和定量分析(g),表明Rg3通过下调肿瘤细胞CCL2分泌抑制M2-TAM细胞迁移;(h,i)体外管腔形成实验的代表性图像(h)和定量分析(i),显示Rg3抑制肿瘤血管生成;(j)Rg3-LNPs促进DC活化及抗原呈递的示意图;(k)荧光图像显示Rg3-LNPs促进树突状细胞(DC)抗原呈递;(l,m)体外骨髓来源的树突状细胞(BMDC)成熟的检测(l)和定量数据(m),表明Rg3和Rg3-LNPs促进DC成熟
(4)G/RM的抗肿瘤效果评估
在原位乳腺癌小鼠模型中,G/RM的抗肿瘤效果被评估,给药方案如图5a所示。肿瘤生长曲线显示,生理盐水(NS)组和空白水凝胶(B-gel)组的肿瘤从第0天到第15天迅速生长(图5b)。与装载胆固醇脂质纳米颗粒(Cho-LNPs)的水凝胶(G/Cho-LNPs)组相比,装载Rg3-LNPs的水凝胶(G/Rg3-LNPs)组的肿瘤生长显著延迟,而G/RM组的肿瘤体积最小(图5b)。各组肿瘤组织被称重并拍照,结果支持G/RM组具有最佳的抗肿瘤效果(图5c、e)。G/RM组小鼠的体重未出现明显下降(图5d)。4T1荷瘤小鼠的HE染色结果显示,B-gel和G/RM处理组未出现明显的组织损伤(图S2a)。肿瘤坏死、凋亡和细胞增殖的分析表明,G/RM处理导致更多的肿瘤细胞坏死、更少的增殖和更高的凋亡(图5g)。总体而言,G/RM显著抑制了肿瘤生长。
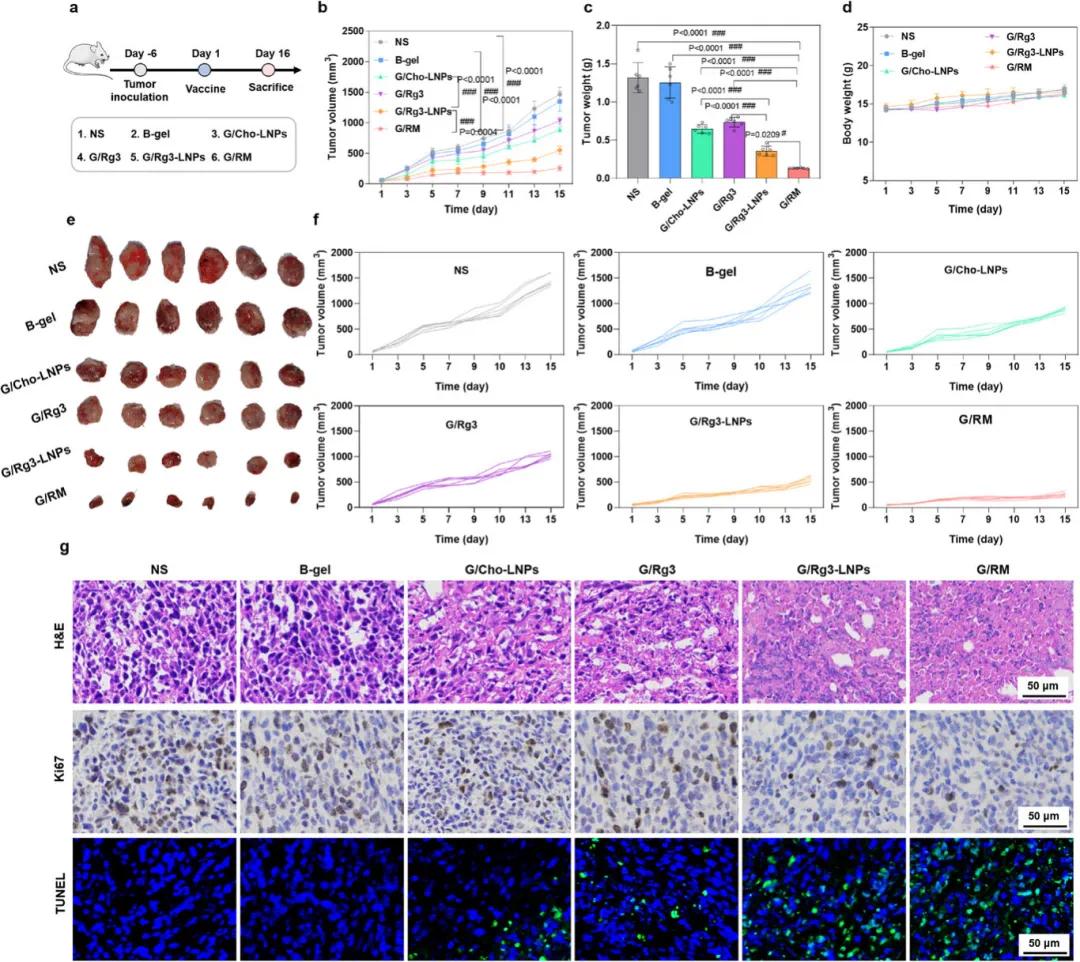
图5 自辅助Rg3-LNPs在原位乳腺癌小鼠模型中的抗肿瘤效果。(a)治疗方案示意图;(b)小鼠肿瘤体积变化;(c)肿瘤重量;(d)小鼠体重变化;(e)肿瘤组织照片;(f)各组肿瘤体积曲线;(g)肿瘤组织的免疫组织化学切片
(5)G/RM对肿瘤免疫微环境的调节作用研究
在原位乳腺癌小鼠模型中,对治疗后的肿瘤免疫表型进行分析。结果显示,G/Rg3-LNPs组淋巴结中成熟树突状细胞(DC)比例高于G/Cho-LNPs组,G/RM组显著高于NS组、B-gel组和G/Rg3-LNPs组(图6a、e)。在肿瘤组织中,G/RM组的CD3+CD4+ T细胞(图6b、f)、CD3+CD8+ T细胞(图6c、f)和CTL(图6d、g)水平显著高于NS组、B-gel组和G/Rg3-LNPs组。此外,G/RM组的免疫抑制细胞(MDSC、M2-TAM和Treg细胞)比例低于NS组、B-gel组和G/Rg3-LNPs组(图6h-m)。ELISA检测显示,G/RM组促炎细胞因子(IFN-γ、TNF-α和IL-12)水平高于NS组、B-gel组和G/Cho-LNPs组,免疫抑制细胞因子(TGF-β和IL-10)水平低于上述各组(图6n)。免疫荧光染色显示,G/Rg3-LNPs和G/RM组肿瘤组织中pSTAT3信号显著弱于NS组、B-gel组和G/Cho-LNPs组,且VEGF和CCL2水平显著低于上述各组(图6n),表明Rg3通过抑制STAT3磷酸化抑制肿瘤细胞分泌CCL2和VEGF。综上,G/RM在调节肿瘤微环境和增强抗肿瘤免疫反应方面具有显著潜力。
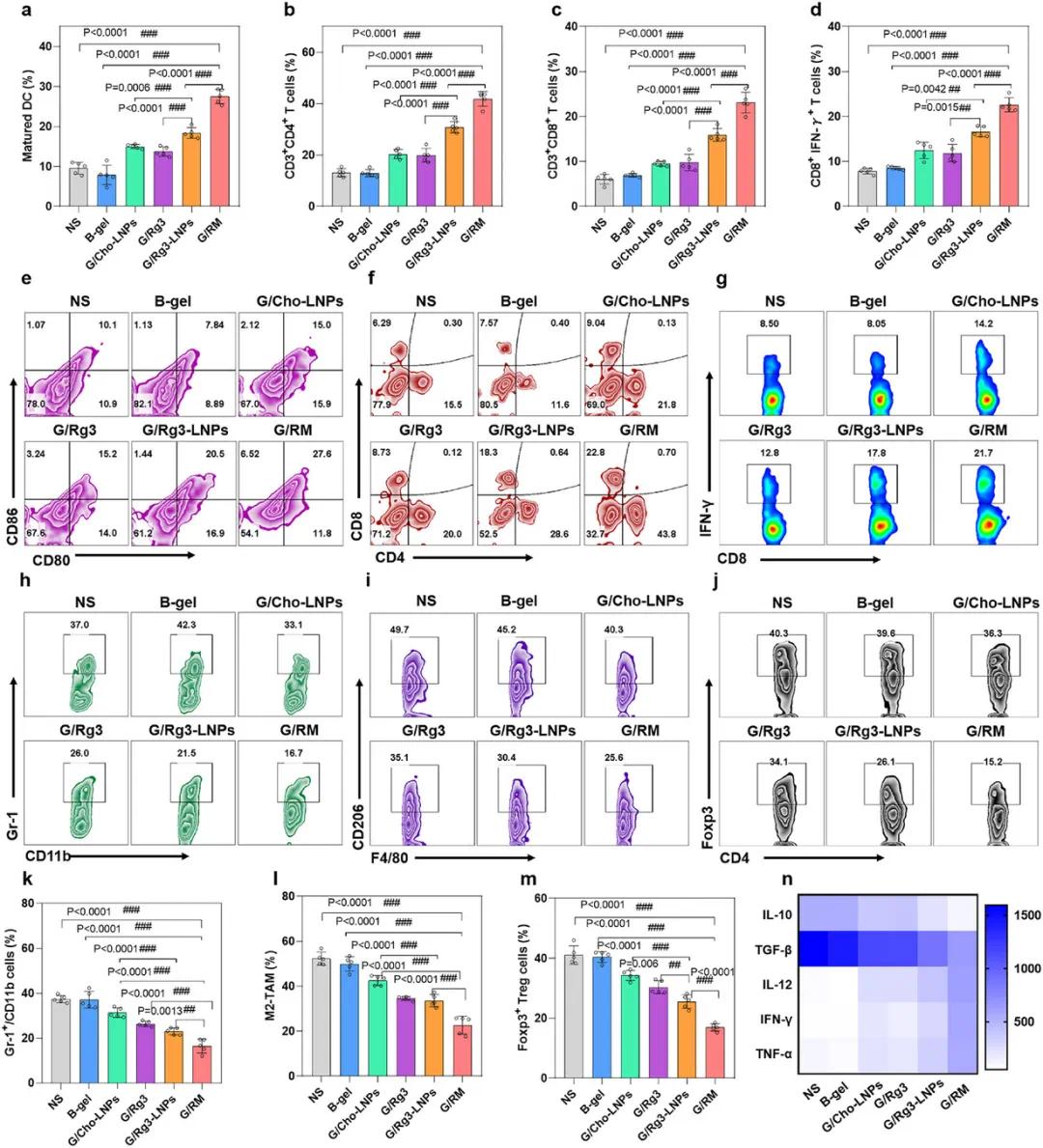
图6 自辅助Rg3-LNPs重塑肿瘤微环境并诱导抗肿瘤免疫。(a,e)淋巴结中成熟DC比例;(b,c,f)肿瘤组织中CD3+CD4+和CD3+CD8+ T细胞比例;(d,g)肿瘤组织中CTL(CD8+IFN-γ+)比例;(h,k)肿瘤组织中MDSC(Gr-1+CD11b+)比例;(i,l)肿瘤组织中M2-TAM(F4/80+CD206+)比例;(j,m)肿瘤组织中Treg(CD4+Foxp3+)细胞比例;(n)肿瘤组织中TNF-α、IFN-γ、TGF-β、IL-12和IL-10水平
(6)G/RM的抗转移能力及免疫记忆效应评估
为评估G/RM的抗转移能力,构建了肺转移模型,给药方案如图7a所示。肿瘤生长曲线显示,G/Rg3-LNPs组和G/RM组的肿瘤生长受到抑制(图S2m)。收集并称重肿瘤组织,G/RM组表现出最佳抗肿瘤效果(图S2n)。通过IVIS检测荧光素酶标记的4T1-Luc细胞的生物发光信号,观察肺转移情况。第16天处死小鼠,收集肺组织进行拍照和HE染色分析。结果显示,G/Rg3-LNPs和G/RM组在第10天和第15天的荧光信号最弱,表明其抑制了肺转移(图7b)。解剖的肺组织分析显示,G/Rg3-LNPs和G/RM组的荧光强度最弱且肺部膨胀较小(图7c、d)。定量肺荧光结果显示,G/Rg3-LNPs和G/RM组的荧光信号低于其他组(图7e),且肺重量也低于其他组(图7f)。HE染色显示,G/Rg3-LNPs和G/RM组的肺组织中转移病灶较少(图7g),表明其具有显著的抗转移效果。
为评估抗肿瘤免疫记忆反应,进行了肿瘤再挑战实验,实验设计如图7h所示。结果显示,NS组和B-gel组的小鼠在50天内全部死亡,而G/RM组在50天内的生存率为66.6%(图7j)。在肿瘤再挑战后14天收集小鼠脾脏,检测效应记忆T细胞(Tem)和中央记忆T细胞(Tcm)的比例。结果显示,G/Rg3-LNPs组的CD4+ T细胞和CD8+ T细胞中Tem和Tcm的比例显著增加(图7i、k、l);G/RM组的Tem和Tcm比例也显著增加(图7i、k、l)。
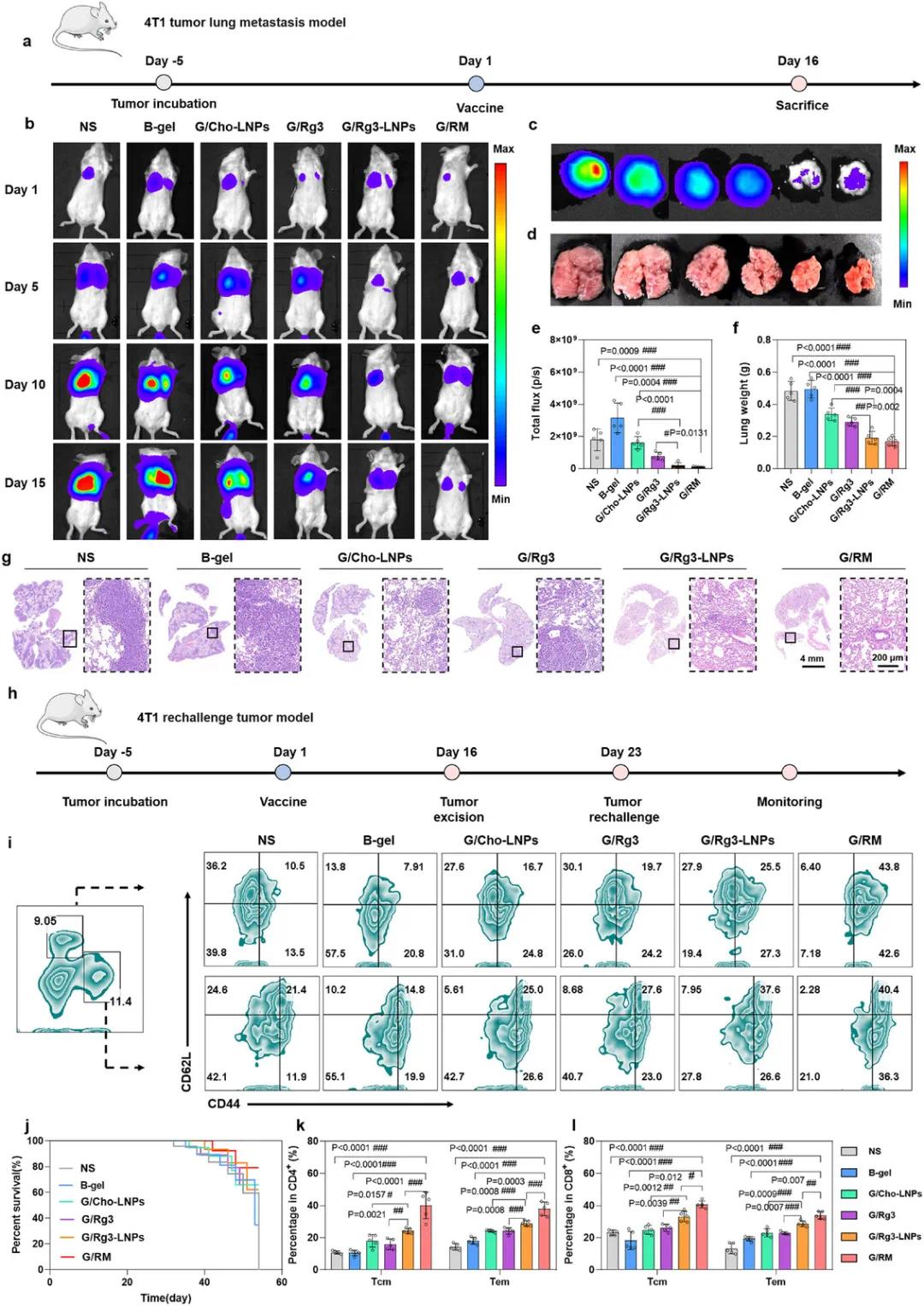
图7 自辅助Rg3-LNPs抑制乳腺癌转移并引发免疫记忆。(a)肺转移抑制试验示意图;(b)体内生物发光图像;(c)肺部离体生物发光图像;(d)小鼠肺部照片;(e)4T1小鼠离体肺的相对生物发光强度;(f)小鼠肺重量;(g)肺组织的H&E染色图像;(h)免疫记忆试验示意图;(i)治疗小鼠的生存曲线;(j)脾脏中CD4+和CD8+ T细胞的Tcm(CD62L+CD44+)和Tem(CD62L-CD44+)亚群的流式细胞术图;(k)CD4+ T细胞的定量结果;(l)CD8+ T细胞的定量结果
(7)G/RM在B16F10黑色素瘤模型中的抗肿瘤效果评估
在GLUT1过表达的B16F10黑色素瘤小鼠模型中,评估了G/RM的抗肿瘤效果。使用表达卵清蛋白(OVA)的质粒装载到Rg3-LNPs中制备G/RM,给药方案如图8a所示。监测各组的肿瘤生长曲线(图8b、f),结果显示,生理盐水(NS)组和空白水凝胶(B-gel)组的肿瘤体积从第0天到第11天迅速增加,第11天时达到约2000 mm³。治疗后,G/Rg3-LNPs组的肿瘤体积低于G/Cho-LNPs组,而G/RM组的肿瘤体积进一步降低(图8b、f)。治疗后的小鼠肿瘤组织被称重并拍照,G/RM组显示出最高的肿瘤抑制率(图8c、e)。此外,G/RM组的肿瘤细胞表现出更高的坏死率、更低的增殖率和更高的凋亡率(图8g),表明G/RM能够抑制黑色素瘤的生长。记录了各组小鼠的体重变化,G/RM组未观察到明显的体重变化(图8d)。主要器官的H&E染色结果显示,G/RM组未出现明显的器官损伤,表明G/RM具有良好的生物相容性和安全性。
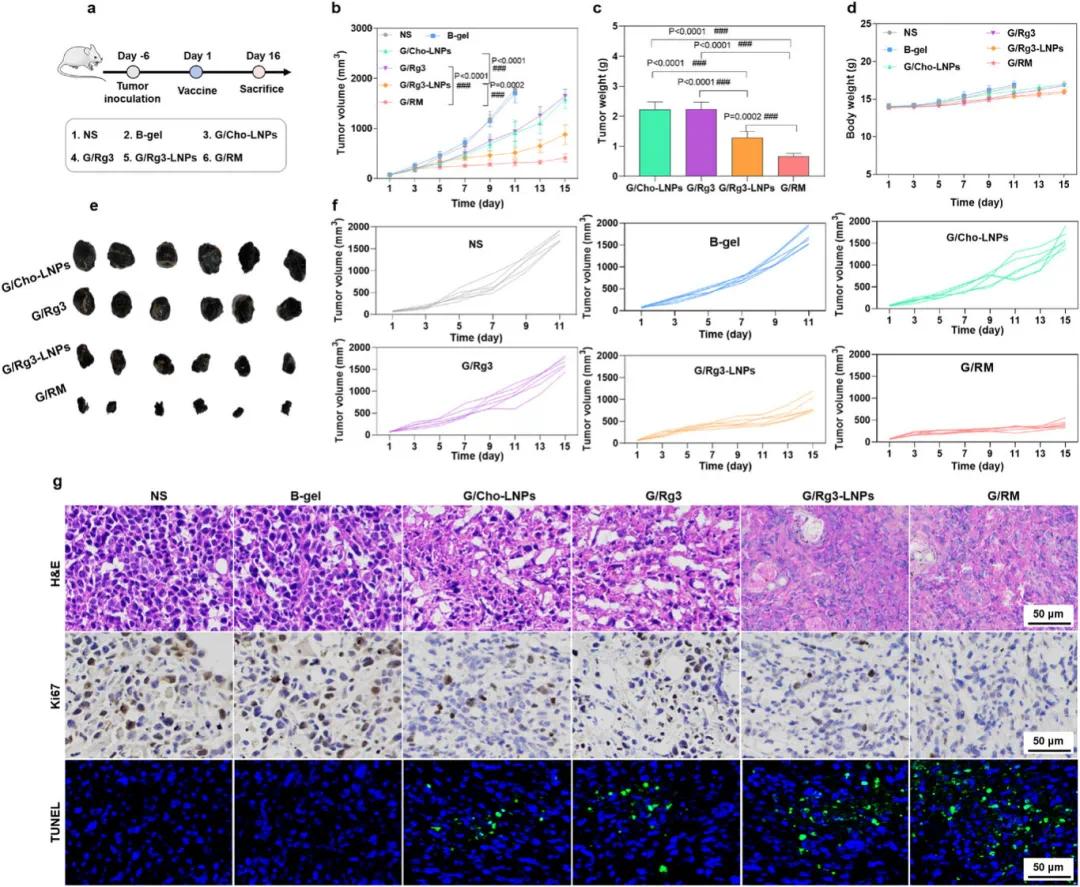
图8 自辅助Rg3-LNPs在原位黑色素瘤小鼠模型中的抗肿瘤效果。(a)治疗方案示意图;(b)小鼠肿瘤体积变化;(c)肿瘤重量;(d)小鼠体重变化;(e)肿瘤组织照片;(f)各组个体肿瘤体积曲线;(g)肿瘤组织的免疫组织化学切片
(8)G/RM在B16F10黑色素瘤模型中对肿瘤免疫微环境的调节作用
在B16F10黑色素瘤模型中,检测了肿瘤微环境(TME)中免疫细胞的丰度和细胞因子的浓度。结果显示,G/Rg3-LNPs组淋巴结中的成熟树突状细胞(DC)比例高于G/Cho-LNPs组,G/RM组肿瘤中的成熟DC比例高于NS组、B-gel组和G/Rg3-LNPs组,G/Rg3-LNPs组肿瘤中的成熟DC比例高于G/Rg3组和G/Cho-LNPs组(图9a、e)。G/RM组肿瘤中招募的DC数量显著高于NS组、B-gel组和G/Rg3-LNPs组(图S2p、q)。G/RM组肿瘤中CD3+CD4+ T细胞(图9b、f)和CD3+CD8+ T细胞(图9c、f)比例显著高于NS组、B-gel组和G/Rg3-LNPs组。装载卵清蛋白(OVA)的G/RM组中,OVA特异性CD8+ T细胞的频率显著高于NS组、B-gel组和G/Rg3-LNPs组(图9d、g),表明G/RM增强了表位特异性细胞毒性T淋巴细胞(CTL)的扩增。
G/RM组的免疫抑制细胞(MDSC、M2-TAM和Treg细胞)比例低于NS组、B-gel组和G/Rg3-LNPs组(图9h-m),G/Rg3-LNPs组治疗后这些免疫抑制细胞的比例也显著低于G/Cho-LNPs组。G/RM组的促免疫细胞因子(IFN-γ、TNF-α和IL-12)浓度高于NS组、B-gel组和G/Rg3-LNPs组,而免疫抑制细胞因子(TGF-β和IL-10)浓度低于其他组(图9n,图S2r-v)。综上,G/RM水凝胶在调节B16F10黑色素瘤模型的肿瘤微环境和增强抗肿瘤免疫反应方面显示出巨大潜力。
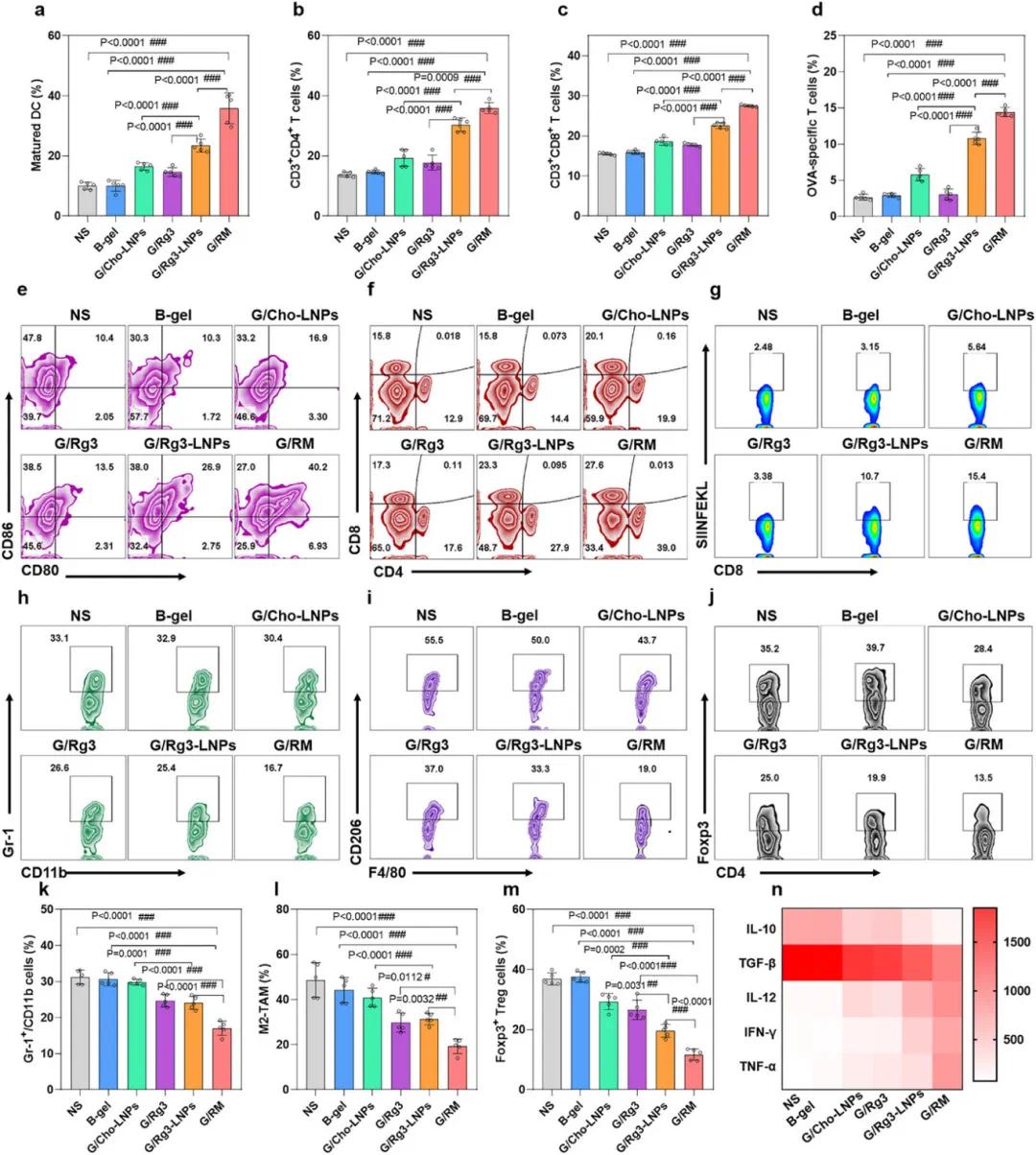
图9 自辅助Rg3-LNP在原位黑色素瘤模型中增强抗肿瘤免疫力。(a,e)淋巴结中成熟DC的比例;(b,c,f)肿瘤组织中CD3+CD4+和CD3+CD8+ T细胞的比例;(d,g)肿瘤组织中OVA特异性T细胞的比例;(h,k)肿瘤组织中MDSC的比例;(i,l)肿瘤组织中M2-TAM的比例;(j,m)肿瘤组织中Treg细胞的比例;(n)肿瘤组织中TNF-α、IFN-γ、TGF-β、IL-12和IL-10细胞因子水平
肿瘤细胞表面抗原的丢失是导致肿瘤疫苗应答率低的关键因素,限制了细胞毒性T淋巴细胞(CTL)对肿瘤细胞的识别和作用。本研究通过筛选天然胆固醇类似物,构建了自佐剂脂质纳米颗粒(LNPs),用于抗原标记引导的治疗性肿瘤疫苗。 优化后的Rg3-LNPs借助肿瘤细胞过表达的GLUT1靶向肿瘤细胞,并将抗原锚定于肿瘤细胞表面,从而增强CTL对肿瘤细胞的识别能力。同时,Rg3-LNPs在淋巴结(LNs)中富集,促进树突状细胞(DC)的活化和抗原呈递,进而刺激CTL的生成。此外,Rg3作为佐剂,通过抑制STAT3磷酸化重塑肿瘤微环境(TME),与GM-CSF协同作用,诱导强烈的免疫反应,促进CTL对肿瘤细胞的杀伤。 本研究强调了抗原标记在肿瘤免疫治疗中的重要性,并指出在肿瘤疫苗设计中同时调控肿瘤细胞和树突状细胞(DC)的必要性。自辅助Rg3-LNPs作为一种肿瘤疫苗平台,能够通过抗原标记肿瘤细胞和激活DC来引导CTL识别和杀伤肿瘤细胞,拓宽了治疗性肿瘤疫苗的应用范围,包括免疫逃逸型肿瘤,展现出良好的临床应用前景。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

