
炎症性肠病(IBD),包括溃疡性结肠炎和克罗恩病,近年来发病率不断上升。现有治疗如手术和药物疗效有限且副作用大,因此需开发更安全有效的方法。病程中,ROS积累引发氧化应激,破坏肠屏障,激活免疫反应,加剧炎症。清除ROS成为关键治疗策略。尽管CeO₂纳米粒子具优异抗氧化性,但在胃肠道中活性下降,需进一步改性。Nrf2通路能促进内源性抗氧化,但体内硒含量不足限制了持续激活,适当补硒可增强疗效。此外,ROS反应产物促进致病菌生长,破坏肠道菌群,加剧病情。因此,结合抗氧化、调控菌群和修复屏障的综合治疗策略显得尤为重要。

针对上述问题,安徽医科大学王婉妮团队研究开发了包埋于海藻酸钙水凝胶的ZnxCeyO2/Se(ZCSO)系统,可口服高效清除ROS并调节肠道菌群。ZCO具有可逆Ce³⁺/Ce⁴⁺活性位点,释放Zn²⁺修复肠屏障,Se层激活Nrf2通路增强抗氧化。小鼠实验表明,ZCSO顺利到达结肠,缓解氧化应激,促进GPx4生成,抑制铁死亡并改善菌群,为IBD治疗提供新思路。该文章于2025年04月16日以《Orally Administered ZnxCeyO2/Se Hydrogel with Effective Antioxidant Activity for Treating Inflammatory Bowel Disease by Inhibiting Ferroptosis》为题发表于《AHM》上(DOI: org/10.1002/adhm.202500088)。
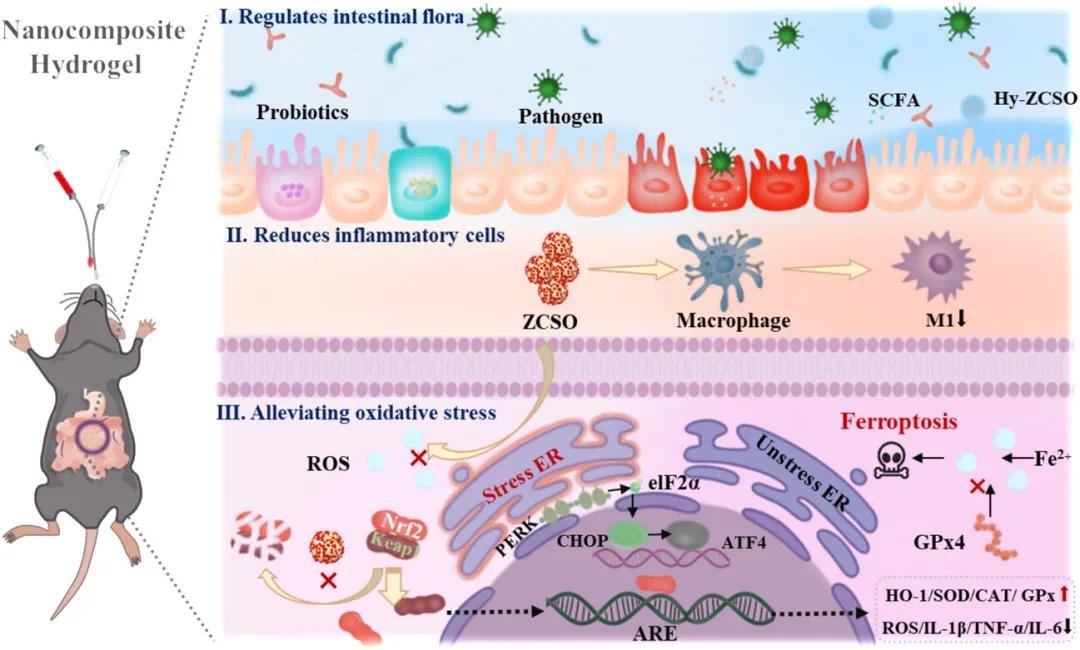
研究示意图
(1)ZO、ZCO和ZCSO的制备、表征、释放和性质
如图1A所示,ZCO NPs通过以ZO为模板的离子掺杂反应合成,并经亚硒酸钠包覆及还原形成ZCSO。合成过程中的颜色变化如图1B所示,从白到黄再到红。透射电镜(图1C)显示其为球形,动态光散射测得最终粒径为167.25 nm± 3.37 nm(图1D)。能谱图(图1E)显示硒均匀分布,含量达23%。XPS分析(图1F、1G)证实成功引入Se,且在模拟体内环境下仍可维持Ce³⁺/Ce⁴⁺共存状态(图1H)。XRD结果(图1I)表明材料为非晶态。为保护材料在胃酸中稳定,ZCSO被包埋于抗酸的海藻酸钙水凝胶中。体外释放实验显示水凝胶有效延缓Ce和Se的释放。抗氧化能力测试表明,如图1J,ZCSO对·ABTS的清除率高达79.58%,并在SOD、CAT活性检测中表现优异(图1K、1L)。此外,如图1M,ZCSO展现出明显的GPx样活性。综上,SeNPs包覆显著增强了ZCSO的抗氧化性能和稳定性。
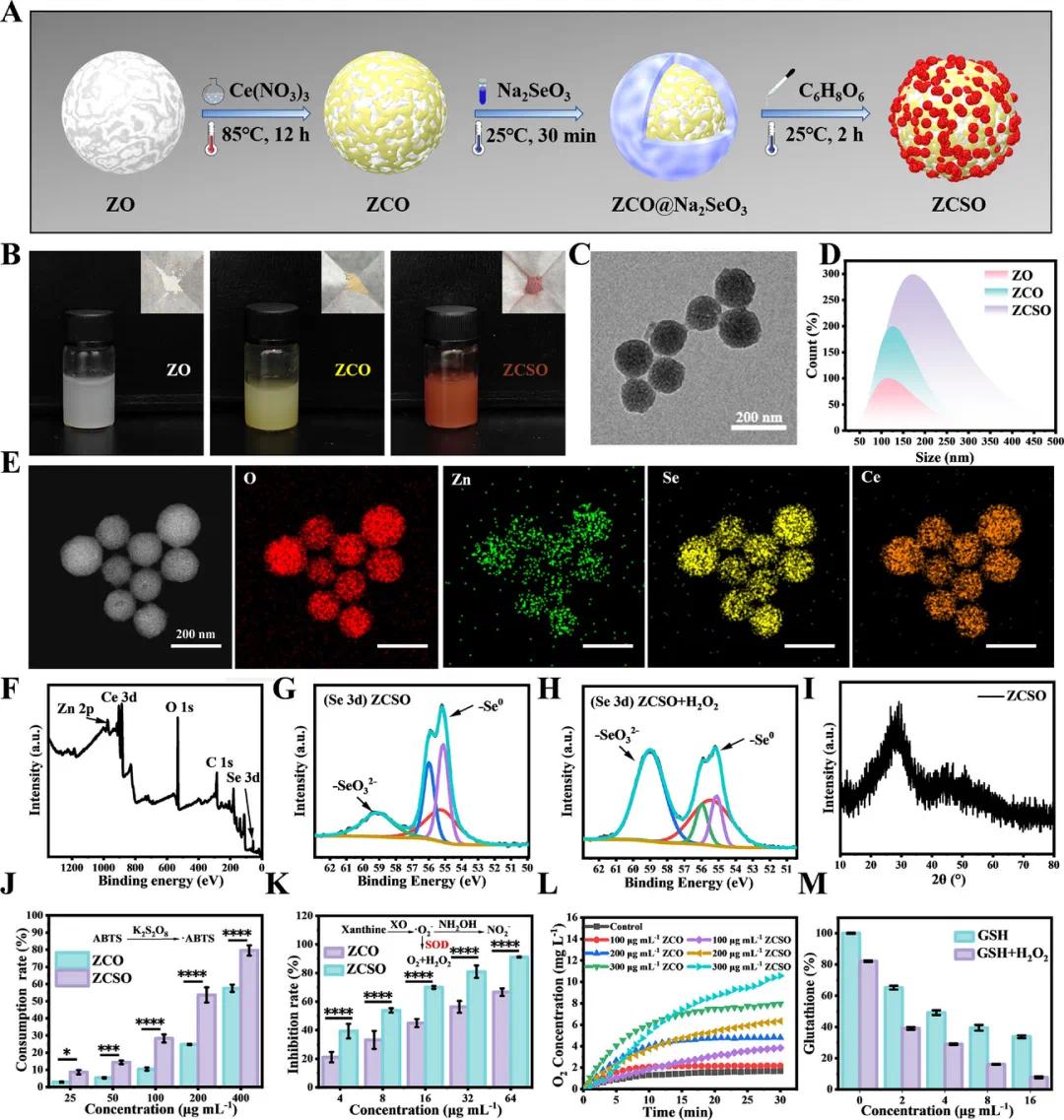
图1 ZCSO纳米酶的制备、表征和性能评估。A) ZCSO纳米酶制备过程示意图;B) ZO、ZCO和ZCSO样品的代表性形貌图像;C) ZCSO纳米酶的TEM图像(比例尺:200 nm);D) DLS分析显示ZO、ZCO和ZCSO的粒度分布;E) ZCSO纳米酶的EDS元素映射(比例尺:200 nm);F) ZCSO纳米酶的综合XPS数据,包括G)详细的Se 3d光谱;H)模拟生理条件下ZCSO纳米酶的XPS分析(Se 3d);I) ZCSO纳米酶的XRD图案;J) ABTS自由基清除活性测定比较ZCSO和ZCO纳米酶;K) SOD抑制率测定;L)氧气生成能力评估;M) ZCSO纳米酶的GSH清除活性评估,n = 3
(2)ZCSO NPs体外抗氧化能力和抗炎能力检测
鉴于ZCSO纳米酶具有强抗氧化能力,分别在HT-29和NCM460细胞中进行了体外ROS清除能力检测。首先,通过CCK-8评估细胞活性,结果显示ZCSO对细胞无明显毒性(图2A)。随后,利用DCFH-DA探针观察到,ZCSO显著抑制了H₂O₂诱导的绿色荧光(图2B)。活/死染色进一步证实,H₂O₂+ZCSO处理组死亡细胞极少(图2C)。通过Image J分析,直观展示了ZCSO的ROS清除和保护效果。此外,JC-1探针检测表明,ZCSO可有效恢复HT-29细胞线粒体膜电位(图2D)。在抗氧化方面,ZCSO处理后MDA水平恢复正常(图2E)且GSH含量下降,GPx活性显著上升(图2F、G)。抗炎实验中,流式分析显示ZCSO显著减少了M1型巨噬细胞比例(图2H),同时qRT-PCR结果表明炎症因子TNF-α、IL-6、IL-1β、IFN-γ表达下调,IL-4、IL-10上调(图2I–N)。此外,ZCSO促进Keap1/Nrf2通路活化,发挥抗氧化抗炎协同作用(图2O、P)。创伤修复实验中,划痕实验结果表明ZCSO能促进NCM460细胞在氧化应激下的增殖(图2Q)。
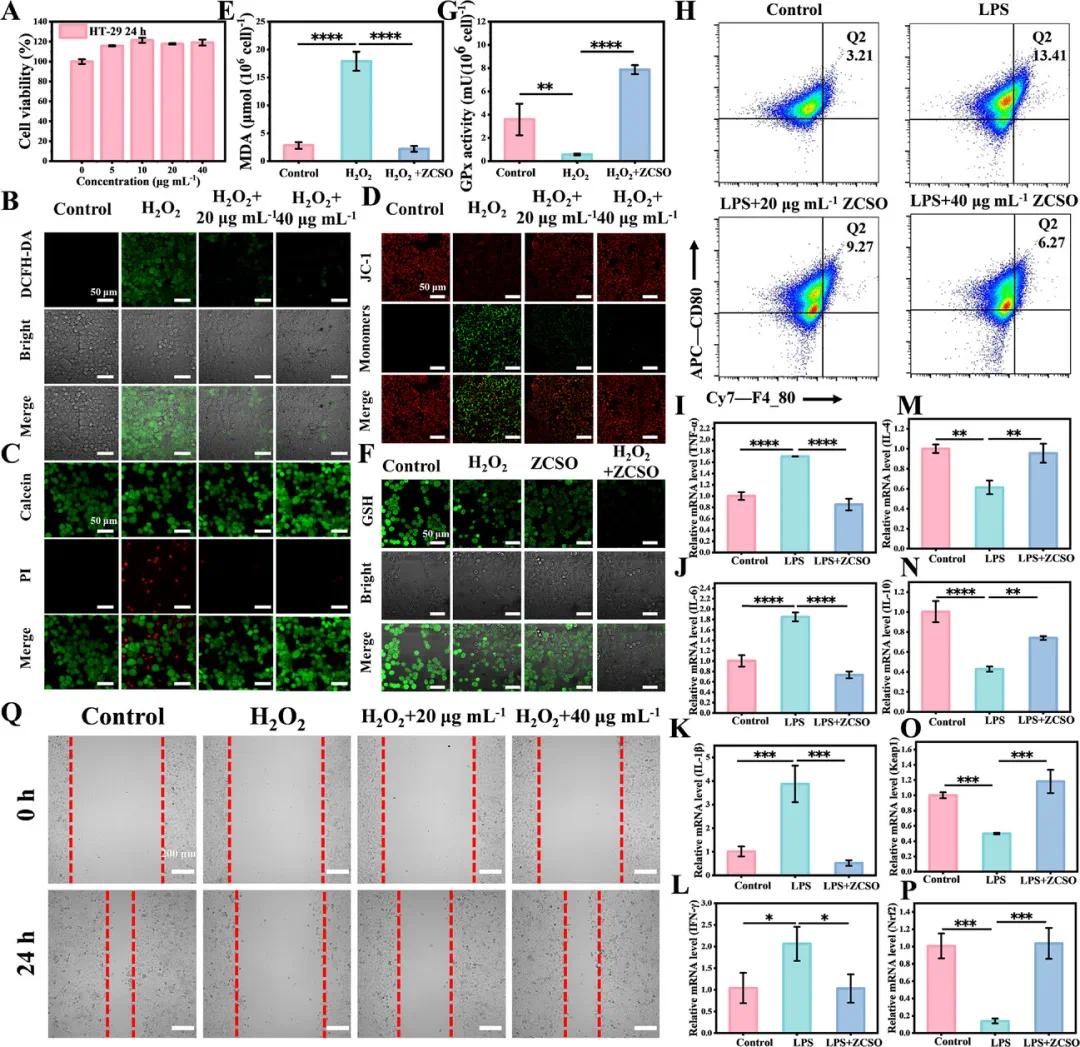
图2 ZCSO纳米酶体外抗氧化和抗炎能力检测。A)HT-29细胞活力测定;B)HT-29细胞中DCFH-DA染色的ROS荧光图像;C)HT-29细胞中钙黄绿素-AM/PI共染色的荧光图像;D)JC-1探针在HT-29细胞中的荧光图像;E)不同处理后HT-29细胞内的MDA含量;F)GSH探针(比例尺:50 µm)和G)不同处理后HT-29细胞中总GPx活性的荧光图像;H)流式细胞术对M1巨噬细胞进行定量分析;通过实时PCR定量分析不同处理后RAW264.7巨噬细胞中I)TNF-α、J)IL-6、K)IL-1β、L)IFN-γ、M)IL-4、N)IL-10、O)Keap1和P)Nrf2的mRNA表达水平;Q)NCM460的划痕后迁移(比例尺:200 µm)
(3)ZCSO纳米酶的生物相容性评价
鉴于生物相容性对于纳米材料临床应用至关重要,该研究评估了ZCSO的体内生物安全性。小鼠在经口给予Hy + 40 mg kg⁻¹ ZCSO后第7天和第30天取血进行血常规和血生化检测,并对心、肝、脾、肺、肾进行切片H&E染色。结果显示,血液指标正常,各主要器官无组织损伤,表明ZCSO纳米酶具有良好的生物相容性和应用安全性。损伤的保护作用。
(4)ZCSO在IBD模型小鼠结肠中的分布及其防治作用
为了提高ZCSO纳米酶的生物利用度并避免胃酸环境下提前释放,该研究采用海藻酸钠包裹材料。如图3A所示,Cy5.5-ZCSO沿消化道主要定位于结肠,口服后在肠道的作用时间约为24小时。随后,评估了ZCSO对结肠炎的预防作用。小鼠按实验分组处理,并通过体重变化(图3C)及每日粪便评分(图3D)评估疾病活动指数(DAI)。结果显示,ZCSO处理组体重下降较轻,DAI得分明显降低。第9天处死小鼠,发现DSS组结肠长度明显缩短(图3E,F)。H&E染色结果(图3G)显示,ZCSO组小鼠结肠组织结构恢复良好。流式细胞术分析(图3H,I)显示,ZCSO可显著减少M1型炎症性巨噬细胞比例。ELISA检测(图3J–N)结果表明,ZCSO降低了MPO、MDA水平及促炎因子(IL-1β、IL-6、TNF-α)表达,同时提高了抗炎因子(IL-4、IL-10)水平。进一步,qRT-PCR结果(图3Q–T)表明,ZCSO可下调PERK、eIF-2α、ATF4和CHOP基因表达,缓解肠道内质网应激。综上,ZCSO纳米酶在IBD防治中展现出良好效果。
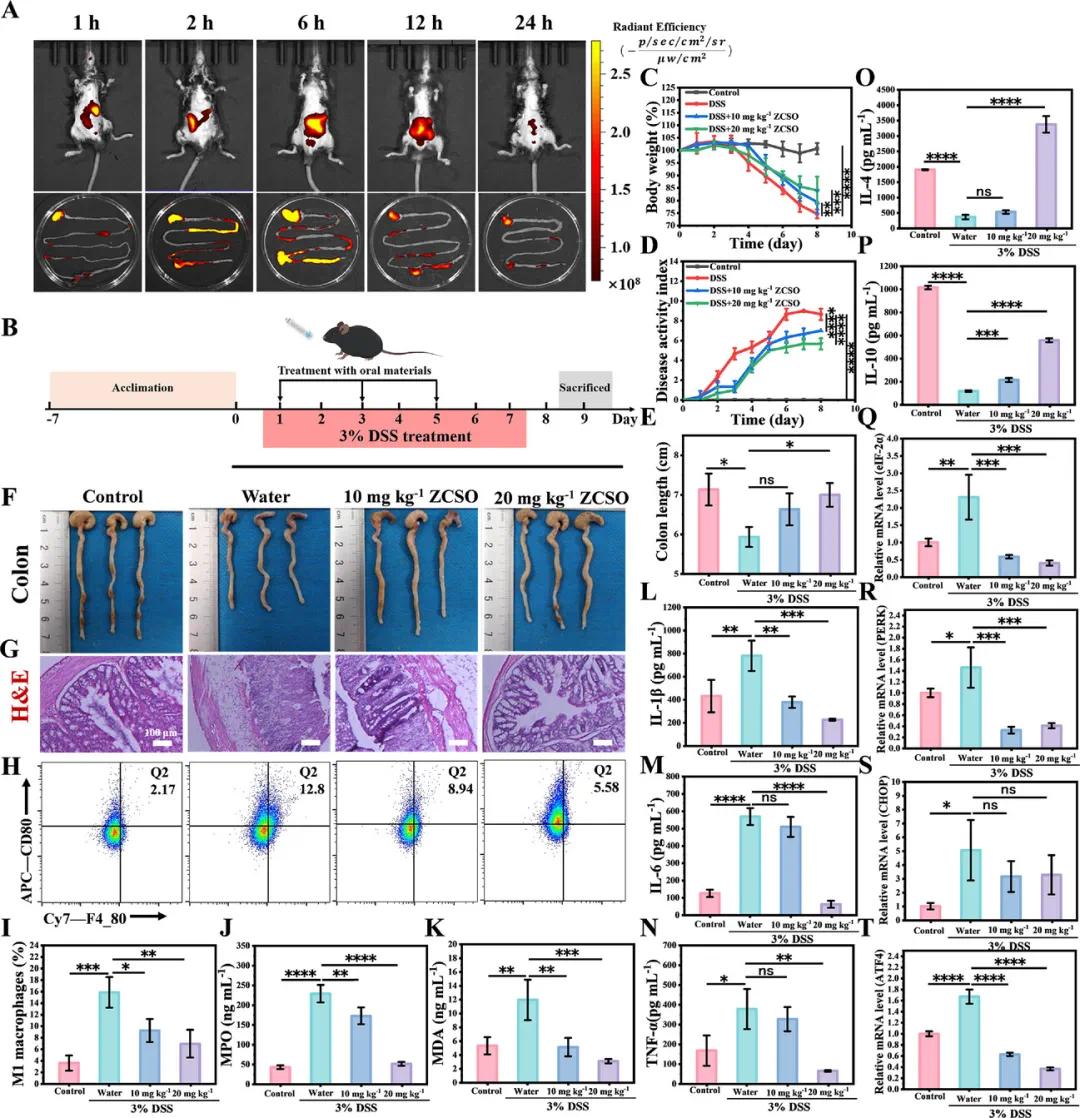
图3 ZCSO在IBD模型小鼠结肠内的分布及防治作用。A)ZCSO纳米酶口服给药后在IBD小鼠体内的分布及分离后结肠的荧光图像;B)预防性治疗实验方案示意图;C)不同治疗组体重变化及DAI评估;治疗结束后E)小鼠分离结肠长度及相应的F)结肠组织照片及G)H&E染色(比例尺:100 µm);H)流式细胞术分析不同治疗组结肠淋巴组织中M1型巨噬细胞含量并进行定量分析I);J)ELISA法测定不同治疗后结肠组织中MPO、K)MDA、L)IL-1β、M)IL-6、N)TNF-α、O)IL-4、P)IL-10的蛋白表达水平;实时PCR定量检测结肠组织中内质网应激相关因子Q)eIF-2α、R)PERK、S)CHOP和T)ATF4的mRNA水平,n = 3
(5)ZCSO纳米酶对结肠炎的延迟治疗作用
根据预防实验结果,ZCSO纳米酶在IBD预防中效果良好。为进一步验证其治疗作用,该团队建立了小鼠结肠炎延迟治疗模型。如图4A所示,小鼠连续饮用3% DSS水13天,并在第8、10、12天给药。此外,除了分别用钙藻酸盐水凝胶递送10和20 mg kg⁻¹ ZCSO外,还设立了空白水凝胶组。图4B显示,DSS组小鼠体重从第3天开始明显下降,Hy组和Hy+ZCSO组则在第8至10天出现体重回升。第14天处死小鼠,图4C、D显示DSS组结肠显著缩短,Hy+ZCSO组结肠长度明显恢复(图4E)。组织学结果显示,Hy+ZCSO组无明显炎症,且MPO水平显著降低。免疫荧光检测表明,Hy+ZCSO组小鼠结肠组织中Nrf2(图4H)和HO-1蛋白表达上调,GPx4也显著增加(图4I)。此外,紧密连接蛋白ZO-1和Occludin在Hy+ZCSO组显著上升(图4J),MDA水平降低(图4J),炎症因子IL-6和TNF-α表达下降(图4K,L,M)。进一步通过Western blot(图4N,O)验证了Nrf2和GPx4的上调,表明ZCSO纳米酶具有良好的抗炎和抗氧化治疗效果。
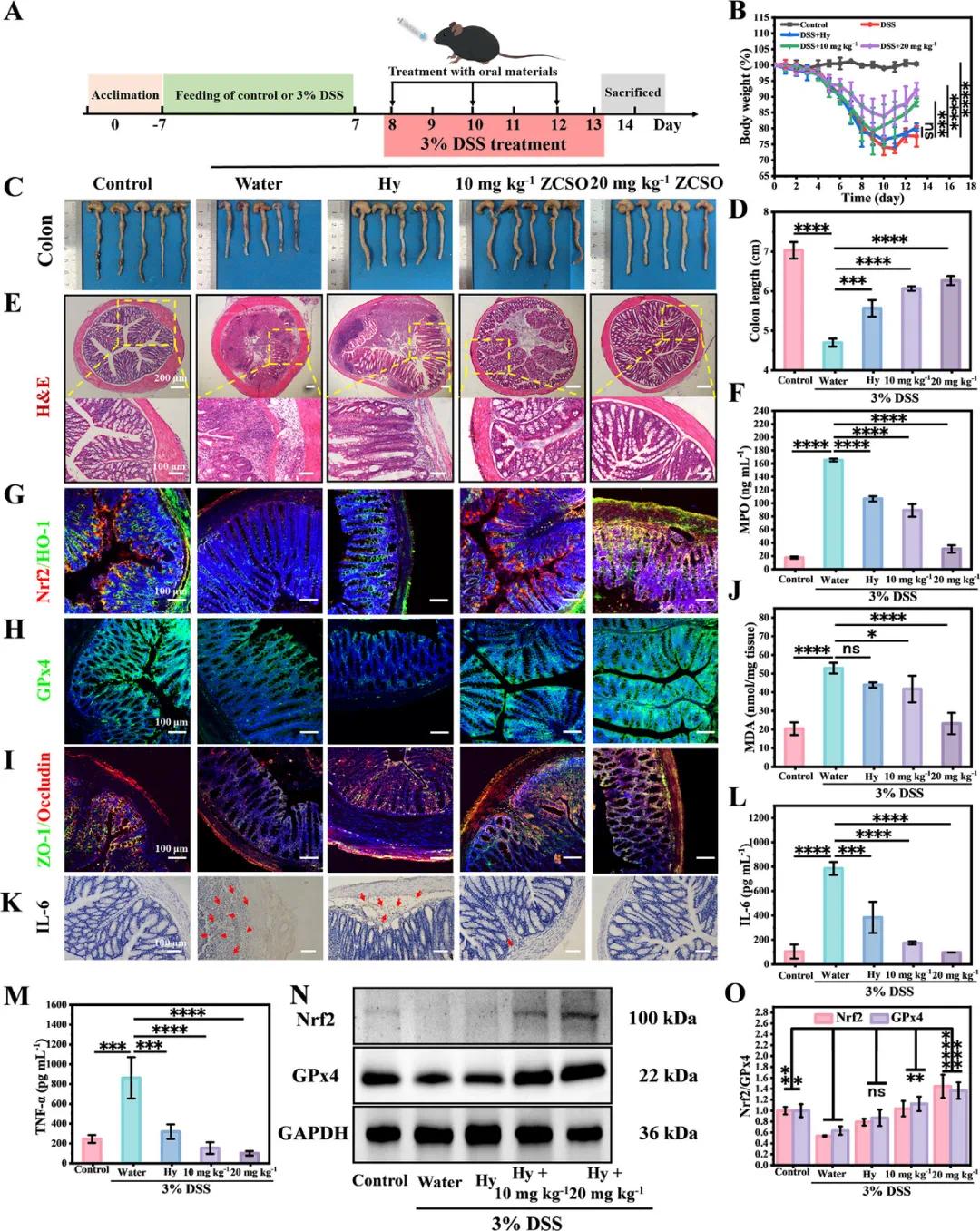
图4 ZCSO纳米酶对结肠炎的延迟治疗作用。A)延迟治疗实验方案流程图;B)各治疗组小鼠治疗期间体重变化曲线;C)治疗结束时小鼠离体结肠照片及相应的结肠长度,D,n=5;E)小鼠结肠切片H&E染色;F)ELISA检测各治疗组小鼠结肠组织中MPO蛋白表达水平;G)小鼠结肠组织切片中Nrf2和HO-1共染色免疫荧光图像,H)GPx4,I)ZO-1和Occludin共染色图像;J)结肠组织匀浆中的MDA水平;K)结肠组织匀浆中IL-6和L)水平的免疫组织化学染色;M)组织匀浆中的TNF-α水平;N)Western blot定量检测Nrf2和GPx4蛋白表达水平,并进行定量分析O),(比例尺:100 µm),n = 3
(6)ZCSO纳米酶治疗TNBS诱发的CD小鼠模型
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD)。基于ZCSO纳米酶在DSS诱导的UC模型中的良好效果,进一步在TNBS诱导的CD模型中进行了研究。分组和处理方案如图5A所示,实验小鼠除健康对照外,第0天接受1% TNBS灌肠,连续3天治疗,第5天处死。TNBS组与Hy组小鼠生存率为71%,而健康对照组和Hy+ZCSO组均为100%(图5B)。体重变化表明,Hy+ZCSO组小鼠体重恢复明显优于TNBS组(图5C),且结肠长度接近正常水平(图5D,E)。HE染色(图5F)显示,ZCSO纳米酶可保护肠道结构。MPO检测显示,Hy+ZCSO组炎症水平显著降低(图5G)。免疫组化和ELISA进一步表明,Hy+ZCSO组GPx4表达上升,炎症因子IL-6、IL-1β和TNF-α显著下降(图5H–N)。此外,Hy+20 mg/kg ZCSO组显著降低了氧化应激标志物MDA水平(图5O)。综上,ZCSO纳米酶对CD治疗展现出良好的潜力。
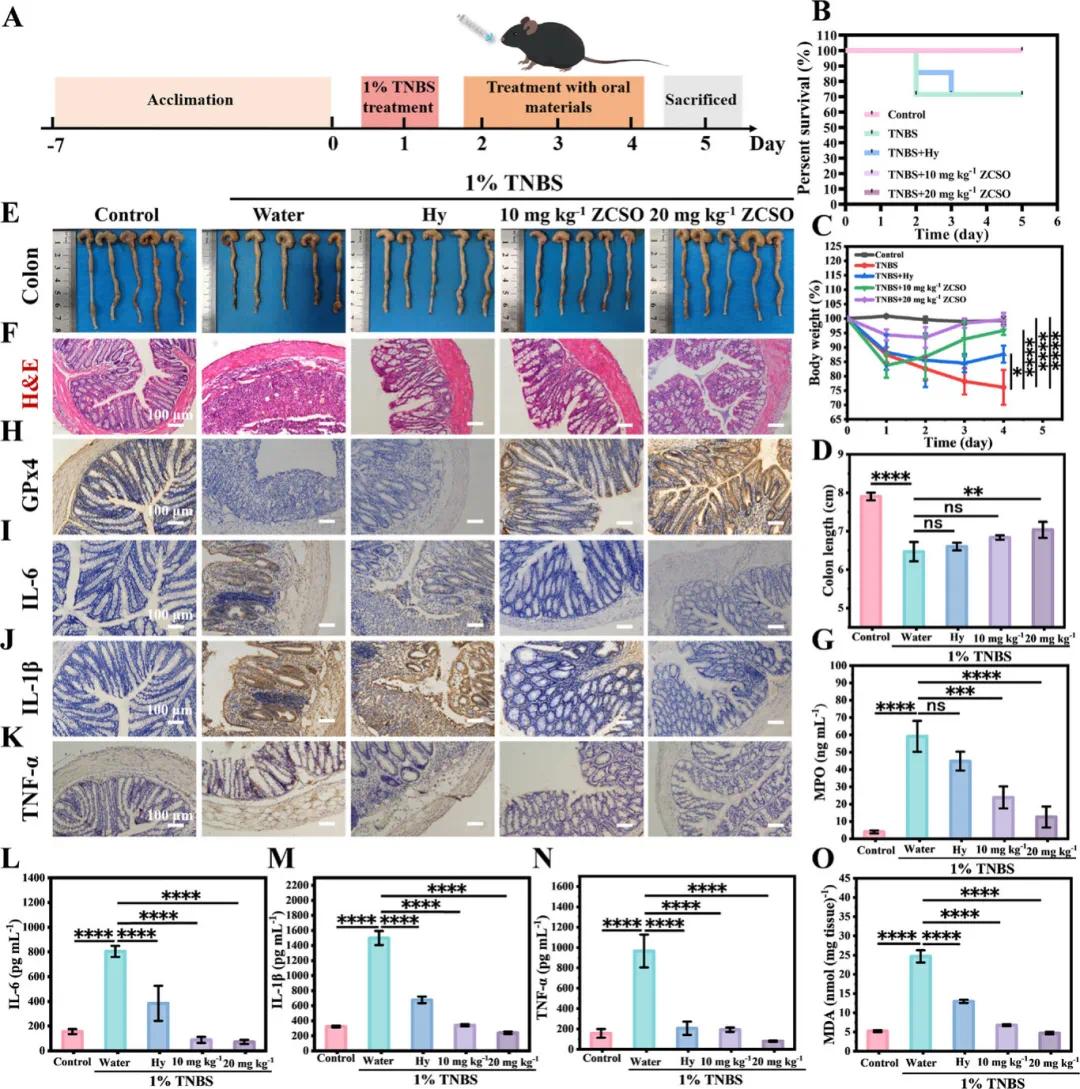
图5 ZCSO纳米酶在小鼠模型中治疗TNBS诱导的CD的实验研究。A) CD模型治疗实验方案流程图;B) 不同治疗组的生存曲线,n = 7;C) 治疗期间的体重变化;D) 小鼠离体结肠的长度和相应的结肠照片,n = 5;F) 结肠的H&E染色;G) 结肠组织匀浆中的MPO水平;结肠组织切片中H) GPx4、I) IL-6、J) IL-1β和K) TNF-α的免疫组织化学染色;结肠组织匀浆中L) IL-6、M) IL-1β、N) TNF-α和O) MDA的蛋白质水平,n = 3
(7)ZCSO纳米酶对DSS诱导的结肠炎小鼠肠道菌群的调节
除氧化应激和免疫反应外,肠道菌群失调也是炎症性肠病(IBD)慢性化的重要因素。为评估ZCSO纳米酶是否影响DSS诱导的结肠炎模型小鼠肠道菌群的多样性与丰度,该团队收集新鲜粪便进行16S rDNA测序。如图6A–D所示,DSS组小鼠的微生物丰度和多样性明显下降,而Hy+ZCSO组则恢复明显。Venn图(图6E)显示,Hy+ZCSO组与健康组菌群重叠性高于DSS组。菌群丰度热图及柱状图(图6F)表明,Hy+ZCSO组菌群组成趋向正常,优势菌门包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和变形菌门(Proteobacteria)。其中厚壁菌门多为抗炎菌,而拟杆菌门中部分菌种可促炎(图6G)。DSS组小鼠厚壁菌门减少,拟杆菌门与变形菌门显著增加,Hy+ZCSO治疗可缓解此变化。乳酸杆菌属(Lactobacillus)具有抗炎与增强免疫功能,图6H表明,DSS组乳酸杆菌代谢通路减少,Hy+ZCSO治疗后明显恢复。同时,拟杆菌属(Bacteroides)在DSS组代谢水平上升,而Hy+ZCSO处理后显著下降(图6H)。以上结果说明,ZCSO纳米酶可调节肠道有益与有害菌水平,促进微生态稳定。
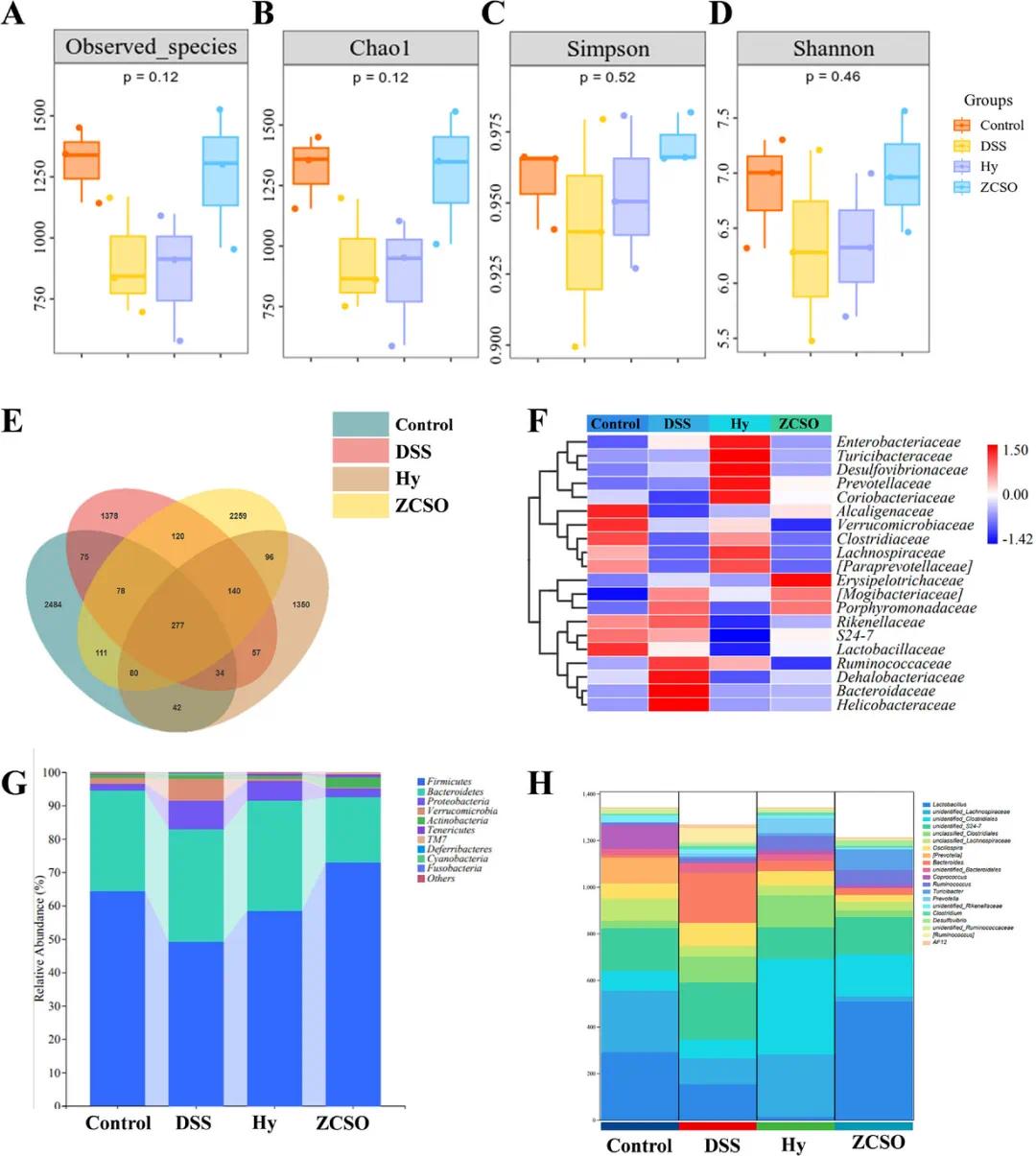
图6 ZCSO纳米酶对DSS诱导结肠炎小鼠肠道菌群的调节作用。A) 观察到的物种,B) Chao1,C) Simpson,D) Shannon箱线图;E) 常见和特有肠道菌群物种的维恩图;F) 物种组成热图;G) 门级物种相对丰度;H) 属级代谢途径丰度值
该研究开发了一种新型ZCSO纳米酶,能够有效清除活性氧(ROS)并修复氧化应激引起的肠道屏障损伤。ZCSO在DSS诱导的结肠炎和TNBS诱导的克罗恩病小鼠模型中表现出显著疗效,主要通过去除炎症部位的ROS并激活Nrf2通路,增强抗氧化酶的产生,从而减少氧化应激。这打破了氧化应激与免疫反应的恶性循环,降低了肠道中的促炎因子。同时,ZCSO还显著提高了与肠道上皮细胞铁死亡相关的GPx4酶的表达,表明其在抑制铁死亡方面具有重要潜力。此外,ZCSO通过恢复有益菌水平并减少致病菌,提供了通过微生物调节治疗IBD的新思路。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

