
骨软骨缺损是一种常见的骨关节疾病,影响运动员和老年人,导致关节疼痛和功能障碍。常见治疗方法包括自体软骨细胞移植、微骨折和生物材料支架植入,但这些方法存在手术复杂、供区损伤和修复不完全等问题,因此需要更有效的治疗策略。内源性干细胞在组织再生中起关键作用,能修复损伤组织。适体Apt19s能靶向细胞表面促进干细胞募集,但在体内易降解。

针对上述问题,来自山东大学马保金的研究团队构建了负载淫羊藿苷(ICA)和EGCG的多价适体,分别命名为ATI和ATE。然后,将ATI和ATE掺入凝胶化甲基丙烯酰(GelMA)和聚乙二醇二丙烯酸酯(PEGDA)的预聚物溶液中,利用数字光处理(DLP)打印技术,制备了可降解、氢键增强的梯度水凝胶支架(GPA-ATI/ATE)。该支架能够有效促进早期干细胞募集,并在术后 12 周显著增强骨软骨结构和功能的综合再生。该研究利用材料设计来招募、保护和诱导内源性干细胞分化的策略对于原位组织再生的应用具有巨大的前景。该文章于2025年4月25日以《Tetrahedral DNA Nanoframework-Based Multivalent Aptamers Functionalized Biomimetic Hydrogel Scaffold Enhances Osteochondral Regeneration by Recruitment and Protection of Endogenous Stem Cells》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202502871)。
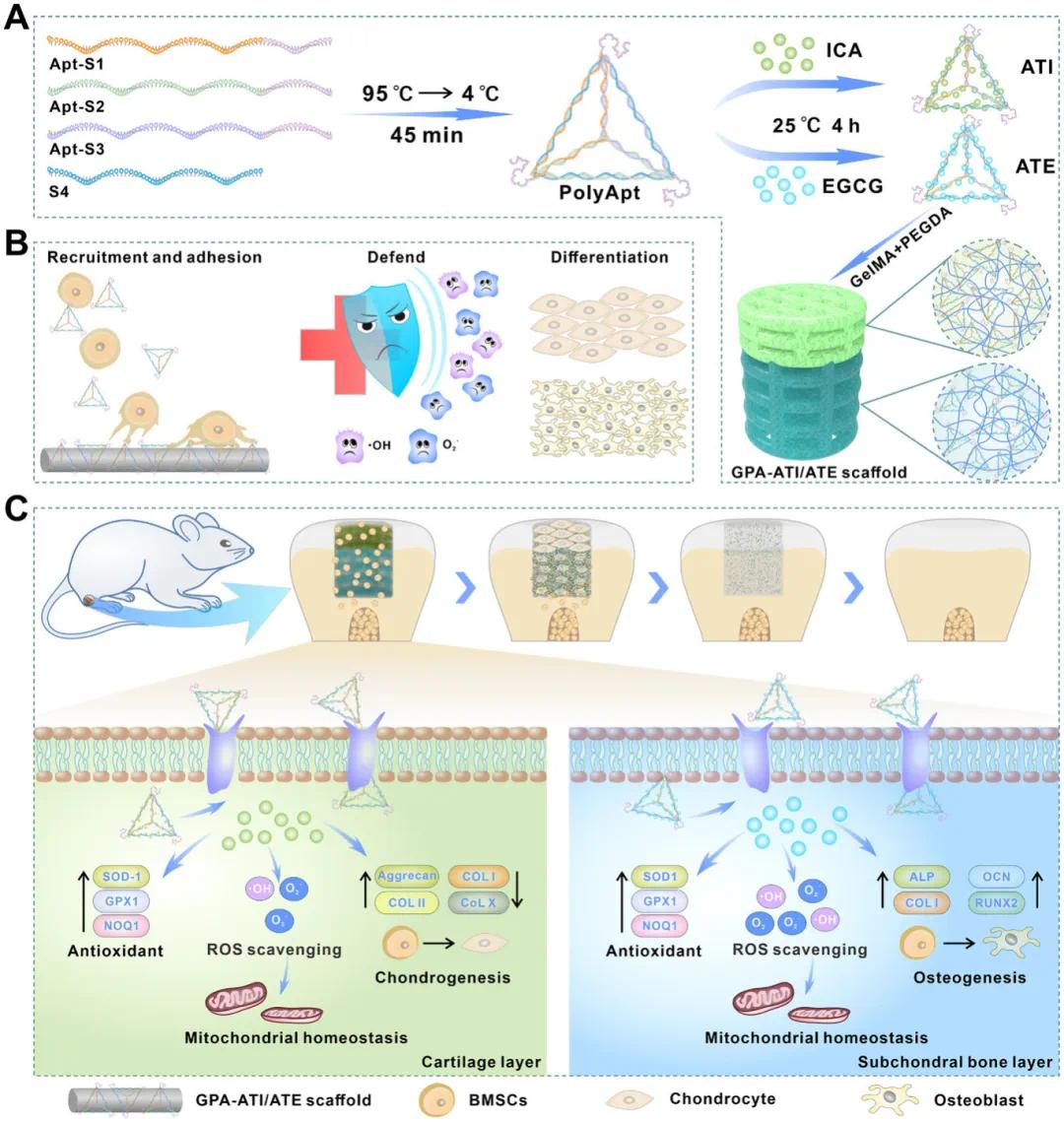
图1 ATI 或 ATE 功能化 GPA 梯度支架修复骨软骨缺损的示意图。A) 构建负载淫羊藿苷或表没食子儿茶素没食子酸酯 (ATI 或 ATE) 的多价核酸适体,分别掺杂到由 GelMA 和 PEGDA 组成的可生物降解水凝胶支架的顶层和底层。B) ATI 和 ATE 募集内源性干细胞,清除活性氧 (ROS),维持线粒体稳态,并保留干细胞活性,从而促进软骨和成骨分化。C) 在动物实验中,利用生物混合梯度 GPA-ATI/ATE 水凝胶支架修复骨软骨缺损
(1)ATI/ATE的制备与表征
内源性干细胞迁移至缺损部位是组织再生的前提。为促进这一过程,该研究设计了八面体DNA折纸结构PolyApt,其三个顶点包含DNA适体Apt19s。PolyApt可通过退火工艺组装,并通过负载ICA或EGCG进一步制备功能性纳米颗粒ATI或ATE。PAGE分析表明,PolyApt已成功组装,并显示出明显的条带。紫外光谱数据显示,ICA和EGCG成功掺入PolyApt的双链DNA中。封装率分别为ICA/PolyApt(51.8%-60.4%)和EGCG/PolyApt(56.9%-59.3%)。Zeta电位分析和DLS结果确认ATI和ATE的成功组装,尺寸分别为7、14和13.5 nm。生物相容性评估显示,PolyApt与对照组细胞增殖无显著差异,ATI和ATE在不同浓度下促进细胞增殖,但高浓度ICA和EGCG可能抑制细胞增殖。Live/Dead实验表明,BMSCs与ATI或ATE共培养时表现出良好生长。基于封装率和生物相容性,PolyApt/ICA(1:25)和PolyApt/EGCG(1:50)被选为进一步实验的最佳组合。
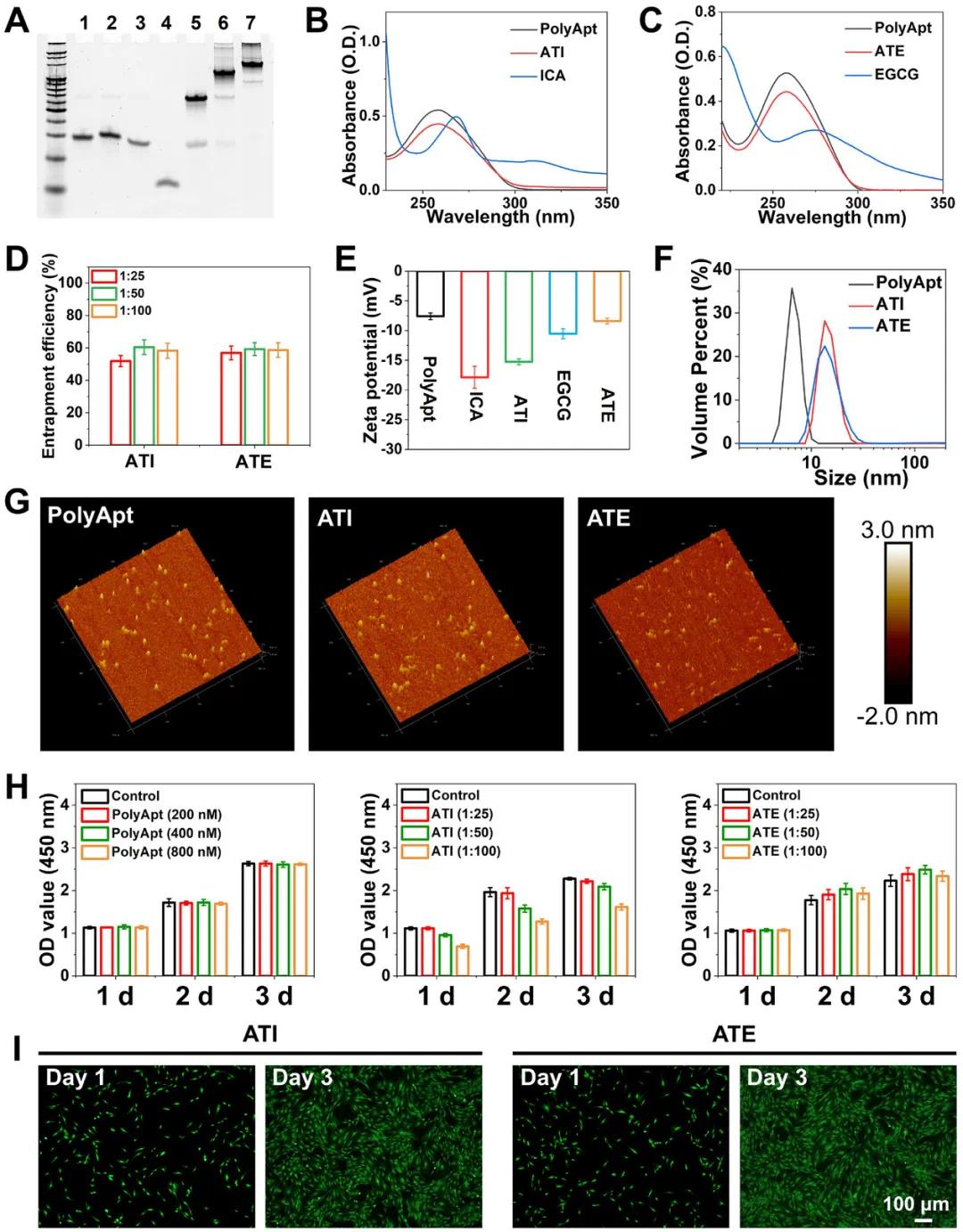
图2 PolyApt、ATI 和 ATE 的表征。A)成功合成的 PolyApt 的凝胶电泳分析,1-7 泳道分别代表 Apt-S1、Apt-S2、Apt-S3、S4、Apt-S1+Apt-S2、Apt-S1+Apt-S2+Apt-S3 和 PolyApt。B、C)PolyApt、ICA、ATI、EGCG 和 ATE 的紫外可见吸收光谱。D)PolyApt、ICA、ATI、EGCG 和 ATE 的 Zeta 电位。E)DLS 分析 PolyApt、ATI 和 ATE 的水动力学尺寸。F)不同 PolyApt/ICA 和 PolyApt/EGCG 摩尔比下 ATI 和 ATE 的包封率。G)PolyApt、ATI 和 ATE 的原子力显微镜成像。 H) BMSCs 与 PolyApt、ATI 和 ATE 共培养后的细胞增殖情况。细胞培养板作为空白对照。I) BMSCs 与 ATI 和 ATE 共培养后的荧光显微镜照片。绿点表示活细胞,红点表示死细胞
(2)DLP打印梯度GPA-ATI/ATE水凝胶支架
内源性干细胞迁移至缺损部位对组织修复至关重要。研究设计了含DNA适体Apt19s的八面体DNA折纸结构PolyApt,并通过负载ICA或EGCG制备功能性纳米颗粒ATI或ATE。PolyApt的组装成功,通过紫外吸收光谱和NMR分析确认了ICA和EGCG的成功掺入。封装率在不同摩尔比下分别为51.8%-60.4%(ICA)和56.9%-59.3%(EGCG)。PolyApt、ATI和ATE的尺寸和形态通过DLS和AFM确认,具有良好的稳定性和生物相容性。细胞增殖实验表明,ATI和ATE在不同浓度下促进细胞增殖,但高浓度ICA和EGCG可能抑制细胞活力。进一步研究显示,PolyApt/ICA和PolyApt/EGCG的摩尔比为1:25和1:50时,具有较高的包封率和良好的生物相容性,适用于组织再生实验。GPA水凝胶通过共聚GelMA和PEGDA,提高了机械弹性和水凝胶稳定性,适用于骨软骨再生。GPA水凝胶的溶胀性、降解速度和力学性能与GelMA相比显著提高,且具有较好的生物相容性。通过调节PEGDA和GelMA的比例,优化了水凝胶的性能,选择了GPA15-2.5作为候选材料。GPA15-2.5水凝胶支持细胞增殖,并具有良好的恢复性能。其流变性表明,水凝胶在外力作用下具有优异的恢复力和高机械强度,适合用于骨软骨修复。通过3D打印技术,GPA15-2.5水凝胶能够制造精确的结构,适用于骨软骨一体化修复,支架具有良好的机械强度和弹性。
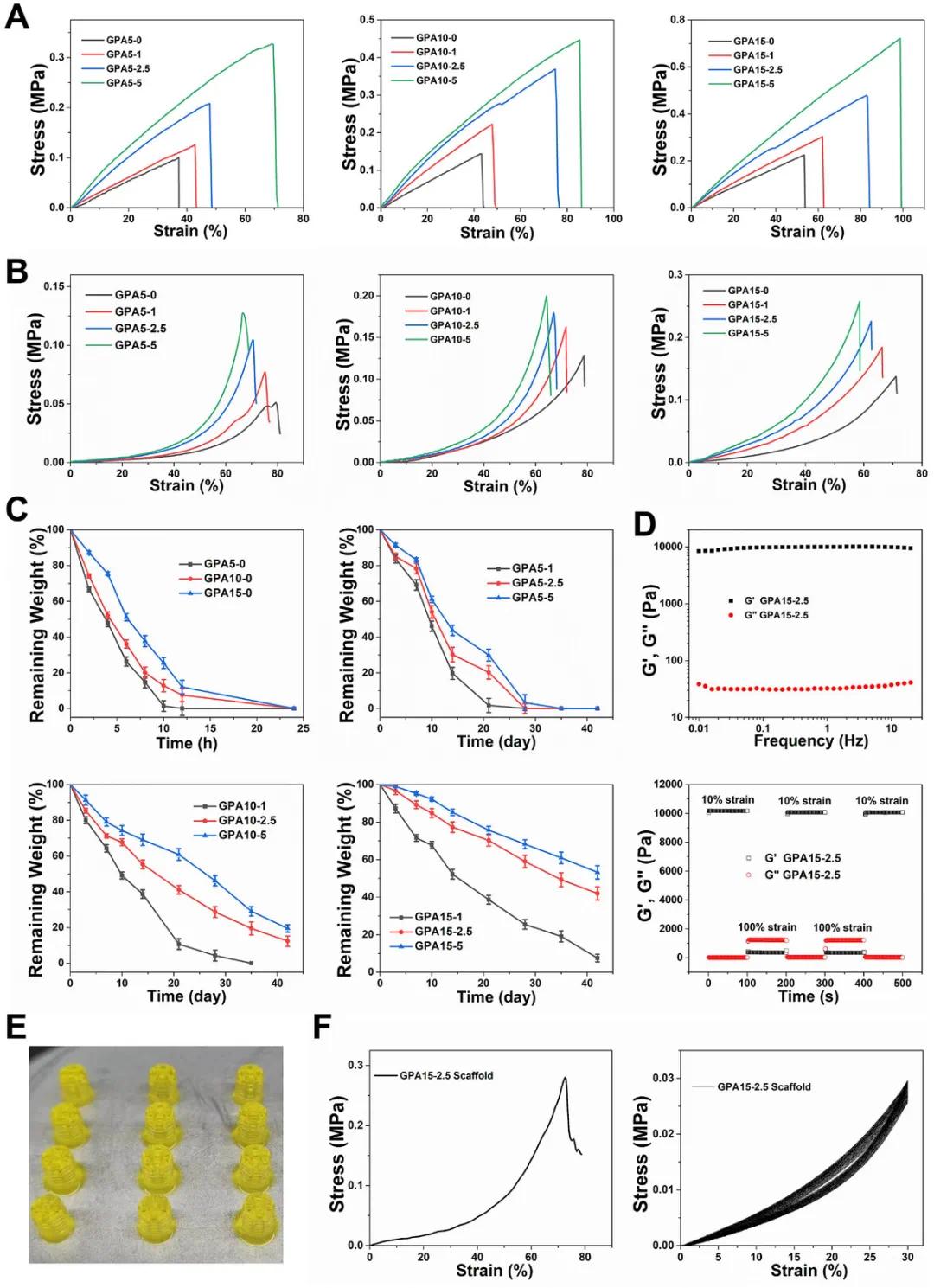
图3 水凝胶理化性质评价。A)不同初始浓度GelMA和PEGDA的GPA水凝胶的拉伸应力-应变曲线。B)不同初始浓度GelMA和PEGDA的GPA水凝胶的压缩应力-应变曲线。C)不同初始浓度GelMA和PEGDA的GPA水凝胶在胶原酶溶液中的体外降解行为。D)GPA水凝胶的流变性质,包括频率扫描测试和连续交替振荡剪切应变测试。E)梯度GPA-ATI/ATE水凝胶支架批量一致打印的代表性图像。F)打印的多孔GPA-ATI/ATE水凝胶支架的压缩应力-应变曲线,以及打印的GPA-ATI/ATE梯度支架在最大应变为30%下的循环压缩应力-应变曲线。循环次数设定为100
(3)打印的 GPA-ATI/ATE 水凝胶支架的干细胞结合和迁移
在评估ATI和ATE的生物功能之前,首先检查了GPA-ATI和GPA-ATE水凝胶支架的体外释放曲线。前两天,ATI和ATE呈爆发性释放,之后释放速率趋于稳定,约14天后进入平衡状态,表明大多数化合物已释放,这表明水凝胶支架可持续释放ATI和ATE,促进BMSCs活性募集和保护。当BMSCs与Apt共孵育时,荧光强度明显增加,表明Apt与BMSCs结合。PolyApt与BMSCs的结合显著增强,ATI和ATE的荧光强度与PolyApt相当,表明ICA和EGCG的掺入未显著影响结合能力。流式细胞术进一步确认,PolyApt的结合能力最强,而ATI和ATE也表现出较强的结合能力,且不影响PolyApt的效率。Transwell实验显示,纯GPA水凝胶不具备趋化特性,而GPA-TFNAs、GPA-Apt和GPA-PolyApt水凝胶则能有效募集BMSCs。GPA-PolyApt水凝胶由于多价效应和TFNAs的贡献,募集效率显著提高。ATI和ATE水凝胶组也能促进BMSCs的募集,且在细胞增殖方面表现良好。划痕试验结果显示,GPA-PolyApt、GPA-ATI和GPA-ATE水凝胶组的BMSCs迁移能力较强,划痕愈合率高于其他组。PolyApt、ATI和ATE的多价效应显著提高了细胞的迁移能力。整体结果表明,这些改性GPA水凝胶具有显著的趋化特性,能够有效促进细胞迁移,具有良好的组织工程应用前景。
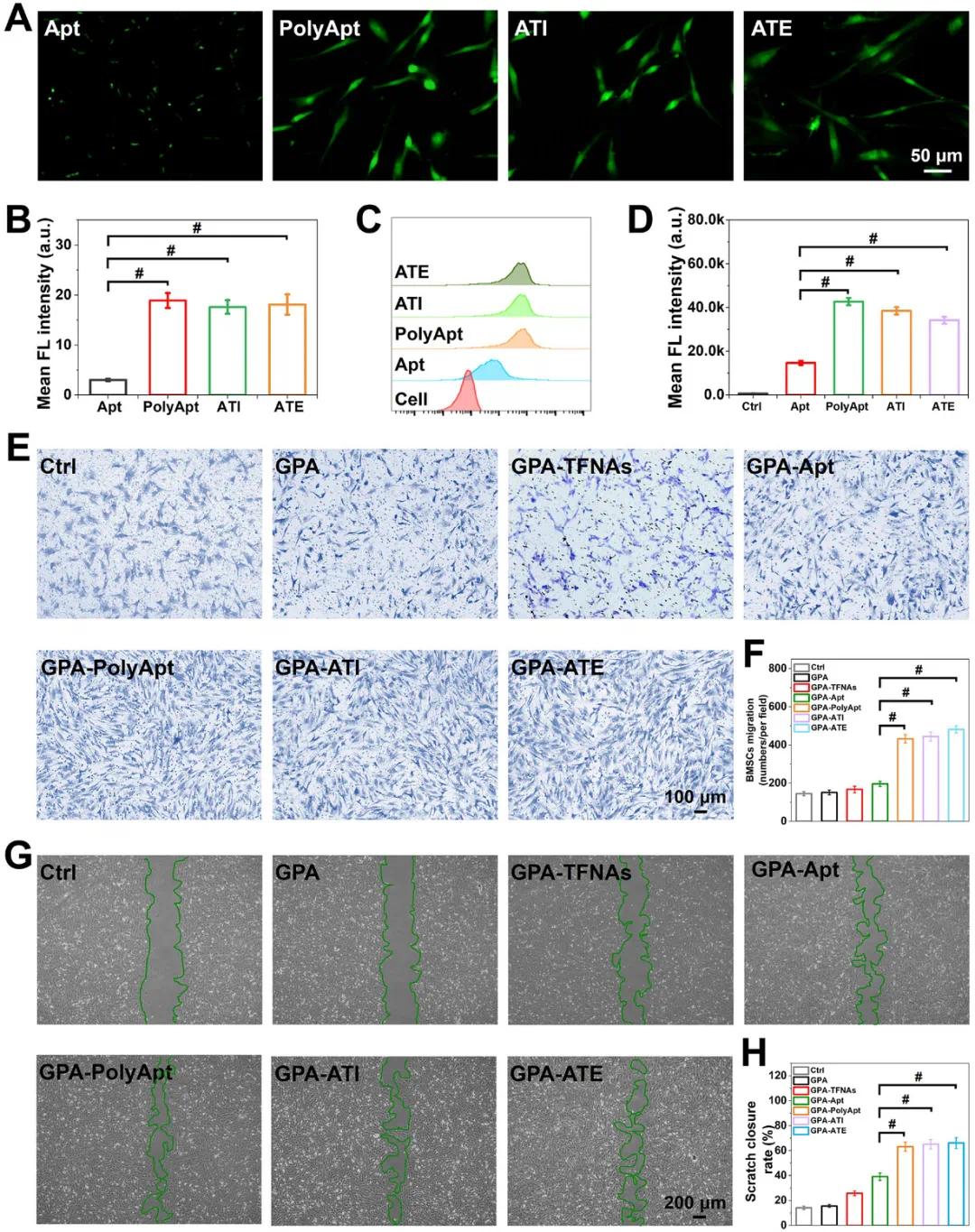
图4 A) Apt、PolyApt、ATI 和 ATE 与 BMSC 的体外特异性结合和摄取能力。B) 使用 ImageJ 对平均荧光强度进行定量统计分析。C) 分别与 6-FAM 标记的 Apt、PolyApt、ATI 和 ATE 孵育的 BMSC 进行流式细胞术分析。D) 对流式细胞术实验得出的平均荧光强度进行定量统计分析。E) Transwell 迁移实验分别评估用打印 GPA 水凝胶支架、GPA-TFNAs 水凝胶支架、GPA-Apt 水凝胶支架、GPA-PolyApt 水凝胶支架、GPA-ATI 水凝胶支架和 GPA-ATE 水凝胶支架处理的组中 BMSC 的趋化行为。F) 对迁移的 BMSC 数量进行定量分析。 G)24小时二维划痕试验的代表性图像,分别评估打印GPA水凝胶支架、GPA-TFNAs水凝胶支架、GPA-Apt水凝胶支架、GPA-PolyApt水凝胶支架、GPA-ATI水凝胶支架和GPA-ATE水凝胶支架组中BMSC的迁移率。H)划痕伤口愈合率的定量统计分析
(4)打印GPA-ATI/ATE水凝胶支架的抗氧化保护作用
为了评估ATI/ATE的抗氧化特性,采用了DPPH、ABTS和超氧化物阴离子测定法。结果表明,ATI/ATE浓度增加时,清除自由基的能力增强,这与ICA/EGCG的抗氧化能力有关。ATI/ATE能有效清除自由基并抑制ROS生成,且随着浓度升高,其抗氧化效果明显增强。在细胞实验中,用H2O2诱导的BMSCs氧化应激后,ATI/ATE治疗显著上调抗氧化酶基因(如GPX1、NQO1、SOD1和CAT)的表达,恢复了细胞内氧化还原平衡。DCFH-DA染色结果也显示,ATI和ATE能增强ICA和EGCG的吸收,进一步提升细胞的抗氧化能力。线粒体是ROS的主要靶点,通过JC-1染色评估ATI/ATE对线粒体膜电位的影响。H2O2处理后,ATI和ATE显著稳定了线粒体膜电位,减少了功能障碍。此外,ATI/ATE水凝胶支架也表现出良好的ROS清除能力,减少了H2O2诱导的线粒体损伤。TEM结果显示,ATI和ATE处理后,线粒体形态和数量恢复正常,减少H2O2引起的损伤。MitoTracker Green染色和流式细胞术进一步证实,ATI和ATE增强了BMSCs中的线粒体生物合成,促进了能量代谢。这些结果表明ATI和ATE不仅能增强抗氧化能力,还能有效保护线粒体功能,保持BMSCs的生物活性。
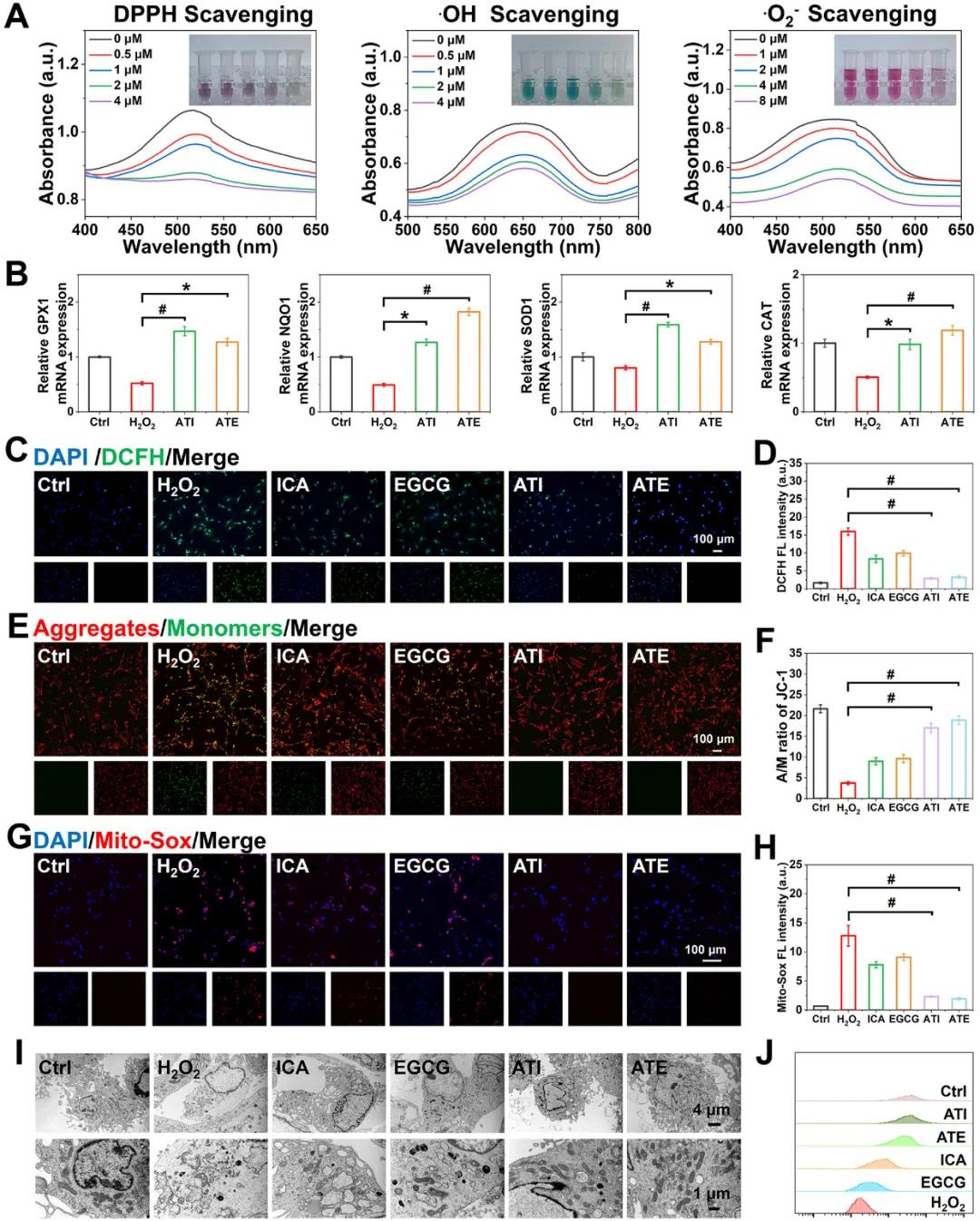
图5 A) 骨髓间充质干细胞(BMSCs)的抗氧化和线粒体功能测定。不同浓度ATE对三种典型自由基(DPPH、·OH和·O 2 − )的清除活性。B) 在H2O2刺激下,不同处理后抗氧化酶(GPX1、NQO1、SOD1和CAT)的相对mRNA表达水平。C) DCFH-DA探针染色评估ATI和ATE的细胞内ROS清除能力。D) 定量分析DCFH-DA荧光强度以评估BMSCs中的ROS水平。E) JC-1染色监测不同处理后BMSCs中的线粒体膜电位。F) 定量分析JC-1聚集体与单体(A/M)的比率,反映线粒体膜电位的变化。 G) 不同处理后 BMSCs 中线粒体 ROS 的 Mito-Sox 染色代表性荧光图像。H) Mito-Sox 染色荧光强度的定量统计。I) 不同处理后 BMSCs 中线粒体的形态和分布的代表性 TEM 图像。J) 不同处理后 BMSCs 经 Mito-tracker green 染色的流式细胞术结果
(5)打印 GPA-ATI/ATE 水凝胶支架的软骨形成和成骨分化能力
除了促进内源性干细胞的募集和保护外,还研究了ATI和ATE对BMSCs软骨形成和成骨分化的影响。通过阿新蓝染色,发现ATI处理组的BMSCs形成了良好的软骨分化聚集体,而GPA-ICA组也表现出较强的糖胺聚糖合成。ATI增强了ICA的细胞吸收效率,有助于提高软骨分化能力。RT-qPCR结果显示,ATI处理组在第7和第14天显著上调了软骨形成相关基因(如COL II和AGG)的表达,表明ATI有助于软骨分化。在成骨分化方面,ATI和ATE处理组的BMSCs表现出较强的ALP染色,且在氧化应激条件下依然保持较好的成骨活性。钙沉积分析显示,GPA-ATE处理组的矿化效果明显,表明其能够保护BMSCs免受氧化损伤并促进成骨分化。进一步的基因表达分析也证实了ATI和ATE在促进成骨分化方面的作用,尤其是在氧化应激条件下。这些结果表明,ATI和ATE通过与GPA水凝胶支架结合,可以有效促进BMSCs的软骨形成和成骨分化,具有广泛的组织修复潜力。
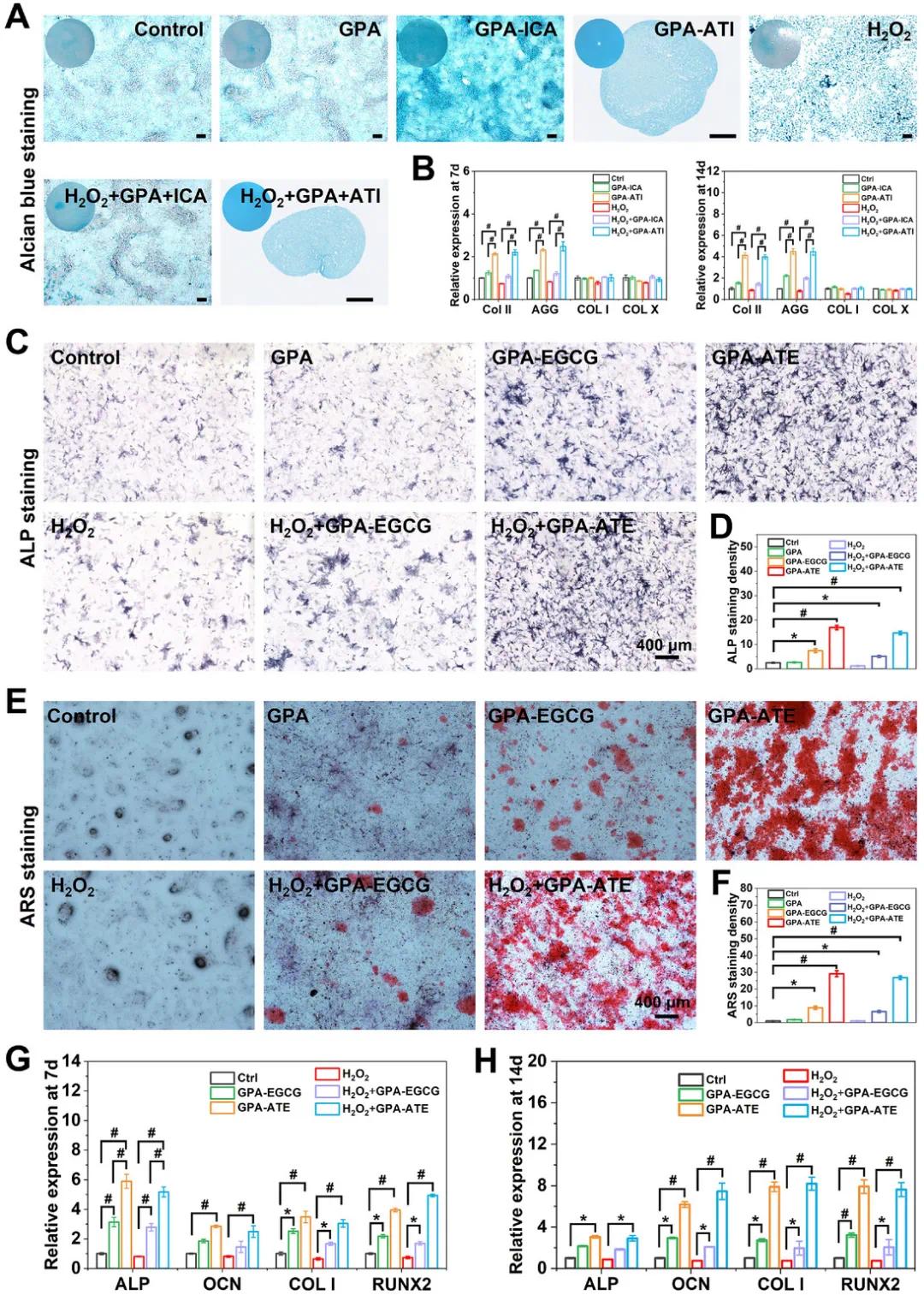
图6 在不同水凝胶支架上,有无H2O2刺激下评价 BMSCs 的软骨和成骨分化。A) 进行阿新蓝染色以评估培养 14 天后,有或没有H2O2刺激下不同水凝胶支架上 BMSCs 的软骨分化。比例尺:200 µm。B) 使用 qRT-PCR 分析在有或没有H2O2刺激下,在第 7 和 14 天不同水凝胶支架上软骨细胞相关基因的表达水平。C) 在第 7 天进行 ALP 染色以评估在有或没有H2O2刺激下不同水凝胶支架上 BMSCs 的早期成骨分化。D) 不同组间相对 ALP 水平的半定量分析。 E) 在第 14 天进行 ARS 染色以评估 BMSCs 在不同水凝胶支架上(有或无H2O2刺激)的成骨分化情况。F) 不同组间相对钙沉积水平的半定量分析。G) 在第 7 天,有或无H2O2刺激的情况下,使用 qRT-PCR 分析不同水凝胶支架上成骨相关基因的表达水平。H )在第 14 天,有或无H2O2刺激的情况下,使用 qRT-PCR 分析不同水凝胶支架上成骨相关基因的表达水平
(6)梯度水凝胶支架的体内骨软骨修复功效
为了评估GPA-ATI/ATE梯度水凝胶支架在募集干细胞、清除ROS、维持细胞活力及促进软骨和成骨分化方面的优势,使用膝关节滑车部圆柱形缺损模型进行了体内评估(图6A)。空白组显示明显缺损,而纯GPA水凝胶组缺损处仍有空洞,GPA-PolyApt组则部分填补缺损。GPA-ATI/ATE组则能有效填充缺损,表面光滑。扫描电镜结果显示,ATI的释放对软骨修复至关重要。术后6周的micro-CT结果表明,GPA-ATI/ATE组的软骨下骨形成明显优于其他组,并在12周时实现了全面修复。GPA-ATI/ATE组的软骨下骨再生程度显著高于纯GPA和GPA-PolyApt组(图6C)。定量分析验证了这些发现(图6D),GPA-ATI/ATE组在骨体积、骨体积比和骨矿物质密度等参数上显著高于其他组。压缩试验结果显示,GPA-ATI/ATE水凝胶支架在恢复膝关节功能方面表现最佳,接近正常膝关节负荷(图S17)。组织学分析(图6E)进一步证实,GPA-ATI/ATE支架显著促进了软骨和软骨下骨的修复,尤其在12周时,软骨和骨的再生与宿主组织良好整合。相比之下,其他组的修复效果较差,显示出裂纹或空洞。这些结果表明,ATI/ATE功能化的GPA水凝胶支架能有效促进骨软骨缺损的修复,具有显著的生物修复潜力。
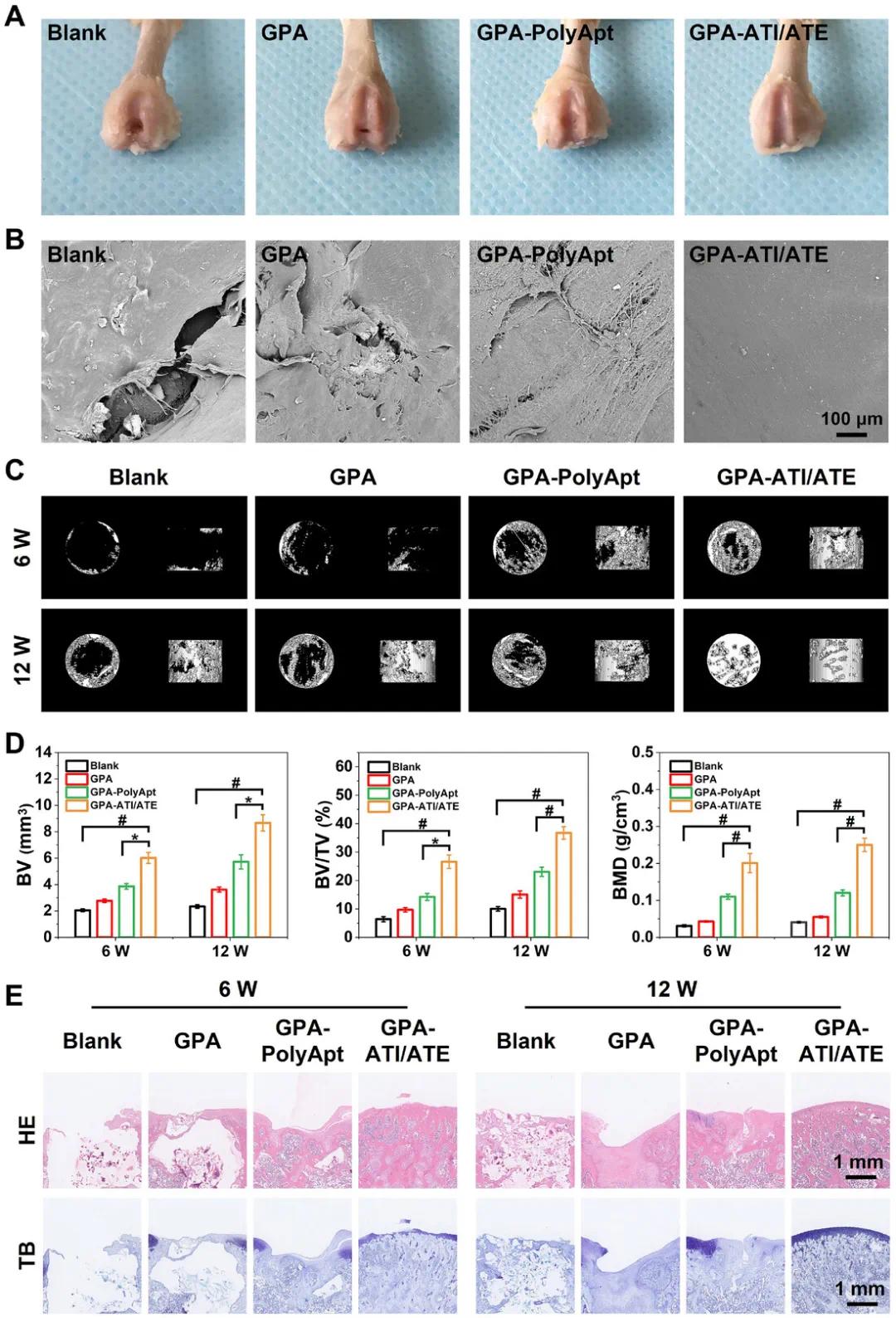
图7 GPA-ATI/ATE 水凝胶支架对大鼠膝关节骨软骨缺损模型的治疗效果。A) 不同组别术后 12 周修复骨软骨缺损的大体图像。B) 不同组别术后 12 周修复软骨表面的 SEM 图像。C) 不同组别术后 6 和 12 周修复软骨下骨的微型 CT 分析的 3D 重建图像。D) BV、BV/TV 和 BMD 的定量微型 CT 分析。E) 苏木精和伊红 (H&E) 和甲苯胺蓝 (TB) 染色显示,与其他组相比,GPA-ATI/ATE 水凝胶支架组的软骨和软骨下骨的修复均得到增强
为了进一步评估GPA-ATI/ATE水凝胶支架在骨软骨修复中的作用,进行了软骨和骨特异性蛋白的免疫组织化学染色(图7A)。植入12周后,GPA-ATI/ATE组的软骨层和软骨下骨区域呈现明显且均匀的阳性染色,尤其是COL II和OCN蛋白的染色强度显著高于其他组,表明该支架能够增强软骨和软骨下骨的修复。这主要是因为ATI和ATE的持续释放,能吸引BMSCs并保护它们免受ROS损伤,同时促进软骨和成骨分化。免疫荧光染色分析(图7B)显示,GPA-ATI/ATE水凝胶支架中BMSCs的富集程度显著高于GPA-PolyApt组,这表明ATI和ATE增强了BMSCs的募集和增殖。流式细胞术结果(图7C)进一步表明,GPA-ATI/ATE组的CD44阳性细胞比例达到13.9%,显著高于GPA-PolyApt组的8.9%,表明ATI和ATE的结合促进了BMSCs的迁移和增殖。ICA和EGCG通过激活Wnt/β-catenin和BMP-Smad信号通路,以及减轻氧化应激,增强了BMSCs的软骨和成骨分化能力。定量分析显示,GPA-ATI/ATE水凝胶支架显著促进了BMSCs的富集,从而改善了骨再生。
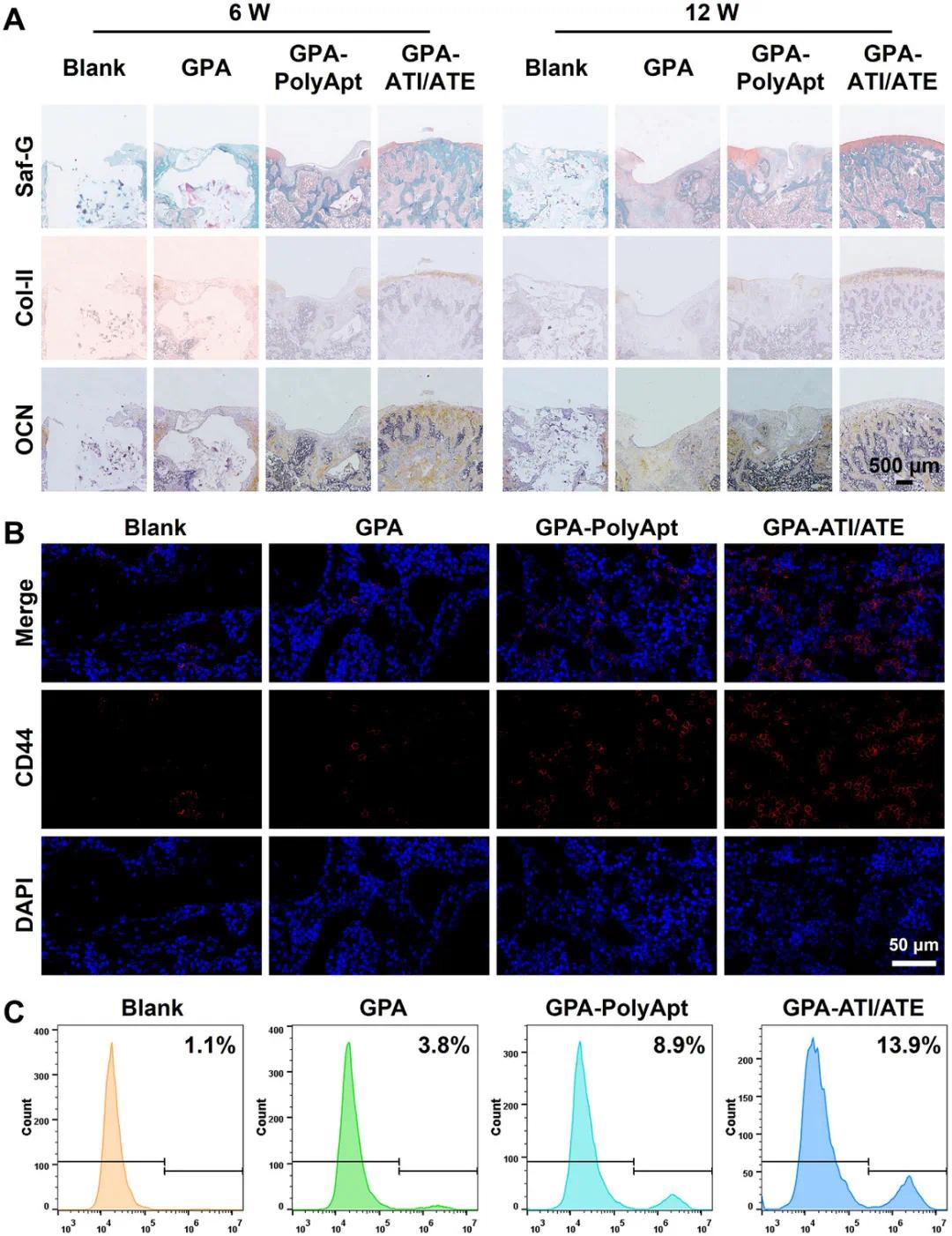
图8 缺损区域的免疫组织学分析和CD44阳性BMSCs募集。A) Saf-G、Coll II和OCN的代表性免疫组织学染色图像,显示不同组别的软骨和软骨下骨修复情况。B) 免疫荧光染色图像显示术后7天,GPA-ATI/ATE水凝胶支架在大鼠膝关节骨软骨缺损处募集的CD44阳性BMSCs。C) 流式细胞术定量分析术后7天,GPA-ATI/ATE水凝胶支架在骨软骨缺损处介导的内源性BMSCs募集情况
本研究通过构建四面体DNA纳米框架,并在其顶点连接干细胞特异性适体Apt19s,成功制备了PolyApt。多价效应显著增强了适体与干细胞的结合能力,有效促进内源性干细胞向骨软骨缺损部位迁移。此外,通过引入中草药中的抗氧化小分子ICA和EGCG,对PolyApt进行功能化,制备了ATI和ATE。实验结果表明,ICA和EGCG能够有效清除活性氧(ROS),保护募集的干细胞免受氧化应激损伤并维持其生物活性。 此外,ICA和EGCG分别促进骨髓间充质干细胞(BMSCs)向软骨细胞和成骨细胞分化,为缺损修复提供功能性细胞。此外,将ATI和ATE掺入GelMA和PEGDA预聚物溶液中,利用DLP打印技术制备了氢键增强的可降解梯度水凝胶支架。该仿生支架模拟正常膝关节的结构特征,在早期提供机械支撑,防止周围宿主组织塌陷,同时促进骨髓间充质干细胞的黏附和扩散。随着支架逐渐降解,整个骨软骨缺损区域将被新生组织填充,实现高效再生和功能恢复。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

