
糖尿病患者常因微血管病变导致糖尿病溃疡,约四分之一的患者在一生中会经历局部性溃疡,形成大面积皮肤组织缺损,严重增加公共卫生负担。针对大面积创面修复,多区域穿支皮瓣因由多条独立血管组成、血供更为可靠,成为临床常用的重建手段。
然而,多区域穿支皮瓣的远端预后受限于“Choke区”与潜在区的血流不足,尤其在糖尿病患者中,微血管损伤与氧化应激加剧了组织坏死风险,严重影响术后成活率。为此,近年来的研究尝试通过局部干预改善微循环与抗氧化环境,如利用L-精氨酸(L-Arg)促进局部一氧化氮(NO)释放,或应用二甲双胍(Metformin)保护内皮细胞、修复线粒体功能。虽然各自疗效已得到验证,但针对糖尿病皮瓣,NO与二甲双胍联合干预是否具有协同促进愈合的效果,目前仍缺乏系统研究,有待进一步探索。

针对上述问题,武汉纺织大学杨红军、武汉大学中南医院张冬、喻爱喜团队合作开发了一种可注射的治疗性水凝胶(MSL@Z/G),用于对抗氧化应激、炎症反应并促进糖尿病皮瓣手术后潜在区域的血管生成。该系统通过将L-精氨酸(L-Arg)修饰于ZIF-90上并负载锶离子(Sr²⁺),形成Sr-L-Arg@ZIF-90(SL@Z)纳米颗粒,随后封装二甲双胍(Metformin),得到MSL@Z纳米颗粒,并掺入GelMA水凝胶基质。注射至皮瓣术区后,水凝胶经紫外交联快速凝胶化,实现药物、离子和气体的联合递送。MSL@Z具备ROS响应特性,在高氧化环境中可持续释放NO并清除H₂O₂,修复因糖尿病导致的内源性NO缺陷,同时锶离子和二甲双胍协同促进Choke区血管新生、降低ROS水平并抑制NF-κB通路,从而提高皮瓣潜在区的血供与成活率。该多功能水凝胶在糖尿病多区域穿支皮瓣治疗中展现出良好的应用前景。该文章于2025年4月5日以《ROS-Responsive Hydrogel Enables Drug/Ion/Gas Co-Delivery for Improving Survival of Multi-Territory Perforator Flap in Diabetes》为题发表于《Advanced Functional Materials》上(DOI:10.1002/adfm.202500586)。
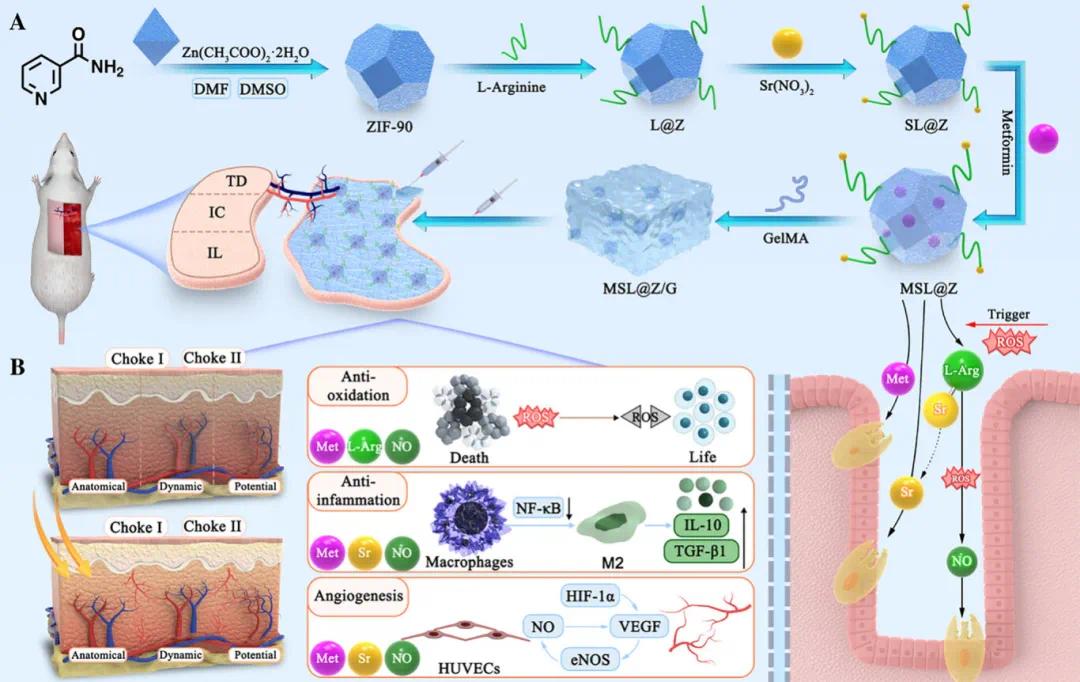
研究示意图
(1)SL@Z纳米粒子的合成与表征
Sr-L-Arg@ZIF-90(记为SL@Z)纳米粒子通过三步工艺合成:首先,咪唑-2-甲醛(2-ICA)和Zn(CH3COO)2·2H2O反应生成ZIF-90;接着,将L-Arg的氨基与ZIF-90的醛基偶联,得到L-Arg@ZIF-90(记为L@Z);最后,将Sr离子添加到L@Z中并与L-Arg的羧基反应,得到SL@Z(图1A)。X射线衍射(XRD)图谱表明,ZIF-90骨架在用L-Arg修饰后保持稳定,且Sr离子修饰后其结构完整性未显著改变(图1B)。傅里叶变换红外光谱(FT-IR)显示,L@Z光谱中出现了一个新的吸收带,对应于L-Arg的C═N伸缩振动,表明L-Arg成功接枝到ZIF-90上,接枝率为79.4%(图1C)。Zeta电位测试显示,L-Arg接枝后显著提高了ZIF-90的表面电荷密度,Sr离子的加入则部分中和了表面正电荷,使zeta电位略有下降,但SL@Z仍保留足够正电荷以促进与细胞膜的相互作用(图1D)。扫描电子显微镜(SEM)图像显示,ZIF-90的形貌在改性后基本保持不变,SL@Z的SEM粒径较小且均匀,但水合粒径较大(图1E)。元素映射和能量色散X射线光谱(EDS)证实了SL@Z中C、O、N、Zn和Sr的均匀分布,表明L-Arg和Sr离子成功修饰(图1F、G)。
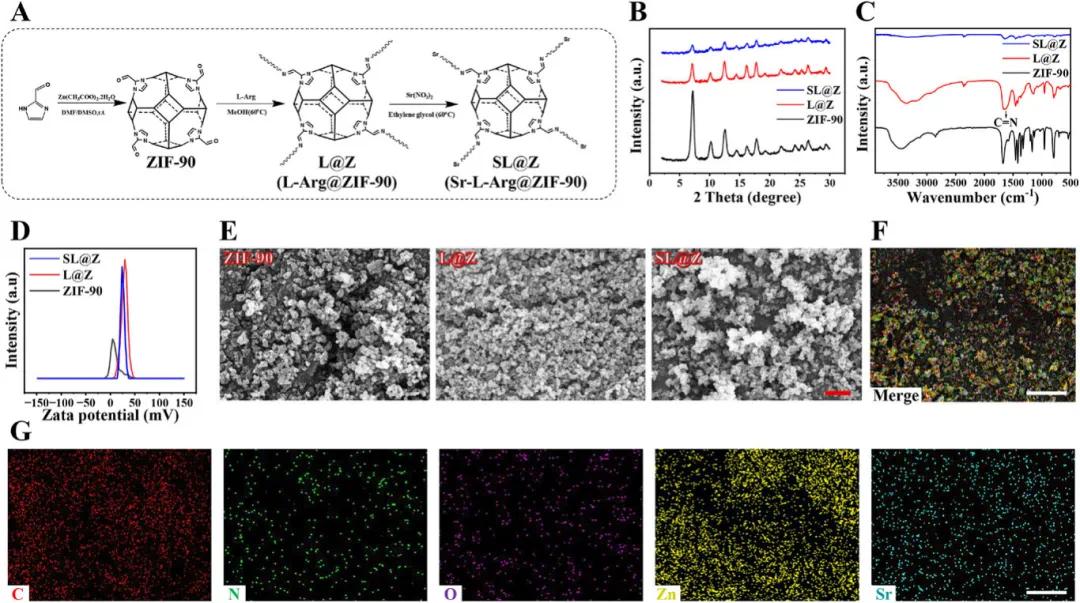
图1. SL@Z纳米粒子的表征。A) 合成SL@Z纳米粒子的示意图。B) XRD图谱,C) FT-IR图谱,D) Zeta电位图谱,以及E) ZIF-90、L@Z和SL@Z纳米粒子的SEM图像。比例尺:2 µm。F) SL@Z纳米粒子元素映射的合并图像和G) SL@Z纳米粒子元素映射的分割图像
(2)SL@Z纳米粒子和MSL@Z/G水凝胶的制备与表征
如图2A所示,通过将二甲双胍封装于SL@Z中制备MSL@Z纳米粒子,并将其添加到GelMA中形成MSL@Z/G水凝胶。图2B显示,MSL@Z/G溶液呈淡黄色,而纯GelMA溶液呈透明白色,且两者均能在紫外线照射后固化。图2C表明,SL@Z/G水凝胶的孔径较小且均匀,表明SL@Z的添加增强了交联效果;而MSL@Z/G的孔径与SL@Z/G相当,说明二甲双胍的添加对孔径无显著影响。图2D、E显示,元素谱图中C和O分布于整个水凝胶中,而Zn和Sr的浓度较低,这归因于SL@Z的添加量有限。图2F、G的流变学测试表明,SL@Z/G和MSL@Z/G的能量储存模量(G′)明显高于纯GelMA水凝胶,且SL@Z和MSL@Z的加入提高了水凝胶的抗变形能力,从而增强了其机械性能。图2H的压缩性能测试显示,SL@Z/G和MSL@Z/G的抗压强度高于纯GelMA水凝胶,但二甲双胍的引入对机械性能无显著影响。图2I的溶胀和降解动力学测试表明,SL@Z和MSL@Z的加入降低了水凝胶的溶胀能力和降解速度,这归因于纳米粒子对网络结构的影响。图2J显示,MSL@Z/G在6天内释放的二甲双胍量为0.136 mg/ mL,表现出快速初始释放和随后的稳定释放阶段,使其成为糖尿病多区域穿支皮瓣的理想递送系统。图2K的体外释放曲线表明,Zn和Sr离子在前24小时内快速释放,随后缓慢增加,到第7天,累积浓度分别为10.23 µg/ mL(Zn)和0.71 µg/ mL(Sr),这些浓度低于细胞毒性水平,且Sr离子浓度足以促进血管生成和抗炎。综上所述,MSL@Z/G水凝胶具有良好的机械性能,可作为二甲双胍、Sr和L-Arg的共递送系统,为糖尿病患者多区域穿支皮瓣的存活提供了新的选择。
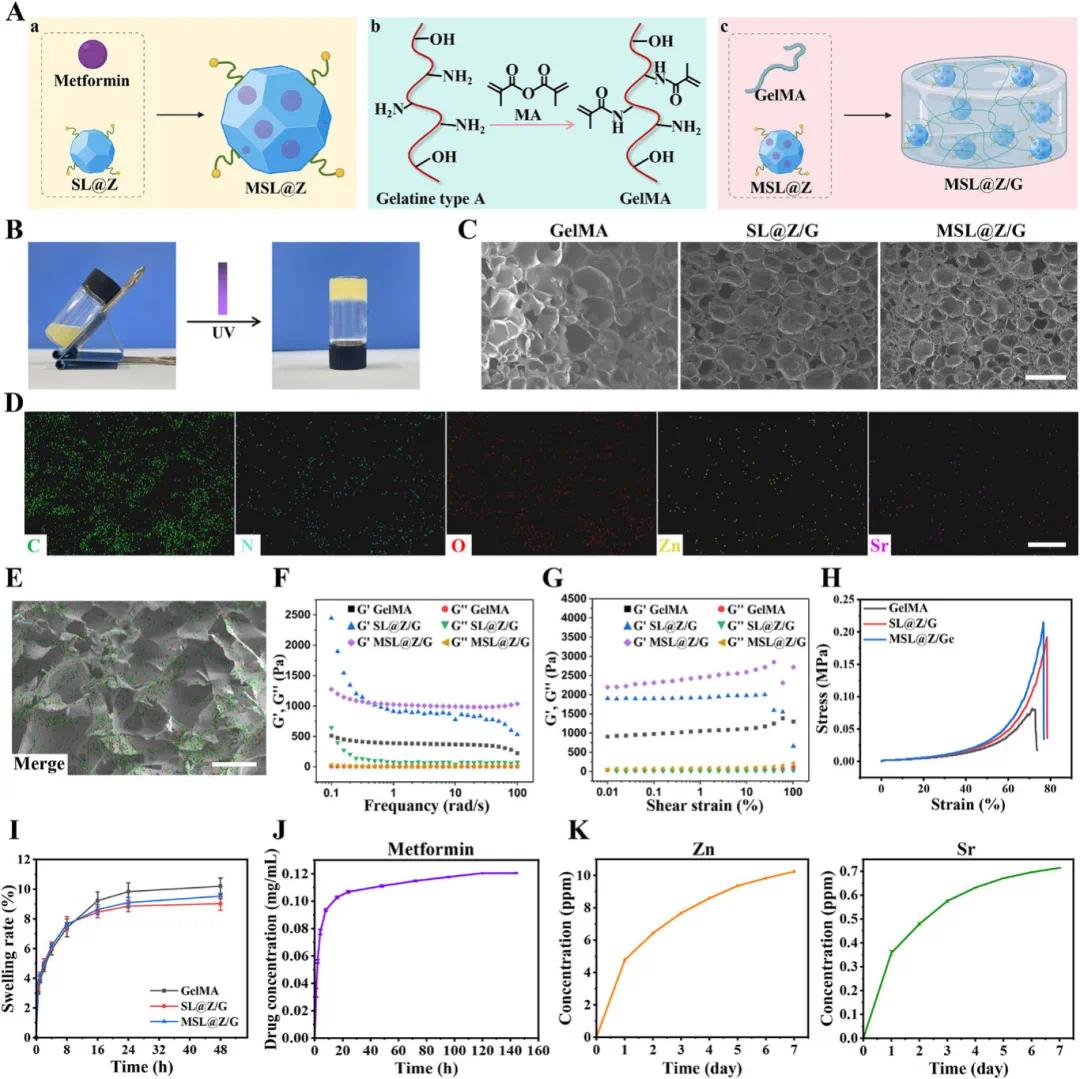
图2. SL@Z 纳米粒子和 MSL@Z/G 水凝胶的表征。A) 合成 a) MSL@Z 纳米粒子、b) GelMA 和 c) MSL@Z/G 水凝胶的示意图。B) MSL@Z/G 水凝胶凝胶化前后的照片。C) SEM 图像显示 GelMA、SL@Z/G、MSL@Z/G 水凝胶的微观结构。比例尺:500 µm。D) MSL@Z/G 水凝胶元素映射的分割图像和 E) 合并图像。比例尺:200 µm。F) 频率扫描流变学、G) 振幅扫描流变学、H) 应力-应变曲线和 I) GelMA、SL@Z/G、MSL@Z/G 水凝胶的溶胀曲线。J) MSL@Z/G 水凝胶中二甲双胍的累积释放曲线。 K)MSL@Z/G水凝胶中Zn和Sr离子的释放
(3)MSL@Z/G水凝胶在氧化损伤下诱导细胞内ROS清除和抗凋亡活性
为了确定细胞环境中的H₂O₂是否能引发L-精氨酸释放NO,利用DAF-FM DA荧光探针评估NO的积累,结果显示在没有H₂O₂时,DAF-FM荧光亮度最低,表明L-精氨酸在正常细胞环境中稳定存在;加入H₂O₂后,人脐静脉内皮细胞(HUVEC)和RAW264.7细胞发射DAF-FM荧光,且荧光强度随H₂O₂浓度升高而呈剂量依赖性增加(图3A),表明ROS能够激活细胞环境中的MSL@Z纳米粒子,导致L-Arg的释放,进而产生NO。DCFH-DA和DHE荧光探针评估结果表明,与100 µm H₂O₂处理相比,400 µm H₂O₂处理诱导的绿色和红色荧光强度更强,表明细胞内ROS的产生增加;与对照组相比,SL@Z/G和MSL@Z/G组的ROS表达显著减少(荧光较弱),这主要归因于L-Arg释放的NO,且MSL@Z/G组的ROS水平在所有组中最低,可能归因于二甲双胍的保护作用(图3B、F)。线粒体膜电位测定结果显示,细胞暴露于H₂O₂导致线粒体膜电位(MMP)耗散,绿色荧光增强,而经MSL@Z/G组处理的细胞线粒体完整性显著保留,红色荧光明显,绿色荧光微弱(图3C、G)。Annexin V/PI流式细胞术检测显示,与阳性对照组相比,MSL@Z/G组细胞凋亡明显减少,提示二甲双胍可能对氧化应激细胞的凋亡具有保护作用;SL@Z/G组的细胞凋亡率也明显低于阳性对照,说明NO对400 µm H₂O₂诱导的细胞凋亡也能发挥明显的抑制作用(图3D、F)。QT-PCR检测结果表明,SL@Z/G和MSL@Z/G处理均能减轻caspase依赖的凋亡途径的激活(图3I)。简而言之,这些数据表明二甲双胍/NO输送可以降低ROS水平,维持线粒体完整性,并抑制细胞凋亡(图3E)。
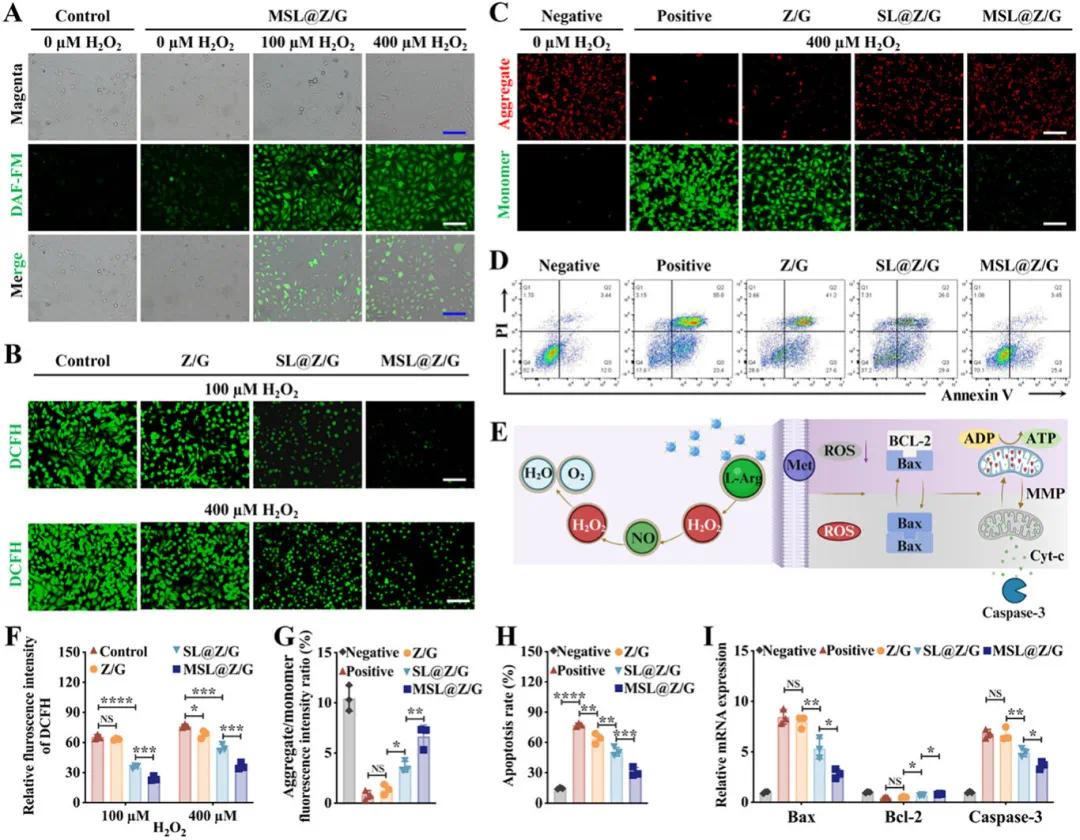
图3. MSL@Z/G 水凝胶的体外抗氧化和抗凋亡作用。A) HUVEC 对 MSL@Z/G 的细胞摄取以及 H2O2刺激下 NO 的释放。B) 用不同水凝胶和 100 或 400 µм H2O2培养12 小时后 HUVEC 的 ROS 染色(DCFH-DA 探针,绿色)。C) 用不同水凝胶和 400 µм H2O2培养 12 小时后 HUVEC 的 JC-1 聚集体(红色)和 JC-1 单体(绿色)染色。阴性组无H2O2 ,阳性组有400 µм H2O2。 D)流式细胞术检测HUVECs与不同水凝胶及400 µм H2O2培养12小时后凋亡情况的代表性图。阴性组不加H2O2,阳性组有400 µм H2O2。E)MSL@Z/G水凝胶诱导HUVECs清除ROS示意图。F)基于DCFH-DA染色定量水凝胶的ROS清除能力。G)JC-1染色定量聚集体/单体荧光强度比。H)凋亡细胞定量,包括早期凋亡细胞(AnnexinV + PI −)和晚期凋亡细胞(AnnexinV + PI +)。 (I) 用水凝胶和 400 µм H2O2处理12 小时后 HUVEC 中凋亡基因 Bax、Bcl-2 和 Caspase 的相对 mRNA 表达
(4)MSL@Z/G水凝胶的抗炎作用
为了研究MSL@Z/G水凝胶的体外抗炎作用,通过用LPS处理RAW264.7巨噬细胞并建立M1表型极化模型(图4A)。免疫荧光染色结果显示,对照组细胞呈现圆形巨噬细胞形态和清晰的CD86荧光,而MSL@Z/G组的巨噬细胞呈现长梭形形态,细胞伸长率是Z/G组的1.95倍,且CD86荧光强度降低,CD206荧光强度升高,表明巨噬细胞可能从M1型复极化为M2型(图4B、F)。流式细胞术分析显示,对照组中M1和M2型巨噬细胞比例分别为26.63% ± 1.36%和1.68% ± 1.45%,而MSL@Z/G组M1巨噬细胞比例显著降低(8.33% ± 0.67%),M2巨噬细胞数量显著增加(18.53% ± 1.93%)(图4C、G)。mRNA表达和细胞因子分泌结果表明,MSL@Z/G组炎症细胞因子基因表达显著下调,抗炎细胞因子产生显著增强,且细胞因子分泌结果与mRNA表达一致(图4D、F、H、I)。这表明MSL@Z/G水凝胶的ROS清除特性削弱了有害的促炎作用并促进了M2表型极化,有助于健康的内皮功能。
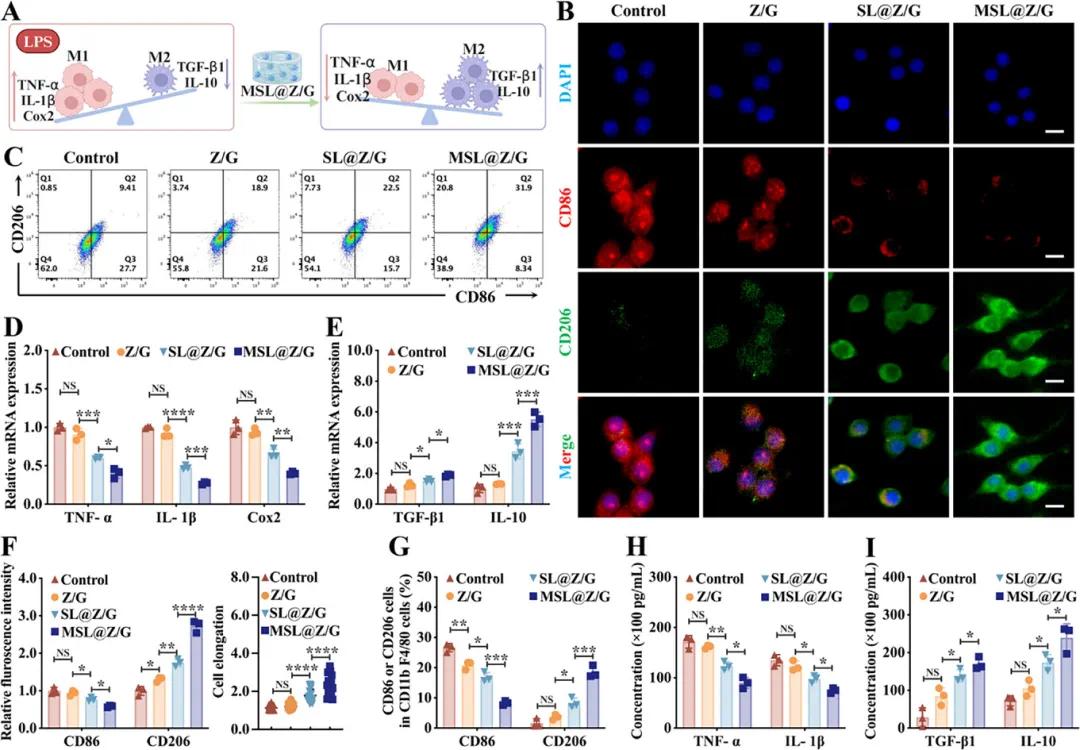
图4. MSL@Z/G水凝胶调控巨噬细胞炎症和极化。A) MSL@Z/G水凝胶诱导巨噬细胞极化对免疫微环境平衡的影响示意图。B) 用不同水凝胶培养第2天的RAW264.7细胞(LPS刺激后)的细胞核(蓝色)、CD86(红色)和CD206(绿色)的IF染色。C) 流式细胞术分析巨噬细胞极化情况。D) 用水凝胶处理第2天的RAW264.7细胞(LPS刺激后)中M1相关基因TNF-α、IL-1β和Cox2的相对mRNA表达。E) M2相关基因TGF-β1和IL-10的相对mRNA表达。 F)基于IF图像的巨噬细胞CD86、CD206定量荧光强度及伸长率的统计结果。G)门控CD11b + F4/80 +细胞后M1细胞(CD86 + CD206- )和M2细胞(CD86 - CD206 + )的定量结果。H)用水凝胶处理第2天的RAW264.7(LPS刺激后)中促炎细胞因子TNF-α和IL-1β的ELISA分析。I)抗炎细胞因子TGF-β1和IL-10的ELISA分析
(5)转录组分析揭示MSL@Z/G水凝胶诱导的巨噬细胞极化途径
为了探究MSL@Z/G水凝胶在巨噬细胞极化中的作用机制,对用LPS刺激的巨噬细胞与MSL@Z/G和Z/G水凝胶共培养的细胞进行了RNA-seq转录组分析。火山图显示,MSL@Z/G与Z/G组间有4514个上调基因和7567个下调基因,表明基因表达存在显著差异(图5A)。基因本体(GO)富集分析显示,MSL@Z/G组减弱了炎症反应过程,导致炎症因子表达降低,且增强了Notch信号通路,该通路是快速血运重建和血管生成的关键驱动因素(图5B、E)。KEGG富集图显示了与抗炎相关的功能注释,包括NF-κB和TNF信号通路,且Notch信号通路在KEGG TOP 30中被鉴定,抑制这些炎症通路可能有助于减少血管内皮损伤,建立有利于血管再生的免疫微环境(图5C)。归一化热图分析显示,MSL@Z/G处理后,与炎症和趋化因子相关的基因表达显著下调,而Notch通路基因上调,这些基因与血管生成过程中的细胞迁移、增殖和存活有关(图5D)。蛋白质印迹试验结果显示,与对照组相比,MSL@Z/G组的IκBα和IκBβ荧光强度显著增强,NF-κB、IL-1β、TNF-α和Cox2的荧光强度降低(图5F、G)。总之,二甲双胍/Sr离子/NO联合应用可以抑制IκB的降解,从而降低NF-κB活化和随后炎症因子的分泌,有助于健康的内皮功能和组织愈合(图5H)。
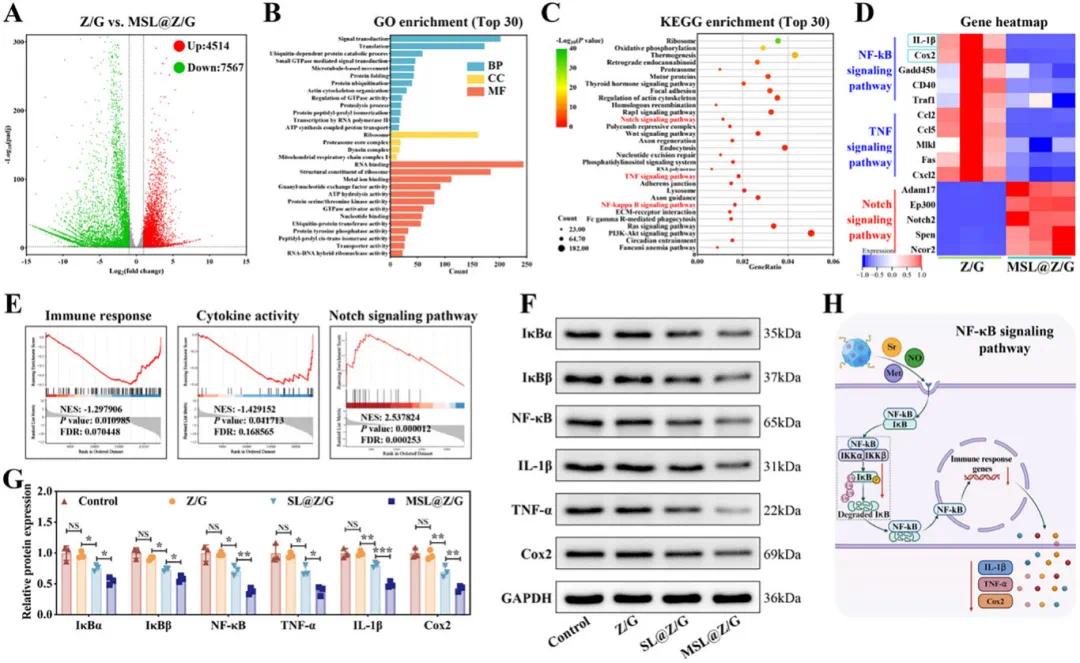
图5. MSL@Z/G水凝胶上巨噬细胞基因表达的生物信息学分析。A)差异表达基因转录组分析火山图。B)MSL@Z/G与Z/G培养的巨噬细胞所有基因的GO分析。C)MSL@Z/G与Z/G的KEGG富集通路。D)NF-κB、TNF和Notch信号通路差异表达基因热图。E)GO term GSEA。F)IκBα、IκBβ、NF-κB、IL-1β、TNF-α和Cox2蛋白表达的Western印迹图像。(G)基于Western印迹图像的蛋白质表达定量分析。H)MSL@Z/G水凝胶抑制NF-κB信号通路示意图
(6)MSL@Z/G水凝胶的体外细胞增殖和血管生成
为了研究MSL@Z/G水凝胶对内皮细胞增殖和血管生成的影响,首先评估了其在正常条件下对人脐静脉内皮细胞(HUVECs)增殖的调控作用。Calcein-AM/PI染色结果显示,MSL@Z/G水凝胶在24小时后具有良好的细胞相容性,且与对照组相比,MSL@Z/G组的细胞数量明显增加,覆盖面积更大(图6A)。Cell Counting Kit-8(CCK8)结果表明,随着时间推移,各组细胞增殖均增加,而SL@Z/G和MSL@Z/G组均加速了HUVECs的增殖,表明Sr离子和二甲双胍的释放对细胞增殖有积极影响(图6E)。在氧化应激条件下,通过划痕实验评估内皮细胞的迁移能力,结果显示,12小时后MSL@Z/G组的伤口愈合率明显高于SL@Z/G组,24小时后MSL@Z/G组的划痕完全闭合,这归因于二甲双胍、Sr和NO的释放促进了细胞迁移(图6B、F)。Transwell实验进一步证实了MSL@Z/G组的HUVEC迁移能力增强(图6C)。此外,通过管道形成实验评估血管生成能力,结果显示MSL@Z/G组形成的管道数量是Z/G组的两倍多,表明其抗氧化作用有助于恢复糖尿病微环境中的血管生成(图6D、G)。RT-PCR结果表明,MSL@Z/G组显著上调了血管化相关基因的表达,包括HIF-1α、VEGF和eNOS,这与二甲双胍刺激HIF-1α产生和Sr离子促进VEGF诱导的血管生成一致(图6H)。综上所述,MSL@Z/G水凝胶通过持续释放二甲双胍和Sr离子,首先上调HIF-1α,进而激活VEGF,随后VEGF上调eNOS,产生内源性NO,最终促进大量VEGF的生成,加速再生血管中的血管生成,从而促进皮瓣愈合(图6I)。
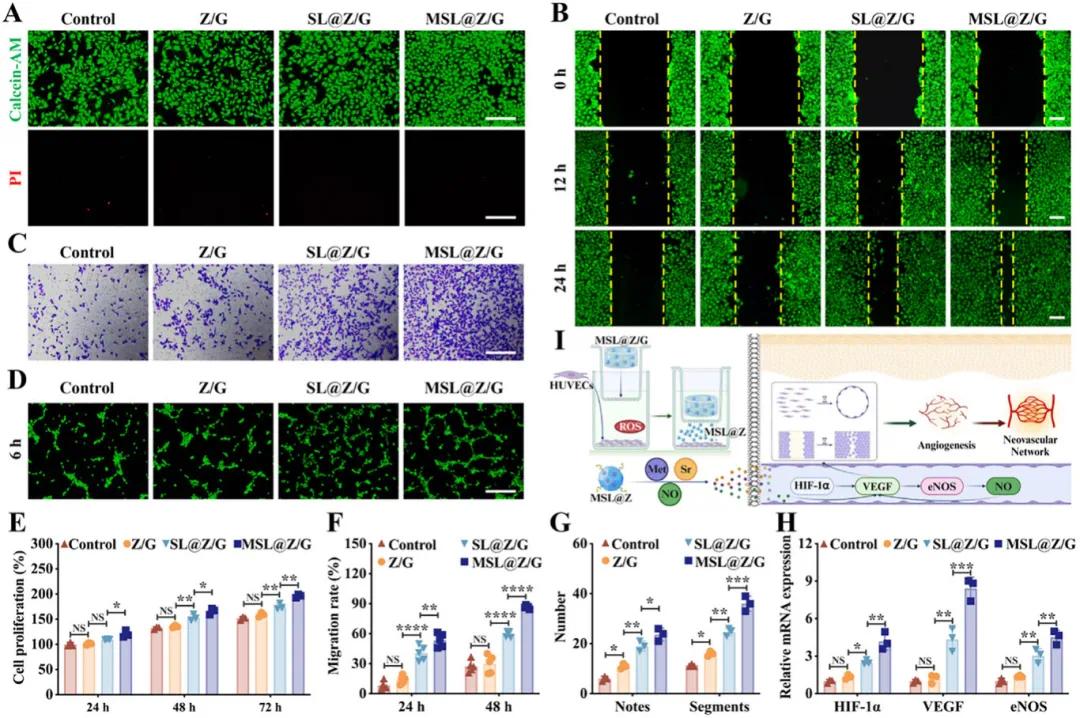
图6.MSL@Z/G水凝胶体外促进HUVEC增殖和血管生成。A) 粘附于不同水凝胶表面24小时的HUVEC的活/死染色。B) 划痕愈合实验,检测与水凝胶一起培养0至24小时的HUVEC的迁移情况。虚线表示划痕边缘。C) 与水凝胶一起培养的HUVEC 24小时Transwell迁移情况。D) 与水凝胶一起培养的HUVEC 6小时Matrigel管形成情况。E) 与水凝胶一起培养24、48和72小时的HUVEC的细胞增殖情况。F) 细胞迁移率量化。G) 节点和节段数量的量化。 H)用水凝胶处理第 7 天的 HUVEC 中血管生成基因 HIF-1α、VEGF 和 eNOS 的相对 mRNA 表达。I)体外共培养体系和 MSL@Z/G 水凝胶刺激的 HUVEC 血管生成示意图
(7)MSL@Z/G水凝胶促进多区域穿支皮瓣成活
使用糖尿病大鼠多区域穿支皮瓣模型评估了MSL@Z/G水凝胶促进血管化和组织再生的能力。通过结扎血管构建了糖尿病单蒂多区域穿支皮瓣模型,TD为解剖区,IC为动力区,IL为潜能区,且存在Choke I和Choke II两个关键区域(图7A、B)。宏观上,对照组远端和外周吻合口出现明显坏死,而水凝胶治疗组坏死面积缩小,MSL@Z/G组愈合状态接近理想状态(图7C)。激光散斑信号显示,对照组Choke II区信号未增加且潜在区信号下降,而SL@Z/G和MSL@Z/G组的信号呈增加趋势,MSL@Z/G组表现出最有效的血管再生和血液运输,第7天整个皮瓣呈持续高信号(图7D)。H&E和Masson染色结果显示,对照组皮瓣胶原纤维排列紊乱且有大量炎性细胞和坏死细胞,而MSL@Z/G组皮瓣上皮结构完整,血管组织丰富,胶原纤维排列整齐(图7E)。
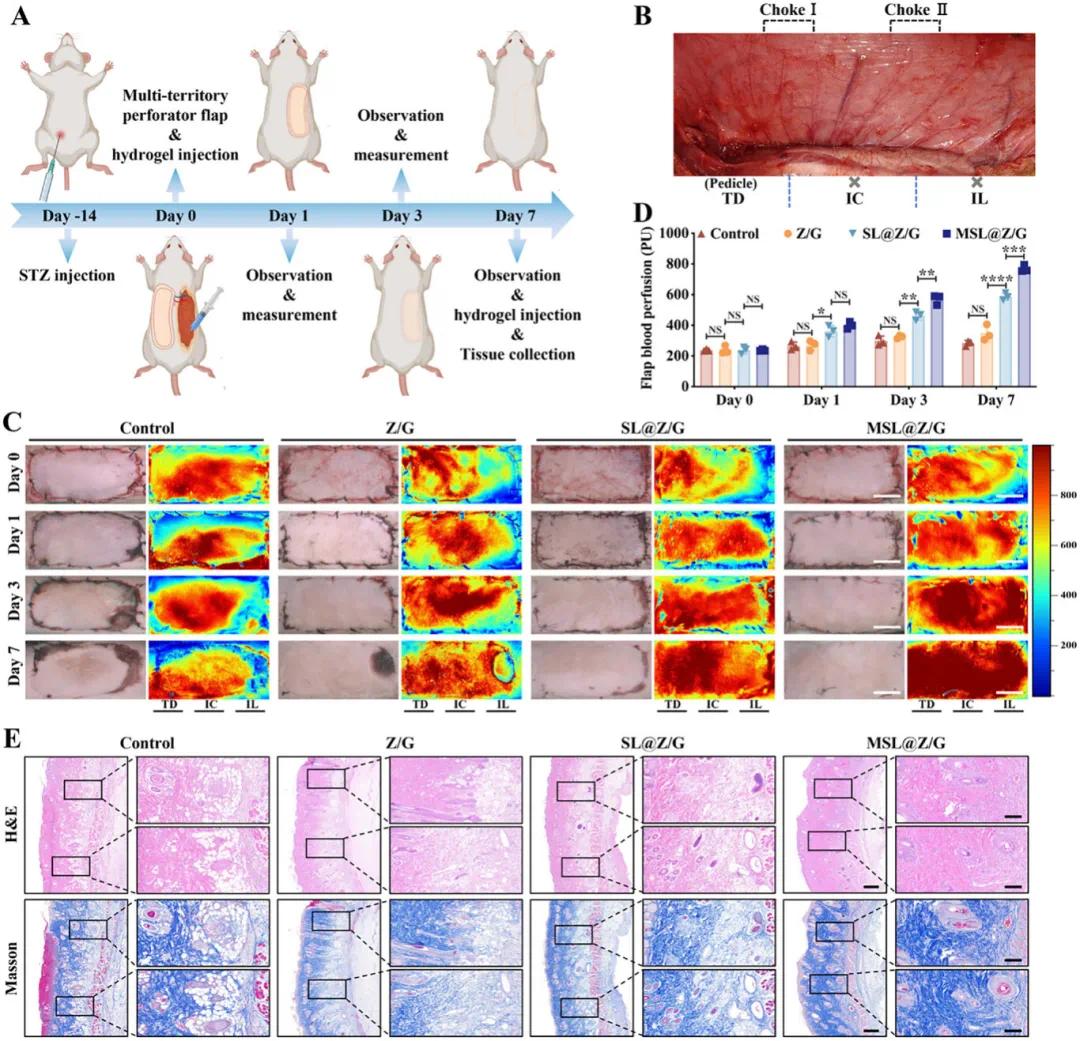
图7.MSL@Z/G水凝胶提高糖尿病大鼠多区域穿支皮瓣成活率。A)建立2型糖尿病及多区域穿支皮瓣大鼠模型。B)多区域穿支皮瓣皮肤血管活体解剖图。TD:胸背穿支(解剖区);IC:肋间后穿支(动力区);IL:髂腰穿支(潜在区);×:切断结扎;Choke I区:TD与IC之间;Choke II区:IC与IL之间。C)术后第0、1、3、7天的皮瓣图像及激光散斑图像。比例尺:2cm。D)基于激光散斑图像的皮瓣Choke II区血液灌注情况。 E)术后第7天,对皮瓣Choke II区进行H&E染色和Masson染色。比例尺:低倍镜下1毫米,高倍镜下200微米
(8)MSL@Z/G水凝胶的体内血管生成和抗炎作用
免疫荧光(IF)和免疫组织化学(IHC)分析用于研究水凝胶在多区域穿支皮瓣中的血管生成和炎症反应。ROS IF染色证明了SL@Z/G和MSL@Z/G水凝胶的过氧化物清除能力,而NO IF染色证实了其释放L-Arg以在体内递送NO的能力(图8A、D)。术后第7天,对照组TNF-α阳性表达最高,而IL-10阳性表达最低,提示以M1型巨噬细胞为主;MSL@Z/G组TNF-α阳性细胞密度最低,而IL-10阳性细胞密度最高,表明其促进巨噬细胞向M2表型极化,减轻炎症反应(图8B、E)。流式细胞术检测显示,SL@Z/G和MSL@Z/G组的M2巨噬细胞比例明显高于对照组和Z/G组,而M1巨噬细胞比例明显低于对照组和Z/G组,与体外结果一致(图8F、H)。CD31和Ang-1的IF染色显示,MSL@Z/G组的微血管更大且更清晰,CD31和Ang-1阳性细胞面积大于其他组,表明其促进血管成熟(图8C、G)。IHC染色显示,MSL@Z/G组的MMP-2和MMP-9浓度最低,表明其减少MMP蓄积,促进皮瓣愈合(图8I)。综上所述,MSL@Z/G水凝胶在皮瓣抗氧化和抗炎方面发挥积极作用,改善糖尿病微环境以促进血管新生(图8J)。
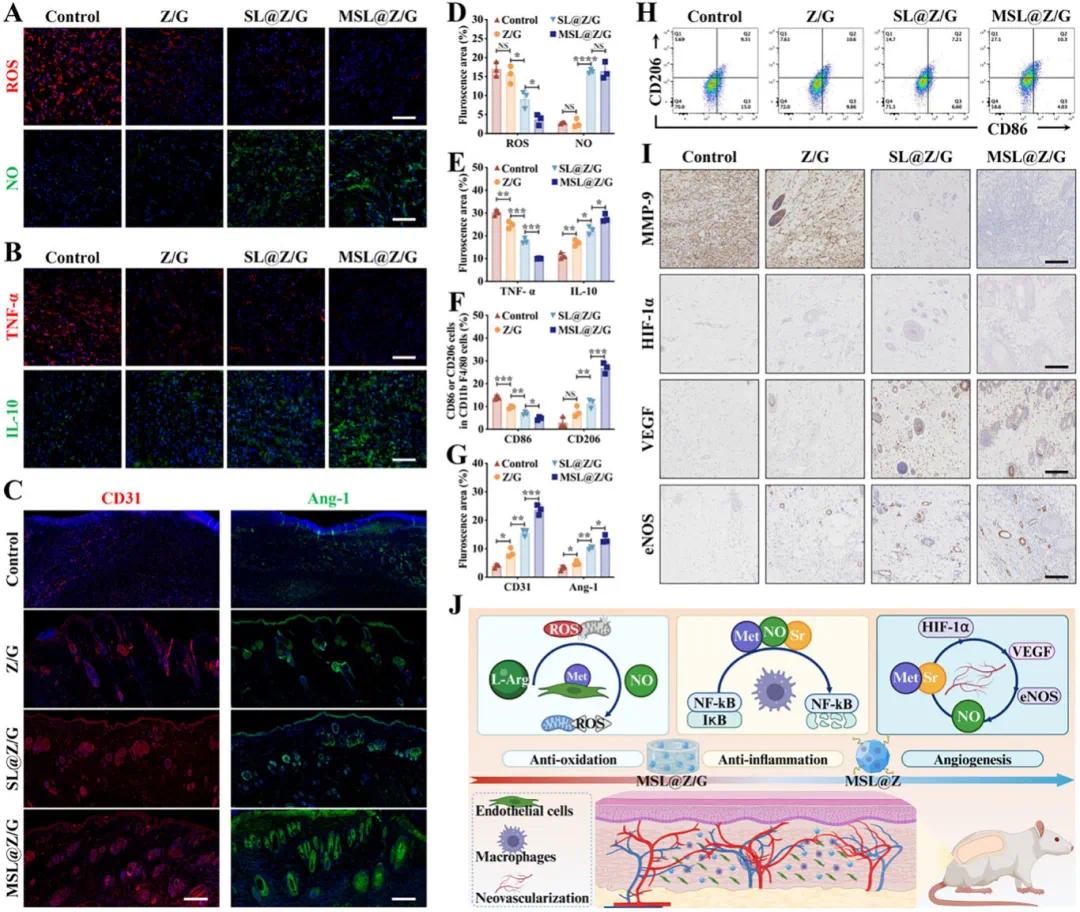
图8.MSL@Z/G 水凝胶增强糖尿病大鼠多区域穿支皮瓣 Choke II 区的血管生成和抗炎作用。A) 术后第 3 天,Choke II 区中的细胞核、ROS(红色)和 NO(绿色)的 IF 染色。B) 术后第 3 天,Choke II 区中的细胞核、TNF-α(红色)和 IL-10(绿色)的 IF 染色。C) 术后第 7 天,Choke II 区中的细胞核、CD31(红色)和 Ang-1(绿色)的 IF 染色。D) 基于 IF 图像的 ROS 和 NO 定量荧光区域。(E) 基于 IF 图像的 TNF-α 和 IL-10 定量荧光区域。F) 在 CD11b + F4/80 +细胞上门控后,M1(CD86 + CD206 −)和 M2(CD86 − CD206 + )细胞的定量结果。G) 基于 IF 图像的 CD31 和 Ang-1 的定量荧光区域。H) 代表性流式细胞术图显示术后第 7 天 Choke II 区周围的巨噬细胞极化。I) 术后第 7 天在 Choke II 区对 MMP-9、HIF-1α、VEGF 和 eNOS 进行 IHC 染色。J) MSL@Z/G 水凝胶改善糖尿病微环境以促进皮瓣成活的示意图
本研究开发了一种基于MSL@Z/G的治疗系统,用于促进糖尿病患者多区域穿支皮瓣的成活。该系统构建了一种响应性NO气体输送系统,以ROS作为触发因素,并结合了二甲双胍和锶离子的缓释特性。在ROS升高的环境中,MSL@Z纳米颗粒通过释放NO激活抗氧化反应,同时二甲双胍降低内源性ROS的产生。此外,二甲双胍、锶离子和NO的联合应用促进了M2巨噬细胞的表达,并通过阻断NF-κB信号通路抑制炎症因子的浸润。 MSL@Z/G水凝胶通过HIF-1α/VEGF/eNOS通路加速了再生血管中的血管生成。细胞增殖和器官H&E染色结果证实了该系统的生物相容性。在糖尿病大鼠多区域穿支皮瓣模型中,MSL@Z/G水凝胶在Choke II区表现出良好的血管生成、炎症抑制和过氧化物清除效果,确保远端皮瓣成活并用于组织修复。其可注射性和良好的机械性能使其易于应用于不同大小的皮瓣。 综上所述,MSL@Z/G水凝胶在糖尿病微环境中具有抗氧化/抗炎特性并促进血管生成,为其未来在糖尿病多区域穿支皮瓣的临床应用提供了理论基础。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

