
骨关节炎(OA)作为一种常见的退行性疾病,传统治疗方法如单独使用大黄酸Rhein(一种天然草药成分)由于低生物利用度和体内快速代谢等因素,效果有限。尽管细胞外囊泡(EVs)在治疗OA方面显示出了潜力,但其在关节内的保留时间短,限制了它们的疗效。此外,持续的氧化应激和炎症反应进一步加剧了OA的发展,而现有的治疗方法往往难以同时解决这些问题,导致临床治疗效果不佳。

针对上述问题,浙江大学周民教授团队开发了一种基于Rhein的超分子网络水凝胶(Rh Gel),并将其与微藻衍生的细胞外囊泡(SP-EVs)结合,形成Rh Gel@SP-EVs复合物,以期提高治疗效果。通过一系列体外实验验证了该复合物对TNF-α诱导的氧化损伤具有显著保护作用,并通过动物模型评估了其在治疗DMM(前交叉韧带切断术)诱导的OA中的疗效。结果表明,Rh Gel@SP-EVs不仅能有效缓解炎症反应、促进能量稳态,还能增加关节软骨厚度、改善OARSI评分,显示出维持关节软骨完整性的潜力。此外,安全性评估也证实了该复合物的良好生物相容性,为未来临床应用奠定了基础。该文章于2025年2月21日以《Microalgae-Derived Extracellular Vesicles Synergize with Herbal Hydrogel for Energy Homeostasis in Osteoarthritis Treatment》为题发表于《ACS Nano》(DOI: 10.1021/acsnano.4c16085)。
研究示意图
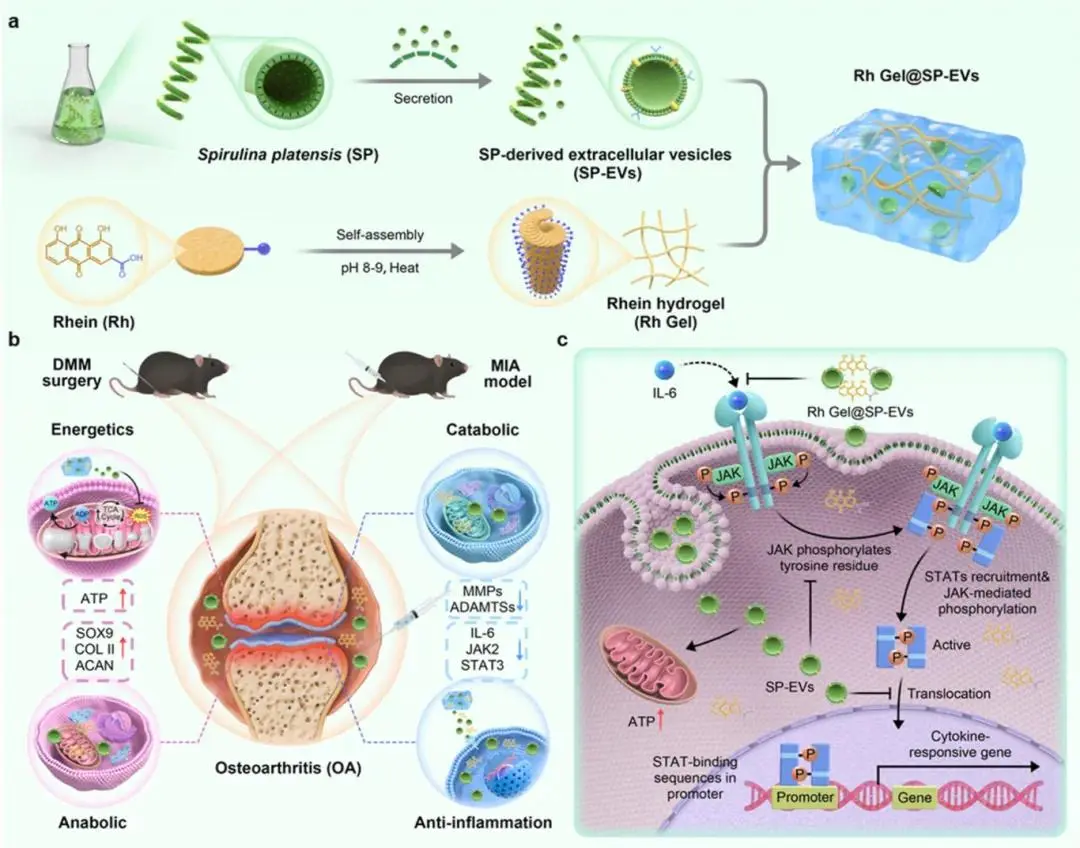
(1)SP-EV的分离、表征、和分析
图1a描绘了SP-EVs的提取流程,通过梯度离心和连续过滤实现了有效纯化;透射电子显微镜(TEM)图像(图1b)显示了典型的50至100 nm盘状囊泡结构,证实了其形态特征(标尺=50 nm)。粒径分布和Zeta电位分析(图1c-d)表明SP-EVs的尺寸集中在50-100纳米范围内,Zeta电位约为-13 mV,进一步验证了分离的有效性。蛋白质组学分析(图1e)揭示了SP-EVs中含有62种蛋白质,基因本体论(GO)分类(图1f-g)和京都基因与基因组百科全书(KEGG)通路分析(图1h)显示这些蛋白质主要参与ATP依赖的活动和代谢过程,强调了它们在能量代谢中的关键作用。此外,正交群组蛋白注释(图 S2)突出了翻译、能量生产和转换相关蛋白质的重要性,表明SP-EVs在调节关节稳态及骨关节炎(OA)病理生理方面具有潜在的应用价值。这些结果综合说明了SP-EVs作为一种治疗OA的新策略的可能性,特别是在调节能量代谢方面的作用。
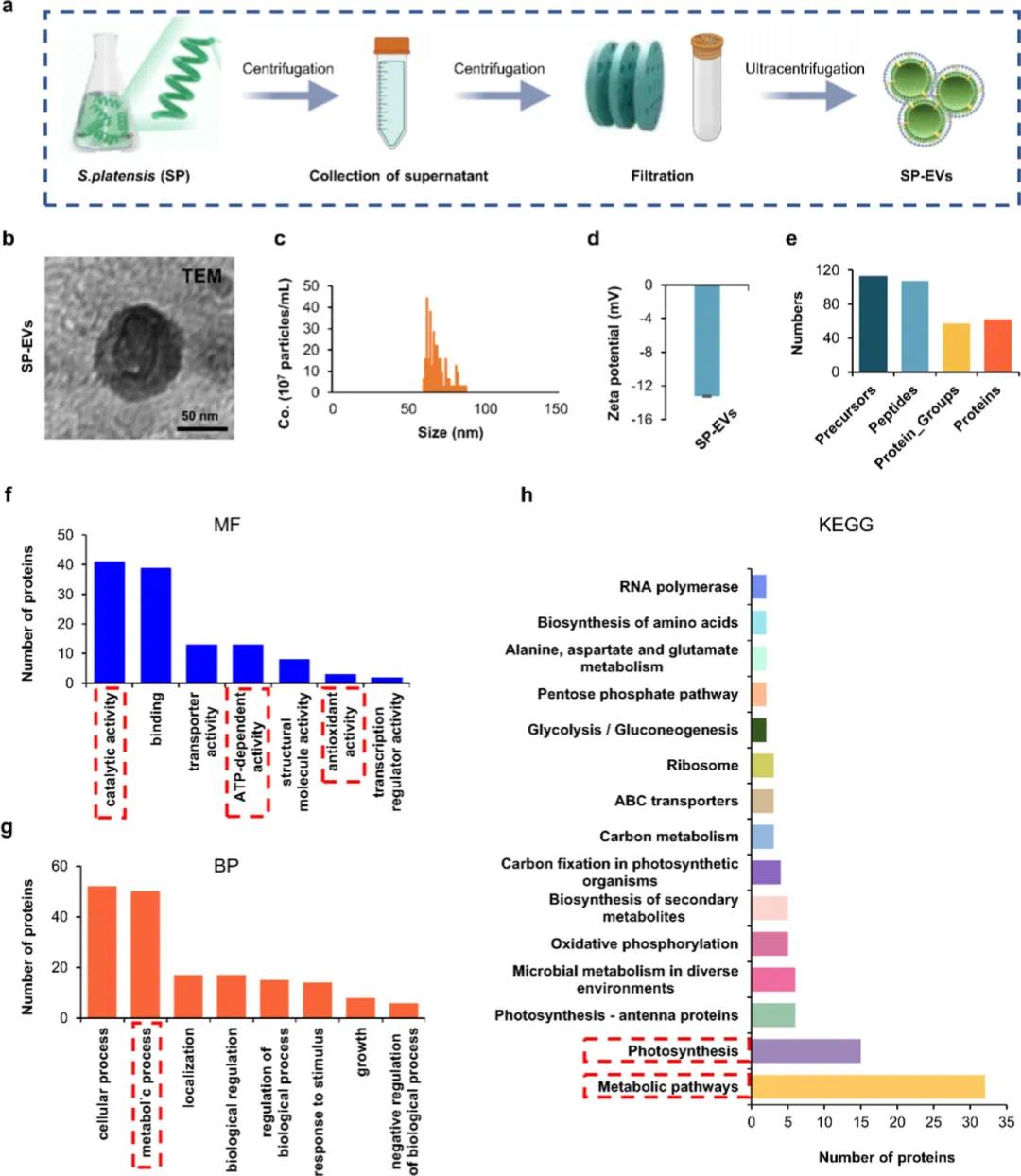
图1. SP-EV的提取、表征和分析。(a)SP-EV的浸提过程;(b)SP-EV的透射电子显微镜(TEM)图像,比例尺 = 50 nm;(c)SP-EV的粒度;(d)SP-EV的Zeta电位(n = 3);(e)通过蛋白质组学分析表征SP-EV中的蛋白质组分;(f)SP-EV中蛋白质的分子功能(MF);(g)与SP-EV中蛋白质相关的生物学过程(BP);(h)SP-EV的京都基因和基因组百科全书(KEGG)富集分析
(2)Rh Gel@SP-EVs的合成与表征
首先,图2a提供了Rh Gel@SP-EVs的合成流程示意图,通过将Rh Gel(由加热溶解于碳酸氢钠溶液中并冷却后自组装形成)与SP-EVs结合,制备了稳定的三维网络结构。不同浓度(2, 4, 8 mg/mL)的Rh Sol和Rh Gel的照片及其紫外可见光谱和荧光光谱分析(图 2b-c)显示,随着Rh浓度增加,样品颜色加深且吸收峰和荧光强度增强。UV荧光光谱和Zeta电位分析(图 2d-e)表明Rh Gel具有较高的稳定性,适合用于药物递送系统。扫描电子显微镜(SEM)图像(图2f)揭示了Rh Gel表面光滑的外表皮层,有助于保持其稳定性和均匀性。照片对比(图2g)直观地展示了SP-EVs、Rh Sol、Rh Gel以及Rh Gel@SP-EVs之间的差异,证实了复合材料的成功制备。紫外可见吸收光谱图(图2h)显示Rh Gel@SP-EVs同时具有SP-EVs特有的680 nm吸收峰和Rh Gel的435 nm吸收峰,证明了两种成分的有效结合。Zeta电位分析(图2i)表明Rh Gel@SP-EVs的Zeta电位较Rh Gel有所降低,但不影响其整体稳定性。不同pH值条件下从Rh Gel@SP-EVs中释放的Rh的照片(图2j)及详细记录的PBS溶液中不同pH值下的Rh释放动力学曲线(图2k)显示,在酸性环境下(pH 5.5),Rh的累积释放率达到92%,而在中性环境下(pH 7.4)仅为68%,表明该系统具有显著的pH响应性释放特性。综上所述,Rh Gel@SP-EVs不仅成功结合了SP-EVs的生物活性成分和Rh Gel的物理化学特性,还展示了良好的稳定性和pH响应性药物释放特性,适用于模拟炎症环境下的药物递送。

图2. Rh Gel@ SP-EV的合成、表征和药物释放。(a)Rh Gel@ SP-EV的合成程序;(b)显示不同Rh浓度(2、4、8 mg/mL)的Rh溶胶和Rh Gel形成的照片;(c)在2、4和8 mg/mL的不同Rh浓度下,分析了Rh溶胶和Rh Gel样品的UV−Vis和荧光光谱(d);(e)Rh溶胶和Rh Gel样品的Zeta电位(n = 3);(f)Rh Gel样本的代表性SEM图像,比例尺 = 1 μm;(g)SP-EV、Rh溶胶、Rh Gel和Rh Gel在SP-EV上的照片;(h)不同基团的紫外-Vis吸收光谱;(i)各组的Zeta电位(n = 3);(j)在不同pH水平(pH 5.5和7.4)下,从Rh Gel@ SP-EV在PBS溶液中获得的Rh释放介质的照片;(k)在不同pH值的PBS溶液中,Rh从Rh Gel@ SP-EV的释放动力学(n = 3)。数据表示为平均值 ± SD
(3)Rh Gel@ SP-EV的细胞毒性和细胞摄取
图3a展示了使用CCK-8实验测定软骨细胞系ATDC5细胞与不同处理物(PBS、SP-EVs、Rh Sol、Rh Gel和Rh Gel@SP-EVs)共孵育1、2、3天后的细胞活力情况,结果显示Rh Gel@SP-EVs(Rh 5 μg/mL和SP-EVs 20 μg/mL)在共孵育期间对细胞活力影响极小,表明其具有良好的生物相容性。图3b通过活/死细胞染色进一步验证了Rh Gel@SP-EVs在这些浓度下无明显细胞毒性。为了观察SP-EVs的细胞摄取效率,研究人员用膜标记染料PKH67标记SP-EVs,并利用共聚焦显微镜成像(图3c),发现SP-EVs能够高效地进入ATDC5细胞的细胞质中,证明了其良好的细胞穿透能力。此外,体内荧光成像(图3d)显示了PKH67标记的SP-EVs在小鼠膝关节软骨细胞内的累积情况,进一步证实了SP-EVs不仅能够进入细胞并递送分子货物,还能影响目标细胞的生物学功能。综上所述,这些结果验证了SP-EVs被软骨细胞摄取的能力,突显了这些纳米囊泡在向细胞传递生物活性分子方面的潜力。

图3. Rh Gel@ SP-EV的细胞毒性和细胞摄取。(a)通过用SP-EV、Rh Sol、Rh Gel和Rh Gel@ SP-EV干预1、2和3天来评估ATDC 5细胞的活力,CCK-8测定结果(n = 3),数据表示为平均值 ± SD;(b)用各组处理1、2和3天后ATDC 5细胞的钙黄绿素-AM/PI染色,绿色表示活细胞,红色表示死细胞,比例尺 = 100 μm;(c)ATDC 5细胞中SP-EV的细胞摄取,细胞核(蓝色),SP-EV(用PKH 67标记,绿色),比例尺 = 50 μm;(d)膝关节组织切片中SP-EV的细胞摄取,细胞核(蓝色),SP-EV(用PKH 67标记,绿色),比例尺 = 100 μm
(4)Rh Gel@ SP-EV对线粒体功能障碍的缓解作用
图4a和4b展示了通过DCFH-DA荧光探针检测ATDC5细胞内ROS水平的结果,表明Rh Gel@SP-EVs显著降低了ROS生成(P<0.01),相较于单独使用SP-EVs、Rh Sol或Rh Gel也显示出中等程度的ROS减少。透射电子显微镜(TEM)图像(图4c)显示,TNF-α处理导致严重的线粒体损伤,包括肿胀、肥大和嵴结构破坏;而SP-EVs和Rh Gel@SP-EVs处理显著改善了这些损伤,恢复了线粒体的正常形态和嵴结构。JC-1染色实验(图4d-e)进一步证明Rh Gel@SP-EVs能够显著提高线粒体膜电位(ΔΨm),红/绿荧光比率从5.9恢复至10.4。Western blot分析(图4f-h)显示,Rh Gel@SP-EVs增加了线粒体转录因子A(TFAM)和ATP合酶(ATPB)的表达,这表明它促进了线粒体生物发生并提高了ATP含量(图4i-j)。免疫荧光分析(图 4i和S10)同样证实了ATP含量的显著增加。这些结果共同表明,Rh Gel@SP-EVs不仅显著减少了氧化应激,还通过增强线粒体功能和能量代谢来改善细胞健康,具有重要的治疗潜力。
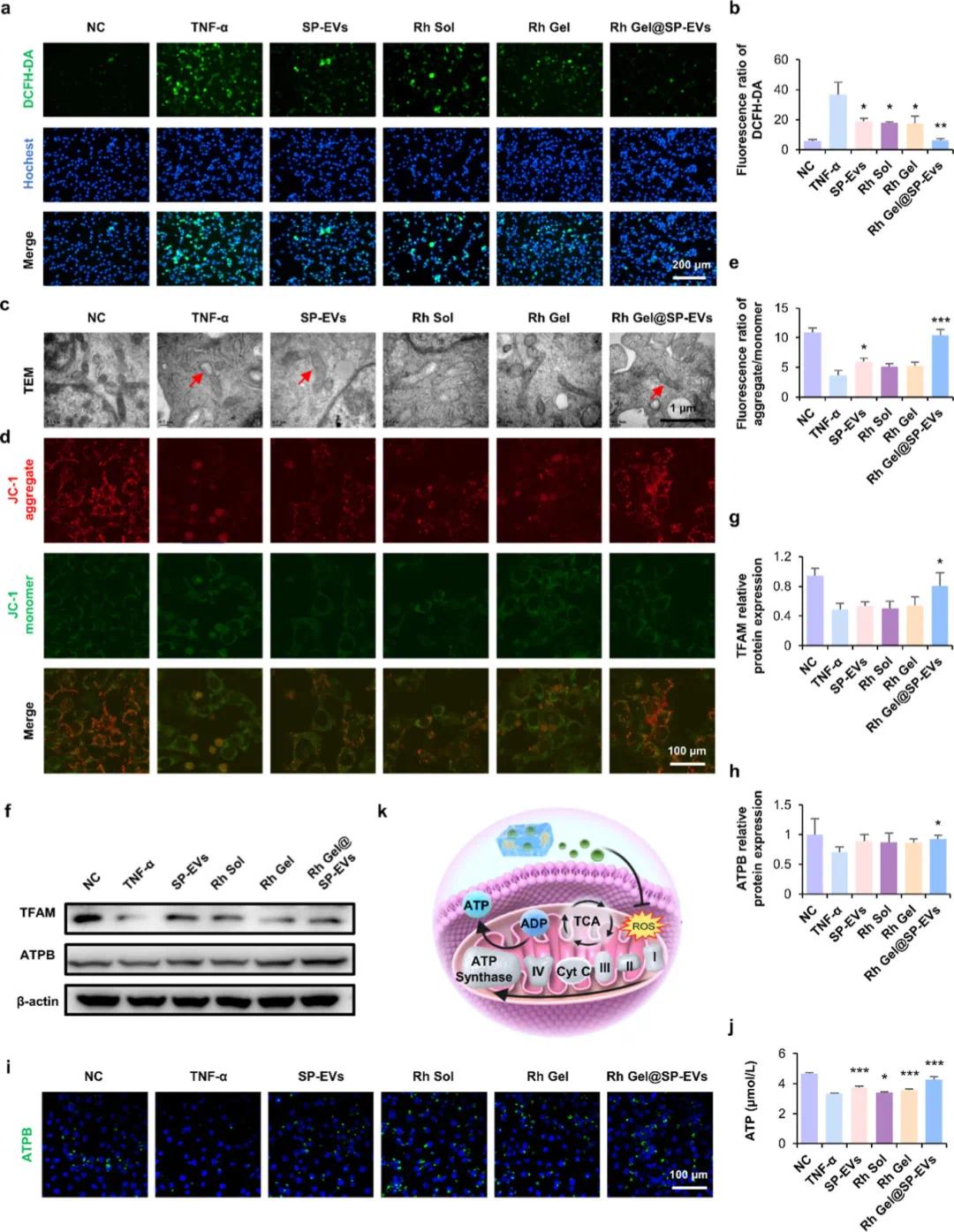
图4. Rh Gel@ SP-EV对ROS、线粒体功能障碍和细胞能量代谢的保护作用。(a)在NC、TNF-α、SP-EV、Rh Sol、Rh Gel和Rh Gel@ SP-EV条件下,用DCFH-DA处理的ATDC 5细胞中细胞内ROS水平的荧光图像,DCFH-DA(绿色),细胞核(蓝色),比例尺 = 200 μm;(b)不同处理后ATDC 5细胞中DCFH-DA的表达率;(c,d)在各种条件下处理的ATDC 5细胞的TEM图像(c)和JC-1染色(d),JC-1的聚集体为红色,而JC-1的单体为绿色;(e)分析JC-1染色的红/绿色强度的平均荧光比(n = 3);(f−h)在不同条件下ATDC 5细胞中TFAM和ATPB的蛋白质印迹结果;(h)不同条件下ATDC 5细胞中ATPB蛋白表达水平的定量(n = 3);(i)不同条件下ATDC 5细胞中ATPB的免疫荧光染色,ATPB(绿色),细胞核(蓝色),比例尺 = 100 μm;(j)ATDC 5细胞在不同条件下的ATP水平;(k)Rh Gel@ SP-EV拯救炎症诱导的线粒体功能障碍并减少活性氧(ROS)产生,从而增强ATP合成的机制示意图
(5)Rh Gel@ SPEV的促合成代谢和抗代谢作用
图5a提供了实验设计的示意图,通过RT-PCR分析TNF-α诱导的ATDC5细胞中的炎症因子表达(图5b),结果显示TNF-α显著上调了IL-6和IL-1β等炎症标记物的表达。为了评估合成代谢相关基因的表达,研究人员检测了Sox9和Col2a1的表达水平(图5c),发现TNF-α处理显著下调了这些基因的表达。此外,分解代谢相关基因如Mmp13和Adamts4/5的表达水平也显著增加(图5d)。然而,SP-EVs、Rh Sol、Rh Gel以及Rh Gel@SP-EVs的应用有效抑制了IL-6和IL-1β mRNA的上调,并缓解了Sox9和Col2a1的下调(图5e-f)。Western blot分析(图5g)进一步验证了Rh Gel@SP-EVs显著降低了MMP13和ADAMTS5的蛋白质表达,减少了基质降解并促进了软骨基质的合成。这些结果表明,Rh Gel@SP-EVs不仅能够减轻炎症反应,还能促进软骨细胞的合成代谢并抑制其分解代谢,为治疗骨关节炎提供了新的潜在策略。
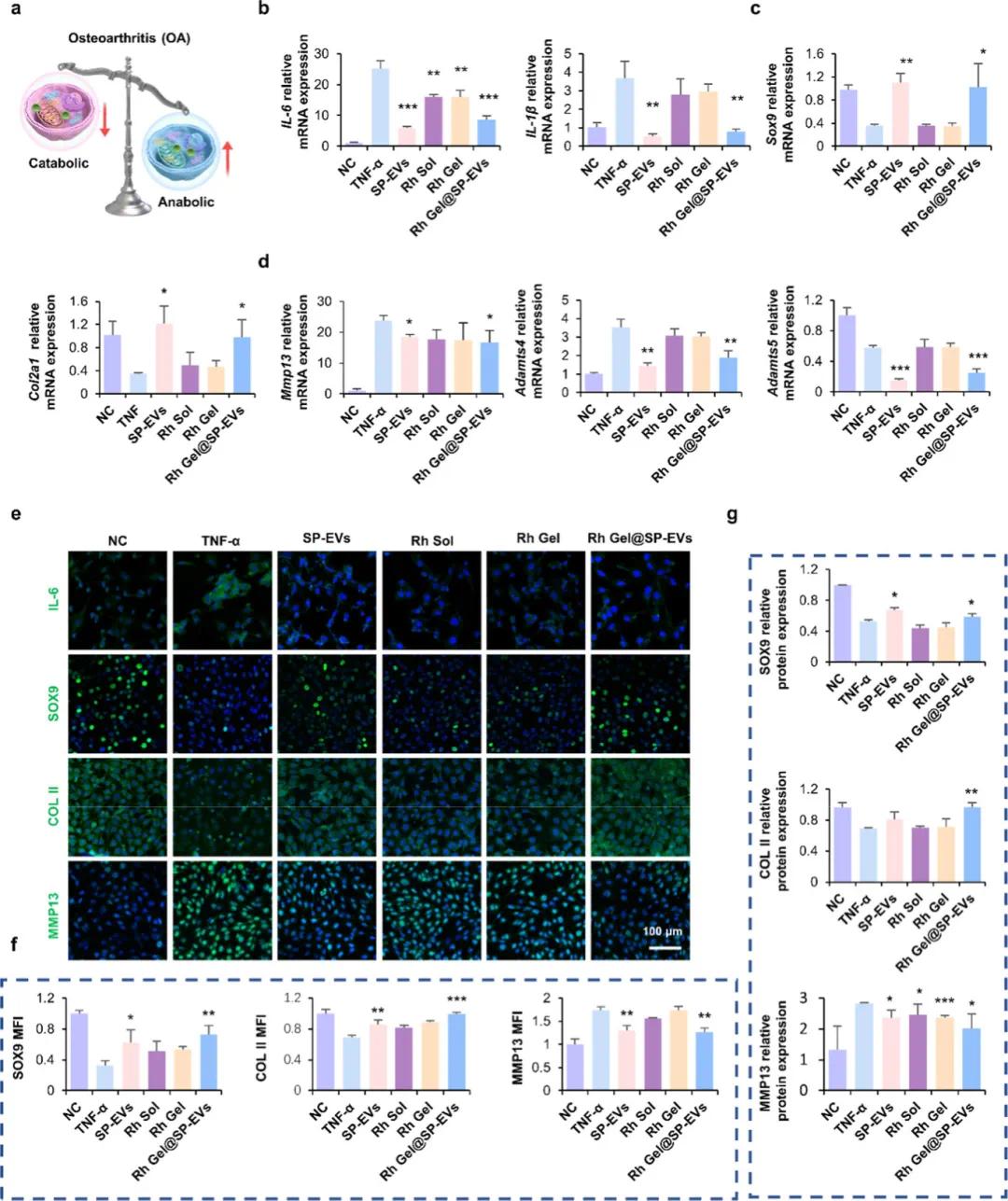
图5. Rh Gel@SP-EVs对ECM合成代谢与分解代谢平衡调节的影响。(a)软骨细胞内环境平衡的示意图。软骨细胞的平衡是通过ECM合成代谢和分解代谢的动态相互作用来维持的,由降解相关酶和合成相关酶进行机械调节;(b−d)实时定量PCR(RT-PCR)检测TNF-α、SP-EVs、Rh Sol、Rh Gel和Rh Gel@SP-EVs处理后ATDC 5细胞中的相对mRNA表达(IL-6、IL-1β、Sox 9、Col 2a 1、Mmp 13、Adamts 4和Adamts 5)(n = 3);(e,f)在各种条件下对ATDC 5细胞中的SOX 9、COL II和MMP 13进行免疫荧光染色和定量,比例尺 = 100 μm;(g)在各种条件下,ATDC 5细胞中各种蛋白(SOX 9、COL II和MMP 13)的表达水平的蛋白质印迹定量(n = 3)
(6)Rh Gel@ SP-EV对JAK/STAT 3信号通路的抑制
图6a和6b展示了RNA测序结果,表明与TNF-α刺激组相比,SP-EVs处理组中有1116个基因下调,161个基因上调。基因集富集分析(GSEA)(图6c-e)显示,SP-EVs显著下调了与ROS途径相关的基因,并显著上调了与线粒体功能和氧化磷酸化相关的基因表达。KEGG通路分析(图6f)进一步确认了钙信号通路、细胞因子信号传导及JAK/STAT通路在SP-EVs处理后的显著变化。Western blot分析(图6h)显示,TNF-α处理显著增强了JAK2和STAT3的磷酸化水平,而SP-EVs和Rh Gel@SP-EVs处理显著降低了这些磷酸化水平。定量RT-PCR结果显示(图6i-j),TNF-α刺激后Jak1、Jak2和Jak3 mRNA表达显著上调,而在SP-EVs和Rh Gel@SP-EVs干预后,Jak2和Jak3 mRNA表达显著下调,Jak1则显示出下调趋势但未达到统计学意义。这些结果表明,Rh Gel@SP-EVs通过精确靶向抑制JAK2磷酸化来失活JAK2/STAT3信号通路,从而发挥抗炎作用,并且通过减少氧化应激和促进能量代谢来改善软骨细胞的功能。

图6. 线粒体能量代谢与炎症调控机制。(a)热图显示TNF-α刺激后SP-EV处理ATDC 5细胞中差异表达的基因;(b)火山图显示161个基因的表达上调,1116个基因的表达下调;(c−g)GSEA用于评估和对比ROS(c)、线粒体基因表达(d)、氧化磷酸化(e)和IL-6/JAK/STAT 3信号通路(g)中基因组的富集;(f)ATDC 5细胞中差异表达基因的KEGG通路分析,用TNF-α刺激ATDC 5细胞,然后用SP-EV处理;(h)不同条件下ATDC 5细胞中各种蛋白质(p-JAK 2、JAK 2、p-STAT 3、STAT 3和β-肌动蛋白)的蛋白质印迹结果;(i−j)RT-PCR检测不同条件下ATDC 5细胞中相对mRNA表达(Jak 1、Jak 2、Jak 3和Stat 3)(n = 3)
(7)Rh Gel@ SP-EV对DMM诱导的OA的治疗作用
图7a提供了实验设计示意图,展示了通过每周一次的关节内注射PBS、SP-EVs、Rh Sol、Rh Gel或Rh Gel@SP-EVs进行治疗前交叉韧带切断术(DMM)诱导的OA的过程。随后,通过微计算机断层扫描(micro-CT)分析(图7b),研究人员发现DMM诱导的小鼠表现出明显的软骨下骨损伤,表现为密集且紊乱的骨小梁结构;而经过Rh Gel@SP-EVs处理后,这些病理变化显著减轻,显示了较好的骨修复效果。H&E染色和番红O/快绿染色(图7c)进一步揭示了DMM组中严重的软骨退化、厚度减少和表面不规则;相比之下,Rh Gel@SP-EVs处理组显著改善了软骨表面完整性,并增加了软骨厚度和面积。OARSI评分(图7d)、糖胺聚糖(GAG)含量(图7e)以及软骨厚度(图7f)的定量分析均表明,Rh Gel@SP-EVs显著降低了OA的严重程度并促进了软骨再生。免疫荧光染色(图7g)则显示,在Rh Gel@SP-EVs处理组中,II型胶原(COL II)和聚集蛋白聚糖(ACAN)的表达显著增加,同时IL-6表达显著降低,这表明该复合物不仅促进了软骨基质的合成,还减少了炎症反应。
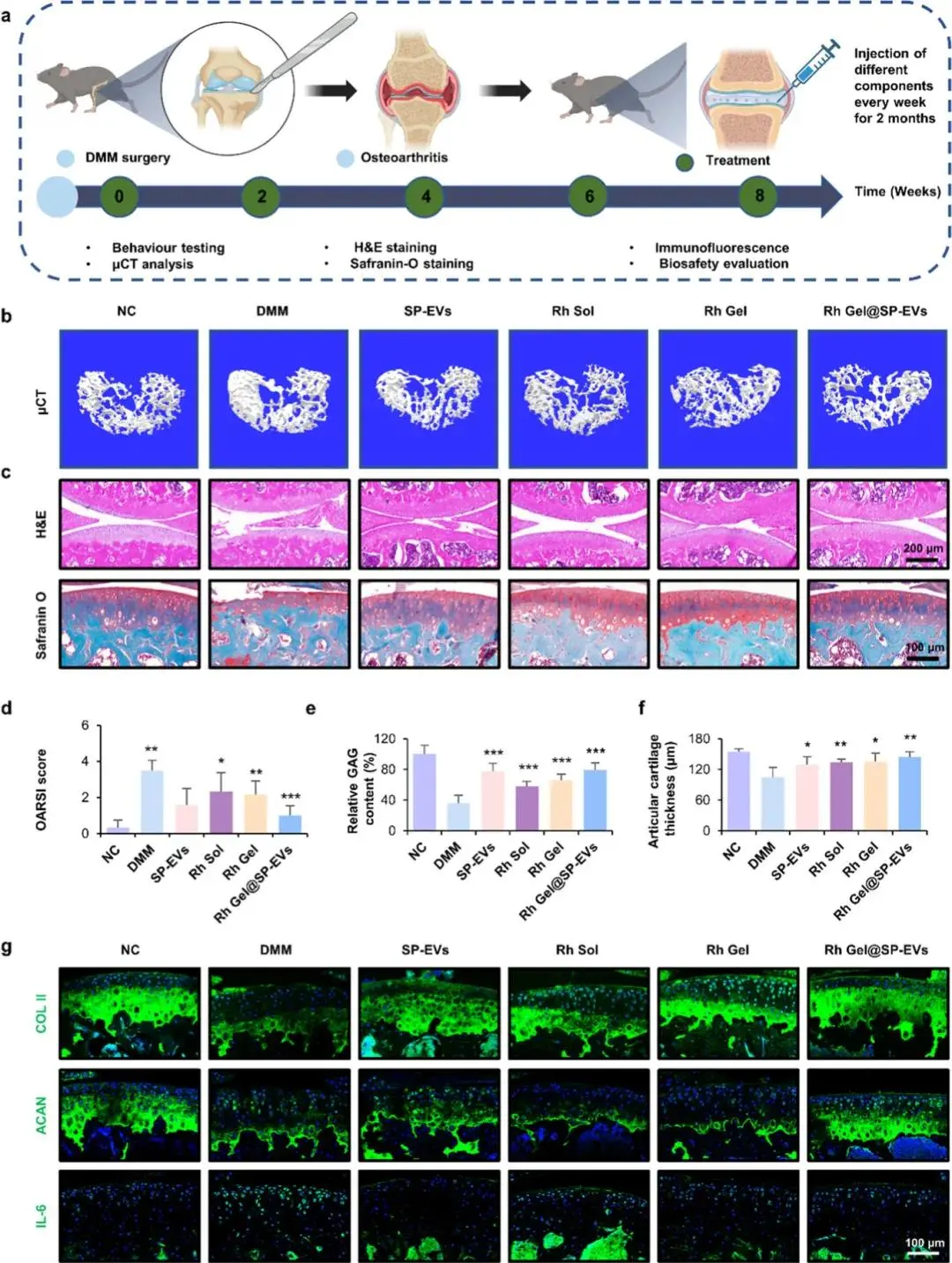
图7. Rh Gel@SP-EVs处理对DMM诱导的OA的体内治疗效果。(a)评价Rh Gel@SP-EVs治疗在DMM诱导的OA小鼠模型中的保护效力的示意图和实验设计;(b)关节软骨下骨的三维重建图像;(c)膝关节切片的H&E染色,对膝关节切片进行番红-O/固绿色染色,番红-O可将软骨染成红色;(d)OARSI评分的量化(n = 6);(e)6份样品中GAG含量的分析;(f)关节软骨厚度的定量(n = 6);(g)小鼠膝关节的代表性免疫荧光染色(COL II、ACAN和IL-6)
(8)Rh Gel@ SP-EV在MIAA诱导的OA中的治疗作用
图8a为实验设计示意图,描述了通过每周一次的关节内注射PBS、SP-EVs、Rh Sol、Rh Gel或Rh Gel@SP-EVs进行治疗单碘乙酸钠(MIA)诱导的OA的过程。随后,通过micro-CT分析(图8b),研究人员发现MIA处理的小鼠表现出显著的软骨下骨损伤,包括紊乱且密集的骨小梁结构;而Rh Gel@SP-EVs处理组则显著减轻了这些病理变化,显示了良好的骨修复效果。H&E染色和番红O/快绿染色(图8c)进一步揭示了MIA组中严重的软骨退化、厚度减少和表面不规则;相比之下,Rh Gel@SP-EVs处理组显著改善了软骨表面完整性,并增加了软骨厚度和面积。OARSI评分(图8d)、糖胺聚糖(GAG)含量(图8e)以及软骨厚度(图8f)的定量分析均表明,Rh Gel@SP-EVs显著降低了OA的严重程度并促进了软骨再生。免疫荧光染色(图8g)显示,在Rh Gel@SP-EVs处理组中,II型胶原(COL II)和聚集蛋白聚糖(ACAN)的表达显著增加,同时IL-6表达显著降低,这表明该复合物不仅促进了软骨基质的合成,还减少了炎症反应。
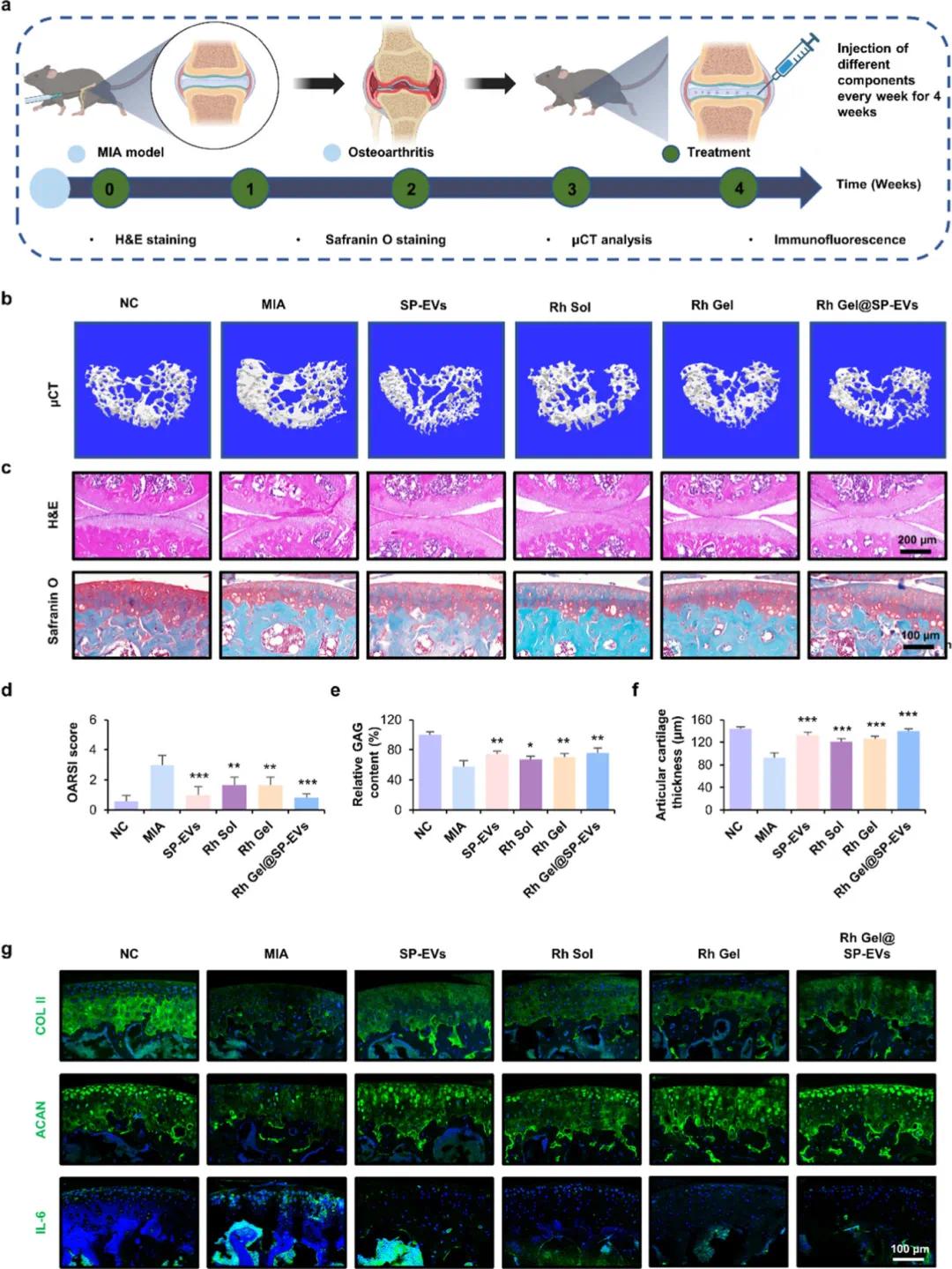
图8. Rh Gel@SP-EVs处理对MIA诱导的OA的体内治疗效果。(a)在MIA诱导的OA模型中评价Rh Gel@SP-EVs治疗有效性的示意图和实验设计;(b)关节软骨下骨的三维重建图像(通过显微CT分析);(c)采用H&E染色以及番红-O/固绿色染色对小鼠关节切片进行组织学分析,番红-O可将软骨染成红色;(d)OARSI评分的量化(n = 6);(e)GAG含量的定量(n = 6);(f)关节软骨厚度的定量(n = 6);(g)小鼠膝关节的代表性免疫荧光染色(COL II、ACAN、IL-6)
(9)Rh Gel@ SP-EV的体内生物相容性
血液学测试显示,所有治疗组与对照组相比,血液参数均在正常范围内,无显著差异,表明Rh Gel@SP-EVs未引起明显的全身毒性反应。接着,图9b展示了肝肾功能参数(包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、血尿素氮(BUN)和肌酐(CREA))的测定结果,结果显示这些指标在所有处理组中均保持在正常范围内,进一步证实了Rh Gel@SP-EVs的安全性。最后,图9c通过H&E染色对主要器官(心脏、肝脏、脾脏、肺和肾脏)进行了组织学分析,结果显示各组之间无显著炎症或其他不良反应,表明Rh Gel@SP-EVs具有良好的体内生物相容性。
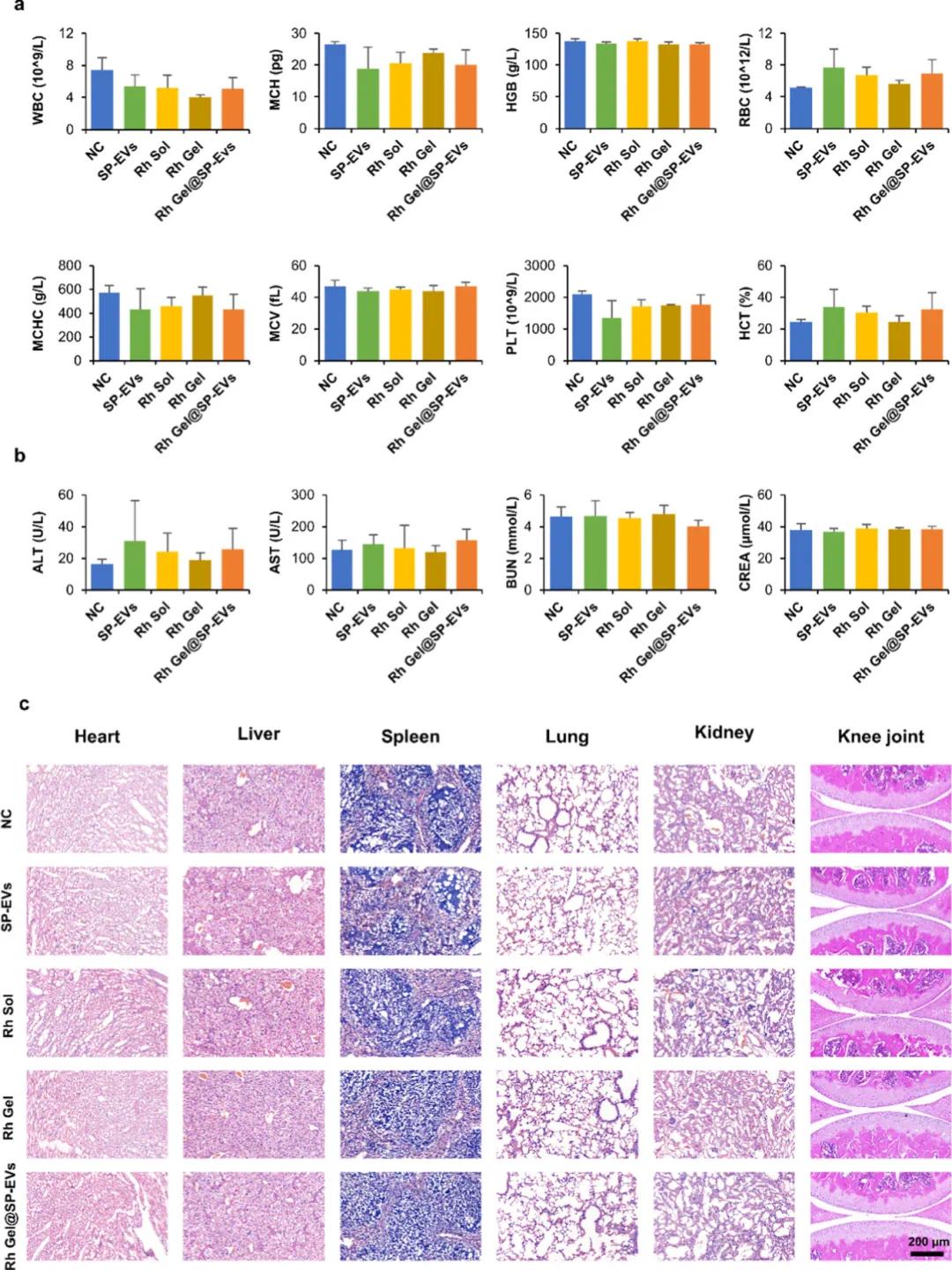
图9. Rh Gel@ SP-EV的体内生物相容性。(a)不同处理后小鼠的血液学检查(n = 3),包括:白色细胞(WBC)、平均红细胞血红蛋白(MCH)、血红蛋白(HGB)和红细胞(RBC);平均红细胞血红蛋白浓度平均值(MCHC)、细胞体积(MCV);血小板(PLT);血红蛋白浓度(HCT);(b)不同处理后小鼠的血清生化分析(n = 5),包括:ALT(丙氨酸转移酶)、AST(天冬氨酸转移酶)、BUN(血尿素氮)、CREA(肌酐);(c)在给药后,使用H&E染色对小鼠的主要器官(包括心、肝、脾、肺、肾和膝关节)进行组织学分析
该研究团队展示了Rh Gel@SP-EVs作为一种新型多功能治疗平台在骨关节炎(OA)治疗中的显著效果和潜在优势。研究结果显示,Rh Gel@SP-EVs不仅具有良好的生物相容性和安全性,还能有效减轻炎症反应、促进软骨再生、改善线粒体功能并调节能量代谢,通过抑制JAK2/STAT3信号通路减少氧化应激,从而显著缓解OA的症状。 此外,体内实验进一步证实了其在DMM和MIA诱导的OA模型中的优异治疗效果,表明Rh Gel@SP-EVs是一种有前景的治疗策略,为未来临床应用提供了有力支持。这些发现为开发基于微藻细胞外囊泡的新型治疗手段奠定了基础,并展示了其在生物医学领域的广泛应用潜力。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

