
自身免疫性疾病(AIDs)影响全球约5% - 10%的人口,主要由T细胞异常激活导致,这些T细胞错误地攻击宿主自身的组织。目前针对T细胞的干预治疗策略(如单克隆抗体或重组蛋白)在临床试验中显示出一定疗效,但由于缺乏对激活T细胞的特异性靶向,常导致全身性免疫抑制和严重的副作用。
耐受性抗原呈递细胞(tol-APCs)在维持免疫耐受中发挥关键作用,通过诱导T细胞无反应性、促进其转化为调节性T细胞(Treg)表型或清除自身反应性T细胞来发挥作用。利用耐受性树突状细胞(tol-DCs)的免疫治疗策略已在1型糖尿病、多发性硬化症、类风湿关节炎和克罗恩病等自身免疫性疾病的I期临床试验中显示出安全性和有效性,但现有的tol-APCs生成方法需要分离和体外操作自体抗原呈递细胞,涉及复杂的处理和高昂的成本,限制了其广泛应用。

针对上述问题,中国科学院大学王育才教授团队提出了一种体内产生耐受性抗原呈递细胞(tol-APCs)的新方法,专门针对自身免疫性疾病中激活的T细胞。该方法通过低免疫原性的mRNA递送在APCs上产生负共刺激分子。与激活APCs的传统脂质纳米颗粒(LNPs)不同,这些专用LNPs旨在最小化免疫原性。通过实验设计(DOE)方法优化了LNPs的N/P比和组成,以降低免疫原性。研究将编码关键负共刺激信号的PDL1 mRNA封装到这些专用LNPs中,称为LNPs/mPDL1。皮下注射后,LNPs/mPDL1被APCs优先摄取,从而在体内产生PDL1+的tol-APCs。这些tol-APCs通过PDL1/PD1途径特异性靶向过度激活的T细胞,同时保留未激活的T细胞,从而提高治疗的安全性。在类风湿关节炎和溃疡性结肠炎的小鼠模型中,该方法不仅抑制了T细胞的过度活化,还诱导了调节性T细胞的扩增,减少了炎症,并显著减缓了疾病进展。该文章于2025年3月28日以《Generation of tolerogenic antigen-presenting cells in vivo via the delivery of mRNA encoding PDL1 within lipid nanoparticles》为题发表于《Nature Biomedical Engineering》(DOI:10.1038/s41551-025-01373-0)。
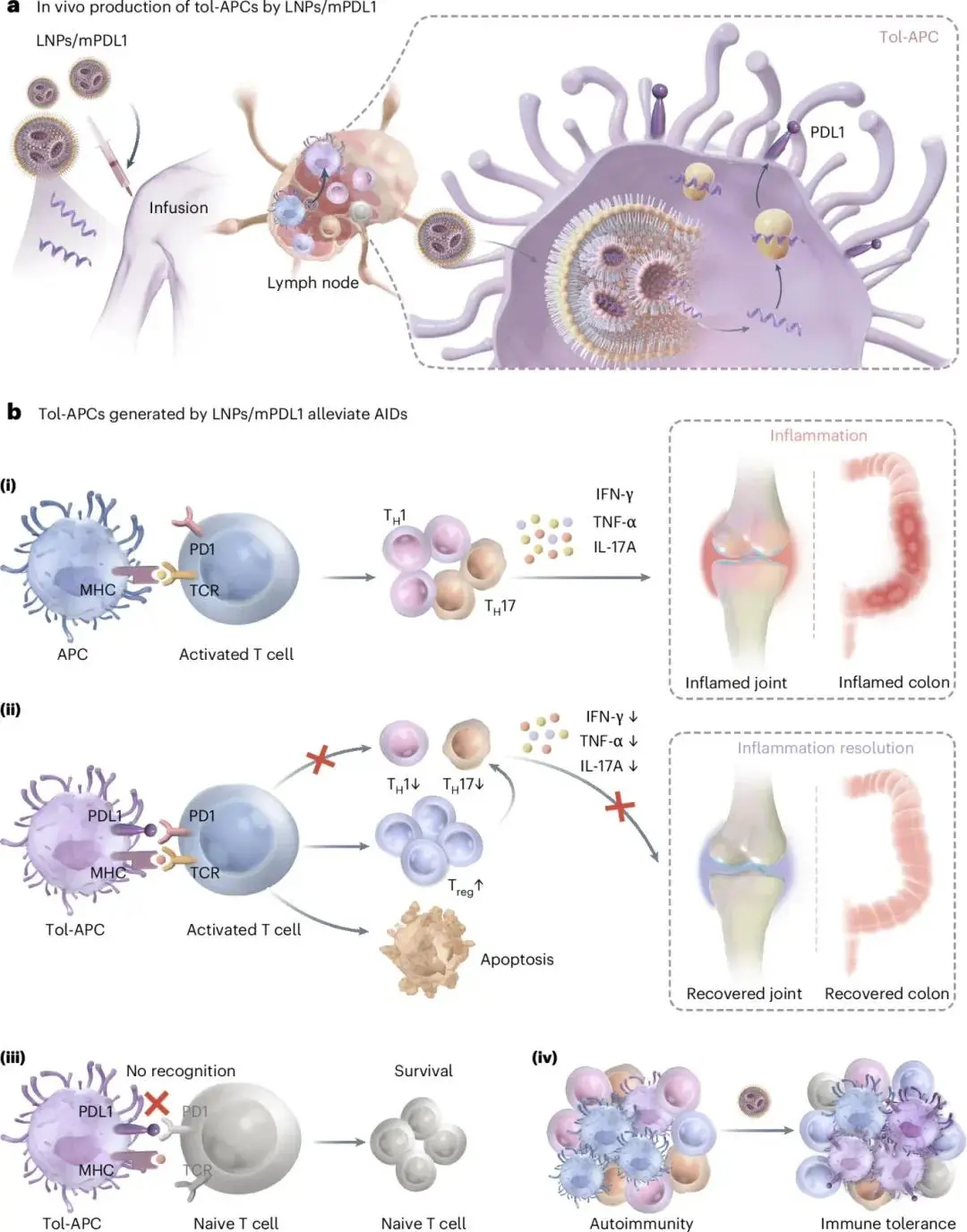
图1:LNPs/mPDL1在体内产生的耐受性抗原呈递细胞(tol-APCs)用于治疗自身免疫性疾病(AIDs)。(A)LNPs/mPDL1在体内产生tol-APCs的概念示意图;(B)tol-APCs缓解AIDs的机制:减少TH1和TH17细胞,增加Treg细胞,诱导激活T细胞凋亡,选择性靶向激活T细胞
(1)使用DOE优化低免疫原性的LNP
在治疗自身免疫性疾病(AIDs)时,目前用于mRNA疫苗佐剂的脂质纳米颗粒(LNP)配方可能上调抗原呈递细胞(APCs)上共刺激分子(如CD80、CD86和CD40)的表达,从而引发非预期的免疫反应。为开发低免疫原性的LNP配方用于AIDs的mRNA治疗,研究者系统调整了LNP配方中四种成分(SM-102、DSPC、DMG-PEG2000和胆固醇)的摩尔比例及N/P比值。以Moderna新冠mRNA疫苗的LNP配方(A0)为参考,通过Taguchi OA设计创建了包含9种配方的库A,包裹增强型绿色荧光蛋白(EGFP)mRNA作为报告基因。在小鼠皮下注射后,评估了这些配方的免疫原性(图2a、b)。结果显示,LNP的组成和N/P比值显著影响转染效率和免疫原性,体现在树突状细胞(DCs)上EGFP和共刺激分子CD80、CD86、CD40的表达水平差异(图2c–e),且N/P比值与LNP免疫原性之间存在显著相关性。配方A7(SM-102:DSPC:DMG-PEG:胆固醇 = 25:5:0.5:69.5;N/P = 4)在淋巴结中总DCs和EGFP+ DCs上共刺激分子的表达水平最低(图2c–f)。基于A7的进一步优化产生了库B,数据显示A7在库B配方中总DCs和EGFP+ DCs上共刺激分子的表达最低(图2h–k)。因此,A7被选为用于AIDs体内研究的最优LNP配方。
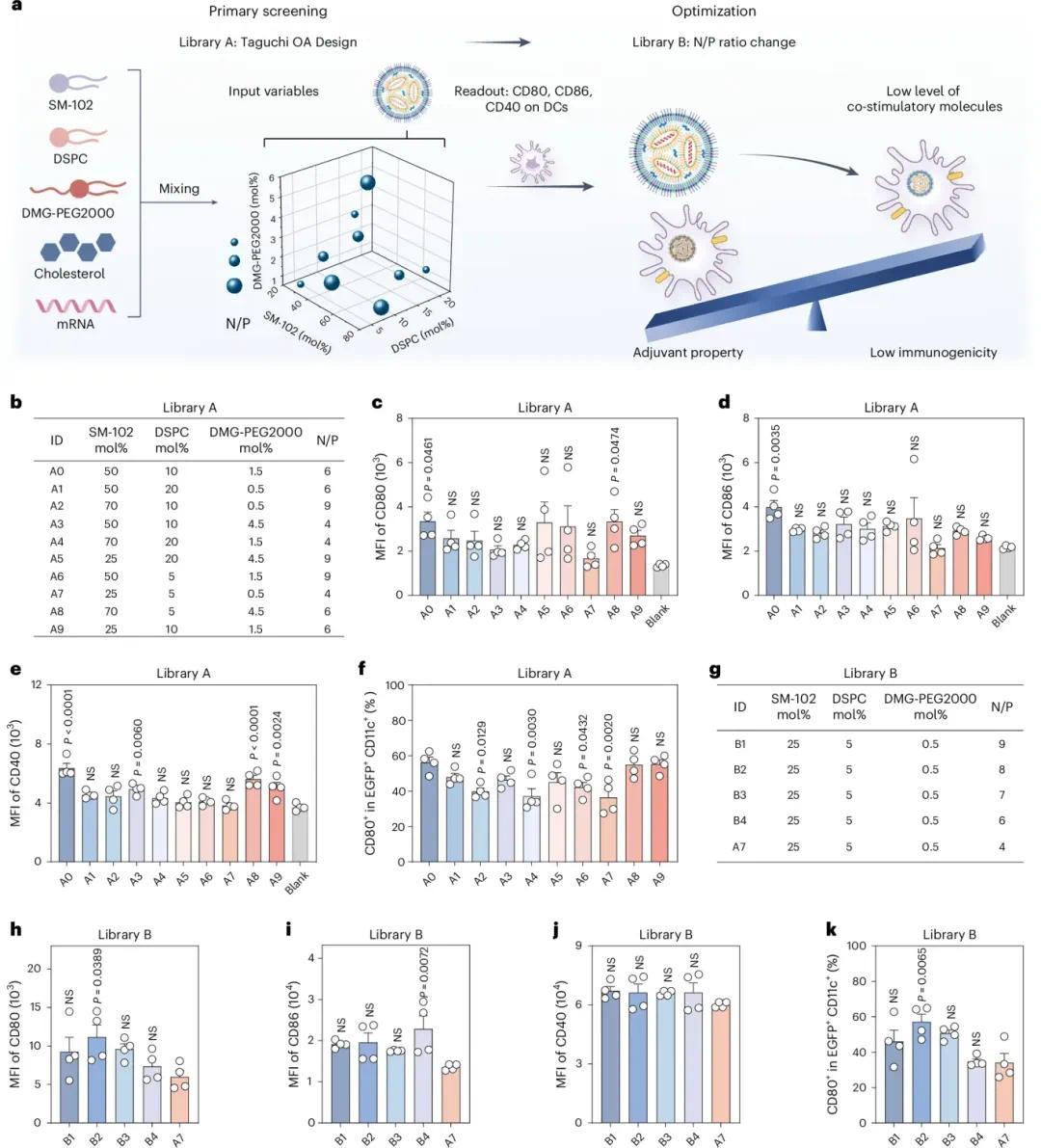
图2:使用实验设计(DOE)优化低免疫原性LNP配方。(A)筛选低免疫原性LNP配方的体内实验流程;(B)A库配方参数;(C–E)A库配方处理后DCs表面CD80、CD86和CD40的流式细胞术分析;(F)EGFP+ DCs表面CD80的流式细胞术分析;(G)B库配方参数;(H–J)B库配方处理后DCs表面CD80、CD86和CD40的流式细胞术分析;(K)EGFP+ DCs表面CD80的流式细胞术分析
(2)LNPs/mPDL1 治疗在体外和体内产生 tol-APC
A7配方的脂质纳米颗粒(LNP)被用于包裹编码PDL1的mRNA,制备了LNPs/mPDL1。PDL1 mRNA经体外转录、密码子优化、帽子修饰及尿苷替换为N1-甲基伪尿苷,LNPs/mPDL1的平均粒径为173 nm,zeta电位为12.9 mV。实验发现,经LNPs/mPDL1处理24小时的DC2.4和RAW264.7细胞,PDL1表达显著高于经空LNPs或PBS处理的细胞,表明其可有效将APCs转化为tol-APCs(图3a–d)。小鼠皮下注射LNPs/mPDL1后,淋巴结中CD11c+和CD11b+细胞表面PDL1表达较高,而CD11b− CD11c−细胞表面PDL1表达较低(图3f、g)。脾脏和外周血中观察到类似结果,但骨髓中未产生tol-APCs,且诱导的tol-APCs至少维持4天(图3h、i)。LNPs/mPDL1处理对共刺激分子表达的影响显示,淋巴结中总APCs上CD80表达略有增加,CD86和CD40表达降低;PDL1+ tol-APCs上CD80和CD86表达增加,CD40表达降低。脾脏中这些分子在总APCs上表达适度增加,但在PDL1+ tol-APCs上无变化或降低,外周血中各APC群体未观察到变化。结果表明,LNPs/mPDL1可在体内高效生成tol-APCs,且主要影响APCs,对非APC免疫细胞影响极小。
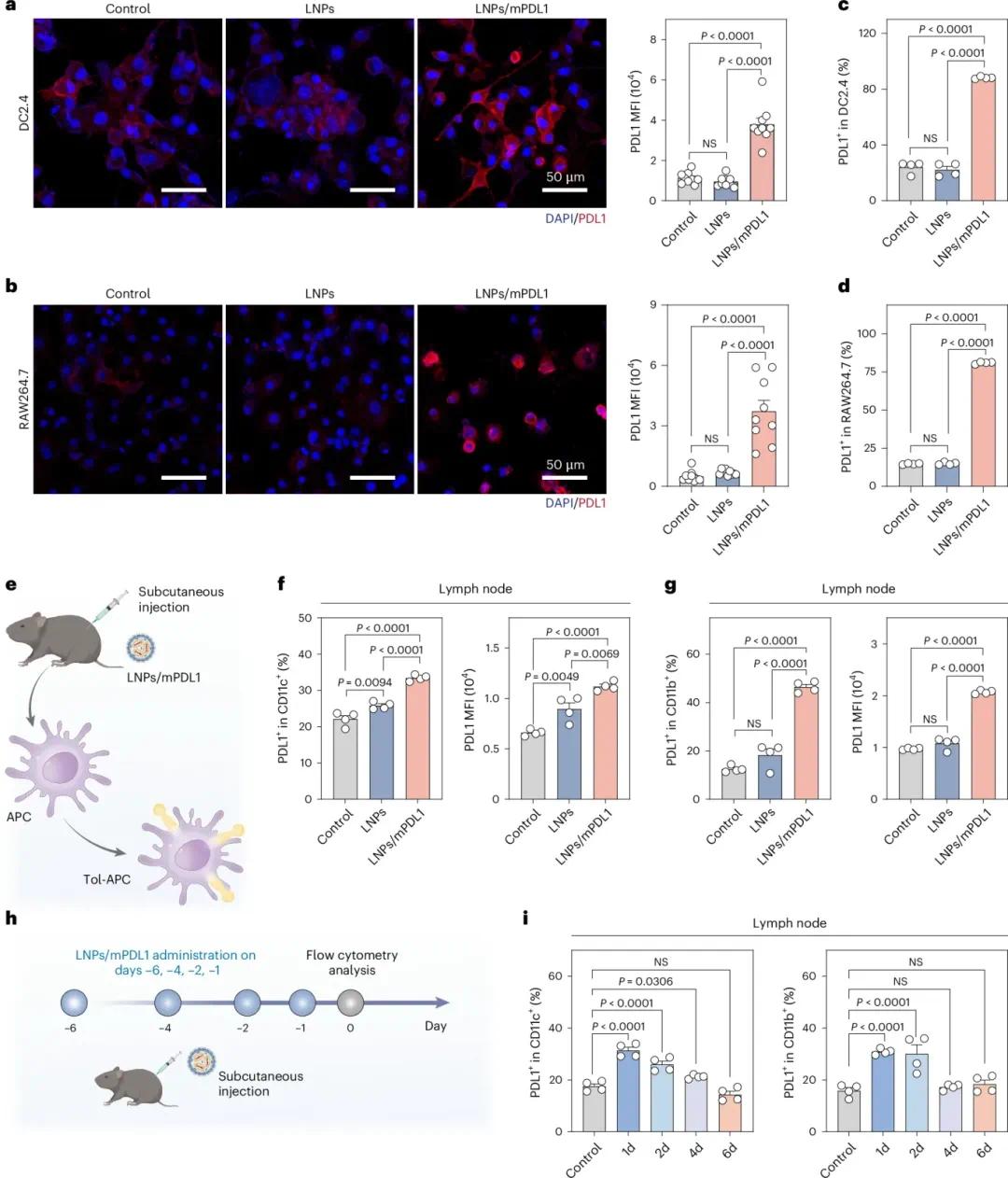
图3:LNPs/mPDL1处理产生的tol-APCs。(A,B)LNPs/mPDL1处理后DC2.4细胞和RAW264.7细胞的PDL1表达(共聚焦显微镜图像及定量分析);(C,D)流式细胞术分析DC2.4细胞和RAW264.7细胞表面PDL1表达;(E)LNPs/mPDL1在体内产生PDL1+ APCs的示意图;(F,G)LNPs/mPDL1处理后腹股沟淋巴结中CD11c+和CD11b+细胞表面PDL1的流式细胞术分析;(H)LNPs/mPDL1在C57BL/6小鼠中的给药时间表;(I)LNPs/mPDL1处理后腹股沟淋巴结中CD11c+和CD11b+细胞表面PDL1的流式细胞术分析
(3)PDL1+tol-APCs在体外选择性降低活化T细胞
PD1在激活的T细胞上表达水平较高,而在幼稚T细胞上表达较低,对防止T细胞过度激活和促进免疫耐受起关键作用(图4a、b)。体外实验中,用CD3/CD28激动剂抗体(αCD3/CD28)刺激的T细胞PD1表达水平更高,模拟了体内T细胞的激活状态。为探究由LNPs/mPDL1产生的tol-APCs是否能抑制T细胞反应,将激活的T细胞用羧基荧光素琥珀酰亚胺酯(CFSE)标记后,与通过LNPs/mPDL1处理生成的PDL1+ tol-DCs共培养(图4a)。48小时后,观察到CD4+和CD8+ T细胞的增殖显著减少(图4c)。此外,PDL1作为程序性死亡配体,与激活T细胞上的PD1结合可诱导凋亡。因此,研究了由LNPs/mPDL1产生的tol-APCs是否能选择性地促进过度激活的T细胞凋亡。将经PBS、LNPs或LNPs/mPDL1处理的DCs与刺激或未刺激的T细胞共培养12小时(图4d)。结果显示,由LNPs/mPDL1产生的tol-APCs显著促进了刺激T细胞的凋亡,但对未刺激T细胞无影响(图4e、f)。这一效应通过刺激T细胞中增强的caspase-3/7活性得到进一步证实。
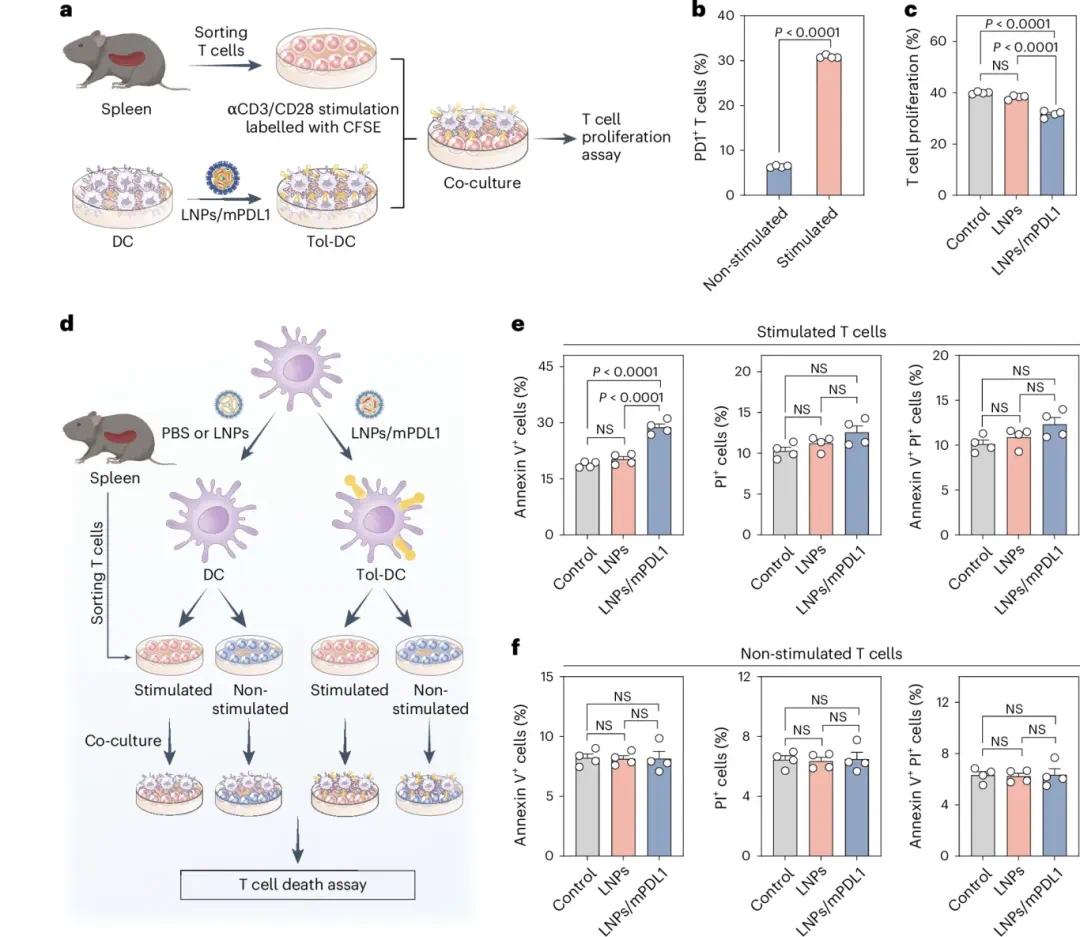
图4:LNPs/mPDL1产生的tol-APCs在体外抑制激活T细胞的增殖并诱导其凋亡。(A)T细胞增殖实验方案;(B)刺激和未刺激T细胞上PD1的表达;(C)CFSE标记的刺激T细胞的增殖;(D)T细胞死亡实验方案;(E,F)Annexin V/PI染色分析刺激和未刺激T细胞的凋亡和坏死比例
(4)PDL1+tol-APC 选择性降低体内活化的 T 细胞
通过过继细胞转移实验进一步探究了LNPs/mPDL1在体内产生的tol-APCs是否能选择性减少激活的T细胞。实验使用BALB/c裸鼠以减少宿主免疫系统对转移细胞的清除。小鼠皮下注射PBS、LNPs或LNPs/mPDL1。从BALB/c小鼠脾脏中分离T细胞,用αCD3/CD28激活并标记不同浓度的CFSE,其中未刺激T细胞(未用αCD3/CD28处理)CFSE水平低,刺激T细胞CFSE水平高。两种T细胞按1:1比例混合后,在LNPs/mPDL1注射24小时后过继转移至BALB/c裸鼠(图5a)。流式细胞术分析证实了受体小鼠体内有效生成了tol-DCs(图5b)。经LNPs/mPDL1处理的小鼠中,刺激T细胞的比例显著降低(图5c)。对于转移的T细胞,LNPs/mPDL1处理小鼠中刺激T细胞在总转移T细胞中的比例以及刺激T细胞与未刺激T细胞的比值均显著低于对照组(图5d、e)。具体而言,LNPs/mPDL1在体内选择性减少了转移的激活CD4+和CD8+ T细胞,降低了小鼠脾脏中激活与未激活CD4+和CD8+ T细胞的比值,同时增加了未激活T细胞的比例(图5f、g)。这些结果表明,皮下注射LNPs/mPDL1可选择性减少过度激活的T细胞,对幼稚T细胞影响极小,突显了该方法的治疗安全性(图5h)。
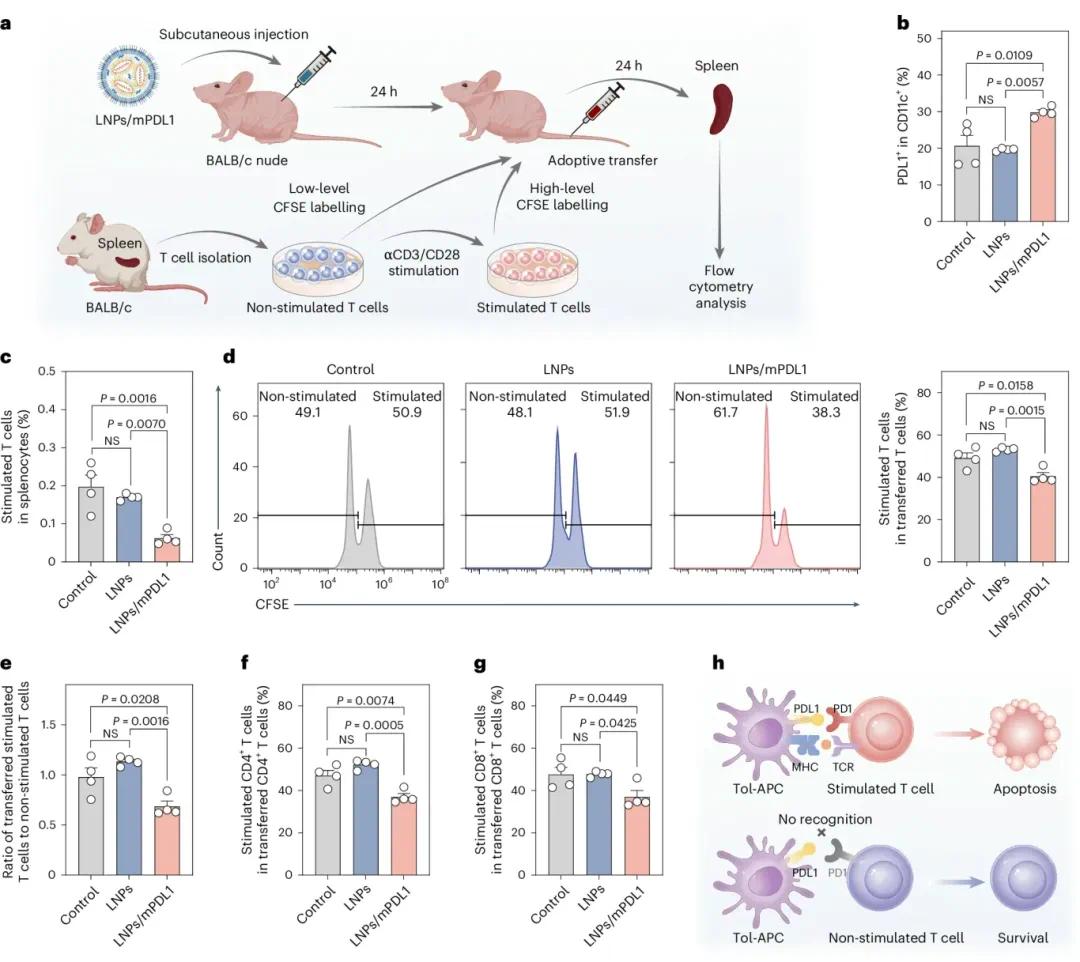
图5:LNPs/mPDL1处理在体内产生的tol-APCs选择性减少激活的T细胞。(A)T细胞过继转移实验示意图;(B)CD11c+细胞表面PDL1的表达;(C)转移的刺激T细胞在总脾细胞中的比例;(D)转移T细胞的定量分析;(E)转移的刺激T细胞与未刺激T细胞的比例;(F)转移的刺激CD4+ T细胞在总转移CD4+ T细胞中的比例;(G)转移的刺激CD8+ T细胞在总转移CD8+ T细胞中的比例;(H)tol-APCs选择性靶向激活T细胞的示意图
(6)体内产生的tol-APC可改善小鼠的RA进展
在类风湿性关节炎(RA)小鼠模型中评估了LNPs/mPDL1的治疗潜力。DBA/1小鼠在第0天和第21天用II型胶原免疫建立RA模型。第28天,小鼠分为4组:未处理对照组、LNPs组、LNPs/mPDL1组和依那西普(iTNF-α)组,各组分别在第28天、第32天、第36天和第40天接受处理,并在第42天前每隔一天评估关节炎指数(图6a)。结果显示,LNPs/mPDL1在RA模型小鼠中有效生成了tol-APCs(补充图21),显著延缓了疾病进展,关节肿胀和炎症反应得到缓解,效果与iTNF-α相当(图6b–d)。第42天,后膝关节Safranin O/fast green(SO/FG)染色显示LNPs/mPDL1和iTNF-α组小鼠软骨厚度显著增加(图6e、g及扩展数据图1a)。免疫组化(IHC)染色证实,治疗后关节中IFN-γ和TNF-α等炎症因子减少(图6f、g及扩展数据图1b、c)。LNPs/mPDL1处理的小鼠后膝关节中CD8+ T细胞和CD4+ T细胞浸润显著减少,Treg细胞增加(扩展数据图1d–g)。流式细胞术分析显示,LNPs/mPDL1处理后,淋巴结中产生促炎细胞因子IL-17A、TNF-α或IFN-γ的CD4+ T细胞显著减少,而Treg细胞增加(补充图22和23),且LNPs/mPDL1在减少促炎性CD4+ T细胞方面比iTNF-α更有效。此外,LNPs/mPDL1处理后,RA小鼠脾脏、腋窝和腹股沟淋巴结以及血液中的循环效应T(Teff)细胞显著减少(补充图24和25)。综上所述,LNPs/mPDL1治疗可有效缓解RA症状。
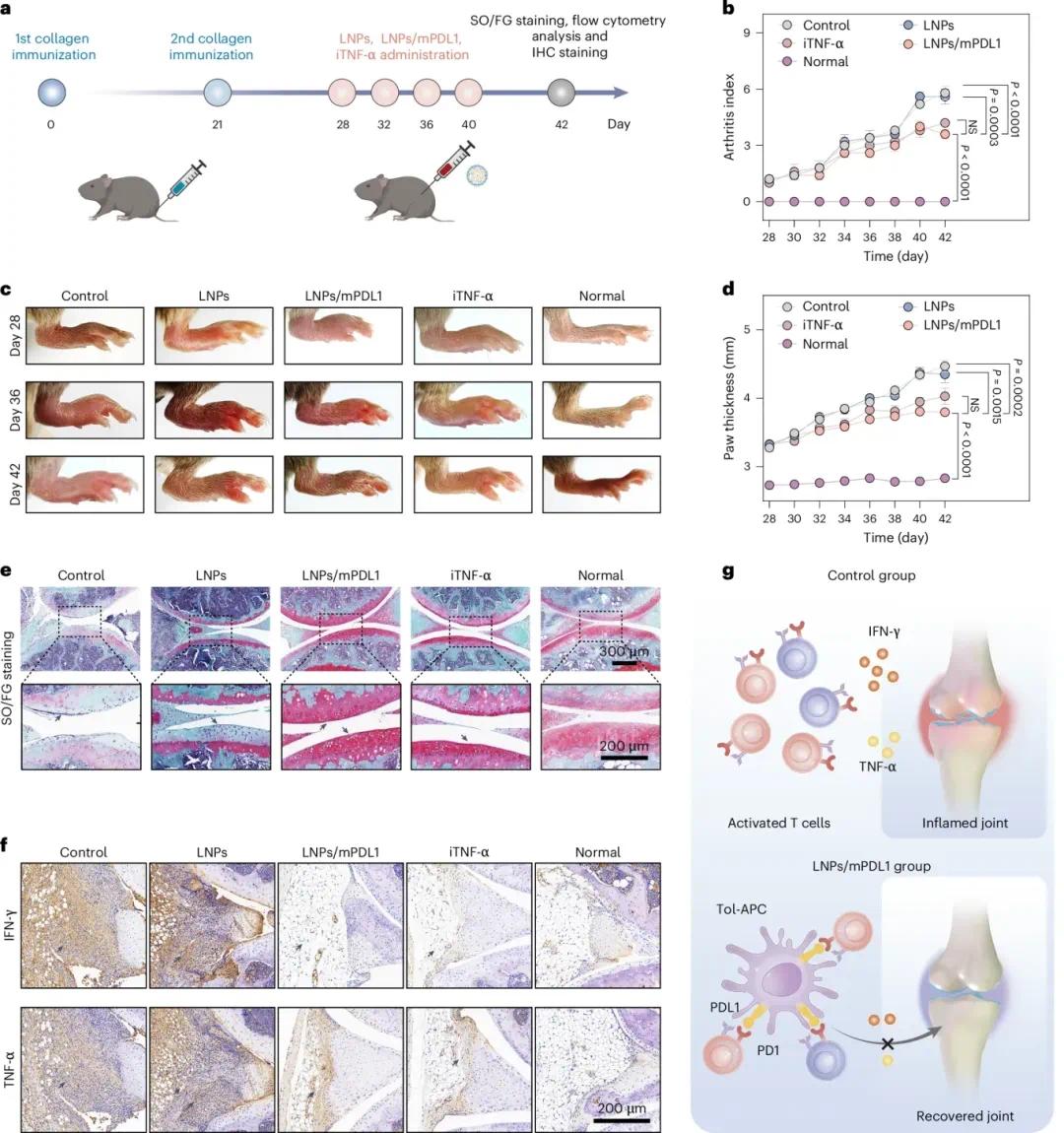
图6:LNPs/mPDL1在体内产生的tol-APCs抑制类风湿性关节炎(RA)的进展。(A)RA诱导及治疗方案;(B)RA小鼠随时间变化的平均关节炎指数;(C)RA小鼠的脚跟垫典型图像;(D)RA小鼠随时间变化的爪子厚度;(E,F)关节切片的SO/FG染色和IFN-γ、TNF-α染色图像;(G)tol-APCs在RA关节中减少炎症细胞和细胞因子的示意图
(7)体内产生的tol-APC可缓解DSS诱发的小鼠的UC
在DSS诱导的溃疡性结肠炎(UC)小鼠模型中,C57BL/6小鼠随机分为4组,第0–7天饮用3% DSS水,第1、3、5天分别接受PBS、LNPs、LNPs/mPDL1和环孢素处理(图7a)。健康小鼠作为对照。结果显示,LNPs/mPDL1在UC模型小鼠中有效诱导tol-APCs,显著降低DAI评分(图7b、c,补充图26),减轻体重下降(图7d),恢复结肠长度(图7e、f),结肠长度从PBS处理的5.6 cm恢复至6.6 cm。组织学分析显示LNPs/mPDL1缓解了UC小鼠的坏死细胞、黏膜损伤和腺窝结构破坏(图7g),治疗效果与环孢素相当。IHC染色显示LNPs/mPDL1显著减少CD4+和CD8+ T细胞浸润,增加Treg细胞水平,降低肠道炎症部位TNF-α水平(图7h,扩展数据图2)。流式细胞术分析显示,LNPs/mPDL1处理后,与环孢素等其他组相比,TH17细胞减少,Treg细胞增加(图7i,补充图27)。此外,LNPs/mPDL1显著减少肠系膜和腹股沟淋巴结、脾脏和血液中的效应T(Teff)细胞(补充图28)。综上所述,LNPs/mPDL1在缓解DSS诱导的结肠炎方面表现出有效性。
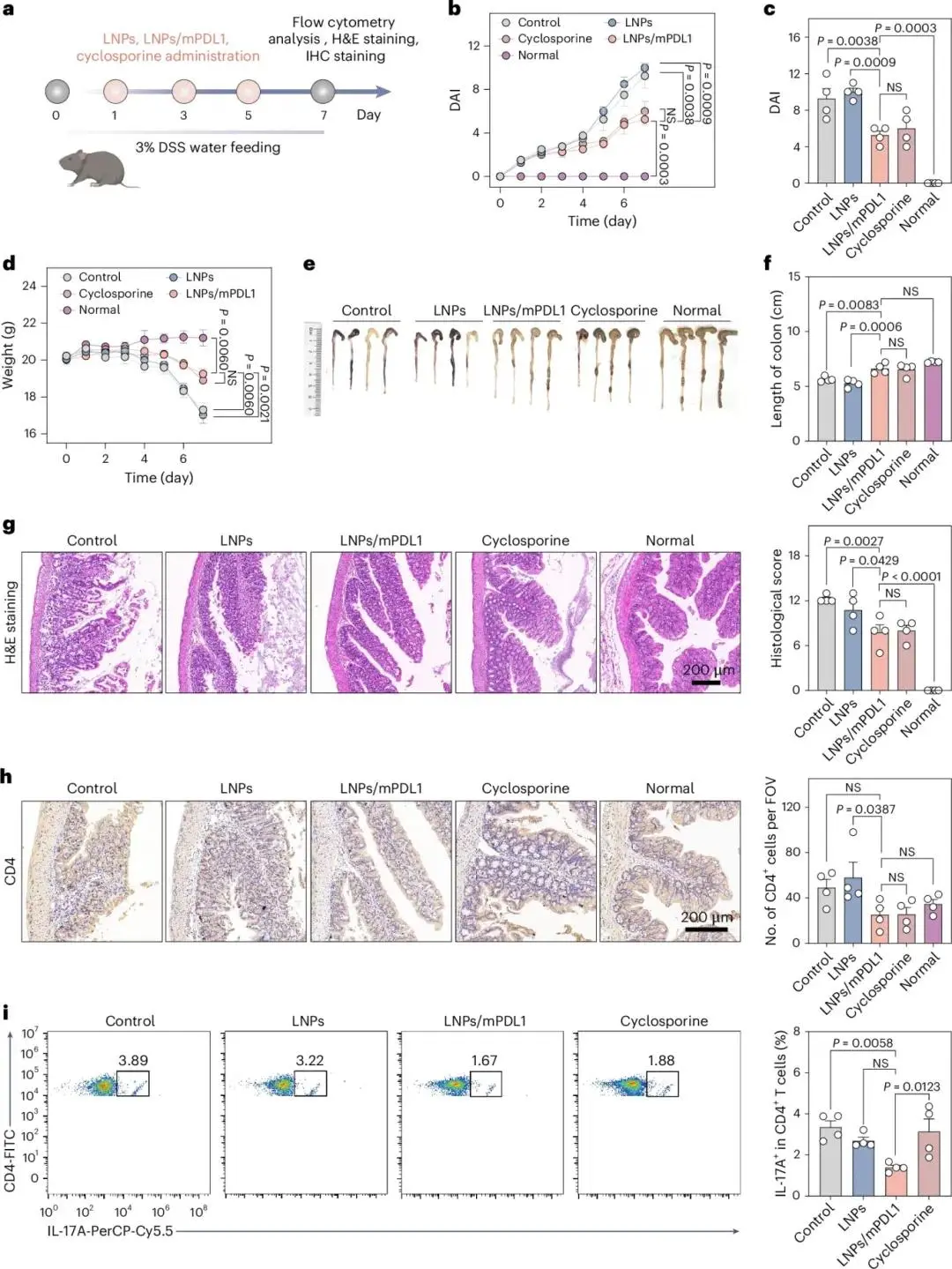
图7:LNPs/mPDL1在体内产生的tol-APCs在DSS诱导的溃疡性结肠炎(UC)小鼠中发挥治疗作用。(A)UC诱导及治疗方案;(B)疾病进展的DAI评分;(C)第7天的DAI评分;(D)体重变化;(E,F)小鼠结肠图像及长度;(G)结肠切片的H&E染色及组织学评分;(H)CD4免疫组化染色及CD4+细胞数量分析;(I)肠系膜淋巴结中CD4+ T细胞的IL-17A表达分析
本研究提出一种在体内生成耐受性抗原呈递细胞(tol-APCs)的新方法,利用低免疫原性LNPs/mPDL1递送系统诱导APCs表达PDL1,实现免疫耐受。该方法在RA和UC小鼠模型中表现出显著的治疗效果,与依那西普和环孢素相当甚至更优。该方法具有显著的临床应用潜力:一是通过皮下注射被APCs优先摄取,减少非靶向效应;二是mRNA瞬时表达确保治疗后APCs功能恢复,对正常免疫系统影响可控;三是与传统细胞转移方法相比,生产成本显著降低。 未来研究方向包括开发体内生成抗原特异性APCs的方法,引导APCs迁移到炎症部位,增强Treg细胞增殖,以及探索整合额外共抑制分子和特定抑制元件到mRNA构建物中。该方法不仅适用于AIDs,还可在器官移植中实现局部免疫耐受,减少长期免疫抑制治疗的依赖。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

