
创伤性脑损伤(TBI)是棘手的临床和公共卫生问题,它显著增加了患阿尔茨海默病和帕金森病的风险。构建拟态矩阵并施加适当的刺激信号来诱导神经再生被认为是最有效的策略之一。
动态变化的机械线索,通过不断协调细胞行为参与中枢神经或周围神经的发育。尽管对机械线索的研究取得了一些进展,但关于细胞生态位的动态机械调节影响干细胞神经分化的分子机制,仍有许多未知数。由于脑组织的天然低模量 (< 10 kPa),基体力学的单向硬化调制是不可取的,而可重复的振动调节是可取的。因此,一种新颖有效的加载动态机械振动的纵方式也备受期待。此外,及时方便地调节细胞生态位的机械线索仍然具有挑战性。

针对上述问题,四川大学生物医学工程学院范红松教授团队开发了一种能够可逆调整刚度变化的磁性纵水凝胶平台,以研究磁性介导的细胞生态位机械调节对骨间充质干细胞(BMSC)神经分化的影响。制备了由胶原蛋白(Col)和双改性透明质酸(DHA)组成的双交联水凝胶,以提供支持细胞生长的基本生物活性基质。通过掺入多巴胺包被的Fe3O4MNP(FO@PDA),磁诱导水凝胶网络的应变硬化/软化,控制水凝胶模量实现BMSCs神经分化和神经再生,水凝胶命名为DHAC-F(Double-modified HA-Col-FO@PDA)。使用离合器加固模型解释具有模量振动的磁性开关水凝胶基质对BMSCs神经突伸长的影响。研究揭示了基质抗性介导PI3K/AKT信号通路和钙信号转导通路机制。项研究证明了磁性纵水凝胶系统在体内创伤修复中的潜力,为组织再生和创伤治疗的新生物材料的设计和临床治疗策略提供了启示。该文章于2024年3月15日以《Magnetic on–off manipulated matrix mechanic vibration to enhance cell clutches-reinforcement and Ca2+ influx facilitating BMSCs neural differentiation and TBI repair》为题发表于《Chemical Engineering Journal》 (DOI:10.1016/j.cej.2024.149521)。
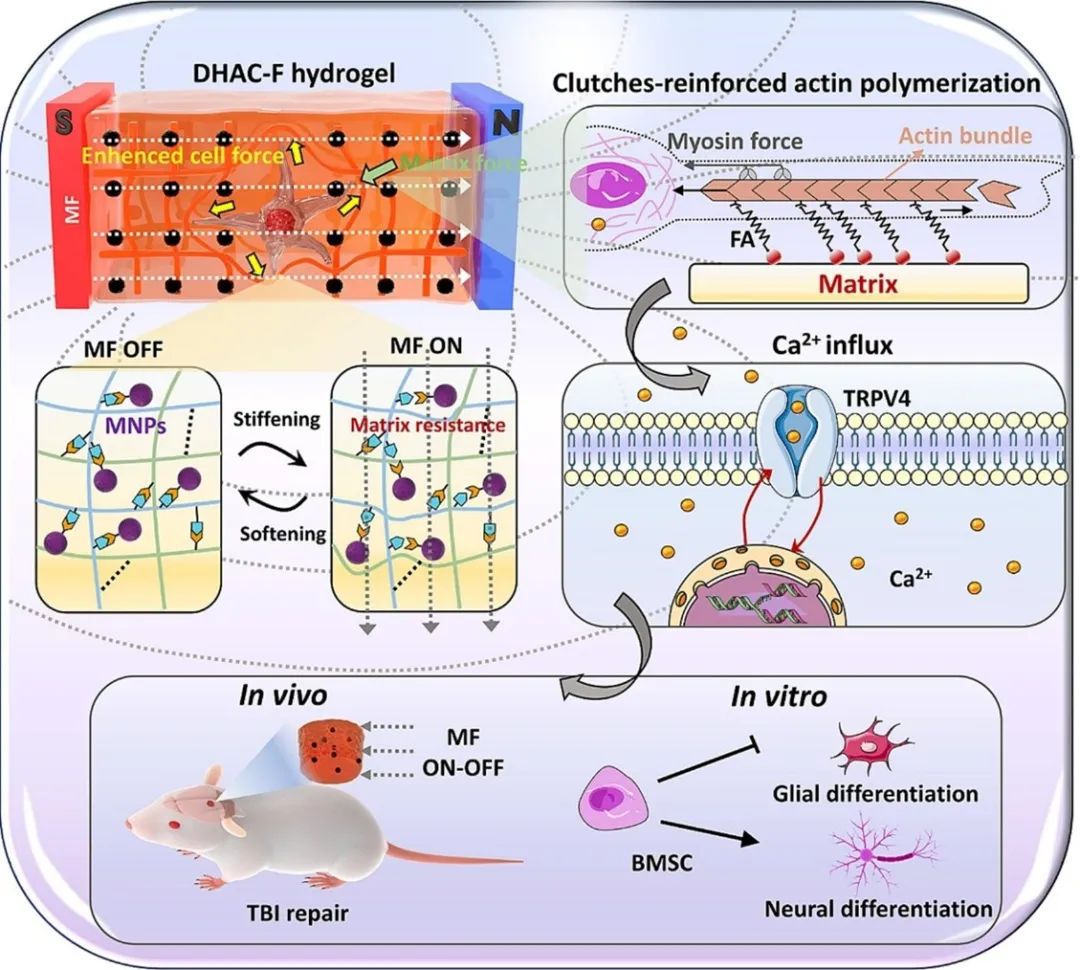
研究示意图
(1) 磁纵杂化 DHAC-F 水凝胶的制备和表征
通过三重交联过程制备了磁性纵可逆水凝胶(DHAC-F)(图1A),包括Col分子自组装、Col和DHA之间的动态亚胺交联以及DHA的紫外线触发自由基聚合。为调节水凝胶刚度,掺入FO@PDA MNP并与DHA发生可逆亚胺交联。研究了不同FO@PDA MNP浓度的纯DHAC水凝胶和磁性DHAC-F水凝胶(DHAC-FL、DHAC-FM和DHAC-FH)的溶胀和降解行为,发现DHAC-FH水凝胶随FO@PDA MNP浓度增加,溶胀率最低(图1B),降解动力学最慢(图1C)。DA包被纳米颗粒通过静电相互作用削弱了HA链羧基与水凝胶的静电排斥及与水分子的氢键形成。测量四种水凝胶初始刚度,所有杨氏模量均<2kPa(图1D),DHAC-F水凝胶杨氏模量高于不含MNP的DHAC水凝胶,因其纳米复合增韧及PDA包被MNPs作为额外交联剂增强了网络密度和稳定性,但三种DHAC-F水凝胶初始杨氏模量无显著差异。SEM图像显示四种水凝胶均有相互连接微孔结构(图1E),且三种DHAC-F水凝胶中FO@PDA MNPs分布均匀,孔隙率和孔径随其浓度增加而增加(图1F&G)。随FO@PDA MNP浓度增加,纳米增强效应及额外交联增加DHAC-F水凝胶刚度,但也破坏了水凝胶网络分子间相互作用和交联(图1H),不过三种DHAC-F水凝胶初始杨氏模量无明显差异。
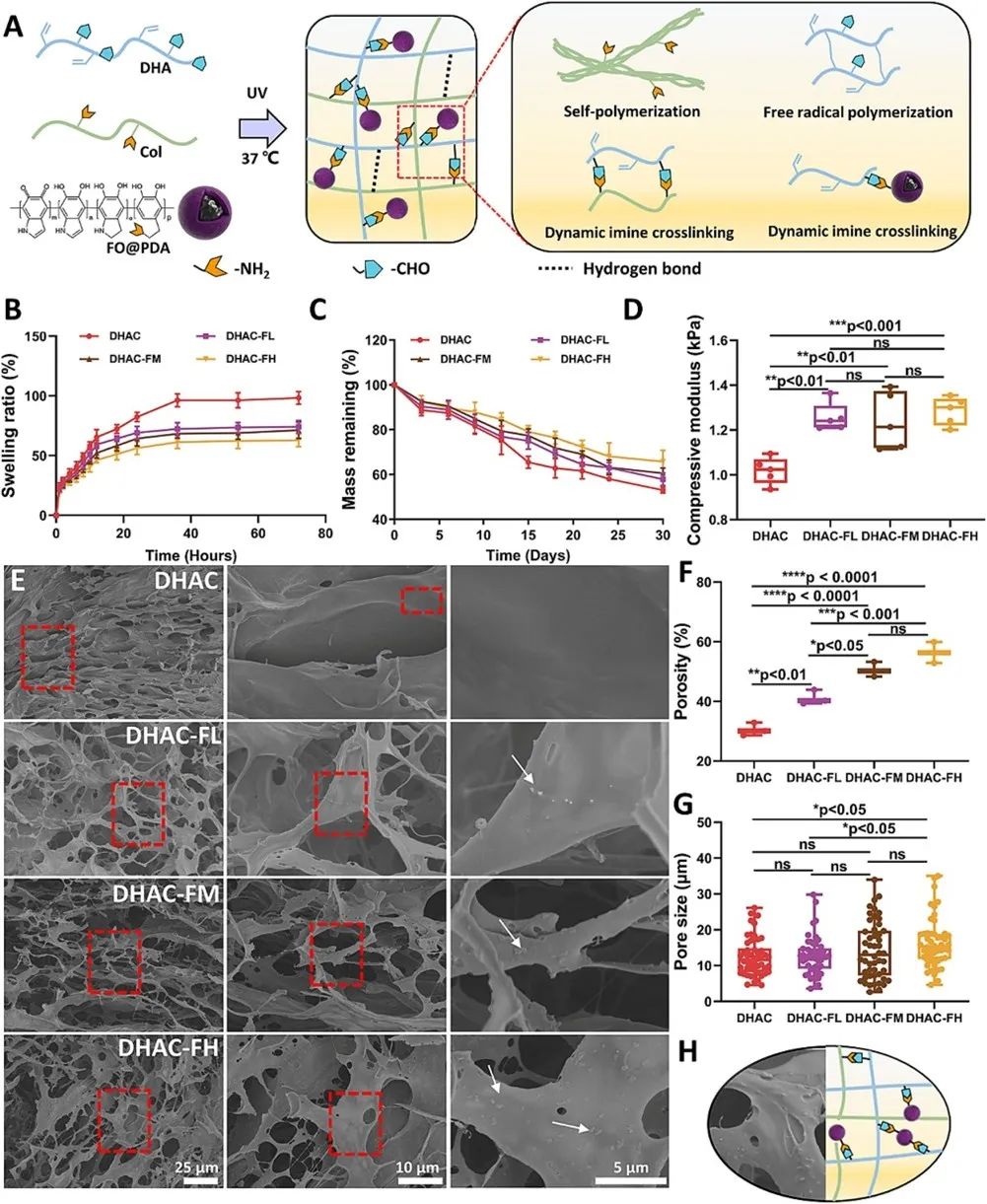 图1磁纵杂化 DHAC-F 水凝胶的制备和表征。(A)具有多种交联的 DHAC-F 水凝胶的制备。(B) DHAC 水凝胶和 DHAC-F 水凝胶的溶胀行为和 (C) 降解行为。(D) 不含任何 NPs 的 DHA 水凝胶和具有不同 FO@PDA NP 浓度的 DHAC-F 水凝胶(DHAC-FL、DHAC-FM 和 DHAC-FH)的杨氏模量。(E) DHAC-F 水凝胶多孔网络的 SEM 图像(白色箭头:FO@PDA NP)。(F) DHAC 水凝胶和 DHAC-F 水凝胶的孔隙率和 (G) 孔径。(H) FO@PDA MNP 和 HA 链之间相互作用的示意图
图1磁纵杂化 DHAC-F 水凝胶的制备和表征。(A)具有多种交联的 DHAC-F 水凝胶的制备。(B) DHAC 水凝胶和 DHAC-F 水凝胶的溶胀行为和 (C) 降解行为。(D) 不含任何 NPs 的 DHA 水凝胶和具有不同 FO@PDA NP 浓度的 DHAC-F 水凝胶(DHAC-FL、DHAC-FM 和 DHAC-FH)的杨氏模量。(E) DHAC-F 水凝胶多孔网络的 SEM 图像(白色箭头:FO@PDA NP)。(F) DHAC 水凝胶和 DHAC-F 水凝胶的孔隙率和 (G) 孔径。(H) FO@PDA MNP 和 HA 链之间相互作用的示意图
(2)DHAC-F 水凝胶的磁性开-关纵机械曲线
根据磁流变水凝胶假说,MF存在时磁性FO@PDA MNP通过可逆亚胺键共价键合到水凝胶网络上,沿MF方向摆动产生额外应力,导致水凝胶磁性硬化(图2A)。使用磁流变仪将轴向MF施加于水凝胶(图2B),采用0到0.2T的脉冲MF(持续1分钟)研究其磁力学曲线(图2C)。无MNP的DHAC水凝胶储能模量(G’)和损耗模量(G'')与MF无关,其模量的轻微振动可能是由测量时施加的剪切力引起(图2D)。集成MNP的水凝胶在0和0.2T的二元MF下显示三个循环的替代G’和G''(图2E&F),所有三种集成MNP的水凝胶对外部MF响应迅速,刚度在每个循环60s内达到最大值。G’最大值随FO@PDA MNPs浓度增加而增加,DHAC-FL为~2.5kPa,DHAC-FM为~5.1kPa,DHAC-FH为~9.8kPa,三种水凝胶的模量与天然神经组织的模量相匹配(<10kPa)。去除MF时,三种水凝胶的G’恢复到初始水平。固定MNPs浓度后,DHAC-FM水凝胶的刚度(G’和G'')随MF强度升高而增加,稳定在约0.2T(图2G),证明了其磁性硬化曲线,且磁调节过程可逆(图2H)。考虑机械可调性和便捷性,选择DHAC-FM水凝胶进行后续实验。无磁性FO@PDA NP时,DHAC水凝胶刚度为~0.6kPa,DHAC-FM水凝胶(MNPs浓度为~1%)刚度为~0.8kPa,其在可逆MF下可硬化至~5kPa(图2I),适用于后续细胞培养以研究细胞与基质相互作用。
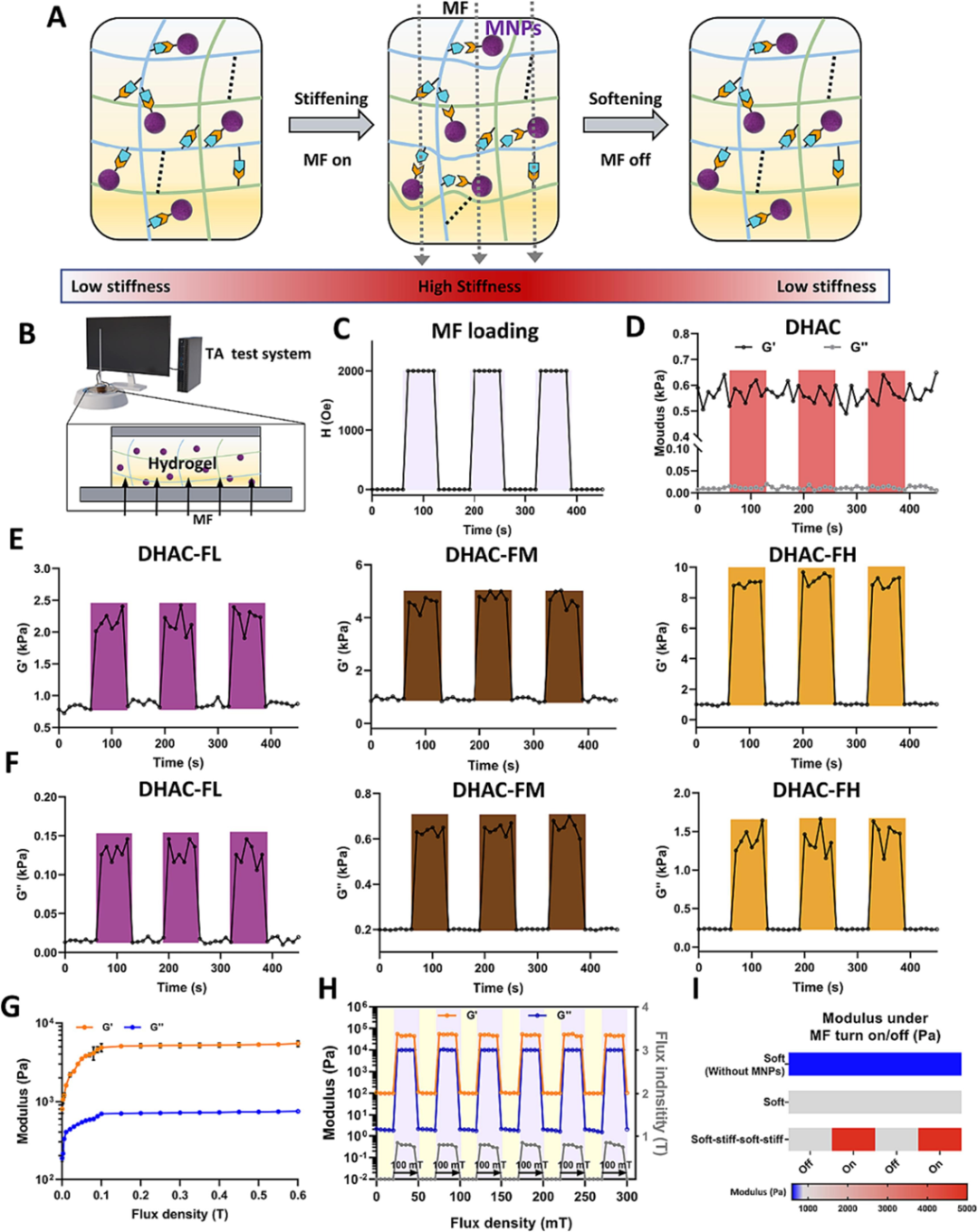
图2 DHAC-F 水凝胶的磁机械调节。(A) DHAC-F 水凝胶的磁性开-关介导的机械调节的示意图。(B) 将 MF 轴向施加到水凝胶上的磁流变设置示意图。(C) 由磁流变仪控制的 0 至 0.2 T 脉冲 MF。(D) DHAC 水凝胶的储能模量 (G′) 和损耗模量 (G′′)。(E) 不同 FO@PDA MNPs 浓度的 DHAC-F 水凝胶的 G′ 和 (F) G′′。(G) DHAC-FM 水凝胶的磁性加固曲线,外部 MF 密度从 0 增加到 0.6 T。(H) DHAC-FM 水凝胶在 0.1 T 脉冲 MF 下的可逆储能模量和损耗模量。(I) 示意图显示 DHAC-FM 水凝胶刚度可以通过外部 MF 进行矩阵机械设置进行调整
(3)水凝胶力学中磁致振动的解析模型
如图 3A 所示,当施加力时,基体内部发生变形。标准线性固体 (SLS) 模型可用于描述水凝胶的机械特性(图 3B)。对于弹塑性零件,参数 σEP以及参数为 H 的塑料单元0和 S边界用于表示水凝胶的振幅依赖性。在没有 MF 的情况下,水凝胶的刚度由初始水凝胶模量和 NP 增韧效应决定。磁流变水凝胶的剪切模量随 MF 增加如图 3C 所示,外力作用下的基本基体变形、NPs嵌入的微区基体变形和NPs的进一步基体沿外加MF方向的进一步基体变形。外部 MF 诱发的剪切应力 σ磁与磁应力张量参数呈正相关(图 3D)。在固化的水凝胶中,MNP 在外部 MF 存在下受到限制,但 MNP 在 MF 方向上增加了局部基质变形,最终增加了水凝胶的整个模量。这种刚度的增加不仅在流变学测试期间的剪切力变形中很明显,在进一步的局部细胞介导的基体变形中也很明显。不可避免的是,COMSOL 模拟了磁诱导的水凝胶刚度变化。如图 3E 所示,MF 强度随着距磁体表面距离的增加而降低。MF |B|(∼0.1 T) 对应于我们上述磁流变测试参数,该区域用于进一步模拟。在没有 MF 的情况下,水凝胶在应力场模式下的模量几乎没有变化(图 3F)。然而,使用 MF 时,水凝胶的模量显着增加,从 < 1 kPa 增加到 ∼5 kPa,这与上述磁流变测试结果一致。总体而言,该模型为观察到的水凝胶刚度变化提供了机械基础,这是由 MNP 的内在特性和施加到周围基质的内部磁性介导应力引起的。
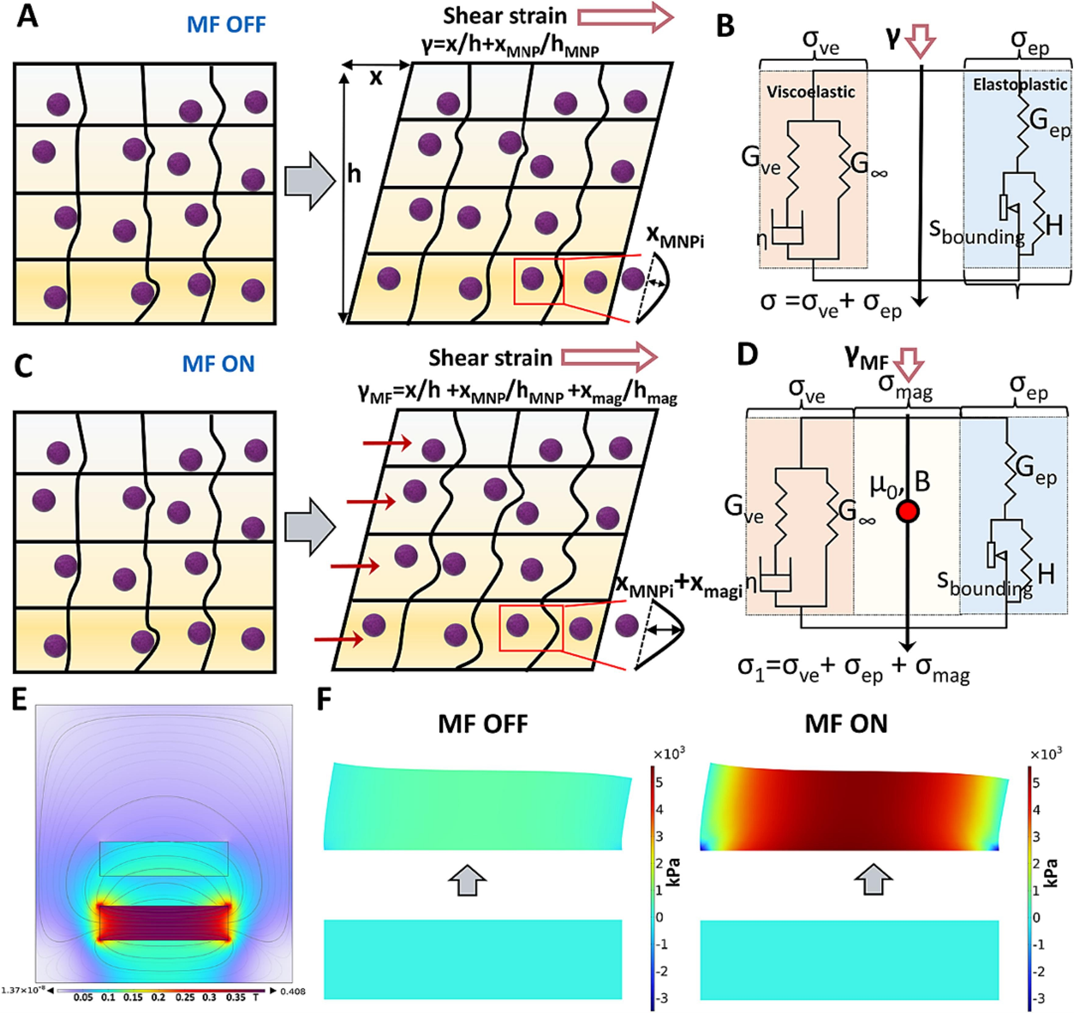
图3 磁性纵水凝胶剪切模量变化的解析模型。(A) MNPs 集成复合水凝胶结构在无 MF (MF OFF) 的变形时和 (B) 标准线性实体模型 (SLS) 的方案。(C) MNPs 集成的复合水凝胶结构在与 MF (MF ON) 一起变形时,显示 MNPs 在 MF 方向上引起的额外基体变形,以及 (D) 具有补充磁应力张量的 SLS 示意图。(E) 硼化钕铁磁铁 (NdFeB) 的 MF 分布。(F) 表面应力张量分布(xy 分量),显示有或没有 MF 的水凝胶的内部模量
(4)磁性通-关可逆刚度通过离合器加固增强 BMSC 伸长率
BMSCs作为神经分化细胞模型,被原位封装在DHAC、DHAC-FL、DHAC-FM和DHAC-FH水凝胶中,以评估9天培养期的生物相容性(图4A)。选择DHAC-FM水凝胶评估基质刚度变化对BMSC细胞行为的影响。在Con群内,细胞可感知水凝胶刚度和周围水凝胶变形。OFF水凝胶中添加的MNPs虽无MF负载,但会诱导周围水凝胶小幅变形,这种变形取决于MNPs浓度。MF负载会进一步导致水凝胶沿MF方向变形,通过定期加载和移除外部MF,可获得细胞培养期间的动态基质刚度(图4B)。评估了磁控刚度变化对BMSC存活的影响(图4C),发现OFF水凝胶中添加痕量MNPs对第5天的细胞存活无明显影响。同样,ON-OFF水凝胶的可逆刚度也不影响BMSC的细胞汇合(图4D)。研究中使用的MF强度较低(0.1T),具有磁安全性,细胞存活和汇合度无显著差异。
细胞通过施加细胞力感知周围基质的机械特性,并调节其生物行为,如FA形成、细胞骨架蛋白扩散和表达增加以响应基质电阻(图4E)。为将此分析与细胞行为和基质刚度变化联系起来,形成“电机-离合器”模型,包含基质、FAs、肌球蛋白和产生力的肌动球蛋白细胞骨架之间的动态分子键(图4F)。在这个模型中,细胞通过延伸肌动球蛋白细胞骨架的聚合细胞内肌动蛋白束来开始伸长。相反方向上,肌球蛋白作为马达,将肌动蛋白束拉向细胞中心,产生逆行流动。FA作为连接,可通过测量其对基质的抵抗来改变肌动蛋白细胞内结构的运动,从而影响肌动蛋白聚合。在神经诱导分化培养条件下,离合器的工作性能可决定BMSCs的最终神经突伸长。
作为细胞伸长的指标,图4G的肌动蛋白染色结果显示,所有三组中培养的BMSCs随时间呈现延伸和分支过程(神经元的形态学特征)。第1天,OFF组BMSCs拉长得更短,而ON-OFF组BMSCs拉长得更长,沿神经突出现薄的毛发状丝状伪足。第5天,ON-OFF组神经突长度最长(图4H)。此外,BMSCs的圆度显示ON-OFF组明显降低,表明细胞扩散程度较高(图4I)。与Con水凝胶相比,OFF水凝胶的圆度略有降低。对于无磁纵的公共矩阵(OFF组),单个FA工作循环的电机-离合器模型的典型过程如图4J所示。FA离合器逐渐与滑动的肌动蛋白丝啮合,以在开始时驱动肌动蛋白聚合。当超过绑定时间时,有界离合器开始断裂并停止向外伸长。这种“加载和失效”响应导致用于调节细胞扩散和伸长的有效结合离合器饱和。而在磁性ON-OFF矩阵中,矩阵从软变为坚硬,然后又回落为软。ON-OFF矩阵在MF应用的时间点经历了更多的硬化期。这个多余的硬化期加强了FA离合器的负载状态,减少了它们的失效并形成更多针对肌动蛋白逆行的锚点,最终增强了肌动蛋白细胞骨架组装和细胞伸长。
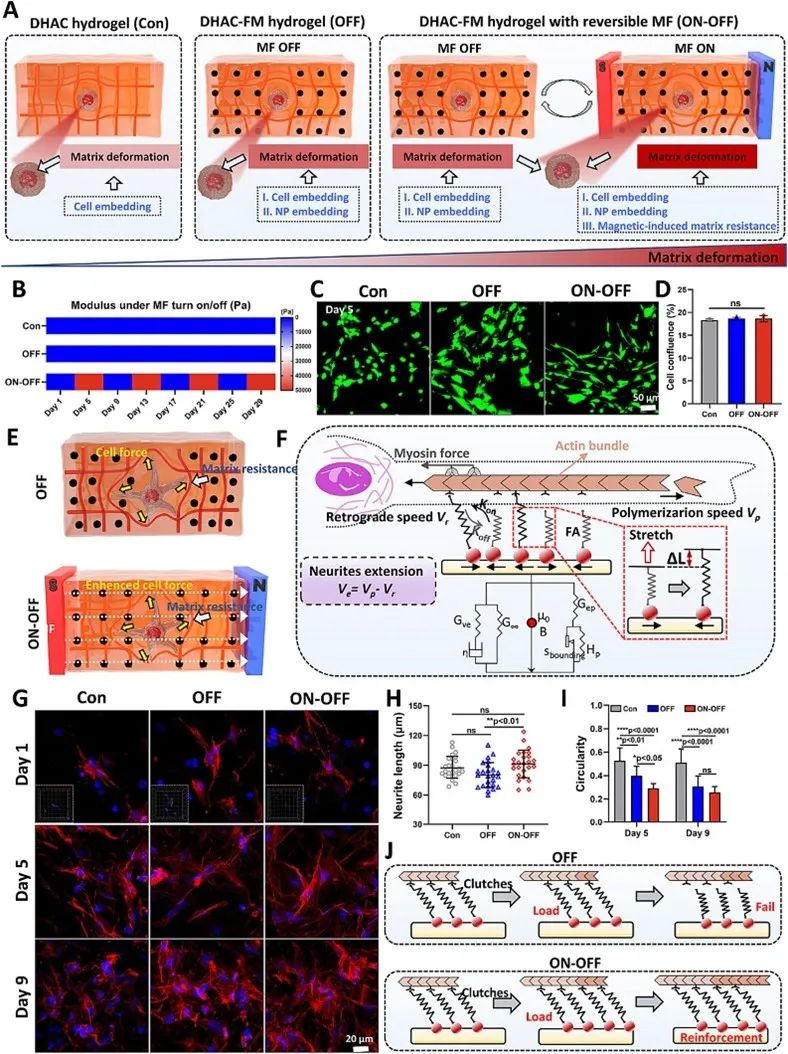
图4 磁通-关可逆刚度通过电机-离合机构触发的离合-加固调节 BMSC 的增殖、形态和伸长。(A) 位于三种不同水凝胶中的细胞的力态示意图:DHAC 水凝胶(也称为 Con 水凝胶)、不含 MF 的 DHAC-FM 水凝胶 (OFF) 和具有可逆 MF 的 DHAC-FM 水凝胶(开-关)。(B) 细胞培养期间 3 种水凝胶的刚度设置。(C) BMSCs 在三种水凝胶中 5 天的活/死染色和 (D) 细胞汇合统计。(E) 抵抗基体变形的胞力示意图。(F) 用于检查刚度对单元展开影响的电机离合器模型方案。(G) 鬼笔环肽/DAPI 染色的 BMSC 的 CLSM 图像。(H, I) 每个细胞的神经突长度 (H) 和圆度 (I) 的统计数据。(J) 负责刚度影响的单元伸长率的离合器加固机构的方案
(5)磁性开关矩阵调节 BMSC 的神经分化
在检测基质刚度变化对BMSCs伸长影响后,研究了其机械转导机制,特别是细胞骨架与TRPV4表达和功能的关系。TRPV4是机械敏感离子通道,可在力作用下发生构象扭曲。第7天评估三种水凝胶(Con、OFF、ON-OFF)中TRPV4基因表达(图5A),ON-OFF组表达最高,TRPV4抑制剂RN1734使其显著下降。免疫荧光染色和蛋白表达强度也显示ON-OFF组TRPV4最高(图5B)。药物抑制剂消除了机械敏感离子通道的激活,类似于非磁性纵水凝胶。TRPV4高表达导致Ca²⁺内流,激活多种转录因子促进神经元存活和可塑性。Fluo-4标记的Ca²⁺染色显示,不应用MF时,引入痕量MNP的细胞Ca²⁺无显著差异(图5C)。可逆MF显著改变Ca²⁺水平,这种增加可被TRPV4抑制剂下调。ON-OFF模式通过诱发TRPV4信号传导控制基体刚度(图5D)。推测磁性纵可逆基质促进BMSC神经分化。将BMSCs封装在Con、OFF、ON-OFF水凝胶中,在神经源性培养基中培养研究体外神经再生(图5E)。ON-OFF水凝胶促进BMSC神经分化启动,第7天Tuj1基因表达上调(图5F)。IF染色证实Tuj1在ON-OFF水凝胶中积累水平较高,表明可逆刚度对BMSC早期神经分化的积极影响(图5G)。通过检测神经丝(NF)基因和蛋白表达研究BMSCs神经成熟。NF保护神经元免受机械应力并确保细胞弹性。第14天,与其他非磁性纵水凝胶相比,ON-OFF水凝胶中NF基因表达更高(图5H),蛋白表达也证实增强的神经突生长(图5I)。为说明可逆刚度对BMSC神经成熟的影响,用抗PSD95抗体免疫染色检查突触蛋白活性。ON-OFF水凝胶PSD95基因和蛋白表达最高(图5J&K)。与PSD95趋势相反,GFAP在第21天ON-OFF组基因表达最低,表明磁性纵水凝胶阻碍BMSCs星形胶质细胞分化(图5L)。长期GFAP蛋白表达也证实了这一点(图5M)。这些结果表明,磁性纵可逆基质促进BMSCs向神经元而非星形胶质细胞分化。
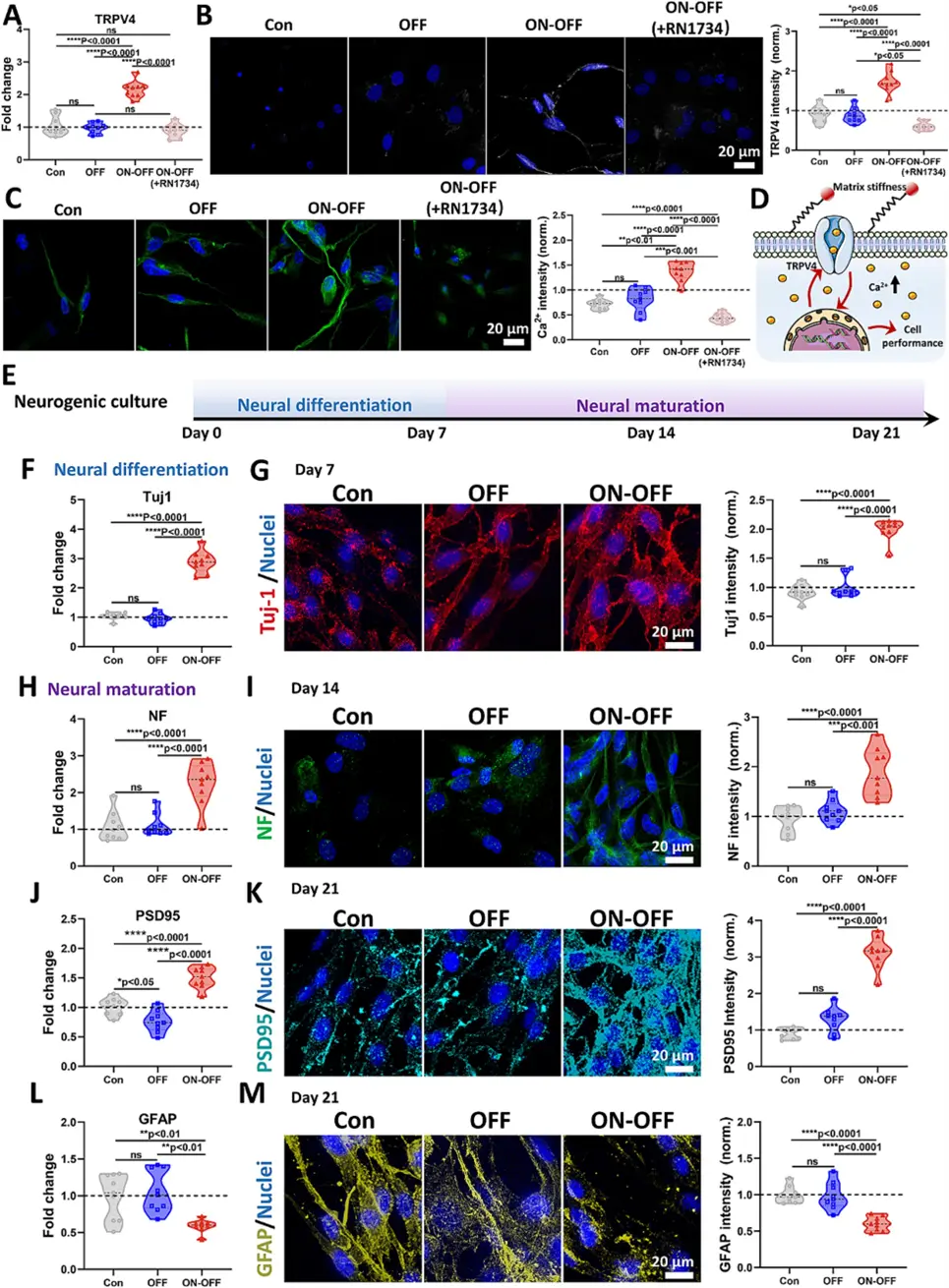
图5 磁性开关矩阵通过 TRPV4 诱发的 Ca2+ 促进 BMSCs 的神经分化流入。(A) 7 天后 TRPV4 在 BMSC 中的基因表达。免疫荧光 (IF) 染色和 (B) TRPV4 和 (C) 细胞内 Ca2+ 的荧光强度7 天后 BMSC 中的水平。(D) TRPV4 诱发 Ca2+ 内流通过基质刚度调节促进 BMSC 的神经分化的机制示意图。(E) 表征不同阶段神经分化结果的方案示意图。(F) 基因表达,(G) 7 天后 BMSC 中 Tuj1 的 IF 图像和荧光强度。(H) 基因表达,(I) 14 天后 NF 的 IF 图像和荧光强度。(J) 基因表达,(K) 21 天后 PSD95 的 IF 图像和荧光强度。(L) 基因表达,(M) 21 天后 GFAP 的 IF 图像和荧光强度
(6)磁性纵矩阵中 BMSC 神经分化的 RNA 测序研究
采用RNA测序分析研究基质刚度变化通过肌动蛋白细胞骨架聚合介导的机械转导途径促进BMSCs神经分化的生物学机制。在ON-OFF和OFF样本中发现677个差异表达基因(DEGs),其中257个上调,420个下调(图6A)。GO Chord图显示DNA修复、神经递质分泌和运输、基于肌动蛋白丝的过程的调节等GO术语之间的关系(图6B)。进一步评估OFF和ON-OFF水凝胶之间差异神经相关表达基因(DNEGs)的表达,与OFF水凝胶相比,ON-OFF水凝胶中更多DNEG的表达水平上调(图6C)。GO分类显示,与OFF水凝胶相比,ON-OFF水凝胶中的DNEGs与神经元分化相关(图6D)。此外,与细胞内机械转导有关,OFF vs Con和ON-OFF vs Con的GO项结果都与“细胞间粘附”和“细胞粘附”有关。与Con相比,ON-OFF水凝胶显示出与细胞外基质组织相关的GO项明显上调,表明对细胞生态位重塑的有效反应。KEGG富集表明,与OFF水凝胶相比,ON-OFF水凝胶中“磷脂酰肌醇3激酶-蛋白激酶B(PI3K-AKT)”信号通路、“钙信号通路”和“粘着斑”信号通路上调(图6E)。细胞内Ca²⁺可能激活小GTP酶Ras,进而募集PI3K。PI3K-AKT信号通路通过激活肌动蛋白成核剂调节肌动蛋白细胞骨架的动力学,参与干细胞的自我更新。Ca²⁺通过多种反馈效应触发细胞内钙信号通路。与OFF水凝胶相比,ON-OFF水凝胶中PI3K-AKT和钙信号的富集通路显示出磁性纵的可逆基质介导与机械转导相关的生物过程。KEGG分析还表明,PI3K-Akt通路中富集了27个基因,钙通路中富集了12个基因(图6F&G)。根据RNA测序结果和上述蛋白质表达,推断磁性纵的可逆基质激活了TRPV4离子通道的开放,导致Ca²⁺增加内流,触发PI3K-AKT和细胞内钙信号通路,通过促进肌动蛋白聚合以实现BMSC的神经分化(图6H)。
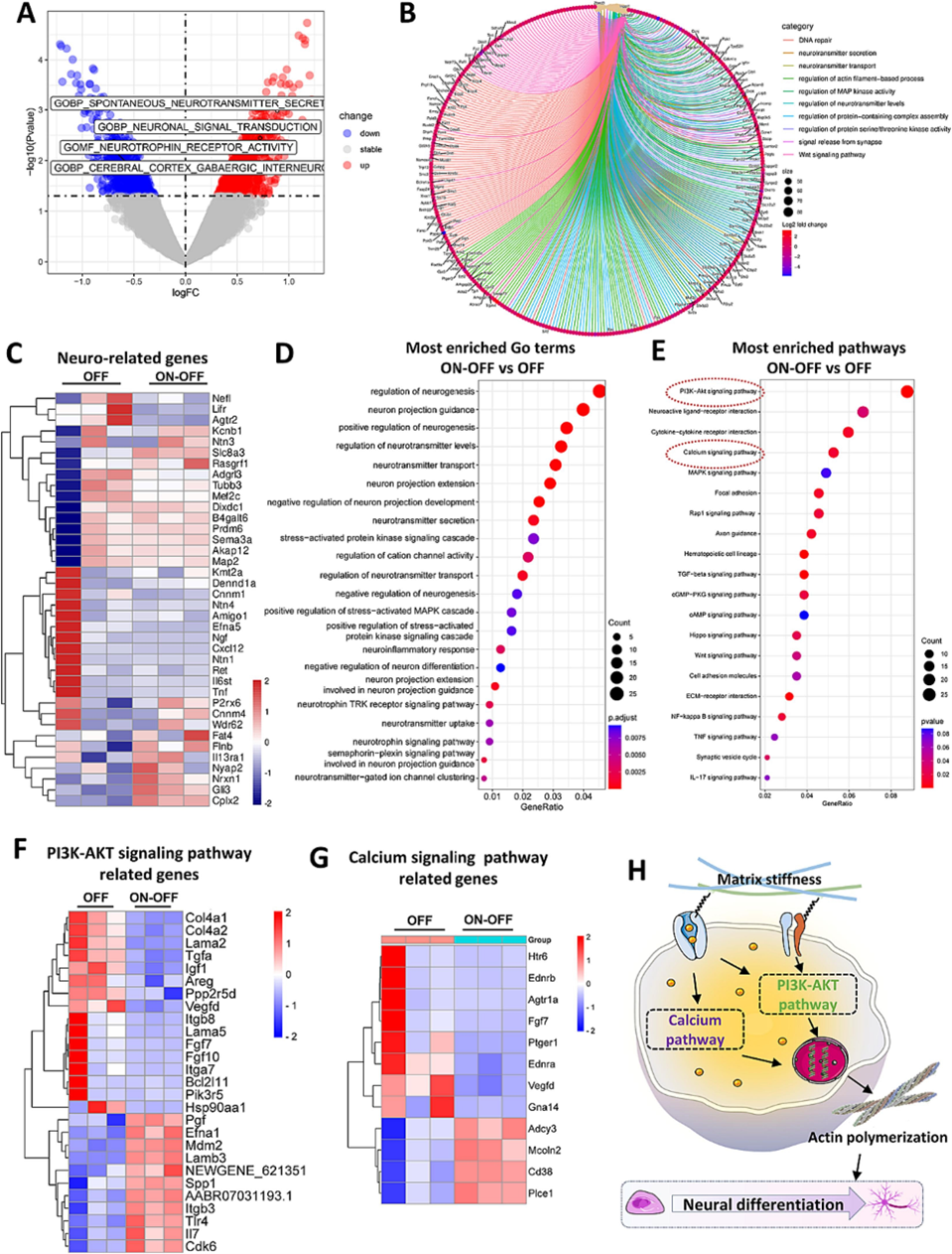
图6 第 21 天 BMSCs 神经分化的 RNA 测序分析。(A) ON-OFF 水凝胶中 BMSCs 下调基因 (蓝色,420) 和上调基因 (红色,257) 的火山图。(B) ON-OFF 水凝胶中差异表达基因 (DEG) 的丰富和弦图。(C) 热图显示了 OFF 和 ON-OFF 水凝胶之间 BMSCs 的差异表达神经相关基因 (DENG)。(D) 与 OFF 水凝胶相比,ON-OFF 水凝胶中 DENG 的基因本体论 (GO) 分类。(E) 与 OFF 水凝胶相比,ON-OFF 水凝胶中富集的 KEGG 通路。(F) OFF 和 ON-OFF 水凝胶中 PI3K-AKT 信号通路相关基因的热图。(G) OFF 和 ON-OFF 水凝胶中钙信号通路相关基因的热图。(H) 基质刚度如何通过激活 PI3K-AKT 和钙信号通路调节 BMSCs 神经元分化,最终促进肌动蛋白聚合的示意图
(7)TBI 后磁纵神经元再生和神经功能恢复
在SD大鼠中建立TBI模型,将TBI大鼠分为4组:注射PBS的对照组(TBI)、DHAC水凝胶处理组(Con)、DHAC-FM水凝胶处理组(OFF)和DHAC-FM水凝胶伴交替MF处理的ON-OFF组,另设正常大鼠为阳性对照(Sham)。TBI建模、治疗及神经功能恢复评估流程如图7A所示。TBI后28天处死大鼠并收集器官。HE染色显示三种水凝胶(Con、OFF、ON-OFF)生物相容性良好,未引起明显结构损伤、炎症等病理变化。评估TBI后28天脑组织完整性,TBI组出现大空腔,水凝胶组空腔减小,尤其是ON-OFF组,部分空腔有细胞松散浸润(图7B)。作为轴突和髓鞘再生指标,NF和MBP的IF染色显示ON-OFF组表达最高(图7C),OFF组表达略高于TBI组,表明生物活性水凝胶可诱导神经纤维和髓鞘再生,磁纵机械信号进一步增强这种影响。GAP43和PSD95染色研究突触形成,ON-OFF组阳性荧光信号最高(图7D、D1&D2),OFF组GAP43面积高于Con组,可能是DA修饰的MNPs促进轴突生长所致,证实ON-OFF水凝胶在体内促进TBI后神经再生和大脑结构重塑。
TBI会导致学习、记忆和认知功能障碍等神经精神后遗症。采用MWM实验评估TBI后的长期神经功能恢复。典型游泳路线显示,经过6天学习,五组大鼠的平台寻找轨迹显著减少(图7E)。第21天移除水下平台记录逃逸潜伏期,五组的逃逸潜伏期在训练后不同程度减少(图7F),ON-OFF组明显小于TBI、Con和OFF组,与Sham组相似,表明磁控可逆矩阵有效促进TBI后大鼠的空间学习能力。第28天评估记忆功能,ON-OFF组大鼠最频繁穿越隐藏平台区域,且在目标象限内停留时间最多(图7E、G和H),表明ON-OFF水凝胶显著提高TBI大鼠的记忆能力。以上结果表明,磁性纵的可逆基质有助于TBI后大鼠的长期神经功能恢复。
综上所述,结果证实磁性纵的可逆基质中的离合器强化效应通过PI3K-AKT和钙依赖性肌动蛋白自组装调节细胞伸长来介导BMSC神经分化(图7I)。在离合器增强效应下,磁性纵基质中的BMSC表现出肌动蛋白自组装上调,增强的细胞内机械信号激活PI3K-AKT和钙信号通路,促进神经分化相关基因Tuj1、NF、PSD95和GFAP的表达,最终促进TBI后神经功能恢复。相比之下,FAs参与的非磁性纵基质的“加载和失败”在肌动蛋白聚合中没有显著促进作用,导致神经分化和神经功能恢复较弱。
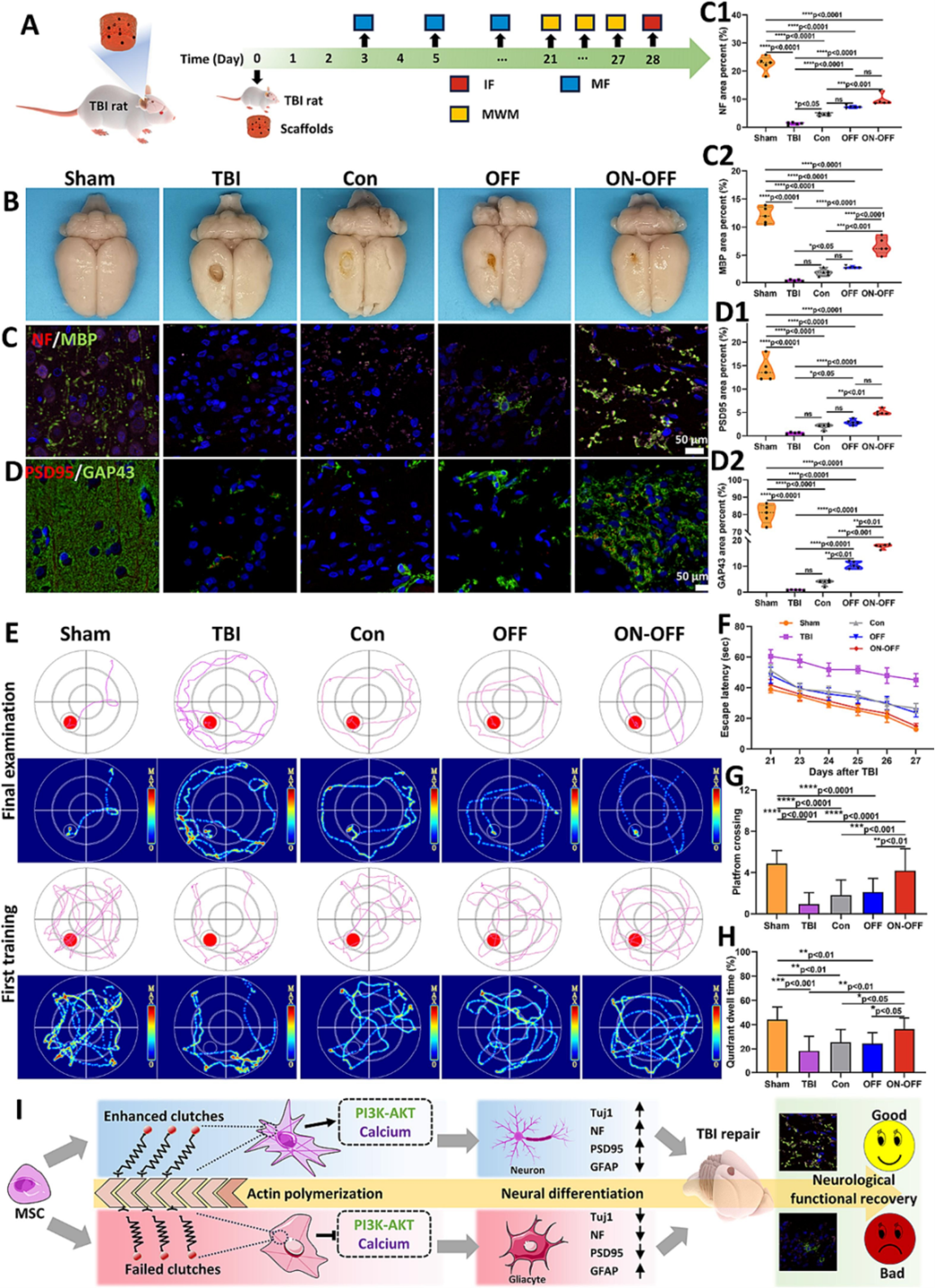
图7 TBI 后用磁性纵水凝胶治疗的大鼠的恢复评估。(A) TBI 建模、水凝胶植入、MF 负荷和神经再生评估的示意图。IF 表示免疫荧光染色,MF 表示 MF 加载点,MWM 表示莫里斯水迷宫。(B) TBI 后 28 天不同组的大脑图片。假动作表示仅暴露颅骨而没有任何植入的大鼠,TBI 表示注射 100 μL PBS 的 TBI 大鼠,Con 组表示用 DHAC 水凝胶治疗的 TBI 大鼠,OFF 组表示用 DHAC-FM 水凝胶治疗的 TBI 大鼠,ON-OFF 组表示用 DHAC-FM 水凝胶治疗的 TBI 大鼠伴有交替的 MF。(C) NF/髓鞘碱性蛋白 (MBP) 的典型 IF 染色图像。每个视野的 (C1) NF 和 (C2) MBP 阳性区域的定量。(D) PSD95/生长相关蛋白-43 (GAP43) 的 IF 染色图像。每个视野的 (D1) PSD95 和 (D2) GAP43 阳性区域的定量。(E) TBI 后第 28 天 MWM 的典型痕迹。(F) TBI 后第 21 至 27 天 MWM 中的逃逸潜伏期。(G) TBI 后第 28 天的穿越时间和 (H) 象限停留时间。(I) 磁性纵的可逆基质的示意图通过调节机械转导介导的 PI3K-AKT 和钙信号通路,通过离合器增强的肌动蛋白组织介导 BMSCs 神经分化
在这项工作中,开发了一种掺入 MNP 的磁性纵水凝胶,磁性纵水凝胶显示出对低 MF 的及时机械响应。这种集成远程磁性开关的水凝胶系统提供了基质刚度可逆作,从而为通过激活离合器增强的肌动蛋白自组装来建立增强的细胞-基质相互作用提供了有利的微环境。磁通-关增强的机械相互作用通过触发涉及细胞伸长的机械诱导来促进 BMSCs 神经分化,Ca2+通过激活 TRPV4 通道通过 PI3K-AKT 和钙信号通路诱导后续神经分化而内流。此外,受益于 MF 负载的安全性和可行性,磁纵策略成功地在体内应用于 TBI 修复,实现了令人满意的脑组织再生和神经功能恢复。这项工作采用智能响应水凝胶,为调节干细胞的机械生态位以定制细胞行为调节提供了有趣的见解和参考。总的来说,这些结果也为体内远程纵智能平台的多功能性和可靠性开辟了新的途径,用于发现/开发旨在治疗神经和其他组织损伤的潜在疗法。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

