
光老化由紫外线辐射引发,导致皮肤胶原纤维减少、弹性纤维变性,出现皱纹、色斑等问题。其主要原因是紫外线产生的活性氧(ROS),ROS会激活信号通路,促进酶表达,降解胶原蛋白,同时抑制TGF-β表达,阻断相关通路,减少胶原合成,并激活炎症通路,引发皮肤炎症。现有非手术治疗光老化方法效果有限,手术方法则存在风险和成本问题。
微针技术因其能有效递送药物、提高药物渗透性而成为研究热点。气体疗法中的氢气具有抗炎和清除ROS的能力,通过金属元素与水反应原位产氢的方法简单有效。此外,生物电在抗光老化治疗中也显示出巨大潜力。

![]()
![]()
针对上述问题,兰州大学范增杰教授团队设计了一种含有镁电极的原电池微针(GCMN)贴片。贴片通过原电池机制运作,通过氧化还原反应产生微电流并释放氢气和镁离子。氢气的抗氧化和抗炎特性、微电流刺激细胞迁移以及镁离子促进血管生成和巨噬细胞M2抗炎极化协同作用,可逆转光老化皱纹并使皮肤再生。此外,该研究还探讨了GCMN对转化生长因子-β/Smad(TGF-β/Smad)通路的影响。这种方法有望推动医疗美容领域的研究和开发。该文章于2025年03月11日以《Galvanic Cell Bipolar Microneedle Patches for Reversing Photoaging Wrinkles 》为题发表于《Advanced Materials》(DOI:10.1002/adma.202500552)。
(1)GCMNs的设计与原理
如图所示为了制造GCMNs,研究者设计并制备了由导电阳极和阴极阵列组成的双极微针阵列,采用两步模板法,基于聚乳酸(PLA)、多巴胺(DA)改性的聚吡咯(PPy)纳米纤维(简称DA-PPy)和聚乙二醇(PEG)。PLA被选为微针基材,因其具有良好的生物相容性和优异的机械性能,确保生物安全性和足够的机械强度。将增塑剂PEG掺入PLA中,可显著提高微针的柔韧性和韧性。此外,将DA-PPy掺入PLA中,以提高微针的导电性。将尺寸约为30-40微米的镁颗粒添加到阳极微针阵列中,使其与阴极微针阵列有所区别。通过导电材料将阴极和阳极微针阵列连接起来,形成GCMNs。双极微针在插入组织后利用组织液作为电解质溶液,形成完整的原电池回路。在弱碱性组织液中发生的自发氧化还原反应中,水获得电子并被还原,导致阴极电极处生成氢气。同时,镁在阳极电极处释放电子,发生氧化反应,转化为镁离子。这在双极微针阵列之间形成电位差,促进电子的定向流动,最终产生生物电。这些反应产生的生物电和镁离子对细胞增殖和迁移具有积极影响。此外,氢气因其抗炎和抗氧化特性,可从病理角度辅助治疗光老化皱纹。
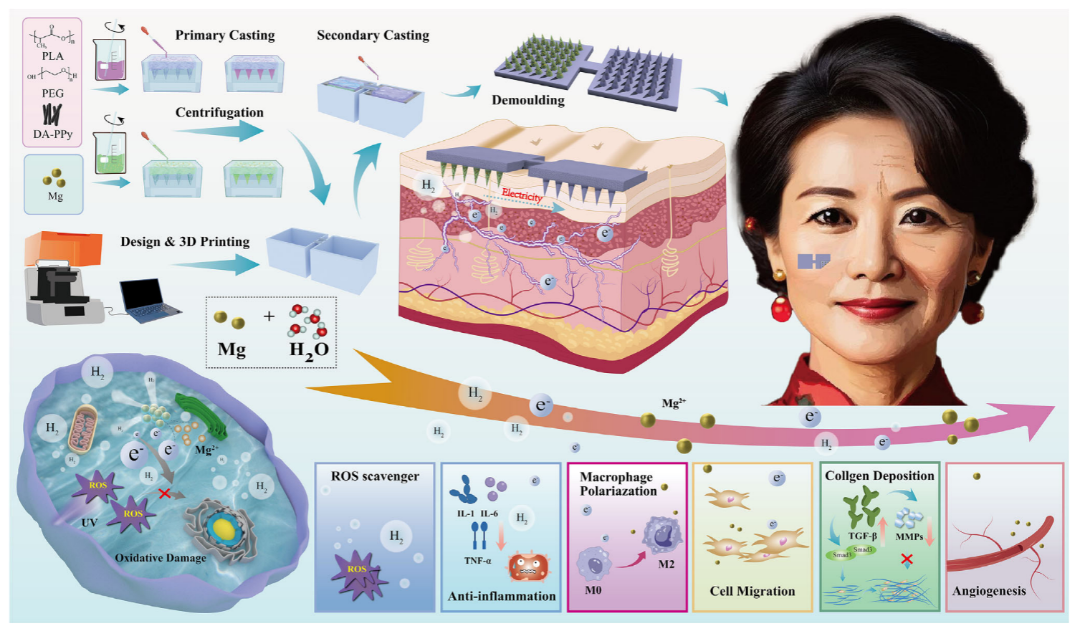
图1. GCMN的制作工艺和工作原理
(2)GCMNs的制备与表征
GCMNs通过模板法制备,阴阳极相连形成完整双极微针结构,3D打印连接模板助力制备。扫描电镜图展示微针表面形貌,所有微针同模板制备,呈11×11阵列,单个微针底径200微米,高600微米(图2A)。能量色散谱图确认微针中镁元素均匀分布,含罗丹明的微针显微镜图显示其圆锥形尖端,阳极可见镁颗粒。傅里叶变换红外光谱分析揭示DA-PPy/PLA/PEG导电基质中DA-PPy的特征峰,证实其成功融入基质(图2B)。X射线衍射分析显示镁颗粒的特征峰,证明其成功融入导电基质(图2C)。
(3)GCMNs的力学性能
GCMNs的机械性能通过在纯PLA微针中添加PEG来改善,以减少其脆性和断裂。使用万能试验机测试了不同PLA/PEG比例的PLA/PEG微针的机械性能。测试结果表明,在450微米位移下,三种PLA/PEG比例的微针所需压力呈先增加后减少的趋势(图2D、E)。

图2. GCMNs的表征与力学性能。(A)(i、ii、iv、v和vi)MN的SEM图像,其中白色箭头指示镁颗粒的位置;(iii)MN的照片图像;(vii)镁的EDS图像;(viii)和(ix)含或不含镁颗粒的MN的罗丹明显微镜照片;(B)材料的FT-IR光谱;(C)材料的XRD图谱;(D,E)MN的机械性能
(4) 氢和微电流产生
GCMNs基于镁与水反应生成氢气的原理,该反应具有抗氧化特性,且不会干扰正常代谢氧化或细胞信号传导。为评估阳极微针的产氢能力,将阳极微针浸入PBS缓冲液中,并定期拍摄显微镜图像。结果表明,在12小时内可观察到持续的氢气释放(图3A)。通过滴定法测定Mg2+浓度变化来量化累计氢气释放量,48小时内累计氢气释放量达到62.6 mmol,表明微针具有持久的抗炎潜力(图3B)。氧化还原反应可以产生微电流,具有抗炎作用并能增强细胞迁移能力。使用高精度台式数字万用表在体外和体内评估微针的微电流产生能力。结果表明,当微针浸入PBS中时,会迅速产生2.68微安的峰值电流,随后逐渐下降,持续24小时(图3C)。当将微针插入小鼠背部皮肤时,观察到类似的2.55微安峰值电流,逐渐下降但比体外环境持续时间更长,这可能是由于体内体液体积较小,每次反应参与的液体较少,从而延长了电流的持续时间(图3D)。
(5)活性氧清除和体外抗氧化能力
研究团队对微针(MN)在体外的自由基清除和抗氧化能力进行了研究。如图3E所示,通过持续释放氢气,在阳性对照组中对DPPH•的清除率达到87.80±3.15%,而在电刺激(ES)组、空白MN组、镁MN组和双极MN组中,清除率分别为13.06±5.18%、42.36±10.57%、55.13±4.85%和84.68±2.52%。此外,对•OH的清除效果在阳性对照组中达到95.08±0.74%,而在ES组、空白MN组、镁MN组和双极MN组中,清除率分别为9.76±1.36%、17.63±0.90%、32.51±2.06%和80.89±1.33%(图3F)。显然,镁MNs和双极MNs对DPPH·都表现出了很强的清除能力。相反,单独的ES对自由基清除作用很小。但双极MNs对·OH和DPPH·的清除活性明显高于镁MNs和ES处理的MNs。这种增强可归因于微电流和原电池反应产生的氢气的协同作用。随后,使用ROS检测试剂盒评估了MN的ROS清除能力。在脂多糖(LPS)刺激下,细胞内出现明显的绿色荧光信号,表明细胞内产生了ROS(图3H)。Mg MN和双极MN观察到明显的荧光淬灭,突出了它们强大的ROS清除功效,而ES和空白MN的清除活性最小。半定量分析结果显示,对照组自由基生成率为51.61 ±6.70%,阳性对照组为100.00 ± 2.11%,ES组为92.03 ± 2.40%,BlankMNs组为80.44 ± 4.21%,Mg MNs组为67.07 ± 2.97%,和56.60 ± 5.56%,进一步证明了MgMN和BipolarMN的有效ROS清除能力(图3G)。
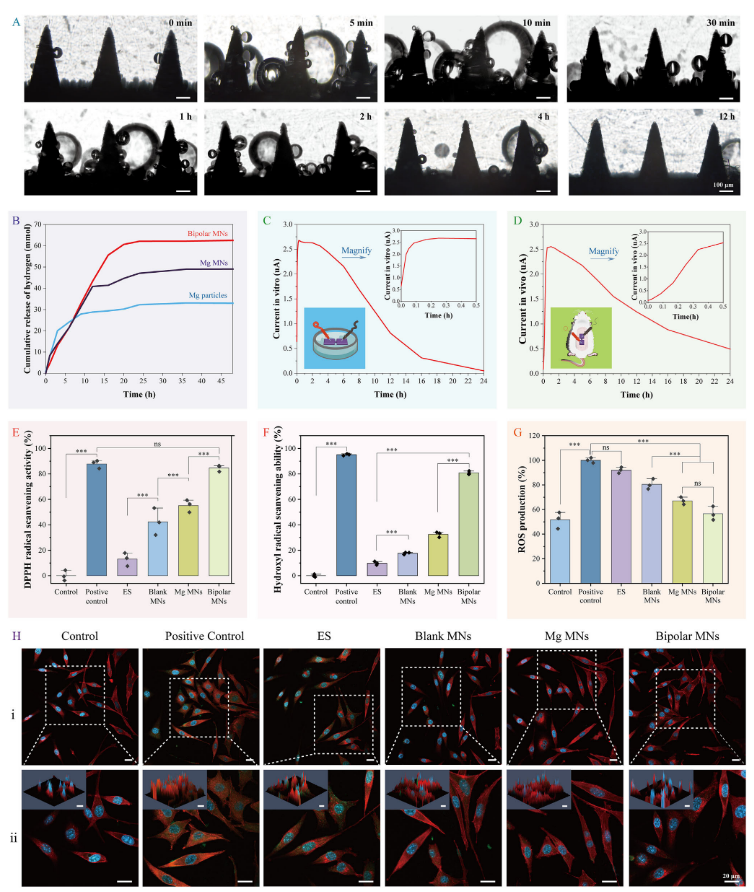
图3. GCMNs的产氢和显著的抗氧化能力。(A)显示氢生成的时间范围的显微镜图像;(B)随着时间推移产生的氢气量;(C)GCMNs的体外微电流产生;(D)GCMNs的体内微电流产生;(E)清除DPPH自由基的能力;(F)清除羟自由基的能力;(G,H)ROS测定和统计学分析:在用简单电刺激(ES)、空白MNs、Mg MNs、双极MNs和正常细胞培养基(对照组)处理24小时后的L929细胞,ROS用DCFH-DA染色(绿色)
(6)细胞增殖、迁移和血管生成
为了评估微针(MN)对细胞增殖、迁移和血管生成能力的影响,研究者进行了多项实验。通过MTT实验检测细胞活力,结果显示所有实验组的细胞存活率均超过85%,高于对照组,表明MN具有良好的生物相容性(图4A)。图4B活/死细胞双染色实验进一步证实了这一点,显示MN处理后的细胞具有较高的存活率。图4C清楚地表明,与MN共培养3天后,细胞骨架形态学没有显著差异。在细胞迁移实验中,使用划痕实验评估了MN对成纤维细胞迁移能力的影响。结果显示,镁MN组和双极MN组的伤口闭合率显著高于对照组,表明MN能够显著促进细胞迁移(图4D、E)。此外,研究者还通过人脐静脉内皮细胞(HUVEC)实验,发现MN处理组的细胞分支点和管长度均高于对照组,表明MN能够有效促进血管生成(图4F-H)。
(7)促进巨噬细胞M2体外极化分析
在巨噬细胞M2极化实验中,研究者发现镁离子能够刺激巨噬细胞向M2表型极化。与对照组相比,镁MN组和双极MN组的M2极化水平显著提高,表明MN能够有效促进巨噬细胞的抗炎极化(图4I)。这些实验结果表明,MN具有良好的生物相容性,能够显著促进细胞增殖、迁移和血管生成,同时具有抗炎作用,有助于皮肤损伤的修复和再生。
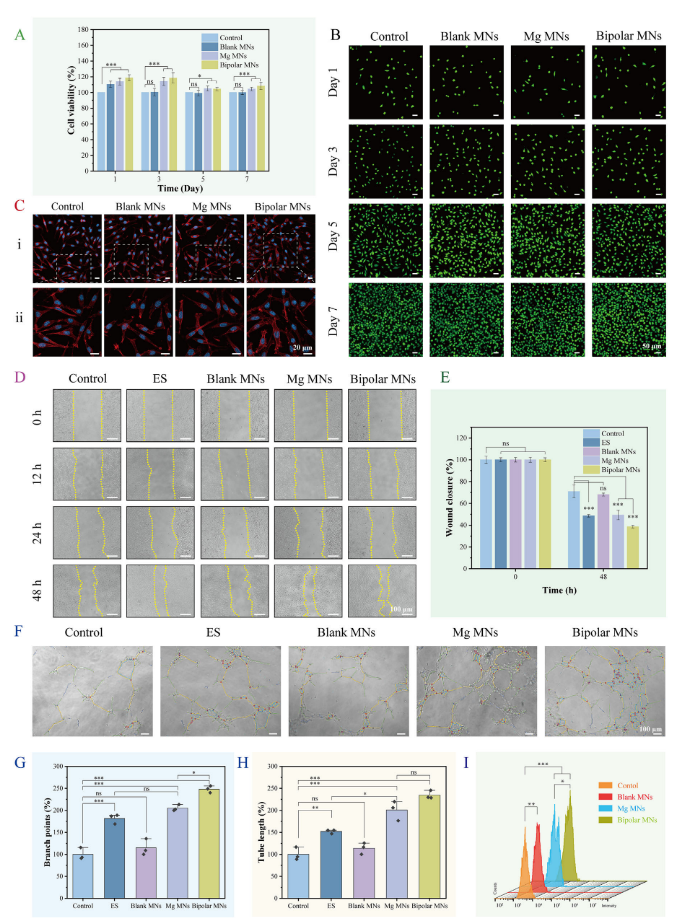
图4. GCMNs的体外生物相容性、细胞增殖、迁移、血管生成和巨噬细胞极化效应。(A)MTT试验结果;(B)活/死双染色实验;(C)鬼笔环肽染色的细胞骨架形态学;(D,E)在各种处理24小时后,使用细胞迁移测定法评价成纤维细胞迁移;(F-H)细胞管形成试验的结果和统计分析;(I)巨噬细胞M2极化的流式细胞术分析
(8)光老化皱纹的治疗效果及组织学分析
研究者采用了UV诱导的光老化小鼠模型。小鼠被随机分为五组:一组不进行任何治疗,其他组分别接受单纯电刺激(ES)、空白微针(Blank MNs)、镁微针(Mg MNs)或双极微针(Bipolar MNs)治疗(图5A)。在治疗期间,获取了小鼠背部皮肤的图像(图5B),结果显示,14天后双极微针组仅表现出轻微的皱纹。相比之下,单纯电刺激组有一定的改善,但总体效果有限。为了进一步评估微针治疗对光老化皱纹的影响,小鼠在第14天被处死,并收集背部皮肤组织进行组织学和免疫组化分析。H&E染色结果显示(图5C),模型组、电刺激组、空白微针组和镁微针组的表皮呈现不规则增厚和结缔组织炎症细胞浸润,而双极微针组的表皮显示出显著的恢复,尽管仍略低于对照组。Masson三色染色用于评估胶原蛋白的损伤和修复情况。结果显示,模型组、电刺激组和空白微针组的皮肤胶原纤维明显减少,部分胶原纤维出现碎片化、排列紊乱和分布不均(图5D)。镁微针组的胶原纤维排列有所改善,而双极微针组则表现出更显著的改善,胶原纤维排列有序、连续且含量增加。图5E、F免疫组化分析显示,双极微针组的胶原蛋白1(COL-1)和胶原蛋白3(COL-3)水平显著高于其他实验组,与对照组无显著差异,表明GCMNs对受损皮肤的胶原蛋白再生具有显著的促进作用。
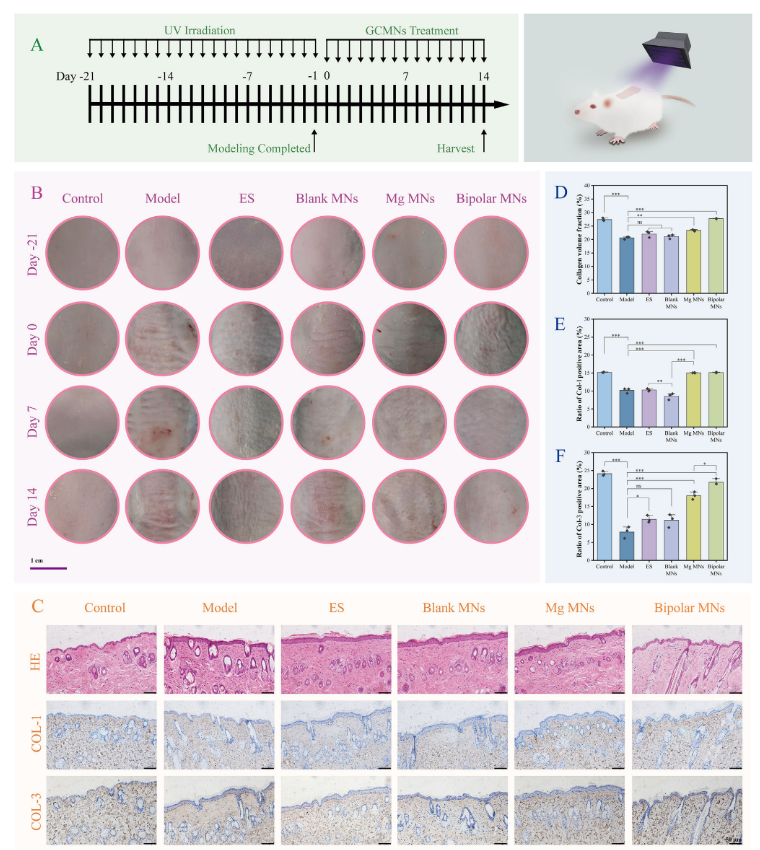
图5. 活体光老化皱纹的治疗效果及组织学分析。(A)动物实验的时间轴;(B)在第-21天、第0天、第7天和第14天,用不同干预处理的小鼠背部皮肤的照片;(C)胶原蛋白1和3的苏木精-伊红(H&E)染色和免疫组织化学结果;(D-F)Masson三色染色和免疫组织化学的定量分析
(9)体内抗炎、巨噬细胞M2极化和血管生成
为了进一步探讨微针(MN)治疗是否能够减轻体内炎症因子的产生,研究者进行了免疫组化染色,以量化IL-1β、IL-6和TNF-α的表达水平(图6)。结果表明,与未治疗的模型组相比,经ES、镁MN和双极MN治疗后,皮肤组织中IL-1β、IL-6和TNF-α的分泌量显著减少。然而,与模型组相比,空白MN组并未抑制炎症因子的表达。镁MN的显著抗炎特性源于镁与组织液反应生成氢气,已知氢气能够抑制炎症介质的产生。尽管ES组在之前的自由基清除实验中影响不大,但在这里也显示出明显的抗炎抑制效果,而双极MN组同时具备镁离子、电刺激和氢气,展现出最佳的抗炎能力。
同时,通过免疫荧光检测评估了抗炎过程中巨噬细胞的极化情况。图7A、B结果显示,模型组和空白MN组中M1型巨噬细胞标志物CD86的表达较高,而在镁MN组、ES组尤其是双极MN组中表达降低。相反,M2型巨噬细胞标志物CD206在模型组和空白MN组中几乎不表达,但在镁MN组、ES组和双极MN组中表达较高。这一结果与体外流式细胞术趋势一致,表明镁离子对巨噬细胞的M2极化有影响。此外,研究者推测MN释放的镁离子应具有强大的促血管生成能力,通过检测组织中CD31的表达来评估,结果显示ES组、镁MN组和双极MN组的CD31表达水平较高,证明了GCMNs中镁离子的促血管生成能力。
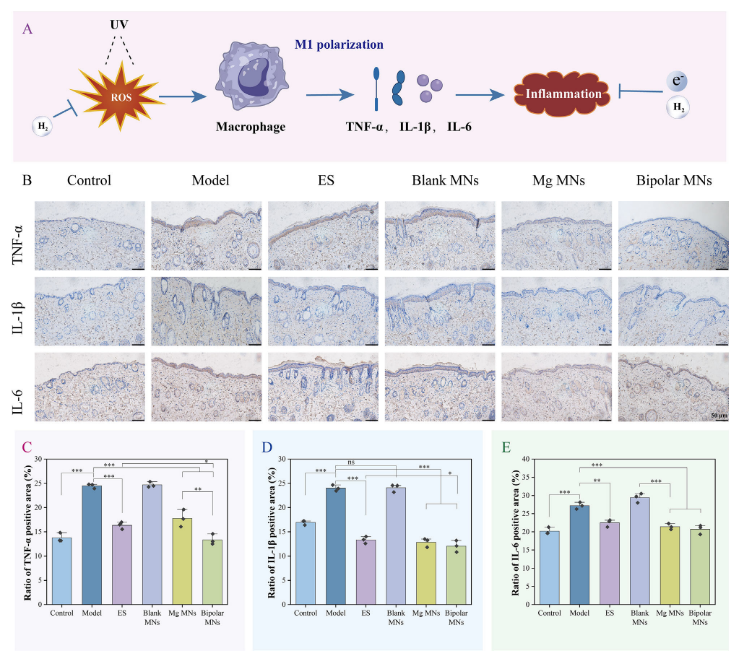
图6. GCMNs的抗炎能力。(A)紫外线引起的皮肤炎症的示意图;(B)显示TNF-α、IL-1α和IL-6表达水平的免疫组织化学图像;(C-E)TNF-α、IL-1α和IL-6表达的统计学分析
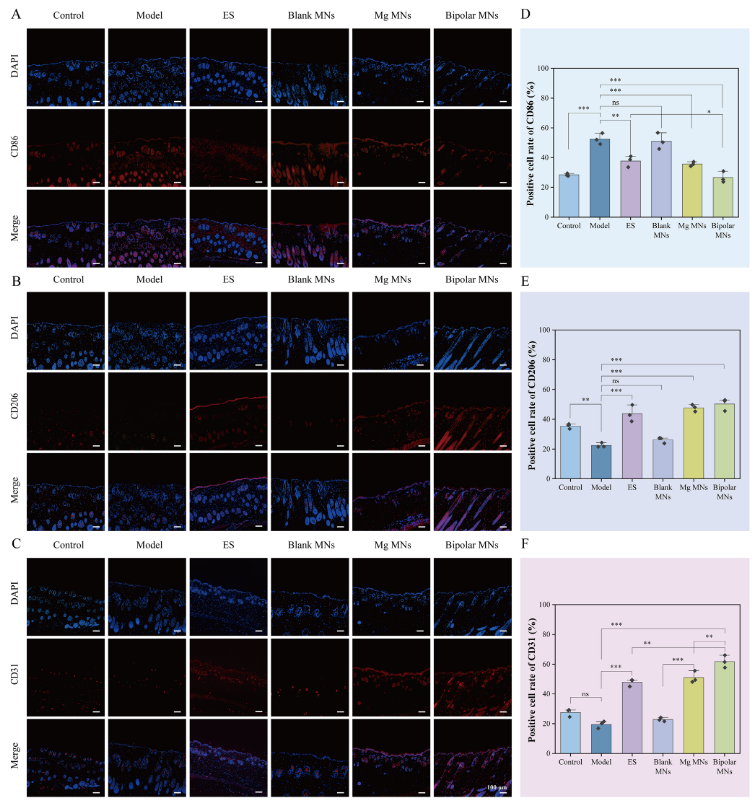
图7. GCMNs在体内对巨噬细胞M2极化和血管生成的促进作用。(A-C)CD86、CD206和CD31的免疫荧光图像;(D-F)免疫荧光定量分析
(10)GCMNs的信号通路及其分子机制
TGF-β/Smad通路在细胞增殖、分化、胶原蛋白合成和免疫调节等过程中起着关键作用。为了评估不同处理对TGF-β1、Smad-3和MMP-9表达水平的影响,研究者进行了免疫荧光染色(图8A-C)。结果显示,双极微针组的TGF-β和Smad-3表达水平显著高于模型组和空白微针组,而MMP-9表达水平显著降低。进一步的Western Blot分析(图8 G)和实时定量PCR(图8H、I)结果也支持了这一结论,表明GCMNs通过激活TGF-β/Smad-3信号通路,促进胶原蛋白积累,抑制胶原蛋白降解,从而有效修复光老化皱纹。
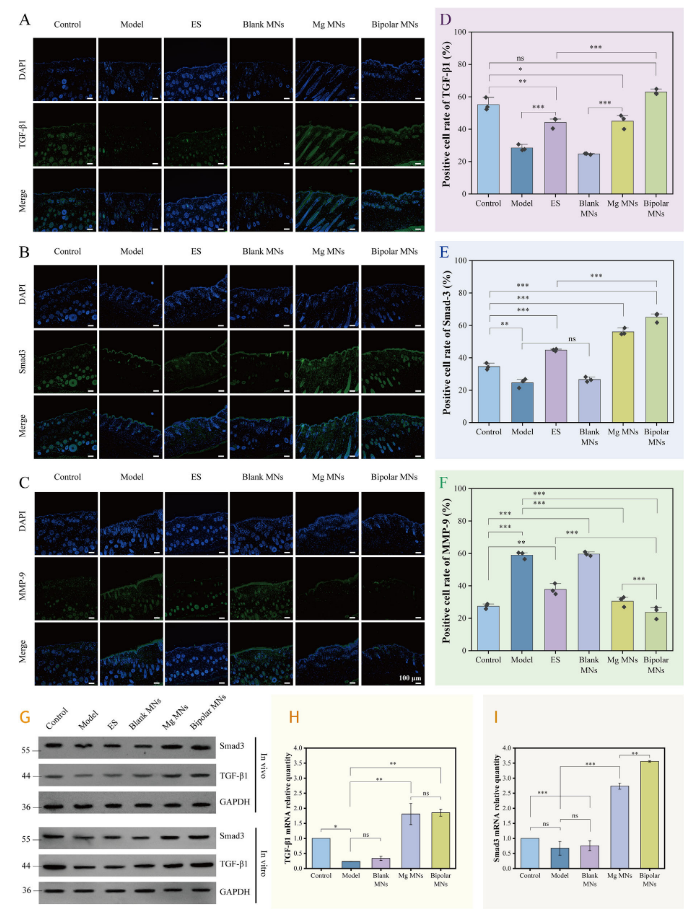
图8. GCMNs通过TGF-β/Smad-3信号通路治疗光老化皱纹。(A-C)TGF-β1、Smad-3和MMP-9的免疫荧光图像;(D-F)免疫荧光的定量分析;(G)通过蛋白质印迹法在体内和体外检测TGF-β1和Smad-3蛋白表达水平;(H,I)TGF-β1和Smad-3的RT-qPCR结果
本研究介绍了一种创新的GCMNs技术,其疗效优于单独的电刺激,并克服了以往方法的局限性,通过整合传统电池和气体疗法,利用微针技术进行递送,并通过自供电实现氢气释放。 这种方法为光老化皱纹患者提供了一种无痛、微创、高效且便捷的治疗选择,具有抗氧化、抗炎、促血管生成和抑制皮肤老化的效果。尽管本研究主要关注皱纹修复,但微针可能对光老化的各种表现具有更广泛的治疗益处,值得未来进一步研究。总体而言,本研究为光老化损伤的修复提供了初步的分子机制见解,标志着医疗美容研究的重要进展。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

