
胶质瘤(GBM)是一种极具侵袭性的脑部肿瘤,患者中位生存期通常不超过15个月。除了血脑屏障(BBB)的阻碍,GBM还表现出高度的“免疫冷”特性,即肿瘤细胞免疫原性极低,且存在复杂的免疫抵抗机制。这种免疫抵抗包括:内在免疫抵抗:肿瘤细胞免疫原性低,难以被免疫系统识别。适应性免疫抵抗:肿瘤细胞通过过表达CD47等免疫检查点蛋白,逃避免疫细胞的攻击。这些特性使得GBM对传统免疫治疗反应不佳,迫切需要新的治疗策略。

针对上述问题,复旦大学孙涛和蒋晨团队研究团队设计了一种基于工程化细菌外膜囊泡(OMVs)的纳米平台(AO@PTP/47aD),用于联合递送阿霉素(DOX)和CD47小干扰RNA(siCd47)。这种纳米平台的设计思路如下:1核心设计:阳离子聚合物复合物(PTP/47aD)-PTP(PEG3.5k-TK-PEI1.8k):一种低分子量的聚乙二醇(PEG)和聚乙烯亚胺(PEI)的复合物,通过活性氧(ROS)响应性连接子(TK-COOH)连接。这种设计使得聚合物在肿瘤细胞内的高浓度ROS环境下能够降解,释放药物。siCd47和DOX:通过静电作用,PTP与siCd47和DOX负载的核酸适配体结合,形成稳定的复合物。2️外层设计:工程化OMVs(ΔmsbBOMVs)OMVs来源:通过基因工程敲除大肠杆菌(E.coliBL21)的msbB基因,减少OMVs中的内毒素含量,提高安全性。功能:OMVs能够穿透血脑屏障(BBB),并激活免疫系统,增强抗肿瘤效果。3️靶向修饰:Angiopep-2靶向肽:Angiopep-2能够特异性结合脑血管内皮细胞上的低密度脂蛋白受体相关蛋白1(LRP1),帮助纳米平台穿越BBB并靶向GBM细胞。该文章于2025年3月4日以《Engineered Bacterial Outer Membrane Vesicles-Based Doxorubicin and CD47-siRNA Co-Delivery Nanoplatform Overcomes Immune Resistance to Potentiate the Immunotherapy of Glioblastoma》为题发表于《Advanced Materials》(DOI:10.1002/adma.202418053)。
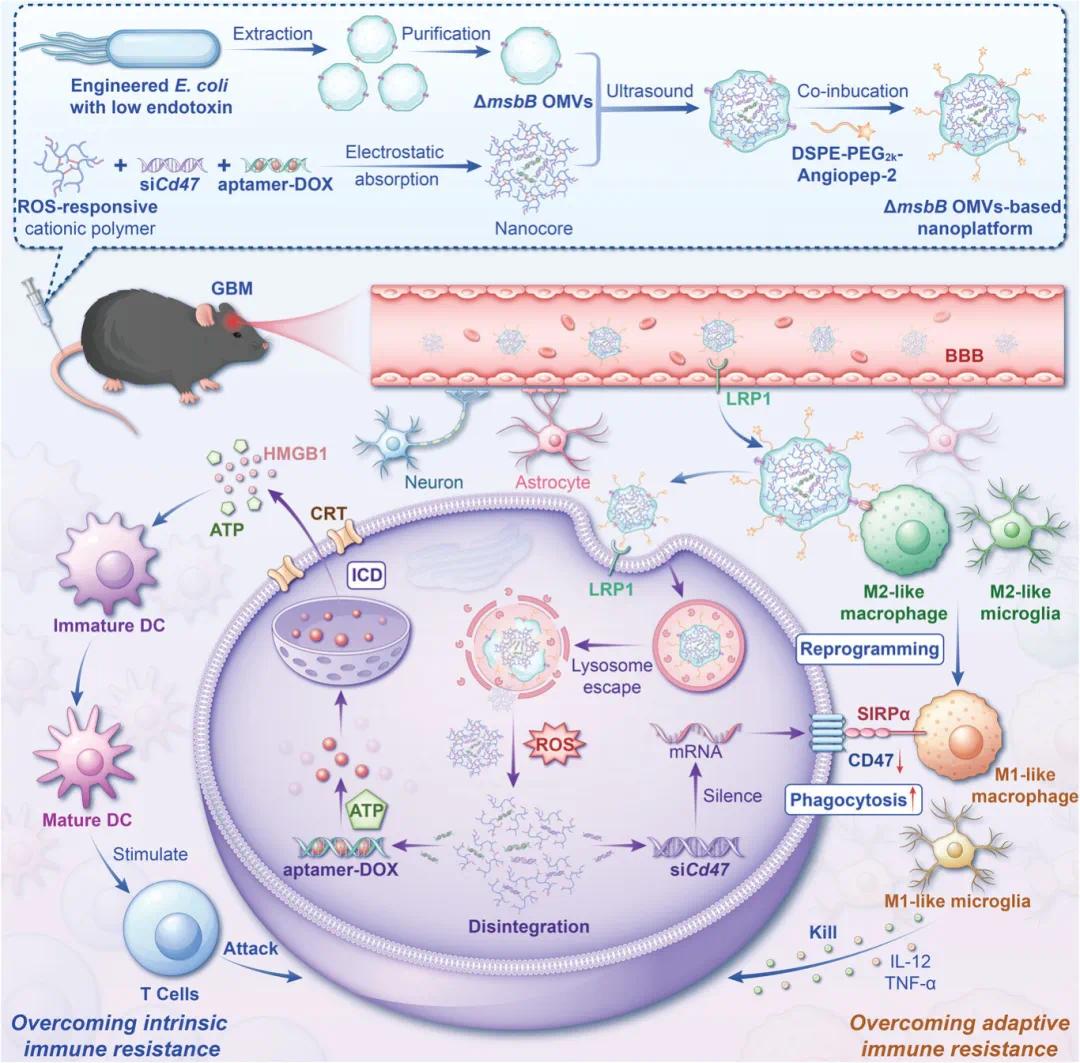
研究示意图
(1) 纳米平台的制备和表征
纳米平台AO@PTP/47aD的制备(图2a)及各组分完成表征,包括aptamer负载阿霉素(DOX)(图2b)及响应ATP释放DOX(图2c)。PAP在相同质量比下与PTP结果一致,二者均成功与siCd47和aD共负载(图2d)。PTP/47aD与1 mM H₂O₂共孵育时粒径显著增加并持续24小时,而与0.1 mM H₂O₂共孵育时几乎无变化(图2e)。ΔmsbBOMV经检测内毒素水平显著降低(图2f),安全性增强。通过超声及共孵育等操作获得共递送纳米平台AO@PTP/47aD,其直径和zeta电位与O@PTP/47aD无显著差异(图2h,i)。形态学观察显示PTP/47aD为完整球形颗粒,ΔmsbBOMV为经典碗状双层结构,AO@PTP/47aD为核壳结构,其大小与DLS结果一致(图1j)。共聚焦激光扫描显微镜(CLSM)显示ΔmsbBOMV的红色荧光与siRNA的绿色荧光高度共定位(图1k),证实其成功封装PTP/47aD,与透射电子显微镜(TEM)和DLS结果一致。
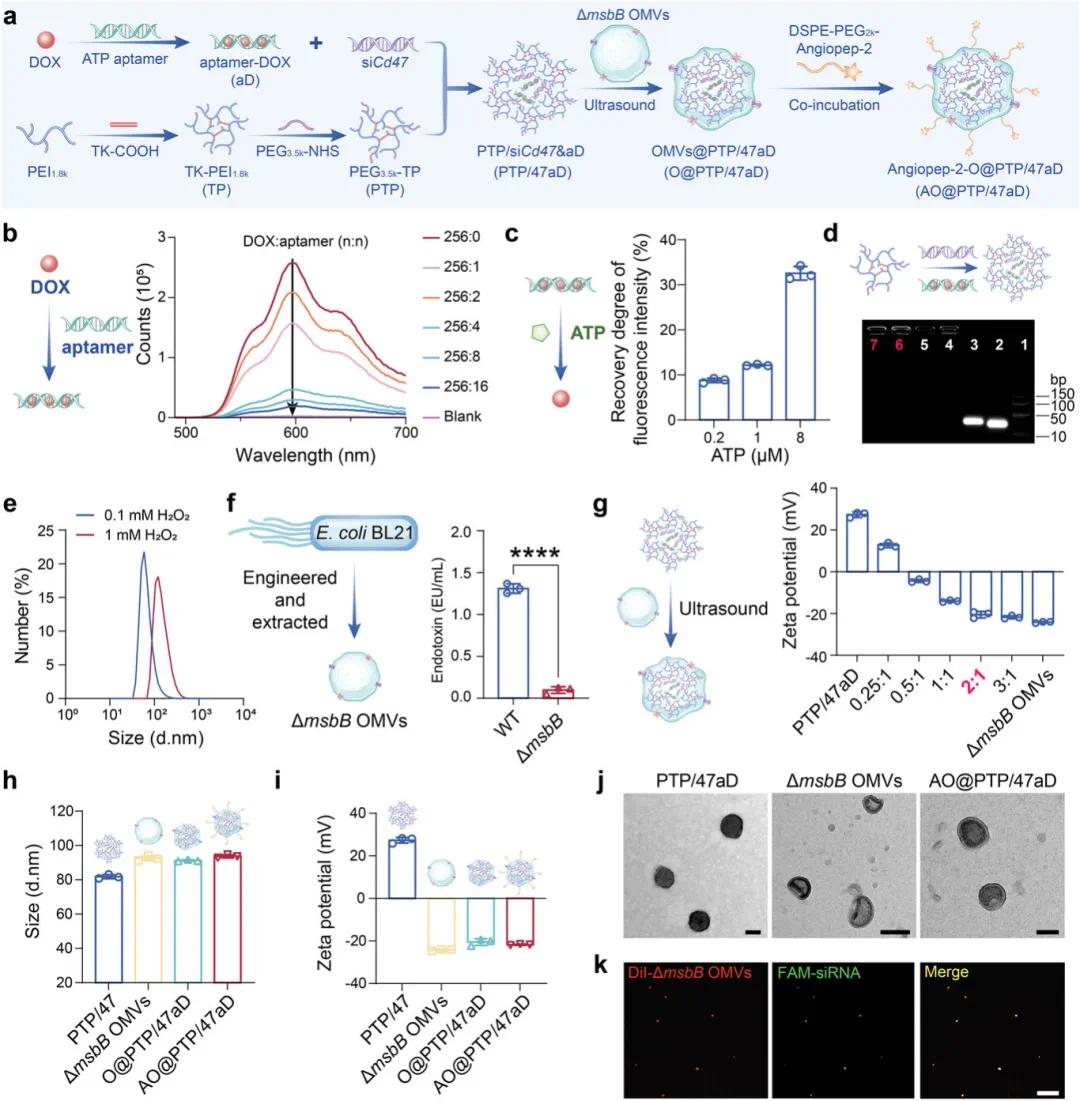
图1 纳米体系的制备与表征。a)AO@PTP/47aD的制备的示意图。B,c)通过ATP适体负载DOX(b)和通过aD响应ATP释放DOX(c)荧光分光光度法分析。d)通过PTP或PAP共压缩siCd47和aD的琼脂糖凝胶电泳分析。(e)PTP/47aD细胞ROS反应性的DLS分析。f)ΔmsbBOMV和野生型OMV的内毒素含量分析。g)ΔmsbBOMV与PTP/47aD比例的ζ电位分析。h,i,j)PTP/47、ΔmsbBOMV、O@PTP/47aD和AO@PTP/47aD的尺寸(h)和ζ电位(i)的半定量结果(j)的TEM图像。比例尺=50nm(左右)。比例尺=100nm(中间)。k)ΔmsbBOMV和siRNA之间共定位的代表性共聚焦图像。用Dil标记的ΔmsbBOMV:红色。用FAM标记的siRNA:绿色。比例尺=10µm
(2)纳米平台诱导的毒性和ICD
鉴于SiRNA和DOX在细胞内发挥作用,研究了纳米平台在细胞水平上的摄取行为。结果显示,G422细胞对AO@PTP/47aD的摄取主要通过能量依赖性机制和网格蛋白介导的内吞作用发生(图3a,b),表明纳米平台经历细胞内溶酶体途径。CCK8实验表明,DOX(447.2 nM)和AO@PAP/47aD(494.5 nM)具有相似的半最大抑制浓度,而AO@PTP/47aD的IC50降低至285.5 nM(图3c)。7-AAD/AnnexinV染色(图3d)观察细胞凋亡情况,AO@PTP/47aD对肿瘤细胞产生实质性细胞毒性作用。接下来,评估了AO@PTP/47aD诱导免疫原性细胞死亡(ICD)的能力。如图3e-g所示,流式细胞术(FCM)和Western Blot(WB)分析表明,所有含DOX的制剂都引起可测量的ICD反应。与ROS非应答制剂和缺乏血管肽素-2修饰的制剂相比,AO@PTP/47aD引起最强的CRT暴露并显著促进HMGB1核转位。免疫荧光(IF)结果进一步证实了这些发现(图3h)。流式细胞术(FCM)分析显示,AO@PTP/47aD组中成熟树突状细胞(DC)的比例最高(图3j),这与观察到的CRT暴露和HMGB1核转位的程度一致,从而为后续T细胞活化奠定了基础。
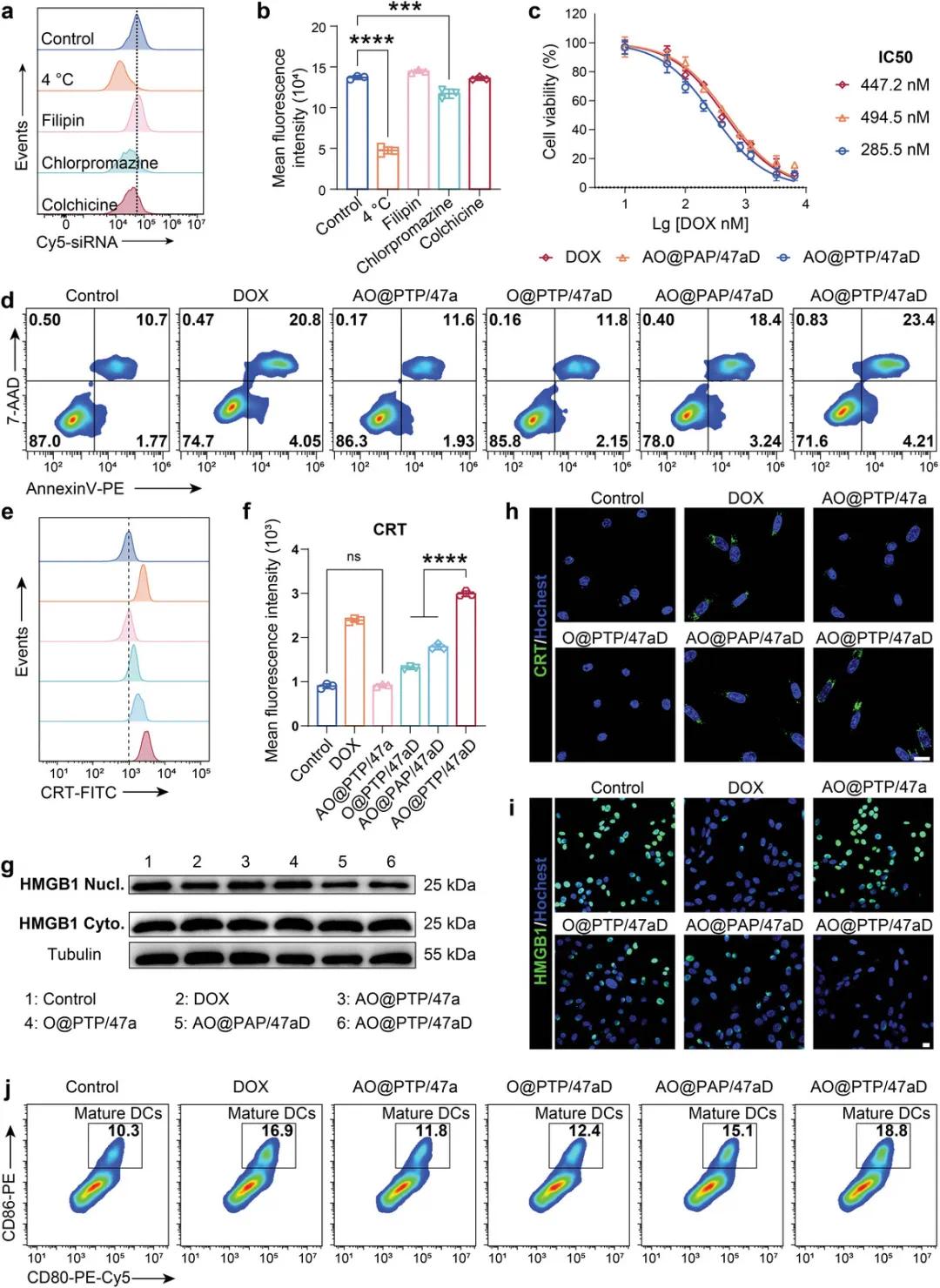
图2 纳米平台诱导的细胞毒性和ICD。a,b)AO@PTP/47aD摄取途径的FCM分析(a)和相应的半定量结果(b)荧光依赖性摄取。c)不同制剂的细胞毒性分析。。d)不同制剂诱导的细胞凋亡的FCM分析。e,f)不同制剂诱导的CRT表达的FCM分析(e)和相应的半定量结果(f)。g)不同处理后细胞质HMGB1和核HMGB1表达的WB分析。h,i)不同处理后CRT表达(h)和HMGB1核共定位(i)的代表性共聚焦图像。比例尺=20μm。j)FCM分析通过不同配方促进BMDC的成熟
(3)纳米平台促进的GAM的吞噬作用
胶质母细胞瘤(GBM)适应性免疫抗性的主要特征是肿瘤细胞通过过表达多种检查点来逃避免疫细胞的攻击和破坏。在肿瘤微环境(TME)中,小胶质细胞/巨噬细胞(GAM)是主要的免疫细胞,CD47介导的吞噬逃逸起着重要作用。对患者来源的GBM组织进行Western Blot(WB)和免疫荧光(IF)分析进一步确认了这一点。这些结果提示,利用siRNA下调GBM细胞表面CD47的表达,可有效降低GBM细胞的吞噬逃逸能力,从而增强GAM对GBM的吞噬作用,克服GBM细胞的获得性免疫抵抗。
通过免疫荧光(IF)观察到,移植G422细胞的原位GBM荷瘤小鼠切片中,GBM区域的CD47荧光信号显著强于周围瘤周组织和相应的正常脑组织中的CD47荧光信号(图4b)。与先前的siCd47筛选一致,Western Blot(WB)和流式细胞术(FCM)分析显示,含有siCd47的制剂在不同程度上降低了G422细胞中的CD47表达水平。值得注意的是,在PTP/47a条件下,ROS响应性和Angiopep-2修饰的AO的沉默效应最为显著(图4c-e)。
此外,为了验证CD47敲低产生的促吞噬作用,从C57BL/6小鼠中提取骨髓源性巨噬细胞(BMDM),并选择BV2细胞代表GAM。流式细胞术结果显示,经AO@PTP/47a处理后,BV2细胞对G422细胞的吞噬能力提高了约1.6倍,超过了商业转染试剂siRNA-Mate的效果(图4g,h)。
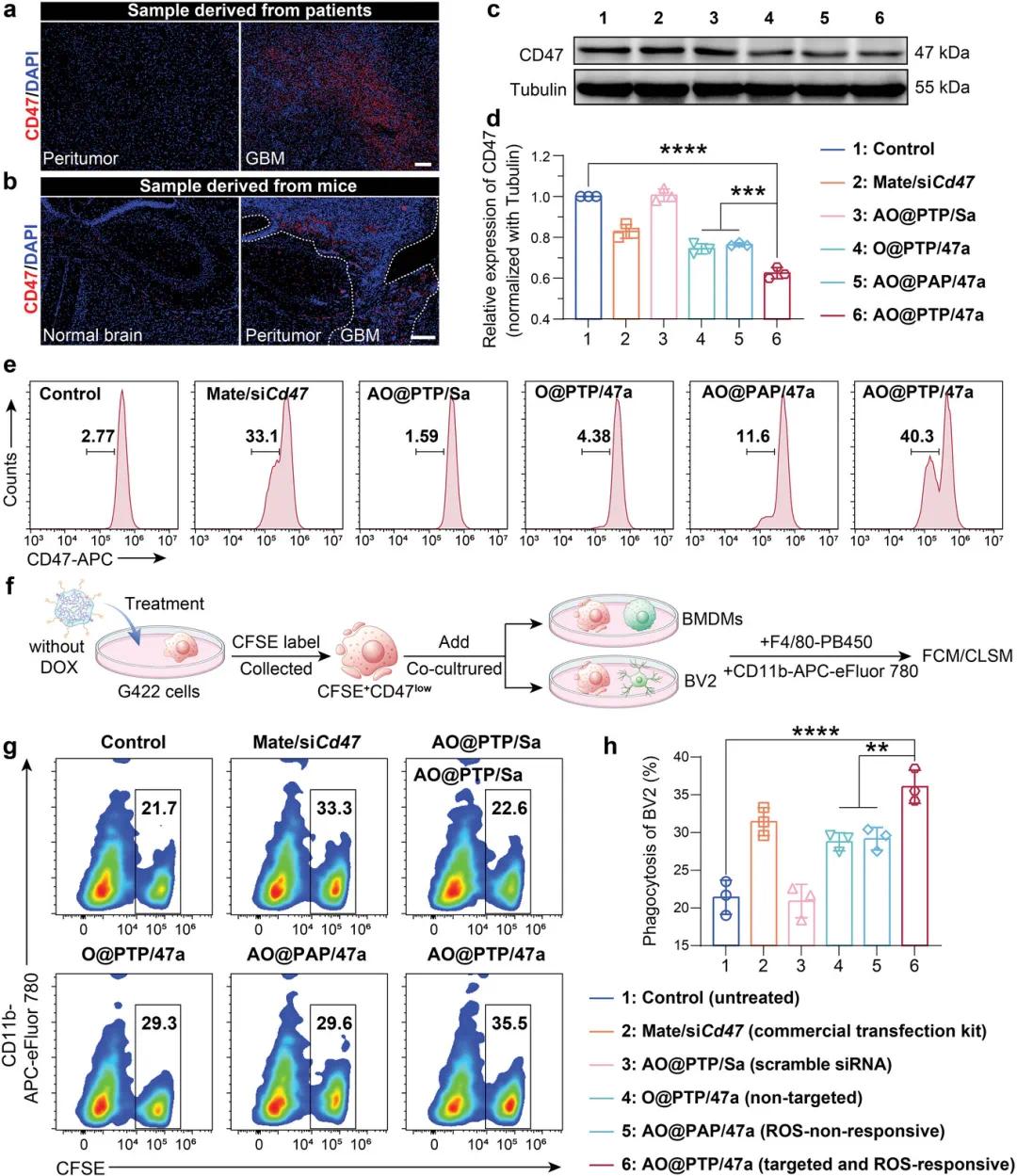
图3 Nanoplatform敲低CD47以促进GAMs的吞噬作用。a,b)来自GBM患者(a)和携带原位GBM的小鼠(b)的瘤周组织和GBM组织之间CD47表达的代表性免疫荧光图像。比例尺=200μm。c,d)不同制剂诱导的CD47敲低的WB分析和相应的半定量结果。e)不同制剂诱导的CD47敲低的FCM分析。f)基于ΔmsbBOMVs的纳米平台促进GAMs吞噬过程的示意图。g,h)不同处理后BV2细胞吞噬作用的FCM分析和相应的半定量结果
(4)纳米平台对GAMS的重编程
尽管ΔmsbBOMV的内毒素含量显著降低,但作为细菌源性物质,它们仍可通过病原体相关分子模式激活免疫系统。此前的研究已证实ΔmsbBOMV可使巨噬细胞恢复。基于此,研究了AO@PTP/47aD是否能逆转GAM的表型,以进一步克服GBM的适应性免疫抗性(图5a)。结果显示,与对照组相比,经ΔmsbBOMV和AO@PTP/47aD处理24小时后,M2样BV2细胞和M2样BMDM的比例降低,而M1样BV2细胞和M1样BMDM的比例显著增加(图5b)。
为探究ΔmsbBOMV启动GAM重编程的潜在机制,重点关注经典的NF-κB通路。Western Blot(WB)分析显示,与对照组和IL-4处理组相比,经LPS和IFN-γ组合处理以及ΔmsbBOMV和AO@PTP/47aD处理的BV2细胞表现出细胞质中p65水平降低和细胞核中p65水平增加(图5d-f)。这一结果证实了NF-κB通路的激活。
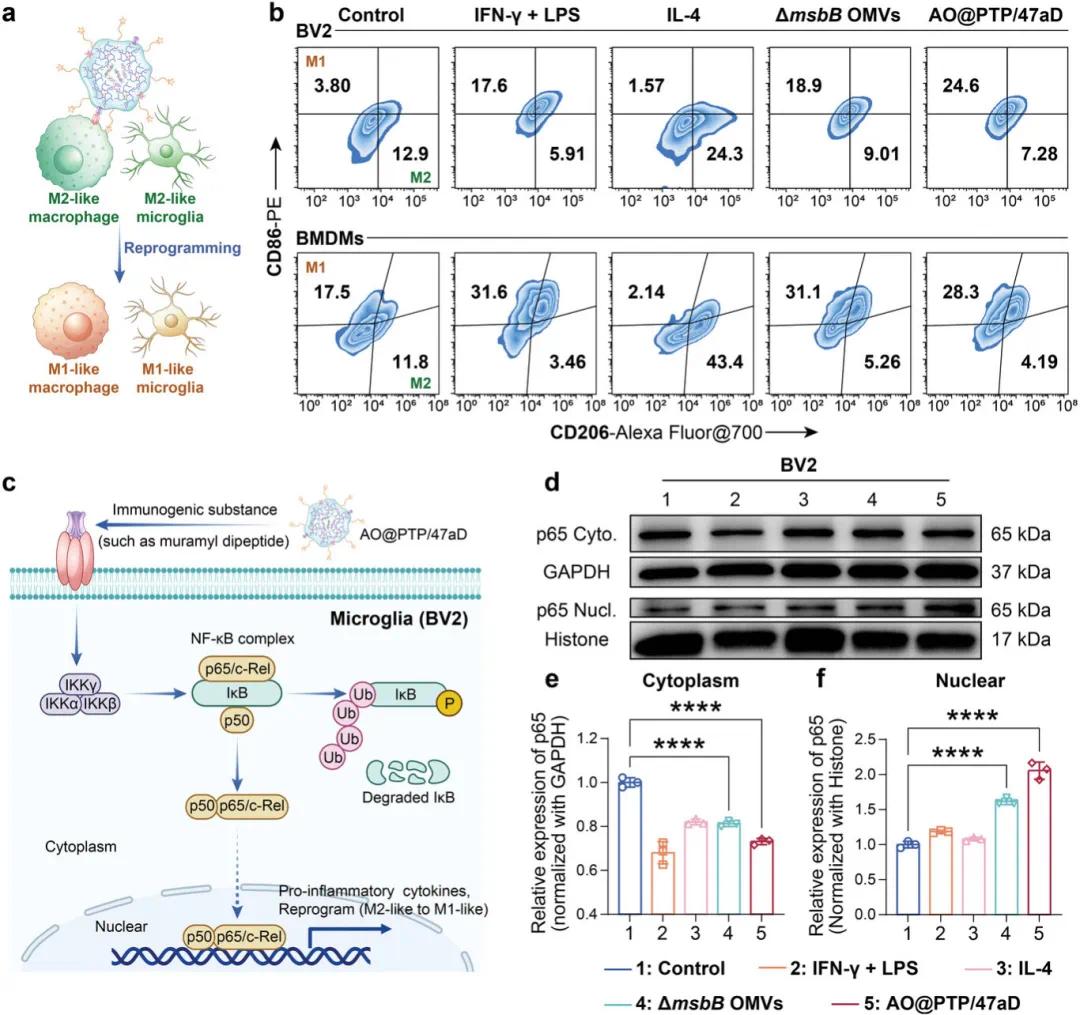
图4 通过纳米平台重编程GAM。a)AO@PTP/47aD重编程GAM的示意图。b)不同处理后BV2细胞和BMDMs重编程的FCM分析。c)AO@PTP/47aD重编程BV2细胞的机制示意图。d-f)不同处理后BV2细胞中细胞质p65和核p65表达的WB分析(d)和相应的半定量结果(e,f)
(5)纳米平台的穿透BBB和GBM靶向能力
首先通过Western Blot(WB)证实LRP1在GBM细胞(G422和GL261)和脑毛细血管内皮细胞(BCEC)中高度表达(图6a),这为基于Angiopep-2的共递送系统在体内穿过血脑屏障(BBB)和靶向GBM提供了基础。随后,使用Transwell构建体外BBB模型,评价其穿过BBB的能力(图6b)。结果表明,AO@PTP/47aD进入下室的渗透是O@PTP/47aD的1.75倍,而游离Angiopep-2的额外存在降低了其BBB渗透能力(图6c)。
随后,进一步探索了其体内靶向GBM的能力。从体内脑内信号变化的角度来看,从尾静脉注射后1小时开始,AO@PTP/47aD在脑内的蓄积明显高于O@PTP/47aD。该差异在注射后8小时进一步增加,并持续至注射后24小时(图6d、e),提示AO@PTP/47aD具有较强的脑靶向性。离体器官成像结果显示,与非靶向组相比,靶向组在脑中的蓄积更多,而在肝脏和肺中的蓄积较少(图6f,g)。因此,Angiopep-2的修饰不仅增强了纳米平台的脑靶向能力,还减少了其在肝脏和肺部的积累,从而最大限度地减少了非特异性分布并减少了脱靶效应。
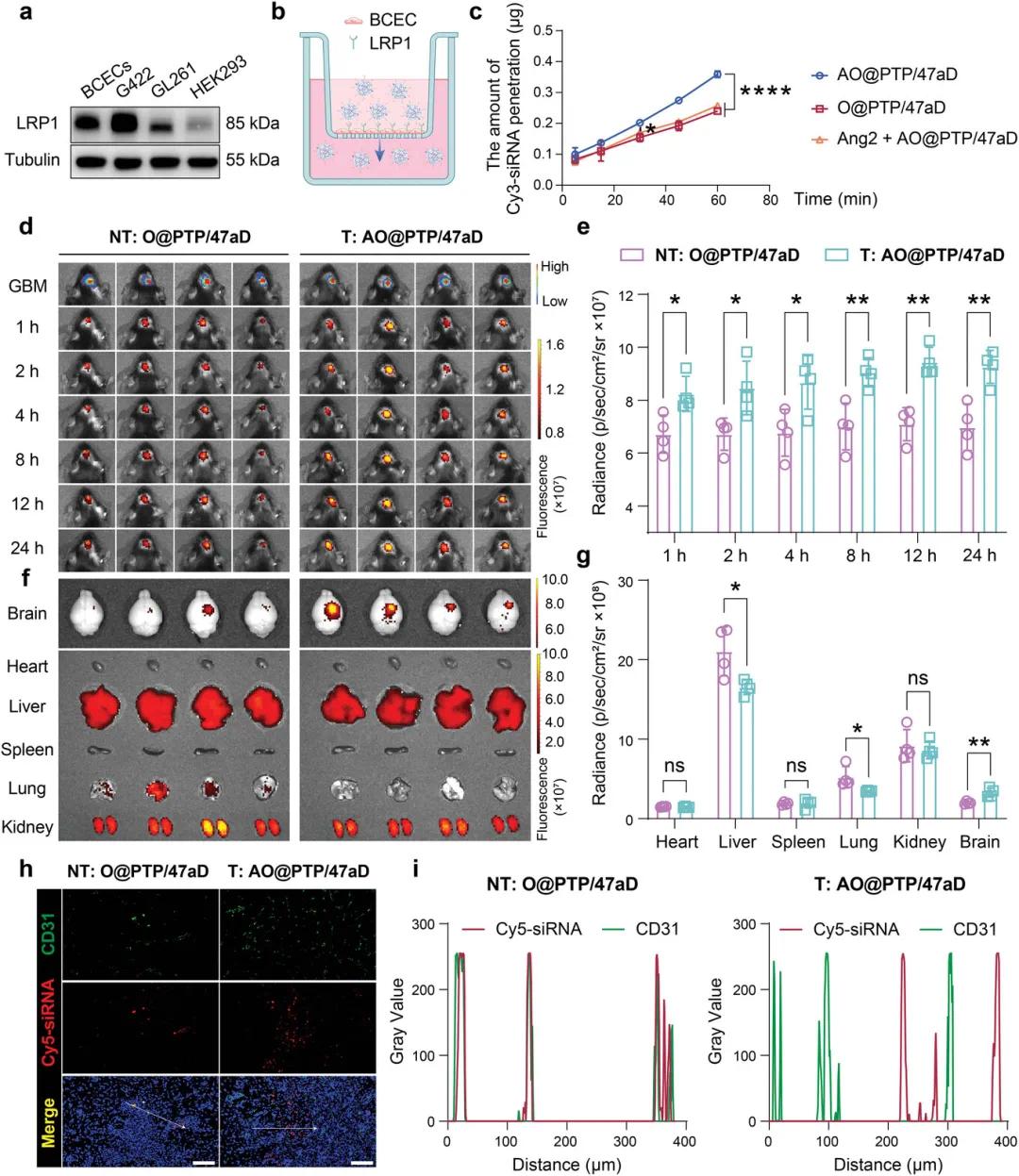
图5 纳米平台穿透BBB并靶向GBM的能力。a)BCECs、G422、GL261和HEK293细胞中LRP1表达的WB分析。b)AO@PTP/47aD穿过体外BBB模型的示意图。c)分析不同制剂在穿越体外BBB中的渗透量随时间的变化。数据以SD±平均值表示(n=3个独立实验)。d,e)AO@PTP/47aD和O@PTP/47aD在不同时间在GBM原位小鼠大脑中积累的代表性IVIS图像和相应的半定量结果。f,g)尾静脉注射后24hAO@PTP/47aD和O@PTP/47aD在主要器官中积累的代表性IVIS图像和相应的半定量结果。h)尾静脉注射后24小时血管标志物CD31和纳米平台在GBM病变区域分布的免疫荧光成像结果(局部区域)。比例尺=100μm。i)CD31和纳米平台在非靶向组和靶向组中的共定位分析
(6)纳米平台的体内抗肿瘤作用
在使用G422-荧光素酶(G422-Luci)构建的C57BL/6原位GBM小鼠模型中探索AO@PTP/47aD的体内抗肿瘤作用。在整个治疗过程中记录小鼠的存活率和体重。如图7b所示,与生理盐水和游离DOX组相比,AO@PTP/47a表现出较弱的肿瘤生长抑制,表明单独调节GAMs在GBM中产生的抗肿瘤作用有限。AO@PTP/SaD显示出一定程度的肿瘤生长抑制,初步表明解决GBM中内在免疫抵抗和适应性免疫抵抗的策略是有效的。此外,在治疗期间,所有小鼠组均表现出体重下降,这可能是由于恶性脑肿瘤的快速增殖。然而,AO@PTP/47aD治疗组的体重减轻有所缓解(图7c)。就存活率而言(图7d),AO@PTP/47a组的中位生存时间为18天,与生理盐水组(15天)相比,未显示出显着的生存获益。随后,我们使用免疫组织化学研究了不同治疗组肿瘤细胞中TUNEL表达。结果表明,AO@PTP/47aD组TUNEL的凋亡信号在对照组中最强(图7e),表明该组中的肿瘤细胞经历了最有效的杀伤。
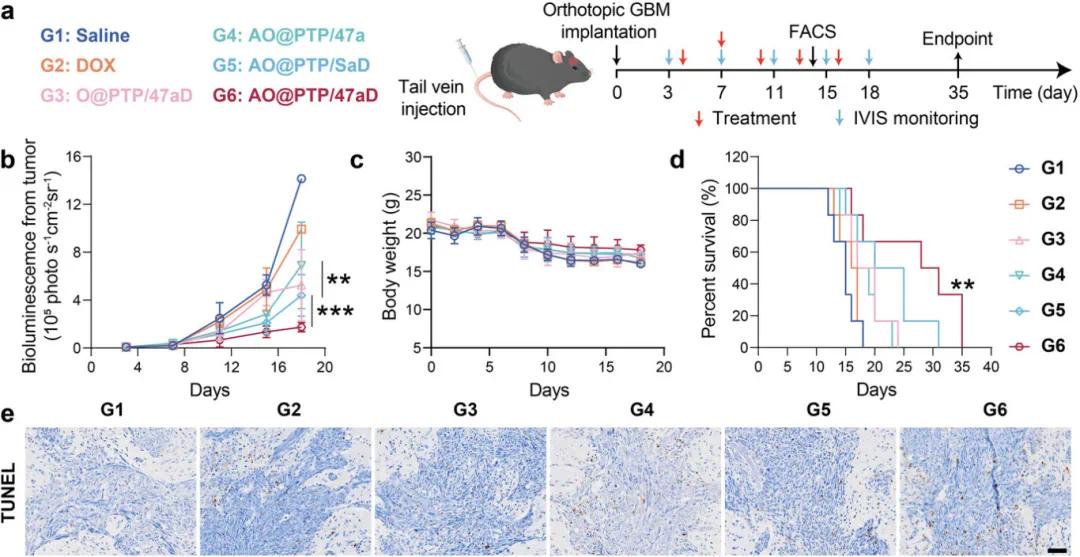
图6 纳米平台的体内抗肿瘤作用。a)原位GBM荷瘤小鼠给药组和方案示意图。b-d)接受指定治疗的原位GBM荷瘤小鼠的平均肿瘤信号生长曲线(b)、体重变化(c)和动物存活率(d)。e)每组中TUNEL表达的免疫组织化学分析。比例尺=50μm
(7)纳米平台的体内抗肿瘤免疫反应
基于AO@PTP/47aD在体内优异的抗肿瘤结果,在体内评估了免疫激活。给药四次后,处死小鼠,解剖和处理其脑组织以制备单细胞悬液。使用Percoll细胞分离溶液和离心,获得富含脑免疫细胞的环层,并通过FCM对免疫细胞进行染色和分析,以评估GBM免疫微环境的整体变化(图8a)。定量FCM结果(图8b-f)显示,AO@PTP/47aD处理后,荷瘤小鼠GBM病灶中成熟DC(CD80CD86)、CD8T细胞(CD3CD8)和M1样GAMs(F4/80CD86)的比例显著增加,而M2样GAMs(F4/80CD206)和调节性T细胞(Tregs,CD25Foxp3)的比例显著降低。这表明GBM中免疫抑制微环境的广泛逆转。随后,使用IF可视化GBM病变部位免疫细胞的分布。与FCM结果一致,G6组CD8T细胞和M1样GAMs的浸润水平显著高于其他对照组,而M2样GAMs和Foxp3Tregs在切片水平上几乎检测不到(图8g-n)。此外,值得注意的是,在G6组中也发现了高水平的颗粒酶B(GZBM),表明AO@PTP/47aD不仅改善了CD8T细胞的浸润,还增强了其活性,以确保其有效的肿瘤杀伤功能(图8o,p)。ELISA来评估GBM部位相关细胞因子的表达。治疗后,G6组诱导的IFN-γ、TNF-α和IL-12水平最高,与CD8T细胞和M1样GAMs的抗肿瘤功能密切相关。相比之下,与M2样GAMs的促肿瘤功能和维持微环境免疫抑制特性相关IL-10和TGF-β的水平最低(图8q-u)。这些结果进一步证实了AO@PTP/47aD全面彻底地激活了大脑中的抗肿瘤免疫反应,将GBM从“冷”肿瘤转变为“热”肿瘤。
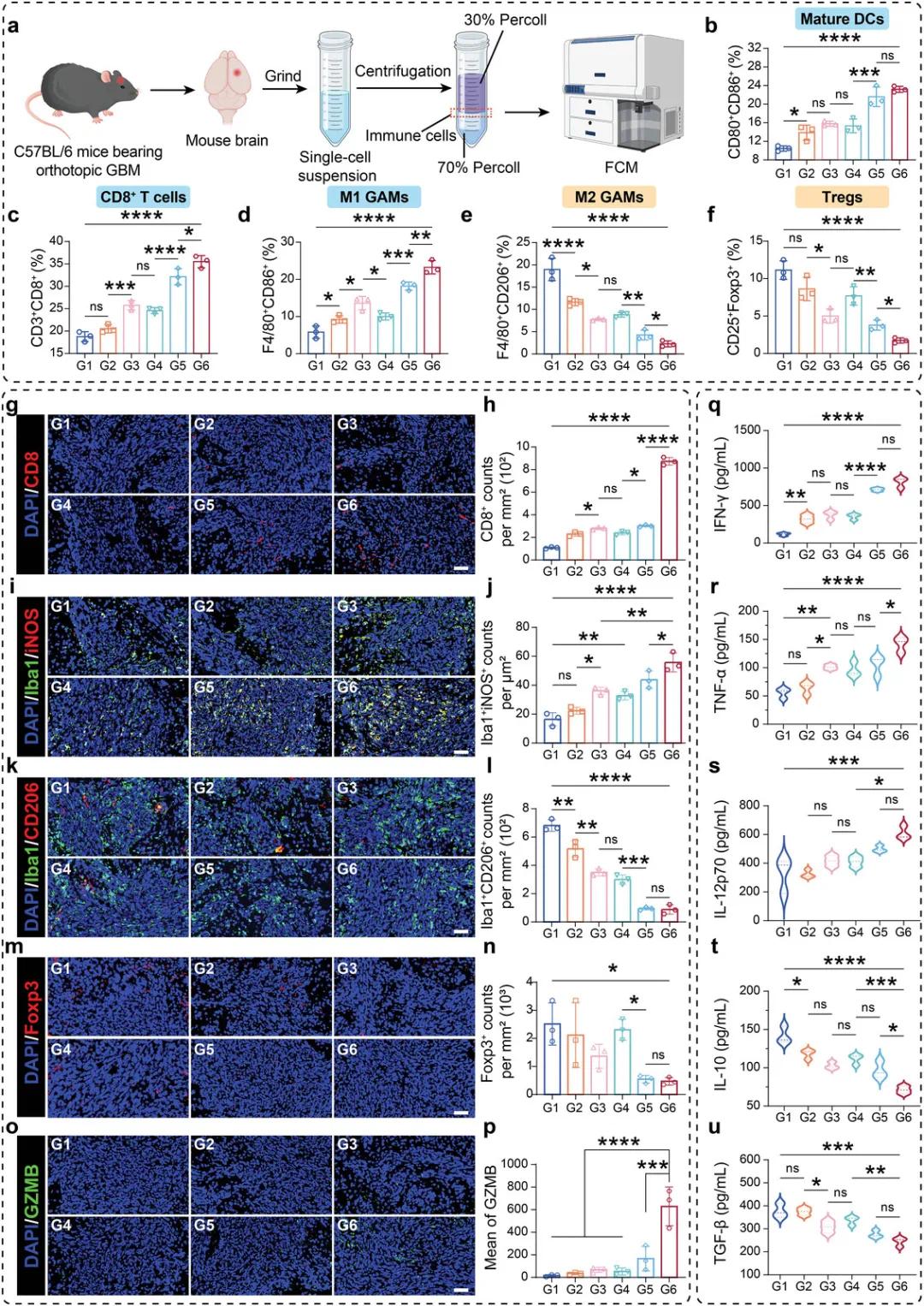
图7 抗肿瘤免疫反应的评估。a)携带原位GBM的C57BL/6小鼠脑组织FCM分析示意图。b-f)荷瘤小鼠大脑中成熟DC(b)、CD8T细胞(c)、M1样GAMs(d)、M2样GAMs(e)和Tregs(f)比例的半定量结果。g、h)5次处理后GBM区域CD8T细胞浸润程度的代表性IF图像(g)和相应的半定量结果(h)。比例尺=50μm。i,j)代表性IF图像经过5次处理后M1样GAMs浸润在GBM区域的程度和相应的半定量结果。k,l)五次处理后GBM区域M2样GAMs浸润程度的代表性IF图像和相应的半定量结果。比例尺=50μm。m,n)五次处理后GBM区域Foxp3Tregs浸润程度的代表性IF图像和相应的半定量结果。比例尺=50μm。o,p)五次处理后GBM区域颗粒酶B表达的代表性IF图像和相应的半定量结果。比例尺=50μm。。q-u)五次治疗后肿瘤问题中IFN-γ(q)、TNF-α(r)、IL-12p70(s)、IL-10(t)和TGF-β(u)含量的半定量结果
(8)体内抗肿瘤作用和免疫反应的机制
AO@PTP/47aD旨在全面破坏GBM的免疫抵抗并增强免疫治疗的疗效。一方面,它通过诱导ICD克服内在免疫抵抗来增强GBM的免疫原性,从而促进DC成熟和T细胞活化。另一方面,它利用siCd47和ΔmsbBOMV精确沉默CD47并重编程GAM,从而克服适应性免疫抵抗,从而增强GAMs对GBM的吞噬能力,使它们分泌大量促炎细胞因子杀死肿瘤细胞(图9a)。因此,这种策略的协同效应可能产生出色的抗肿瘤和免疫激活能力,促使我们验证潜在的机制。给药五次后,处死小鼠,收集脑组织制备组织切片和匀浆。首先,使用IF检查肿瘤组织中CRT的表达。值得注意的是,与其他对照组相比,在用AO@PTP/47aD治疗的肿瘤核心区域观察到强烈而集中的CRT荧光信号(图9b,c),表明GBM的内在免疫抵抗被有效克服。同时,组织WB分析显示AO@PTP/47aD处理组的CRT和HMGB1表达水平最高(图9d-f),进一步证实了这一结论。随后,为评价各治疗组GBM的适应性免疫抵抗能力,使用组织WB定量肿瘤中GAMs表型标志物和CD47的表达。如图9g,h所示,与生理盐水组相比,游离DOX处理后GBM中的CD47水平有所增加。这可能归因于响应化疗引发的免疫效应而上调的特异性免疫检查点。相比之下,其他治疗组的CD47表达显著降低,表明GBM的适应性免疫抵抗被破坏。与CD47表达的变化不同,与G4相比,在G5和G6中观察到M1样GAM标志物(CD86和CD16)的增加更明显,而M2样GAM标志物(CD206和Arg-1)的减少更显着(图9i-l)。这表明,通过克服GBM的内在免疫抵抗,可以进一步破坏适应性免疫抵抗。综上所述,这些结果表明,基于ΔmsbBOMV的纳米平台AO@PTP/47aD通过同时克服GBM中的内在免疫耐药性和适应性免疫耐药性,引发了强大的抗肿瘤免疫反应。
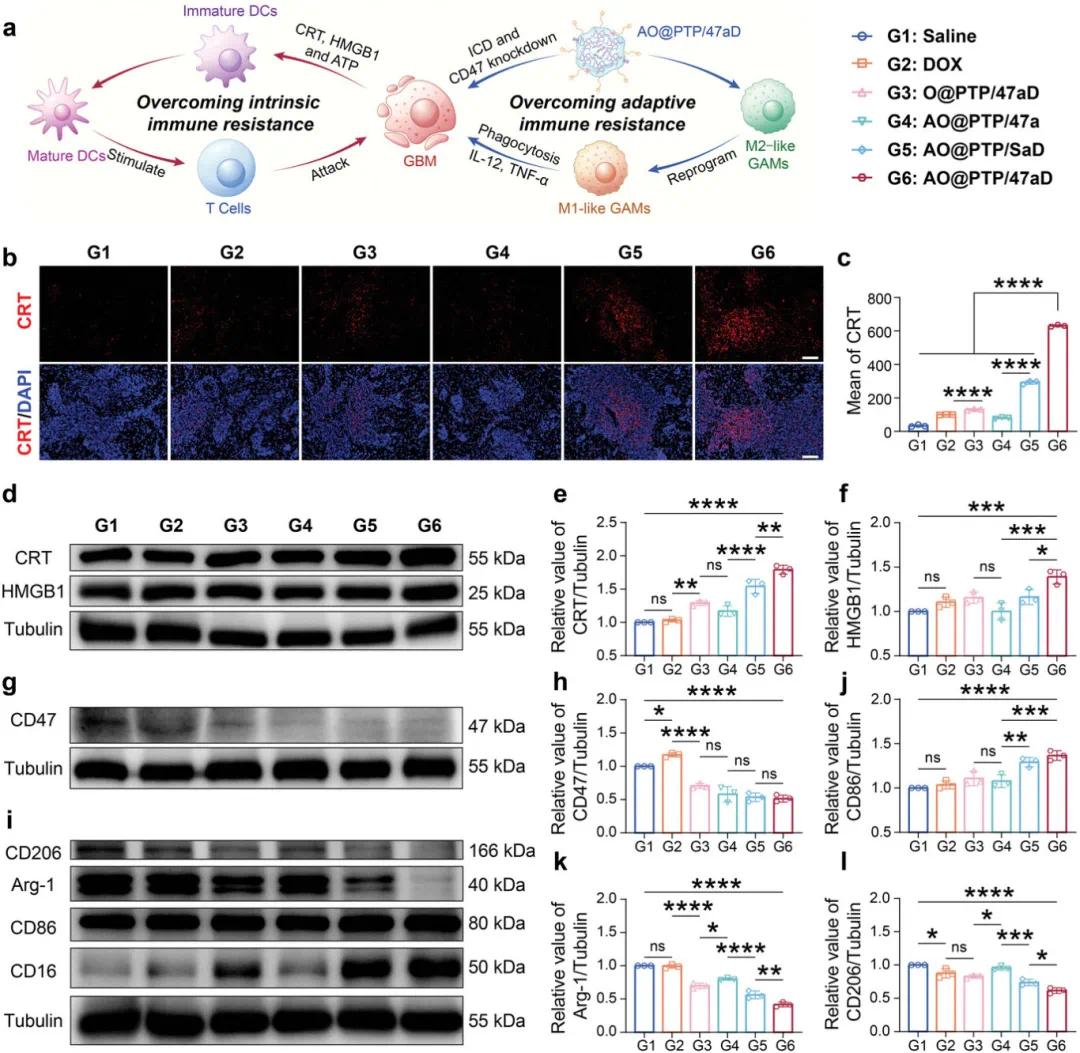
图8 体内抗肿瘤作用和免疫反应激活的机制。a)AO@PTP/47aD克服GBM和适应性免疫抵抗的示意图。b,c)5次处理后GBM区域CRT表达的代表性IF图像和相应的半定量结果。比例尺=100μm。。d)5次治疗后肿瘤组织中CRT和HMGB1表达的WB分析。e,f)5次治疗后肿瘤组织中CRT(e)和HMGB1(f)表达的半定量结果。g,h)WB分析治疗5次后肿瘤组织中CD47表达的相应半定量结果。i)5次治疗后肿瘤组织中CD206、Arg-1、CD86和CD16表达的WB分析。j-l)5次治疗后肿瘤组织中CD86(j)、Arg-1(k)和CD206(l)表达的半定量结果
细菌外膜囊泡 (OMV) 在治疗 GBM 方面具有独特的优势,因为它们具有作为载体和免疫佐剂的多功能特性以及穿过 BBB 的能力。然而,传统的 OMV 会导致毒副作用和 BBB 中紧密连接的破坏。因此,为了提高 OMV 的体内安全性和靶向能力,该研究团队引入了工程化 OMV 来降低毒性,并通过进行简单的肽修饰进一步构建了模块化组装的纳米平台。 该纳米平台表现出令人满意的生物安全性,并且能够在 Angiopep-2 的帮助下连续穿过 BBB 并靶向 GBM。随后,OMV 上的免疫原性物质以及携带的小干扰 RNA (siRNA) 和阿霉素可以分别促进和增强巨噬细胞和小胶质细胞的重编程和吞噬能力,增加 GBM 的免疫原性,最终克服 GBM 免疫抵抗,增强免疫治疗的疗效。这种基于 OMVs 的纳米平台为 GBM 免疫疗法的发展提供了新的范式和见解。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

