
研究背景:
胶质母细胞瘤(GBM)是中枢神经系统中最具侵袭性的恶性脑肿瘤,标准治疗包括手术、化疗和放疗。然而,GBM的浸润性生长常导致手术无法完全切除,且手术会破坏肿瘤免疫微环境,延缓化疗并促进复发。术后空腔为肿瘤复发提供空间,血脑屏障则阻碍药物和免疫细胞的递送,给术后治疗带来巨大挑战。
代谢重编程在肿瘤细胞的增殖和侵袭中起关键作用,癌细胞通过代谢产物与免疫细胞交流,调节细胞代谢可重塑免疫微环境。谷氨酰胺代谢在癌细胞中尤为重要,靶向谷氨酰胺代谢可影响免疫细胞功能,增强免疫治疗效果。然而,单药治疗受限于肿瘤异质性和药物递送难题。

针对上述问题,中国科学院大学李俊柏教授团队开发了一种针对胶质母细胞瘤(GBM)术后治疗的创新策略,构建了一种原位可注射的肽水凝胶系统,负载谷氨酰胺酶抑制剂CB-839和铜离子-肽配位纳米颗粒(Cu-His NPs)用于化学动力治疗(CDT)。该系统通过抑制谷氨酰胺代谢,降低肿瘤细胞内谷胱甘肽(GSH)水平,从而增强CDT的细胞毒性,同时诱导免疫原性细胞死亡(ICD)以激活免疫反应对抗肿瘤微环境。研究中使用的短肽水凝胶由Fmoc-YYK和Fmoc-YD自组装形成,具有优异的生物相容性和低免疫原性,能够填充术后空腔,物理限制肿瘤增殖,并通过调节降解实现药物的可控释放。实验结果表明,这种基于代谢重编程的联合治疗策略能够有效抑制GBM复发,并显著延长小鼠的总生存期,为GBM术后治疗提供了一种新的解决方案。该文章于2025年2月20日以《Immunostimulatory Hydrogel with Synergistic Blockage of Glutamine Metabolism and Chemodynamic Therapy for Postoperative Management of Glioblastoma》为题发表于《Advanced Science》(DOI:10.1002/advs.202412507)。
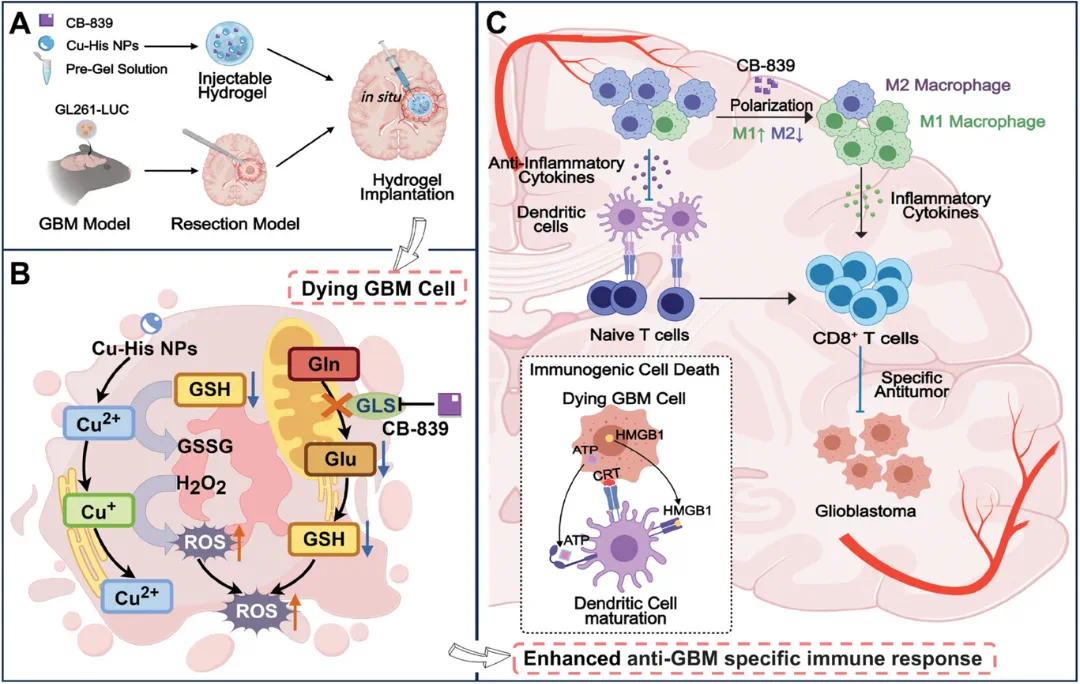
研究示意图
(1)复合凝胶的合成与表征
本研究成功制备了负载Cu²⁺-肽纳米粒子(Cu-His NPs)和谷氨酰胺酶抑制剂CB-839的可注射肽水凝胶(组合凝胶)(图1A)。采用带正电荷的Fmoc-YYK和带负电荷的Fmoc-YD短肽分子,通过静电和π-π相互作用构建水凝胶支架。Cu-His NPs作为CDT发生器,通过组氨酸的咪唑基团与Cu²⁺配位,实现Cu²⁺在肿瘤微环境中的靶向释放。其SEM图像(图1B)和HRTEM图像(图1C)显示,Cu-His NPs为直径约40 nm的球形颗粒,且X射线光电子能谱(XPS)结果表明Cu²⁺与肽链内氮或氧原子形成配位键(图1D)。电子探针微分析(EPMA)进一步证实Cu²⁺在样品中的均匀分布(图1E)。Cu-His NPs和CB-839被封装于水凝胶中,扫描电子显微镜(SEM)图像显示其在纤维基质中均匀分散(图1F),且凝胶具有优异的注射性(图1G)。通过调整短肽分子组装,制备了与脑组织机械性能(1–2 kPa)相匹配的凝胶支架(图1H),并验证其生物相容性(图1I)。
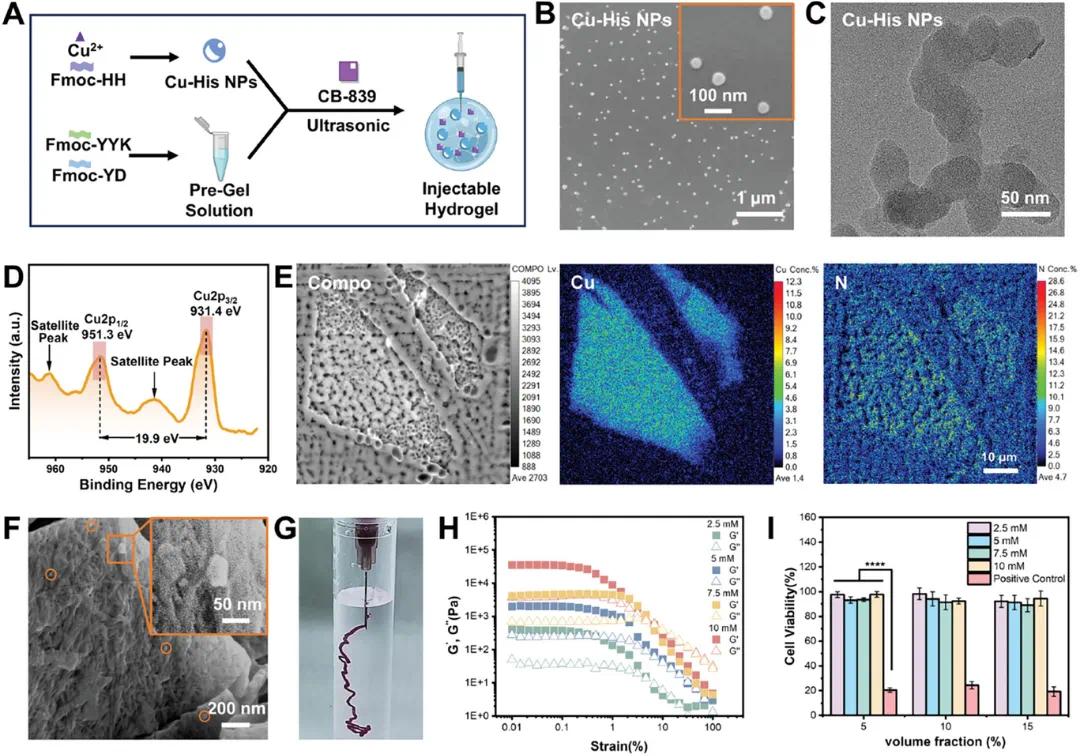
图1 可注射水凝胶Combo Gel的特性。(A)Combo Gel制备的示意图;(B)Cu-His NPs的SEM图像;(C)Cu-His NPs的HRTEM图像;(D)Cu-His NPs和Fmoc-HH的XRD光谱,黑色箭头指示卫星峰的位置;(E)通过EPMA检测的Cu-His NPs的COMPO图像以及Cu、N元素分布图像;(F)Combo Gel的SEM图像;(G)通过22号针头将Combo Gel注入水中时,立即形成稳定的凝胶;(H)在37°C下,Fmoc-YD/YYK水凝胶在不同浓度下的幅度扫描曲线,实验重复了三次;(I)与阳性对照组相比,不同浓度的Fmoc-YD/YYK水凝胶的生物相容性,Fmoc-YD/YYK是指Fmoc-YD和Fmoc-YYK的1:1混合物,n=3
(2)水凝胶的体外抗肿瘤研究
Cu²⁺可与谷胱甘肽(GSH)发生氧化还原反应,生成Cu⁺和氧化型谷胱甘肽(GSSG)。SEM分析显示,Cu-His NPs在与GSH反应5分钟后即失去球形完整性(图2A),表明反应动力学极快。这证实了Cu-His NPs在GSH存在下可降解并产生Cu⁺和GSSG。亚甲蓝(MB)的紫外吸收峰可用于检测羟基自由基(·OH)的生成。图2B显示,MB单独与H₂O₂反应或与Cu-His NPs和GSH混合时,4小时内紫外吸收峰变化较小;而当MB、H₂O₂、Cu-His NPs和GSH共同存在时,紫外吸收峰显著变化。这表明在GSH存在下,Cu²⁺与H₂O₂的类芬顿反应可高效产生·OH,从而靶向破坏肿瘤细胞。
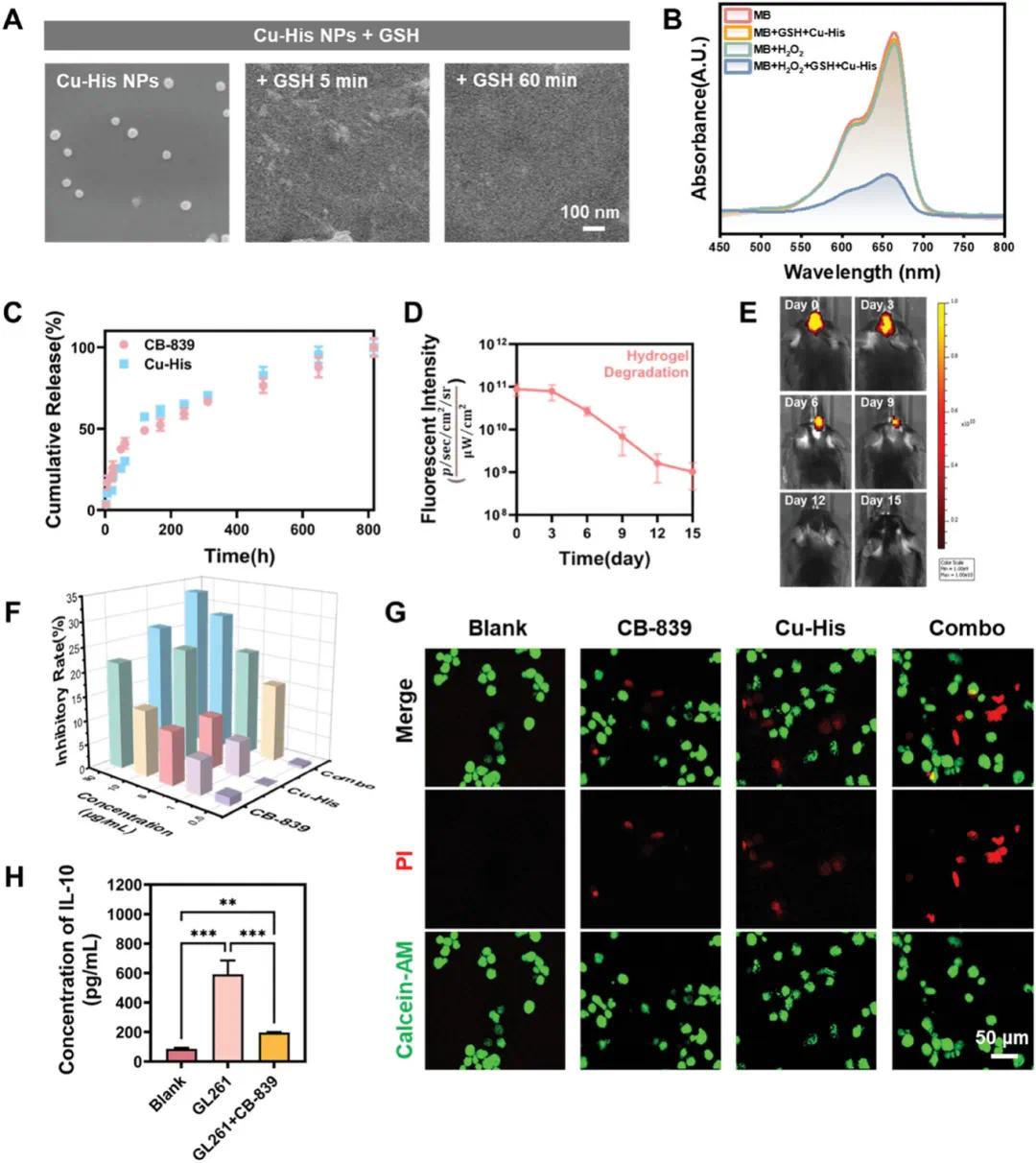
图2 铜-组氨酸纳米颗粒的CDT机制,以及铜-组氨酸纳米颗粒和CB-839在体外的协同细胞毒性作用,以及水凝胶延长药物局部滞留和释放的能力。(A)在不同时间间隔下,铜-组氨酸纳米颗粒与GSH混合的SEM图像;(B)4小时反应后MB的降解证实了Cu⁺与H₂O₂之间的类芬顿反应,产生·OH,;(C)水凝胶中铜-组氨酸纳米颗粒和CB-839的累积释放曲线;(D)定量分析了水凝胶在小鼠大脑中的降解;(E)使用IVIS系统在特定时间点捕获老鼠大脑中水凝胶滞留的荧光图像,水凝胶用Cy5标记以进行追踪;(F)在24小时孵育后,评估了铜-组氨酸纳米颗粒和CB-839对GL261细胞系的抑制作用;(G)GL261细胞在暴露于铜-组氨酸纳米颗粒和CB-839 12小时后的活/死染色;(H)体外免疫串扰实验,每个分级的上清液与巨噬细胞共培养后,通过巨噬细胞检测IL-10分泌
Cu-His NPs在水凝胶中释放12小时后保持球形结构。Cu-His凝胶和CB-839凝胶浸泡于37°C的PBS中,5天后Cu-His NPs和CB-839释放量分别为57%和49%,20天后均达80%(图2C)。两种药物遵循零级释放动力学,表明水凝胶有效维持药物释放,延长滞留时间。药物释放速率与水凝胶体积损失同步,主要依赖于水凝胶降解。体内实验中,组合凝胶注入小鼠大脑后,通过IVIS系统监测Cy5标记的水凝胶信号(图2D, E),表明水凝胶在小鼠颅腔内迅速发生溶胶-凝胶转变,有效防止药物快速释放。
使用CCK-8试剂盒检测GL261胶质瘤细胞系在Cu-His NPs、CB-839单独或联合处理24小时后的细胞抑制率(图2F)。结果显示,联合治疗的细胞抑制率显著高于单药处理,10 µg/mL联合药物浓度下抑制率达27%。活/死细胞染色实验也证实了联合治疗的协同作用(图2G)。通过ELISA检测与GL261细胞系上清液共培养的RAW264.7巨噬细胞分泌的IL-10水平(图2H)。GL261细胞系上清液使巨噬细胞IL-10分泌增加约7倍,而CB-839处理后的GL261细胞系上清液诱导的IL-10水平显著降低,约为对照组的2倍(195.9 pg/mL),表明CB-839可重新编程肿瘤细胞中的谷氨酰胺代谢,减少巨噬细胞向M2表型的极化。
(3)细胞对Cu-His NPs的摄取以及通过协同治疗增强ROS生成和ICD效应
Cu-His NPs与GSH相互作用时发出紫色-红色荧光。为可视化Cu-His NPs的细胞内释放过程,使用Lysotracker Red标记溶酶体,并与标记有Cy5的Cu-His NPs(蓝色荧光)共定位(图3A)。孵育4小时后,Cu-His NPs的荧光几乎完全与溶酶体荧光重叠,显示黄色荧光,表明Cu-His NPs在胞吞后被隔离在溶酶体中,并部分逃逸到细胞质中。这证实了Cu-His NPs在细胞内可逃逸至溶酶体并释放药物,增强细胞内功效。其机制可能涉及组氨酸在溶酶体酸性环境中的质子化及其电荷变化,促进其与溶酶体膜的相互作用并实现逃逸。
过量的活性氧(ROS)会破坏肿瘤细胞的氧化还原平衡,诱导损伤或死亡,并触发免疫原性细胞死亡(ICD),释放损伤相关分子模式(DAMPs),激活抗原呈递细胞(如树突状细胞),从而刺激免疫系统。谷胱甘肽(GSH)对抵抗ROS引起的氧化应激至关重要,其水平与ROS呈负相关,GSH减少可能导致ROS积累和细胞死亡。该研究评估了不同配方对GL261细胞中GSH和GSSG水平的影响。结果显示,CB-839和Cu-His NPs单独处理可将GSH水平分别降低至19.0 µM和11.7 µM,而联合使用时,GSH水平进一步降低至8.2 µM(图3B)。随后,通过DCFH-DA染色监测治疗后肿瘤细胞的ROS产生,发现联合治疗组的ROS产生最高,荧光强度显著增加(图3D)。此外,与ICD相关的DAMPs,如表面钙网蛋白(CRT)、高迁移率族蛋白1(HMGB1)和ATP,在细胞死亡过程中被释放。其中,ATP发出“find-me”信号,促进凋亡细胞的吞噬并触发抗肿瘤免疫反应;CRT作为“eat-me”信号,增强树突状细胞对凋亡细胞的吞噬,促进其成熟和功能;HMGB1则激活免疫信号通路并放大免疫反应。实验结果表明,联合治疗组肿瘤细胞中CRT、HMGB1和ATP的表达显著高于单药治疗组(图3C、E、F)。这表明联合治疗不仅通过促进胶质母细胞瘤(GBM)细胞释放DAMPs增强ICD,还显著放大了免疫反应,显示出持久抗肿瘤免疫的潜力,为癌症治疗提供了一种有希望的方法。
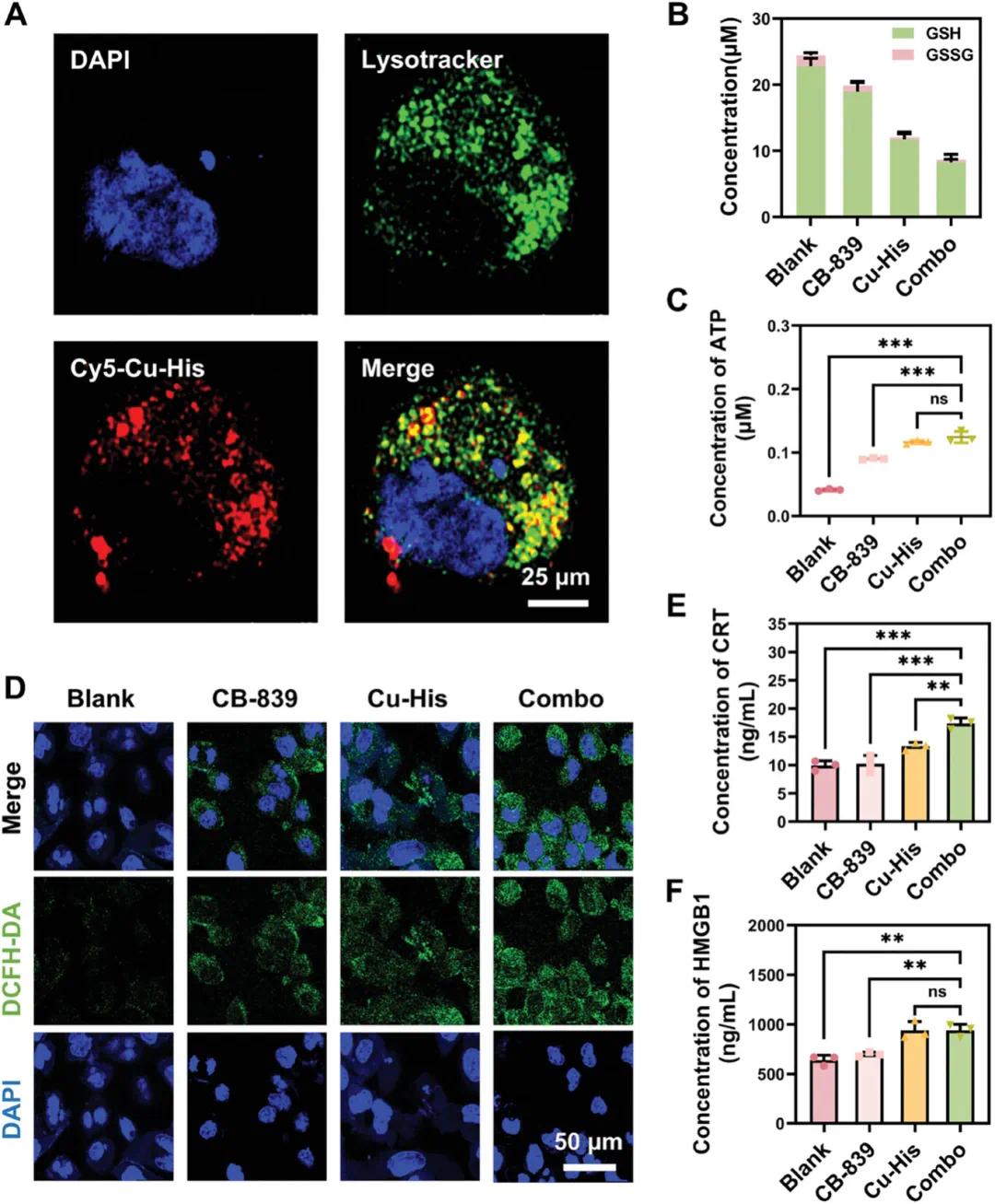
图3 细胞对Cu-His NPs的摄取以及通过协同治疗增强ROS生成和ICD效应。(A)2小时Cu-His NPs处理后GL261细胞的共聚焦显微镜图像,细胞核用DAPI染成蓝色,溶酶体用Lysotracker染成绿色,Cy5标记的Cu-His NPs呈红色荧光;(B)GBM细胞在24小时暴露于药物后细胞内GSH和GSSG水平的量化;(C)24小时治疗后GBM细胞内ATP水平的测量;(D)与药物孵育4小时后GBM细胞中的ROS染色荧光,用DAPI染成蓝色的细胞核和DCFH-DA染成绿色的ROS进行可视化;(E)药物处理后24小时GBM细胞释放CRT和(F)HMGB1,数据以平均值±标准差表示
(3)水凝胶的体内抗肿瘤研究
胶质母细胞瘤(GBM)的浸润性生长往往导致肿瘤边界不清晰,使得完全手术切除变得困难,并导致术后频繁复发。利用 Luc-GL261 细胞成功建立了原发 GBM 模型(图 4A,B;图 S20,支持信息)。选择肿瘤生长相似的鼠,并在接种 Luc-GL261 细胞后的第七天进行切除(图 4C)。小鼠分别接受 PBS、空白 Fmoc-YD/YYK 水凝胶(空白凝胶)、CB-839 水凝胶(CB-839 凝胶)、Cu-His NPs 水凝胶(Cu-His 凝胶)、自由 CB-839 和 Cu-His NPs(自由组合)或 CB-839 和 Cu-His NPs 水凝胶(组合凝胶)的治疗。通过监测生物发光信号追踪肿瘤复发,并在整个研究过程中记录小鼠的体重和存活率。接受 PBS 治疗的小鼠由于缺乏药物干预,经历了 GBM 的快速复发和随后的体重下降。自由组合组最初体重下降,可能是由于高剂量药物的快速释放。 与对照相比,CB-839 凝胶、Cu-His 凝胶和组合凝胶组体重变化最小,表明药物负载水凝胶能有效抑制 GBM 生长,且无明显毒副作用(图 4D)。选择生物发光强度在 10 6 和 10 7 之间的术后小鼠进行手术,并在第 8 天通过重新监测生物发光来确认手术的成功。 40 每隔 7 天监测肿瘤生物发光,直到 PBS 组的小鼠数量降至三个以下。组合凝胶组对 GBM 生长的抑制作用最为显著,在所有监测点中具有最低的荧光素酶强度(图 4E,G)。Kaplan-Meier 生存曲线显示,组合凝胶处理组的平均生存时间显著延长至 48 天,超过了 PBS 组的 27 天、空白凝胶组的 28 天、CB-839 凝胶组的 33 天、Cu-His 凝胶组的 35 天和自由组合组的 30 天(图 4F)。图 4H 显示了术后两周切除和原位给药的各种治疗方法的 H&E 染色脑组织切片。 与对照组相比,接受组合凝胶治疗的鼠表现出最小的肿瘤面积,表明其在预防肿瘤复发方面的优越疗效。总之,实验结果表明,结合谷氨酰胺代谢调节与 CDT 的组合凝胶治疗提供了卓越的治疗效果。它有效地抑制了 GBM 肿瘤的复发,延长了小鼠的中位生存期,并在体内诱导了全身抗肿瘤免疫。

图4 肿瘤切除后正位GBM模型中不同治疗方法的抗肿瘤复发疗效。(A)动物研究时间线示意图;(B)不同时间点正位Luc-GL261 GBM小鼠的T2加权MRI图像,实验重复了三次,肿瘤区域用橙色勾勒;(C)在第7天肿瘤植入后对小鼠进行正位Luc-GL261细胞的手术减瘤,肿瘤区域用橙色勾勒;(D)治疗后小鼠体重变化;(E)随时间变化的肿瘤生物发光,数据以平均值±标准误表示;(F)不同治疗方法后小鼠的生存曲线;(G)治疗组中Luc-GL261肿瘤生物发光信号的时序变化(部分数据),数据以平均值±标准误表示;(H)手术切除和原位药物治疗两周后,获取小鼠脑切片进行H&E染色组织学分析,实验重复了三次
(4)组合凝胶的体内肿瘤免疫效应研究
ROS诱导的细胞焦亡与DAMPs(如HMGB1和CRT)的产生密切相关。图5A显示,在手术切除后两周,组合凝胶组在大脑中CRT和HMGB1的荧光信号最强,尤其是HMGB1表达显著上调,促进了体内树突状细胞(DC)的成熟。相比之下,CB-839凝胶组DAMPs表达较低,表明Cu-His NPs在肿瘤细胞内产生的过量ROS是增强细胞焦亡的主要原因。肿瘤细胞与免疫细胞的代谢竞争影响抗肿瘤免疫治疗。肿瘤细胞对谷氨酰胺的高需求(“谷氨酰胺成瘾”)可通过GLS1抑制剂CB-839进行调节,从而减少肿瘤细胞对谷氨酰胺的消耗,为免疫细胞提供营养,增强其抗肿瘤功能。代谢重编程不仅抑制肿瘤细胞增殖,还影响免疫细胞功能,打破代谢循环与免疫微环境之间的通信网络。CB-839是一种GLS1抑制剂,可减少肿瘤细胞对谷氨酰胺的消耗,促进T细胞增殖和细胞因子产生,并影响巨噬细胞极化。流式细胞术分析显示,CB-839凝胶组和组合凝胶组的M1型肿瘤相关巨噬细胞(TAM)比例显著增加,M1/M2 TAM比率分别达到23.6±1.0和23.1±1.5,是PBS组(5.0±0.4)的4.6倍(图5B-H)。这表明CB-839可诱导M2型TAM向M1型极化,重塑肿瘤免疫微环境。尽管组合凝胶组中M2 TAM数量变化不大,但其向更具免疫活性的表型转变是显著的。
组合凝胶组的活化树突状细胞(DC)百分比显著高于其他组,局部复发肿瘤组织中的DC细胞计数比PBS组增加了十二倍(图5E, I),表明免疫抑制性微环境有所改善。此外,组合凝胶处理的肿瘤中CD8⁺T细胞浸润显著增加(图5F, J),而Cu-His凝胶组也有类似效果(图5K)。相比之下,缺乏凝胶支架的Free Combo组效果减弱,表明组合凝胶的持续药物释放促进了T细胞浸润,重塑了肿瘤免疫微环境。
通过ELISA分析小鼠脑组织匀浆中的细胞因子,组合凝胶组表现出促炎细胞因子(TNF-α、IFN-γ和IL-6)水平升高,而抗炎细胞因子IL-10水平降低(图5L-O)。TNF-α和IFN-γ的表达分别比PBS组增加了1.4倍和2.4倍,而IL-6的表达是PBS组的2.4倍。这些结果表明,组合凝胶通过增加促炎细胞因子和抑制抗炎细胞因子,调节免疫细胞功能,增强T细胞浸润和TAM极化,引发免疫反应。
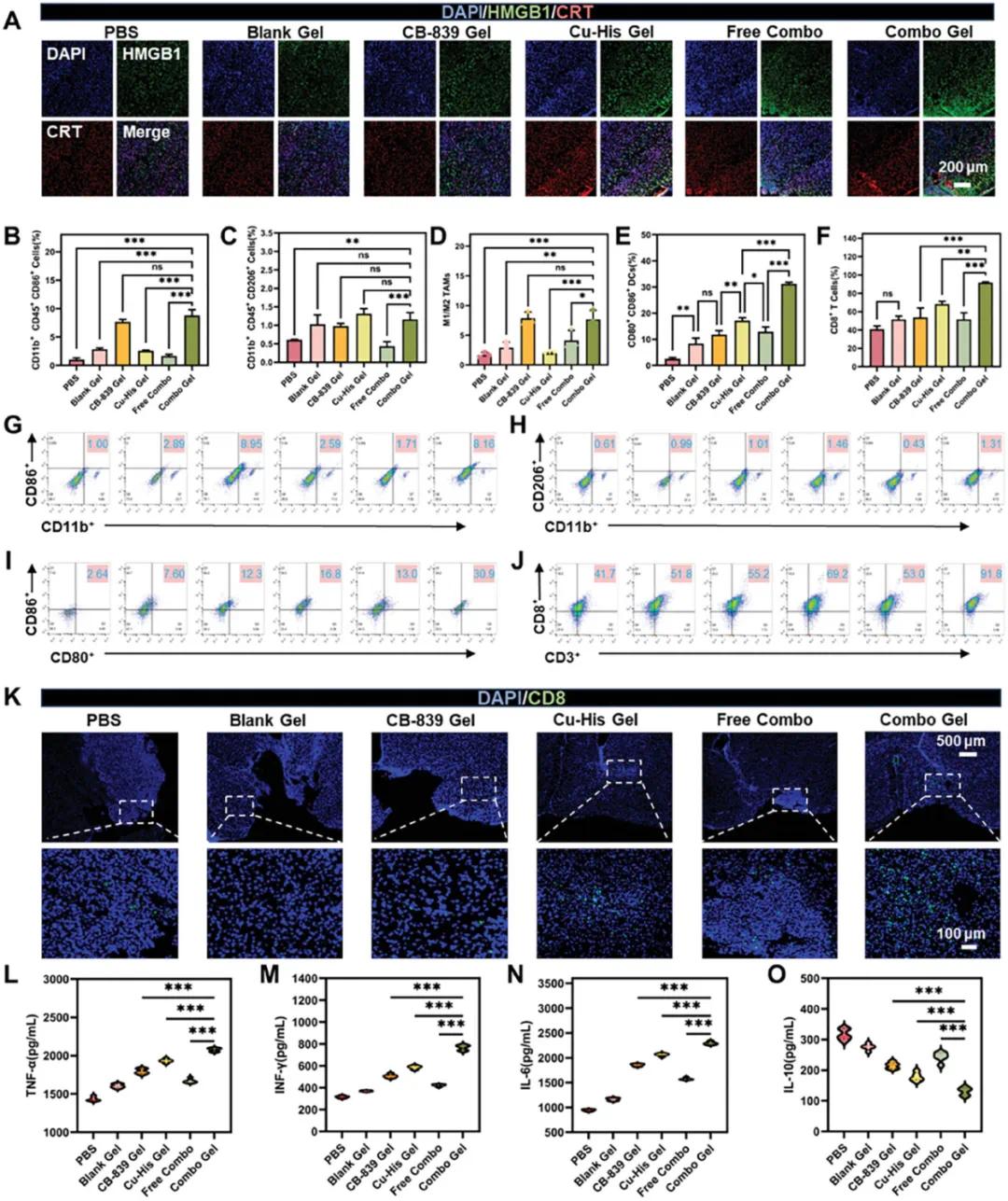
图5 激活治疗后使用不同药物的抗肿瘤免疫。(A)HMGB1和CRT的免疫荧光分析;(B)流式细胞术分析小鼠脑组织中切除后两周及原位给药的M1型TAMs;(C)M2型TAMs;(D)M1/M2 TAMs比例;(E)成熟DCs;(F)CD8 T细胞。流式细胞术量化各组脑组织中浸润的(G)M1型TAMs;(H)M2型TAMs;(I)成熟DCs;(J)CD8 T细胞;(K)小鼠肿瘤组织中CD8 T细胞浸润的免疫荧光分析;ELISA量化每组小鼠脑组织匀浆中的(L)TNF-α;(M)IFN-γ;(N)IL-6;(O)IL-10
原发性胶质母细胞瘤治疗难在血脑屏障会阻挡药物进入大脑,手术切除是常规方法。该研究把治疗和手术结合,在切除处用药物水凝胶,让药物在颅腔集中、持续输送,减缓复发。该研究开发出原位肽凝胶注射免疫治疗策略,能满足术后治疗要求,还能靠代谢重编程增强化疗动力学治疗。这种水凝胶能填充不规则腔隙,可合成Cu-His纳米颗粒产生活性氧破坏肿瘤细胞,同时CB-839抑制药效,协同增强氧化应激。Cu-His纳米颗粒能放大细胞焦亡,CB-839调节代谢途径极化巨噬细胞,二者一起调节免疫微环境,增强免疫反应,让局部免疫微环境长期改善。结果表明,这种联合凝胶治疗系统效率高,很有临床应用潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

