
随着全球人口老龄化,心血管疾病已成为全球死亡的首要原因。血管内膜增生是最常见且严重的病理状态之一,其特征是动脉壁平滑肌细胞过度增殖和迁移,导致血管狭窄和血流紊乱,从而增加心血管并发症的风险。传统的药物治疗通常用于解决内膜增生问题,然而这些方法通常未直接作用于内膜增生的细胞机制,因此治疗效果有限。
基因疗法已逐渐成为治疗心血管疾病的有效方法。在各种基因治疗载体中,重组腺相关病毒(rAAVs)由于安全性高、免疫原性低、稳定性好且表达持久,被广泛应用于基因递送。然而,目前大部分rAAVs的递送方式是全身给药,不仅效率较低,还可能引起全身性的不良反应。此外,通过血流靶向动脉的方法存在不足之处,由于血流速度过快,病毒载体在血管壁细胞感染的时间不足。同时,内膜增生形成的屏障降低了病毒载体在平滑肌层的转导效率,血液中存在的中和抗体也可能严重影响治疗效果。因此,目前迫切需要一种高效、便捷的药物递送方法,以实现对患病血管的局部基因递送。

针对上述问题,南京大学医学院附属医院周敏团队开发了一种响应式的载有rAAVs的微针贴片(AMNP),用于治疗内膜增生,实现血管周围的基因递送。这些补片主要由生物相容性明胶组成,尖端内嵌 rAAVs 用于血管周围基因递送,后层混合多巴胺用于粘附和响应。得益于多巴胺成分,补片不仅实现了与血管内膜的紧密附着,还延长了用于基因治疗的 rAAVs 的转染时间。通过 rAAVs 过表达 miR-145 可以调节平滑肌细胞的表型,从而缓解血管内膜增生。基于这些特点,在大鼠颈动脉模型中评估了 AMNP 的实用性,结果表明 AMNP 能够有效抑制或潜在逆转内膜增生的进展。这些结果表明,AMNP 很有希望成为治疗各种血管疾病的方法,因此具有广阔的临床应用前景。该文章于2024年11月15日以《Multifunctional Microneedle Patches for Perivascular Gene Delivery and Treatment of Vascular Intimal Hyperplasia》为题发表于《ACS Nano》(DOI: 10.1021/acsnano.4c09527)。
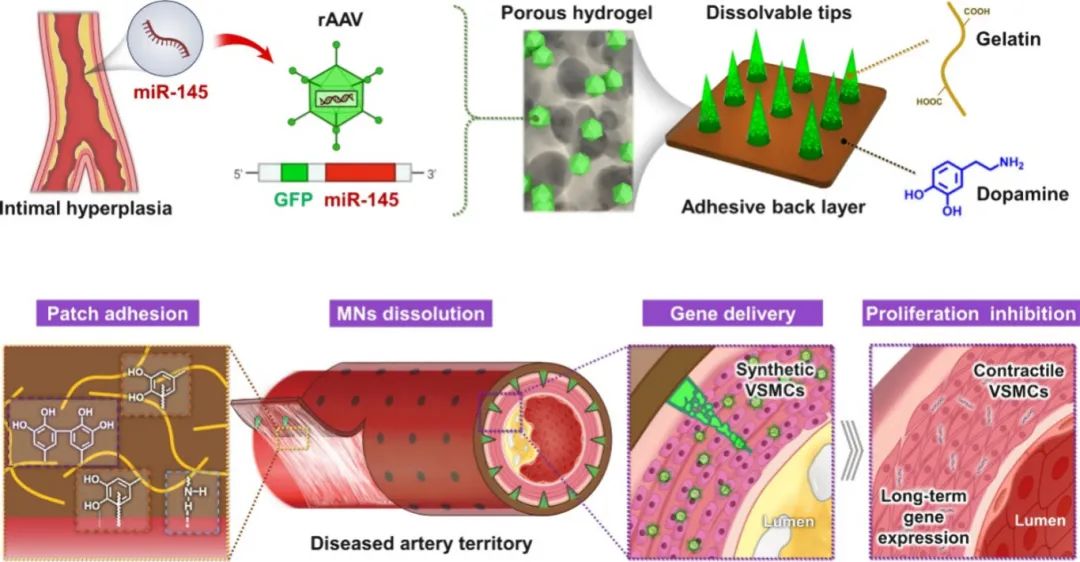
研究示意图
(1)微针贴片的制备和表征
图1a呈现了明胶微针贴片的制备过程:首先,含有rAAVs的明胶溶液被加入模具中,并通过离心作用富集到微针尖端;随后,加入掺杂不同浓度多巴胺(DA)的明胶溶液以形成背衬层;最后,经过冷冻干燥或空气干燥,制成完整的rAAVs负载微针贴片。图1b为氢核磁共振(H NMR)光谱分析图,揭示了多巴胺掺入明胶后不同浓度下的化学特征变化。其中,“Gel”代表纯明胶,“Gel-LDA”为低浓度多巴胺组,“Gel-HDA”为高浓度多巴胺组。图1c进一步通过傅里叶变换红外光谱(FTIR)分析,证实了多巴胺成功引入明胶材料中,特征峰的差异清晰展现了不同组分之间的化学结构变化。图1d展示了显微镜下不同干燥方法(空气干燥和冷冻干燥)制备的微针贴片外观对比。结果显示,冷冻干燥制备的微针针尖更尖锐且排列更规整,而多巴胺的加入并未明显影响针尖外形及孔隙结构。图1e通过扫描电子显微镜(SEM)观察到微针内部结构的差异:冷冻干燥的微针内部呈现多孔结构,而空气干燥的微针内部则较为致密。这表明冷冻干燥方法更适合病毒载体(rAAVs)的稳定保存。
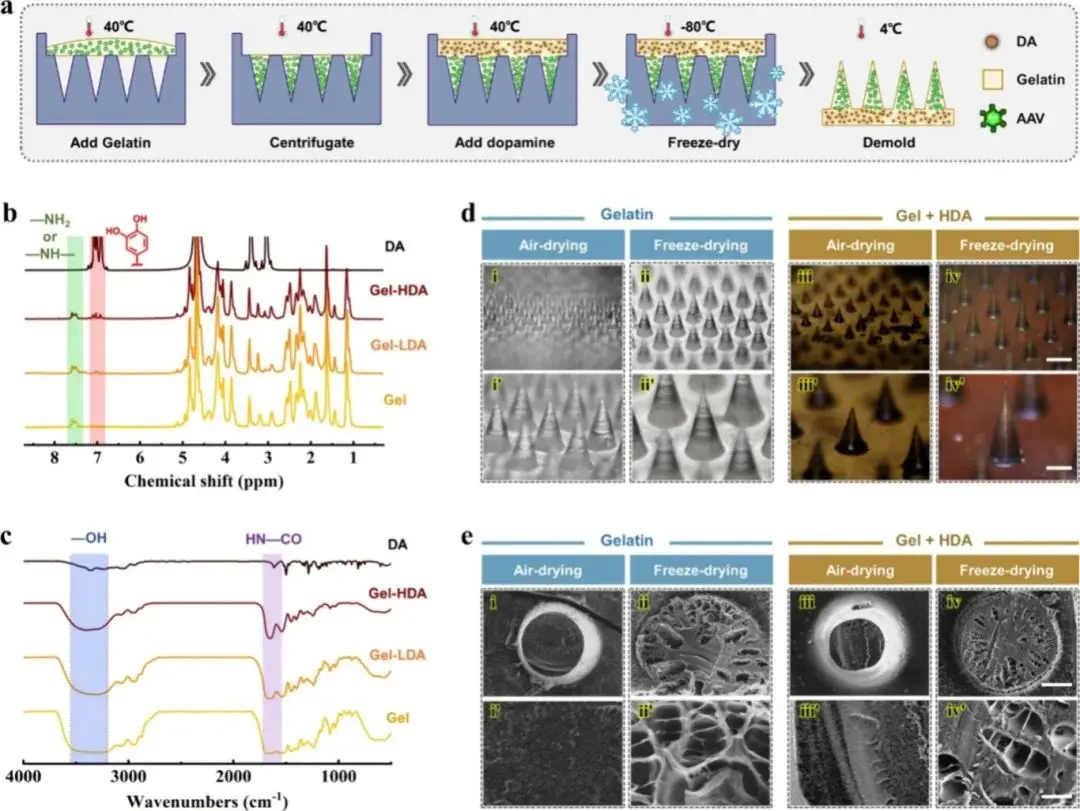
图1 微针贴片的制备和表征。(a)制作过程示意图;(b)多巴胺(DA)和无(Gel)、低多巴胺(Gel-LDA)和高多巴胺(Gel-HDA)浓度明胶贴片的傅里叶变换红外光谱(FTIR);(c)凝胶、凝胶-LDA、凝胶-HDA贴片和多巴胺的¹H NMR;(d)使用不同技术制作的微针的显微照片:(i, i', iii, iii')空气干燥和(ii, ii', iv, iv')冷冻干燥;(e)使用不同技术制作的微针的扫描电子显微镜(SEM)图像:(i, i', iii, iii')空气干燥和(ii, ii', iv, iv')冷冻干燥。比例尺:(d, i-iv)为250 μm,(d, i'-iv')为100 μm,(e, i-iv)为40 μm,(e, i'-iv')为8 μm
(2)MN的机械性能和粘附性测试
图2展示了明胶微针贴片的化学交联机制、界面黏附性能及相关力学测试结果。图2a呈现了明胶与多巴胺在高碘酸钠(NaIO₄)催化下进行交联反应的化学过程,揭示了明胶与多巴胺分子之间的化学交联机制;图2b展示了明胶-多巴胺(Gel-DA)水凝胶与组织之间的界面黏附机制,通过功能基团与组织表面的相互作用实现了较强的界面黏附性能。图2c为三组不同微针贴片(纯明胶Gel、低浓度多巴胺Gel-LDA、高浓度多巴胺Gel-HDA)的外观照片以及微针在不同受力(压缩)状态下的形态变化,结果显示所有微针尖端均在相似受力下发生弯曲或折断;图2d为微针贴片的受力-位移曲线图,反映了不同微针贴片在压缩条件下的机械强度及受力情况;图2e为柱状图,测试了不同浓度明胶对微针最大耐受压缩力的影响,发现明胶浓度增加可增强微针的机械强度,而多巴胺浓度对微针的机械强度影响不明显。图2f和g分别为搭接剪切测试(lap shear test)的示意图及典型的受力-位移曲线图,用于评估微针贴片与组织的剪切强度;图2h和i为拉伸测试(tensile test)的示意图及典型的受力-位移曲线图,用于评估微针贴片与组织界面的拉伸强度;图2j和k为180°剥离测试(peel test)的示意图及典型的受力-位移曲线图,用于评估微针贴片与组织间的剥离强度与黏附性能;图2l为剪切强度与拉伸强度的柱状图对比分析,表明含高浓度多巴胺(Gel-HDA)组的黏附强度远高于纯明胶(Gel)组,说明多巴胺显著增强了贴片的组织黏附性能;图2m为黏附能的柱状图比较,结果进一步证实高浓度多巴胺(Gel-HDA)能够明显提高微针贴片与组织界面的黏附能量。综上所述,这些结果表明多巴胺的加入虽然未明显提高微针本身的机械强度,但显著增强了微针贴片对组织的黏附性,使其更适合用于局部药物递送。
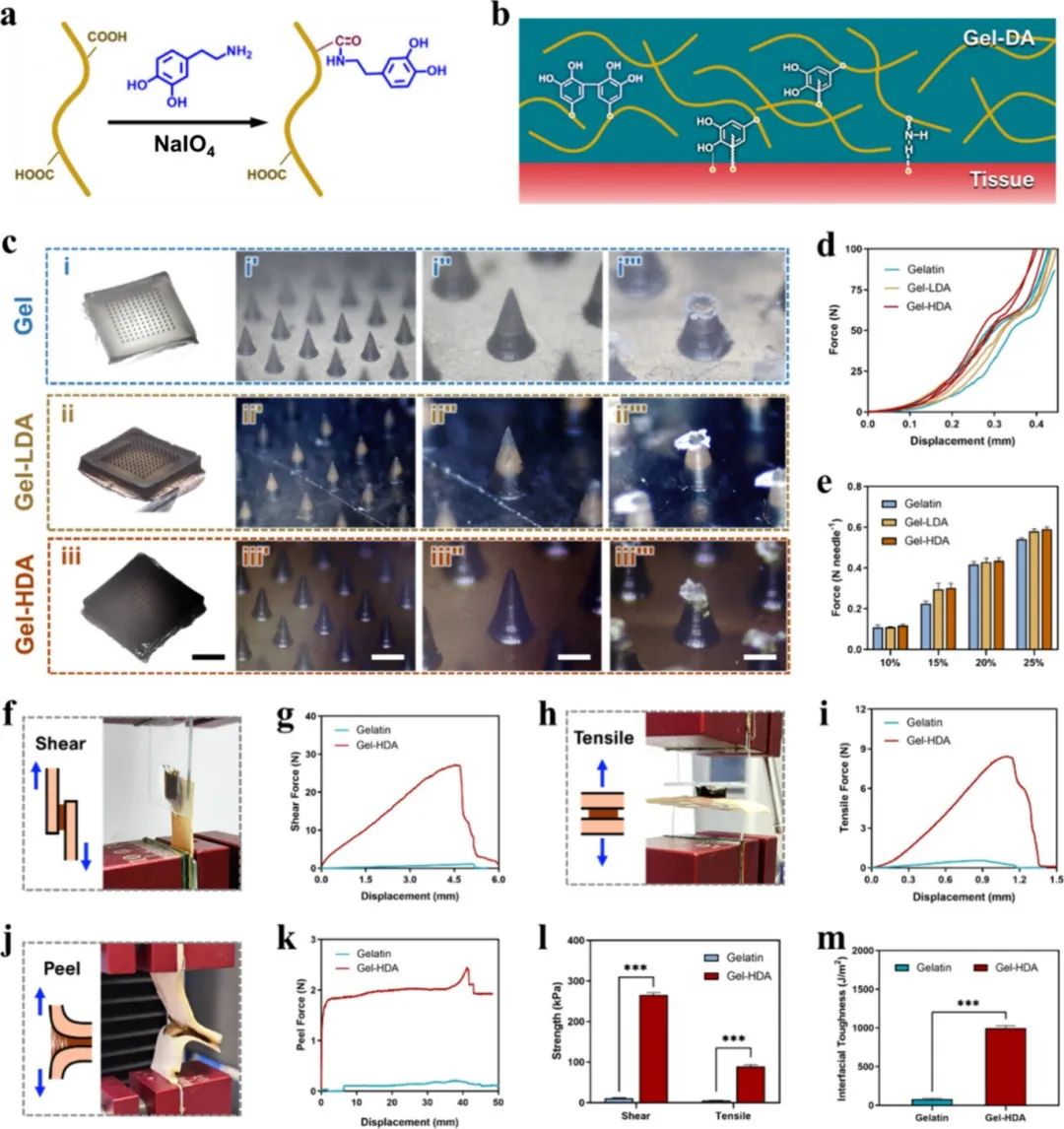
图2 微针的机械性能和粘附性测试。(a)合成过程示意图;(b)Gel-DA交联和粘附组织的原理示意图;(c)微针在机械强度测试前(i-i', i-ii'', iii-iii'')和测试后(i''-iii''')的光学图像;(d)不同凝胶-DA比率的微针的轴向断裂力;(e)具有代表性的微针剥离力随时间变化的曲线;(f-m)测量三种不同贴片在猪主动脉膜上的粘附性能:(f, h, j)剪切、拉伸和剥离过程的示意图和照片;(g, i, k)相应的力-位移曲线;(l)剪切强度和拉伸强度统计;(m)界面韧性统计
(3)微针穿透和降解性能的表征
图3a为微针贴片应用于血管的示意图,展示了微针如何穿透血管外膜,实现病毒载体(rAAVs)的快速释放,同时背衬层则实现病毒载体的持续缓释。图3b是荧光显微镜下微针尖端装载荧光纳米颗粒(模拟病毒颗粒)的图像,证实了微针尖端成功负载药物。图3c为微针穿透琼脂凝胶后的光学和荧光显微镜图像,展示了清晰的穿刺孔和颗粒释放扩散情况,证实了微针的穿透和药物释放能力。图3d通过激光共聚焦显微镜(LSCM)拍摄了微针穿透离体猪动脉组织后荧光颗粒的组织内分布情况,说明微针具备有效穿透血管并深度释放药物的能力,释放深度可达约350 μm。图3e和f分别展示了三种成分的微针尖端(Gel、Gel-LDA、Gel-HDA)和背衬层在PBS中不同时间点的降解状态,结果显示多巴胺的加入显著延长了微针尖端的降解时间,且随着多巴胺浓度的升高,背衬层的降解速度显著降低。图3g为三种微针贴片材料在PBS中降解过程中重量损失的定量曲线图,明确展现了多巴胺浓度升高后降解速率显著降低的趋势。图3h进一步展示了高浓度多巴胺组(Gel-HDA)的背衬层在PBS中随时间推移的降解百分比变化曲线,说明Gel-HDA背衬层具有长效稳定性,有助于长期持续药物释放。以上图示结果证实了微针贴片良好的穿刺能力、药物释放性能,以及多巴胺加入显著延长降解时间,有助于更好的临床应用效果。
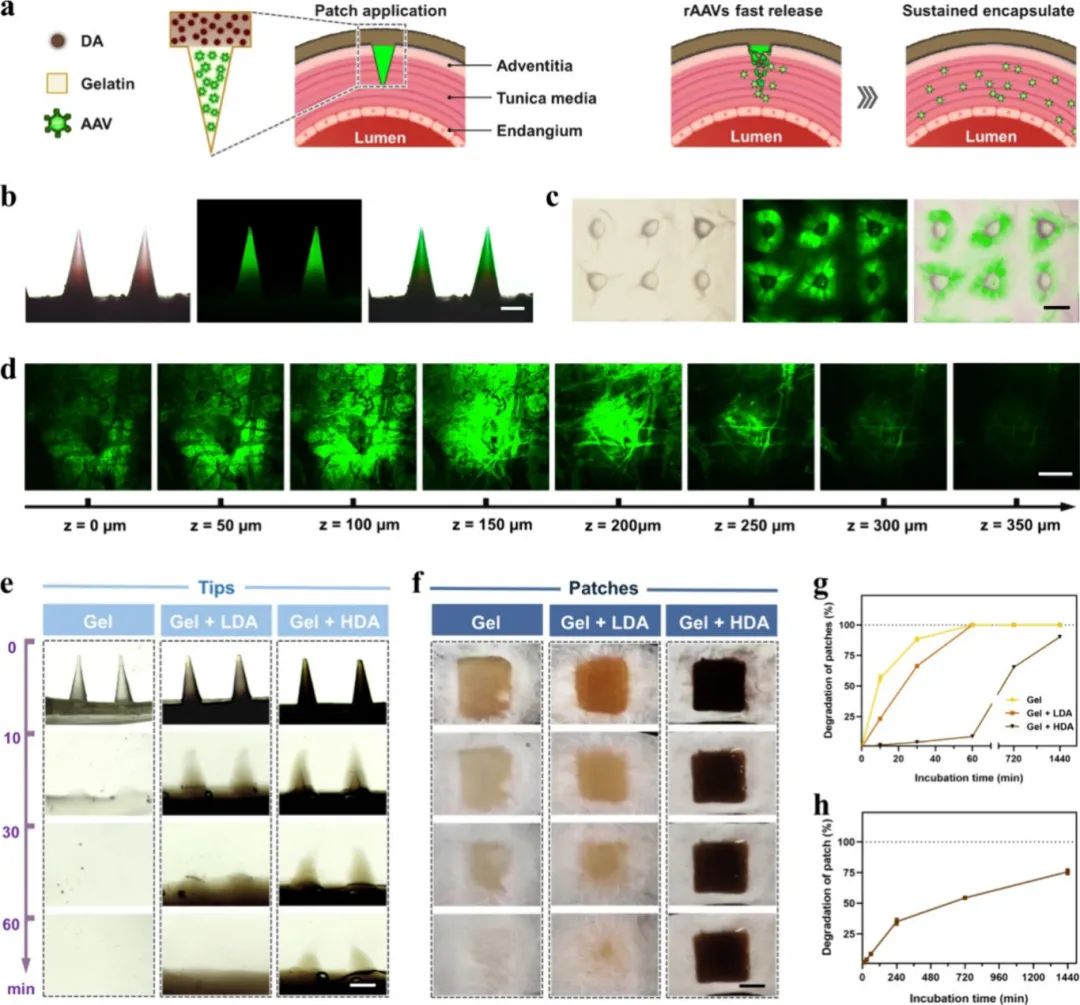
图3 微针穿透和降解性能的表征。(a)可溶解微针和在针尖释放rAAVs的示意图;(b)头端带有荧光纳米颗粒的微针贴片的宏观图像;(c)插入琼脂糖凝胶后针孔周围染色的荧光显微镜图像;(d)插入猪主动脉后微针孔的激光扫描共聚焦显微镜(LSCM)图像;(e)微针在37°C下的溶解过程;(f)37°C下,贴片背层在PBS中的溶解过程;(g)背衬层的降解率(n=3,独立样本)。比例尺:(b)为100 μm,(c)为150 μm,(d)为100 μm,(e)为150 μm,(f)为500 μm
(4)微针贴片中 rAAV 的转染能力
图4a为微针贴片体外实验的总体流程示意图,展示了负载rAAV-GFP的微针贴片(AMNP)与动脉平滑肌细胞(VSMCs)共培养的过程,用于评估病毒颗粒(rAAVs)的转染效率和生物相容性。图4b通过激光共聚焦显微镜(LSCM)观察了不同处理组(空白组、直接加入rAAV-GFP组、微针贴片负载rAAV-GFP组)平滑肌细胞内绿色荧光蛋白(GFP)的表达情况,其中绿色荧光强度直接反映了病毒的基因转染效率,结果显示微针贴片的转染效果与直接加入病毒的转染效果类似,但微针制备过程略微降低了病毒活性。图4c-e为流式细胞术(FCM)对不同处理组VSMCs转染GFP的阳性率分析图:图4c为空白对照组细胞未见明显荧光;图4d为直接用病毒(rAAV-GFP)转染的细胞,GFP表达阳性率较高;图4e为微针贴片(rAAV-GFP patch)转染的VSMCs组,其转染率略低于直接病毒转染组。图4f为不同处理组细胞(血管平滑肌细胞和内皮细胞)的活性染色图像(细胞存活染色),其中空白组为阳性对照,Negative为阴性对照,Patch为实验组,结果显示微针贴片组的细胞存活状态良好,与空白组相似,表明微针贴片具有良好的细胞相容性。图4g为含病毒的明胶微针贴片对细胞(内皮细胞和VSMCs)的细胞毒性评价(OD值测定),结果显示各实验组的OD值与对照组差异不明显,进一步证实微针贴片对细胞无明显毒性,具有良好的生物相容性。图4h为不同处理组中GFP阳性细胞比例的统计结果柱状图,结果表明微针处理后病毒颗粒转染细胞的比例稍低于直接病毒组,说明冻干过程轻微降低了病毒载体的转染活性,但整体仍保持较高的转染效率。
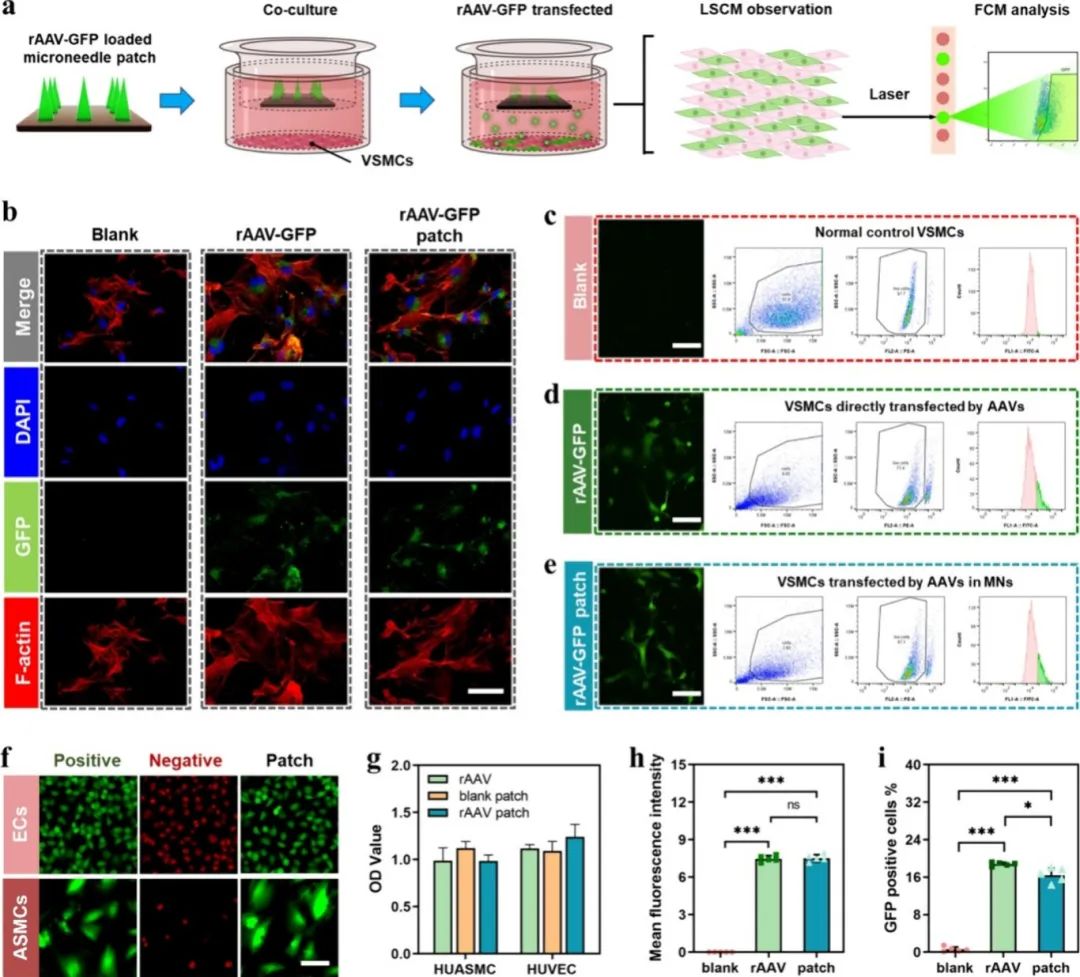
图4 微针贴片中rAAV的转染能力。(a)rAAV和ASMCs共培养、观察和分析示意图;(b)GFP阳性ASMCs的激光扫描共聚焦显微镜(LSCM)图像及DAPI和F-actin染色;(c-e)转染rAAVs的ASMCs的GFP阳性细胞图像和流式细胞术分析;(f)活细胞和死细胞染色;(g)ECs和ASMCs的CCK-8染色;(h)共培养后平均荧光强度分析;(i)共培养后GFP阳性细胞百分比分析。n=5,独立样本。比例尺:(b)为60 μm,(c-f)为100 μm
(5)rAAV-MN 贴片处理新内膜增生模型的结果
图5a为微针贴片治疗新生内膜增生的示意图,描述了通过球囊导管损伤血管内膜建立动物模型后,将微针贴片贴附于血管外膜,通过释放病毒载体(rAAVs)进行基因治疗,实现局部基因治疗的机制。图5b为活体荧光成像,显示不同处理方式(空白组、注射组、微针贴片组)的病毒转染效率差异。结果显示,微针贴片组在左侧颈动脉区域局部出现明显的绿色荧光,表明贴片给药具有显著的局部靶向性,而注射给药和空白组则无明显局部荧光表达。图5c为离体动脉的多种染色分析,包括HE染色(组织结构)、von Kossa染色(钙沉积)、弹力纤维染色(EVG)以及免疫荧光染色(α-SMA绿色、CD31红色),用于评估各组动脉组织病变的严重程度。结果显示,微针贴片组的内膜增生显著减少,内皮层完整性得到改善,验证了微针贴片治疗对抑制内膜增生的显著效果。图5d通过Western blot检测α-SMA和OPN蛋白的表达水平,明确微针贴片治疗组(Exp)的相关致病蛋白表达明显降低,进一步证实其对内膜增生的有效抑制作用。图5e为彩色多普勒超声(CDFI)图像,用于评估各组血管的通畅程度及血流速度。结果显示,贴片治疗组的血管管腔狭窄情况明显改善,表明治疗效果显著。图5f和g分别为骨桥蛋白(OPN)和α-平滑肌肌动蛋白(α-SMA)的定量统计图,评估血管内膜增生程度。结果显示,治疗组的OPN和α-SMA表达水平显著降低,表明微针贴片有效抑制了病理性内膜增生和平滑肌细胞的异常增殖。图5h为血管管腔狭窄率柱状图,显示微针贴片组的管腔狭窄率显著降低,表明治疗显著改善了血管狭窄情况。图5i为各组治疗后不同时间(0和1个月)的血流速度比较柱状图,证实贴片组的血流速度接近正常值,说明贴片治疗能够长期有效抑制内膜增生导致的血管狭窄。图5j和k分别为新生内膜面积和内膜/中膜面积比例的柱状图对比,结果显示微针贴片治疗后新生内膜面积明显减少,内膜/中膜面积比例显著降低,进一步验证了微针贴片治疗对内膜增生的良好抑制效果。
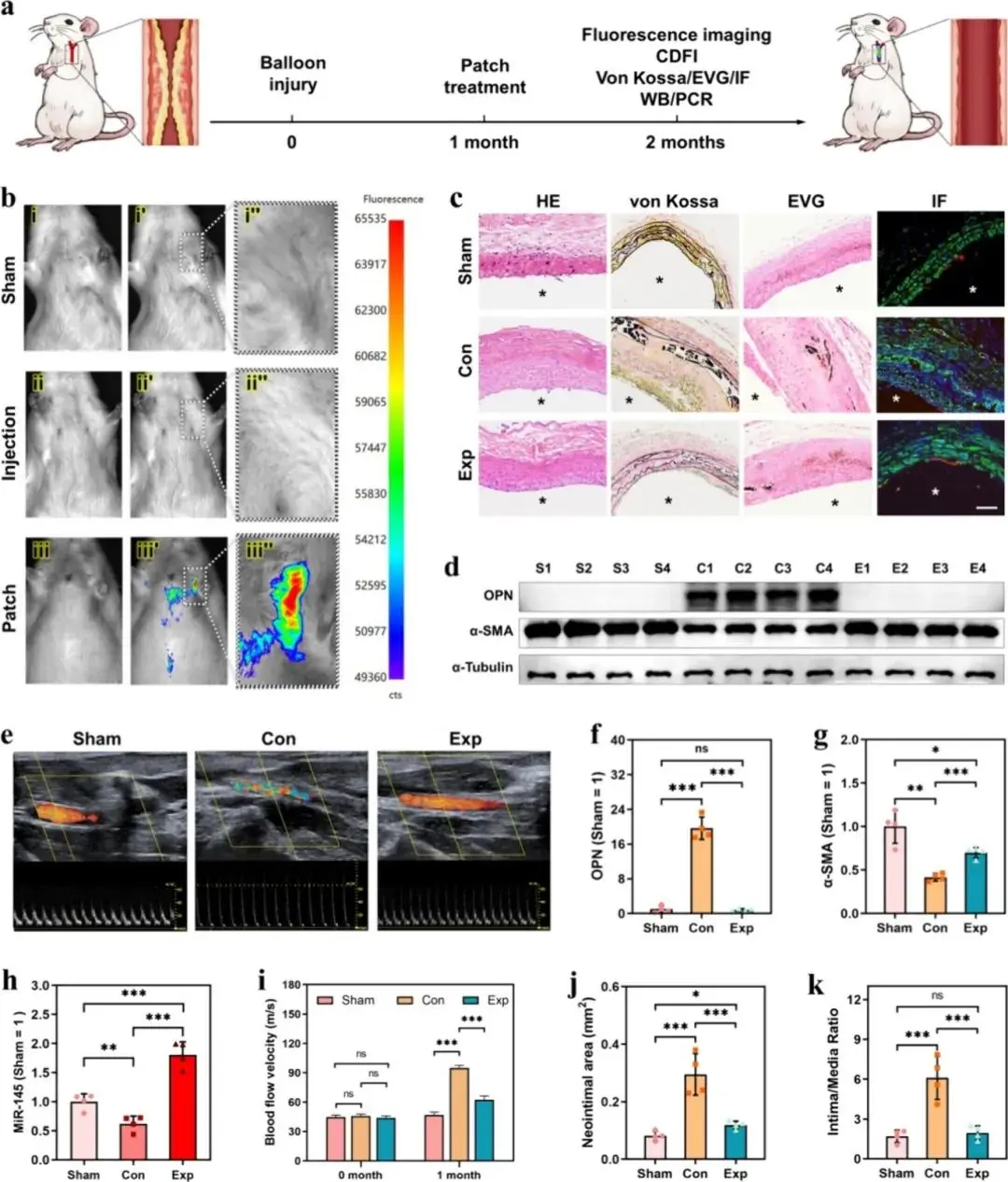
图5 rAAV-MN贴片处理新内膜增生模型的结果。(a)模型建立、处理和样本分析的实验方案示意图;(b)体内成像;(c)1个月后的Von Kossa、EVG和免疫荧光(IF)染色(绿色α-SMA/红色CD31/蓝色DAPI);(d)增殖标志蛋白OPN和α-SMA蛋白的Western blot(WB)结果;(e)术后1个月的颈动脉多普勒血流成像;(f)蛋白质OPN的WB图像统计;(g)蛋白质α-SMA的WB图像统计;(h)通过qPCR测定的miR-145的表达;(i)术后即刻和术后1个月的血流速度统计;(j)内膜/中膜比率分析;(k)新内膜面积分析。n=4,独立样本。比例尺:100 μm
在这项研究中成功研制了一种可黏附的病毒载体(rAAVs)负载微针贴片(AMNP),能够调控动脉壁内miR-145表达,减少血管内膜增生导致的血管狭窄。在贴片制备过程中,明胶针尖负载了rAAVs,背衬层添加了多巴胺。制备过程未明显降低病毒的活性。当贴片应用于病变血管后,背衬层通过强黏附性牢牢地附着于血管外膜,微针则穿透外膜进入血管中膜并释放病毒载体(rAAVs)。微针尖端的明胶成分在体温下逐渐溶解,使病毒迅速释放并进入血管中层,实现了有效的局部转染。实验结果表明,该微针贴片可有效减轻大鼠颈动脉内膜增生病变的程度,表现出显著的治疗效果。这说明微针贴片具有作为心血管疾病(如再狭窄、动脉粥样硬化)基因治疗载体的巨大临床潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

