
缺血性中风是一种由脑血管阻塞引起的血栓炎症性疾病,是全球范围内导致死亡和残疾的主要原因之一。目前,治疗缺血性中风的黄金标准是使用重组人组织型纤溶酶原激活剂(rtPA)进行静脉溶栓,以在有限的时间窗口内恢复血流。然而,rtPA的溶栓效果有限,半衰期短,且难以应对再灌注损伤,临床应用受到限制。此外,由于血脑屏障(BBB)的存在,许多神经保护剂难以进入大脑发挥作用。理论上,治疗缺血性中风的理想药物应具备快速靶向溶栓、有效清除自由基、减少神经细胞死亡等特性,但目前尚缺乏能同时满足这些要求的治疗方法。

为了解决这些问题,南昌大学王小磊团队开发了一种受冷啤酒启发的多功能纳米酶(CMPd(H)U),旨在实现快速血栓清除和持久的氢气疗法,以改善缺血性中风的治疗效果。CMPd(H)U有效靶向血栓,并结合气体疗法加速溶栓并恢复血流。此外,CMPd(H)U释放H2以消除ROS,从而减轻再灌注损伤。此外,CMPd(H)U通过调节小胶质细胞对M2表型的极化和抑制神经元焦亡表现出抗炎和神经保护特性。动物行为实验证实了该系统在促进中风后神经运动功能恢复方面的有效性。该文章于2025年1月11日以《Cold beer-inspired multifunctional nanozyme for ischemic stroke with rapid thrombus clearance and long-lasting hydrogen therapy》为题发表于《Nano Today》(doi:10.1016/j.nantod.2025.102636)
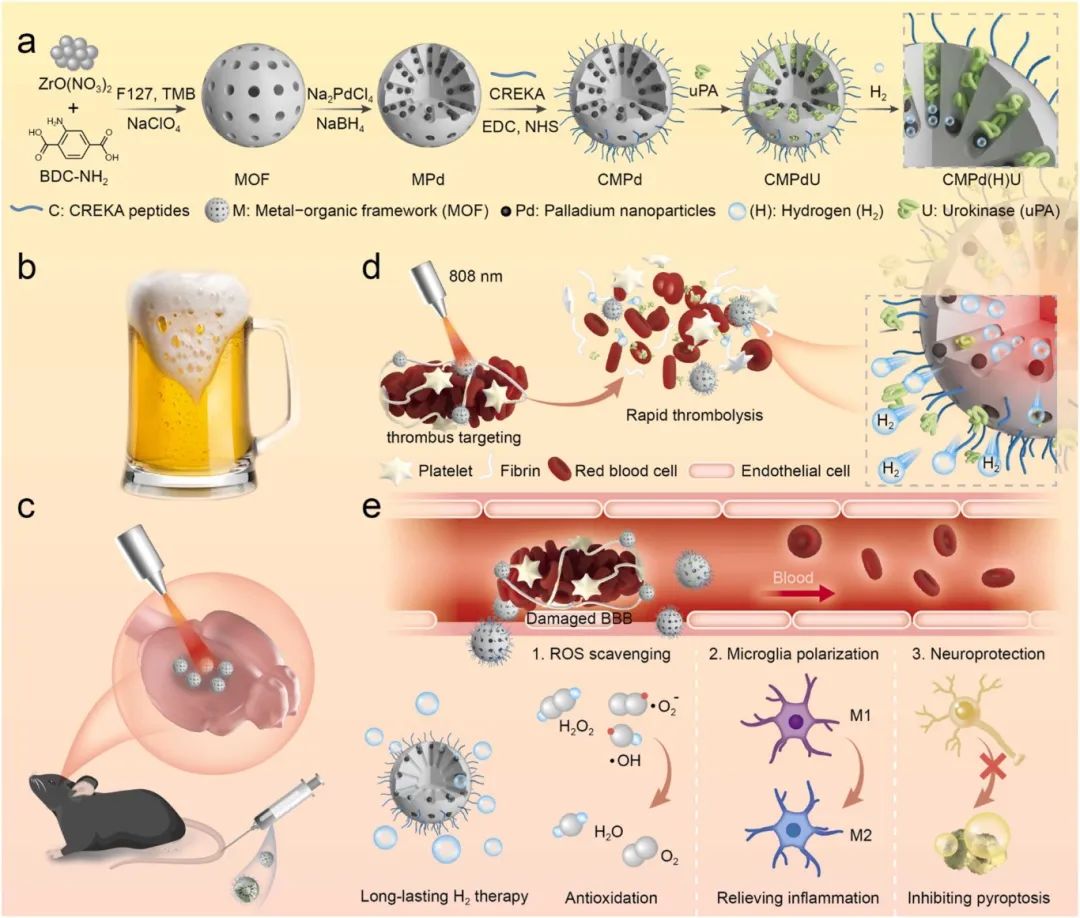
图1 CMPd(H)U纳米酶的合成及其在缺血性卒中快速血栓清除和长效H2治疗中的应用
(1)CMPd(H)U纳米酶的合成与表征
图2a所示,SEM图像可以看到MOF、MPd、CMPd的表面含有大量均匀的开放孔隙。TEM和AFM图像证明CMPd(H)U纳米酶内部的介孔结构分布均匀(图2b和c)。EDS图像显示锆、钯、硫和溴元素的分布(图2d)。CMPd的氮气吸附等温线呈现IV型曲线,表明存在介孔(图2e),BJH孔径分布证实了这一结果(图2e插图)。FTIR光谱分析了CMPd(H)U纳米酶的官能团变化表明CREKA肽修饰成功(图2f)。经过修饰后各种材料的zeta电位结果图(图2g)。X射线衍射图谱表明经过一系列修饰后,MOF的框架结构仍然得到了很好的保持(图2h)。X射线光电子能谱分析证实了零价钯的存在(图2i)。动态光散射结果证明了CMPd(H)U纳米酶的良好稳定性(图2j)。上述结果证明了纳米酶的成功制备。
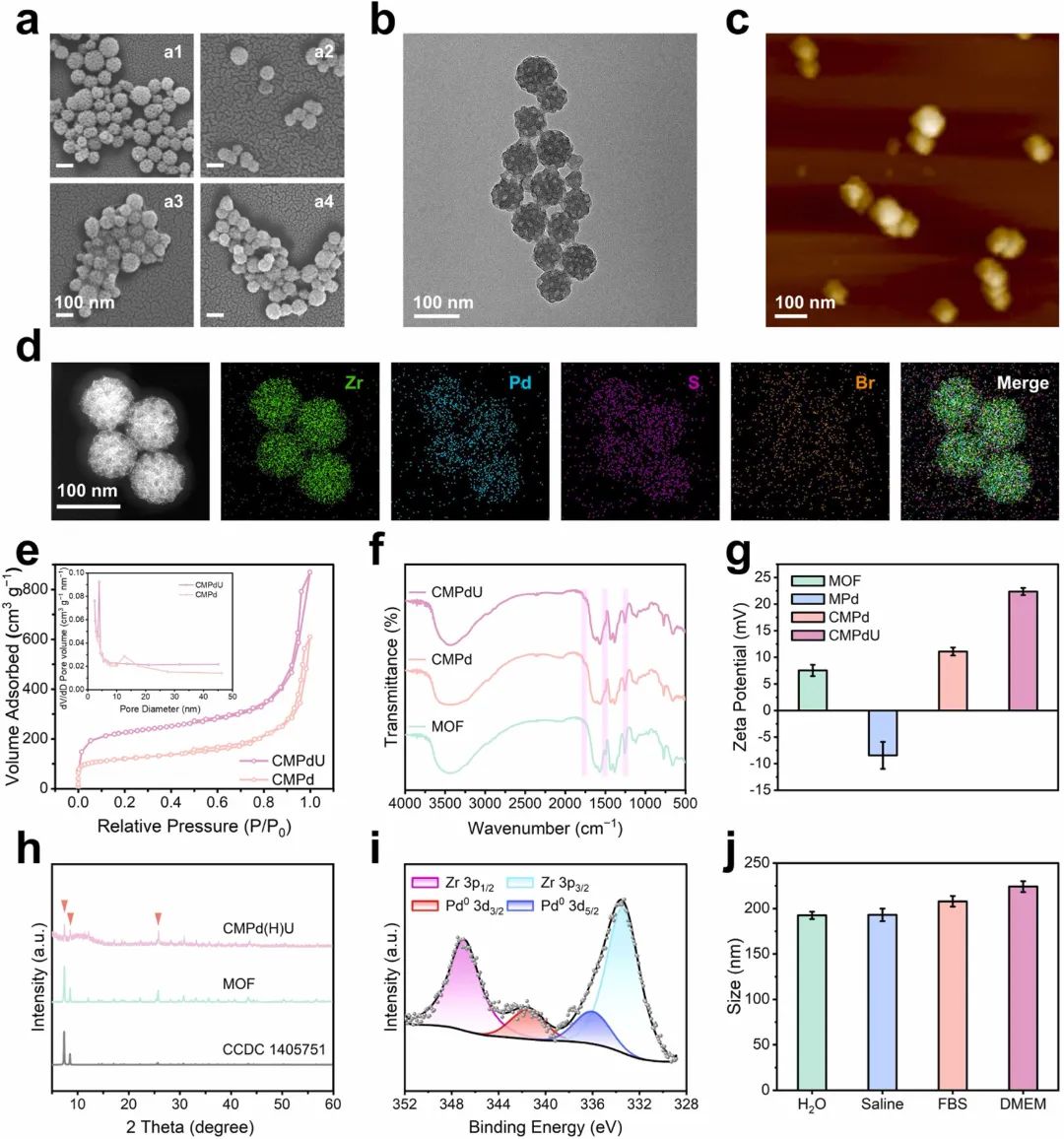
图2 CMPd(H)U纳米酶的特性表征。(a)(a1)MOF、(a2)MPd、(a3)CMPd和(a4)CMPdU的扫描电子显微镜图像;(b)CMPd(H)U的透射电子显微镜图像和(c)原子力显微镜图像;(d)CMPd(H)U中Zr、Pd、S和Br元素的元素分布图;(e)CMPd和CMPdU的氮气吸附-脱附等温线,插图:相应的BJH孔径分布;(f)MOF、CMPd和CMPdU的傅里叶变换红外光谱;(g)MOF、MPd、CMPd和CMPdU的zeta电位;(h)MOF和CMPd(H)U的X射线衍射图谱;(i)CMPd(H)U中Zr 3p和Pd 3d的高分辨X射线光电子能谱;(j)CMPd(H)U在不同溶液中7天后的流体动力学直径,数据为平均值±标准差(n≥3)
(2)NIR增强的体外H2释放和溶栓
首先探索CMPd(H)U纳米酶的光热特性。在NIR照射10分钟后,CMPd(H)U溶液的温度大约上升了22.3℃(图3a)。此外,在开/关循环实验中,CMPd(H)U纳米酶仍表现出稳定的光热转换性能(图3b),表明其具有优异的光热稳定性。进一步研究NIR对CMPd(H)U纳米酶释放H2能力的影响。经过CMPd(H)U纳米颗粒处理的MB的UV-vis吸收峰显著降低,并且并NIR将H2的释放过程缩短至12小时(图3c)。研究了CMPd(H)U纳米酶在BV2和HT22细胞模型中的细胞内H2释放情况。在NIR照射下,经过CMPd(H)U纳米酶处理的BV2呈现出最浅的蓝色(图3d)。在HT22中也观察到了相同的结果(图3e)。这表明NIR刺激下从CMPd(H)U纳米酶快速释放的H2具有更强的生物还原性。随后研究了CMPd(H)U纳米酶在37℃或NIR照射下的uPA释放行为。在NIR照射下,uPA的释放量在37℃时仅为8.51%(图3f)。从老鼠身上采集新鲜血液,建立体外血栓模型(图3g)。实验结果表明CMPd(H)U + NIR组的溶栓是uPA、光热和H2气泡的协同作用的结果(图3h)。
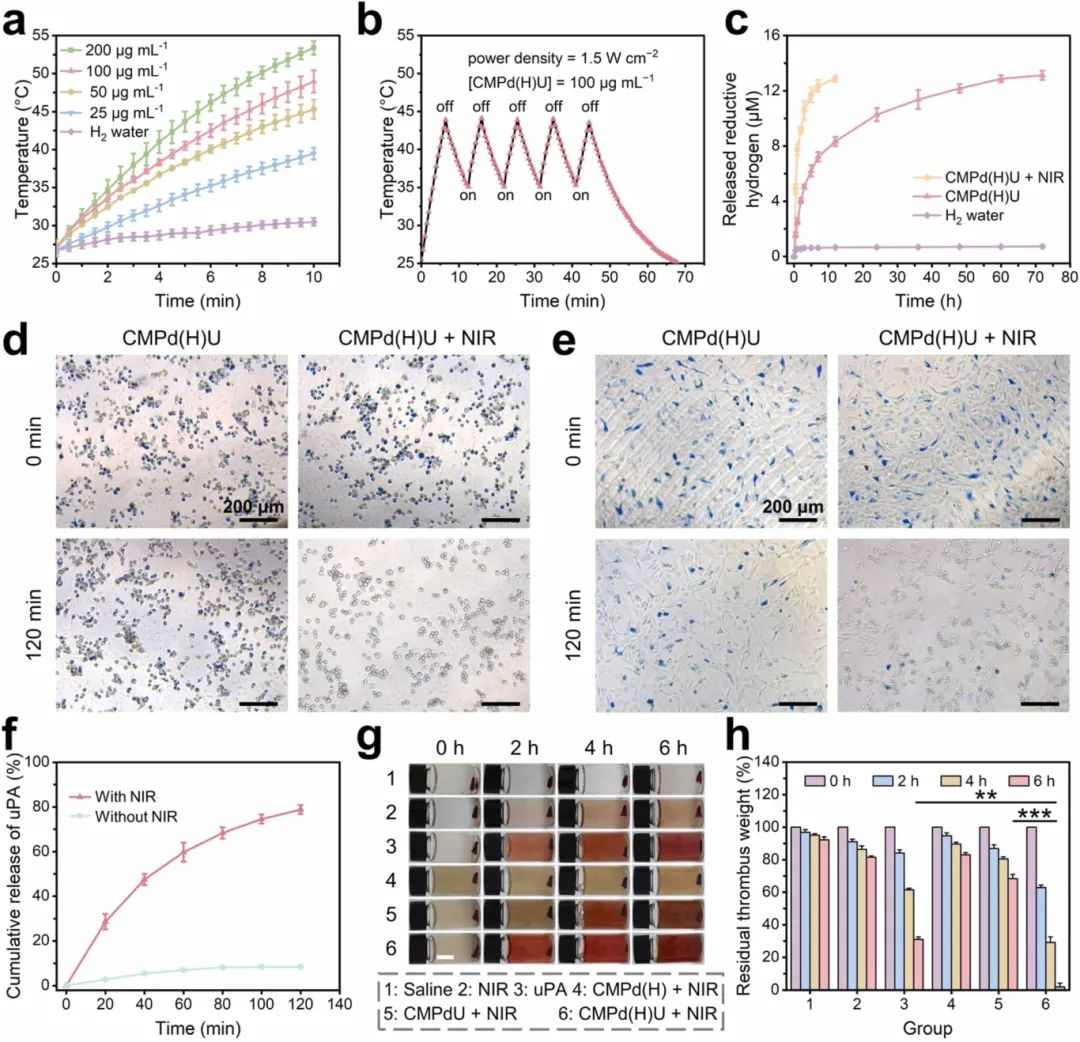
图3 近红外增强的体外释放行为和溶栓效果。(a)CMPd(H)U在不同浓度下经近红外激光照射的光热曲线;(b)CMPd(H)U经过五次近红外开关循环后的温度变化;(c)采用MB探针测量H₂O和CMPd(H)U的还原性H₂释放行为;使用MB染色的(d)BV2和(e)HT22细胞对CMPd(H)U在有无近红外激光照射下释放的还原性H₂进行定性调查;(f)CMPd(H)U在37℃或经近红外激光照射下释放的uPA;(g)不同处理后血栓的照片(比例尺=1 cm);(h)残余血栓重量。数据为平均值±标准差(n≥3)。**p<0.01, ***p<0.001
(3)体外抗氧化、细胞毒性和BBB通透性
CMPd(H)U纳米颗粒的抗氧化能力示意图如图4a所示。由于还原性H2的释放以及钯纳米颗粒的超氧化物歧化酶样酶活性,两种自由基的信号强度显著降低(图4b和c)。随着CMPd(H)U浓度的增加和时间的推移,H2O2的分解率增加,表明CMPd(H)U具有类过氧化氢酶活性(图4d)。当浓度达到100 μg mL⁻¹时,CMPd(H)U能够清除约60%的DPPH•和75%的ABTS⁺•(图4e和f)。图4g和h显示,与CMPd(H)U共培养3天后,bEnd.3、HUVECs、BV2和HT22的存活率均高于90%。评估CMPd(H)U的BBB穿透能力和脑靶向能力,bEnd.3接种在上室以模拟BBB,BV2或HT22接种在下室作为受体细胞(图4i)。在不同时间点观察BV2和HT22的荧光,Cy5-CMPd(H)U的荧光不仅更强,还显示出更明显的共定位现象(图4j),在HT22中也观察到类似现象(图4k)。所有这些结果表明,该纳米酶具有良好的BBB穿透能力和对BV2和HT22的靶向能力。因此,CMPd(H)U纳米酶有望在脑缺血病变区域积累。
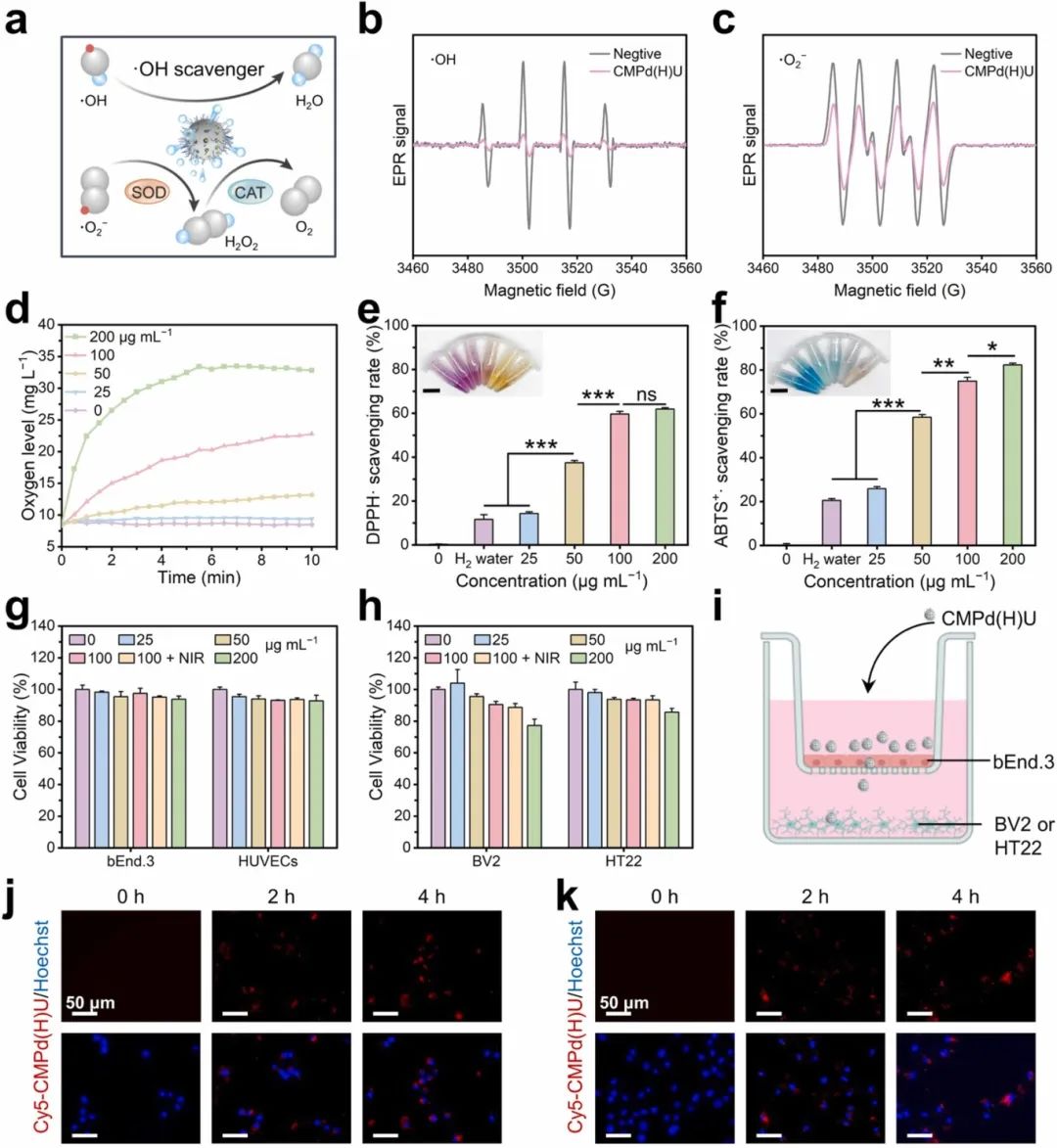
图4 CMPd(H)U纳米酶的抗氧化活性、细胞活力和细胞摄取行为。(a)CMPd(H)U纳米酶清除活性氧(ROS)的机制;(b)羟基自由基(•OH)和(c)超氧阴离子自由基(•O₂⁻)清除的电子顺磁共振(EPR)光谱;(d)CMPd(H)U纳米酶催化产生的溶解氧浓度;(e)DPPH•和(f)ABTS⁺•的清除率,插图:相应反应的图像(比例尺=1 cm);(g)bEnd.3和HUVECs以及(h)BV2和HT22细胞在与不同浓度的CMPd(H)U共培养72小时后的细胞活力;(i)体外血脑屏障模型构建的示意图;(j)BV2和(k)HT22细胞的共聚焦激光扫描显微镜(CLSM)图像,显示细胞摄取情况。数据为平均值±标准差(n≥3)。*p<0.05, **p<0.01, ***p<0.001, ns:不显著
(4)体外抗炎和神经保护作用
清除ROS可以有效地促使小胶质细胞从M1表型极化为M2表型,从而缓解炎症微环境(图5a)。用DCFH - DA检测细胞内ROS,CMPd(H)U处理显著降低了细胞内ROS水平(图5b)。通过流式细胞术检测CD86(和CD206,以进一步探讨不同组对BV2细胞极化的影响(图5c - f)。此外,CMPd(H)U + NIR组有效减少了TNF-α的分泌,增加了IL-10的分泌(图5g和h)。上述结果均表明,CMPd(H)U + NIR组通过快速释放还原性H2抑制BV2的M1极化,增加M2极化,有效减少了LPS诱导的BV2细胞炎症。
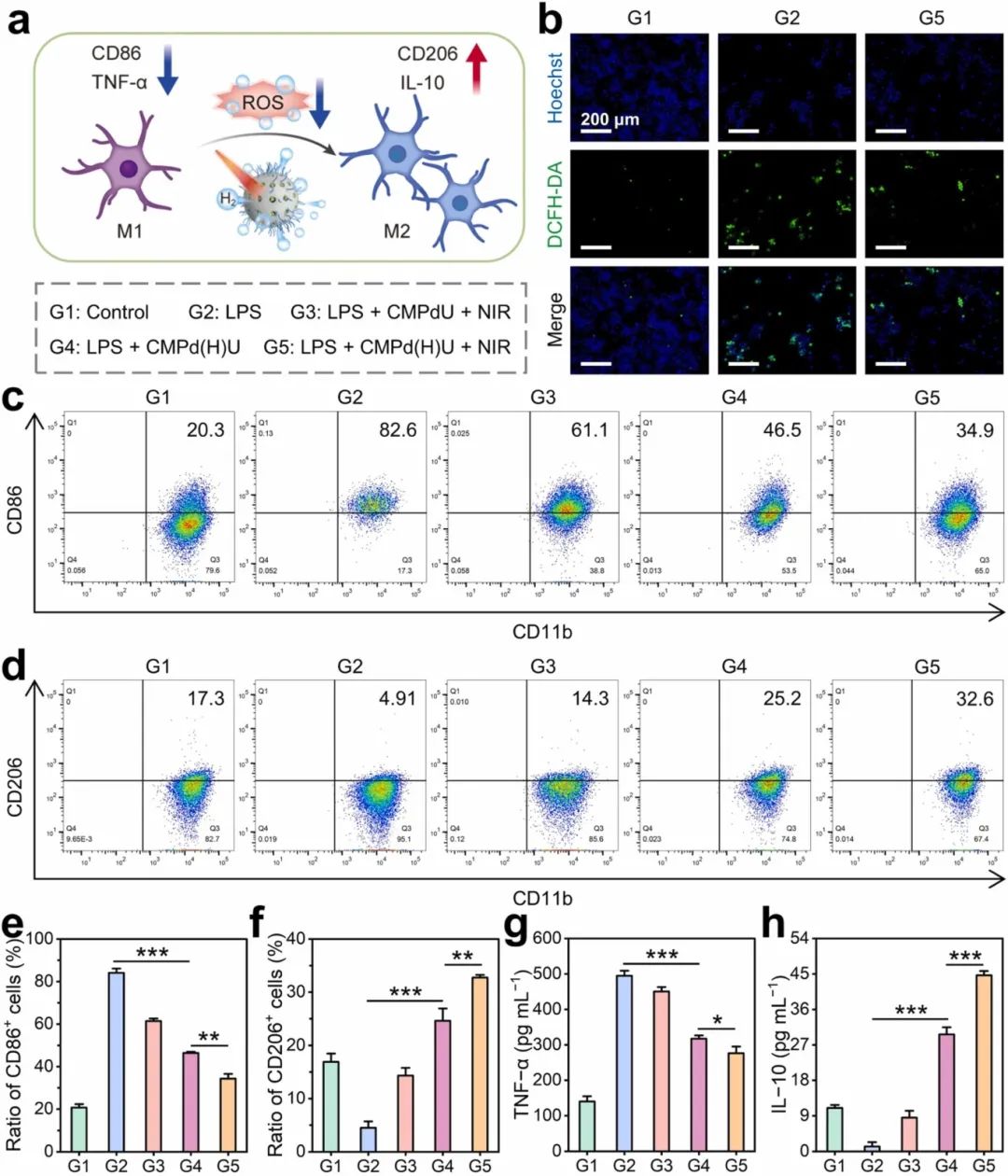
图5 CMPd(H)U的体外活性氧清除和抗炎效果。(a)描述CMPd(H)U调节LPS诱导的BV2极化机制的示意图;(b)LPS(1 μg mL⁻¹)刺激后不同组BV2中活性氧(ROS)的荧光图像;流式细胞术及其对应的定量分析显示,经过不同处理后BV2的(c, e)M1和(d, f)M2极化情况;酶联免疫吸附试验(ELISA)检测LPS诱导的BV2在不同处理后上清液中的(g)TNF-α和(h)IL-10水平。数据为平均值±标准差(n≥3)。*p<0.05, **p<0.01, ***p<0.001
进一步研究CMPd(H)U纳米酶对抑制神经元焦亡的影响(图6a)。采用DCFH-DA鉴定细胞内ROS,该纳米酶表现出令人满意的抑制过量ROS产生的能力(图6b)。图6c所示, CMPd(H)U + NIR组显示出相对正常的形态,囊泡数量显著减少。进一步的免疫荧光染色分析表明,CMPd(H)U + NIR组可以显著抑制GSDMD-N的表达(图6d)。图6e和f所示,CMPd(H)U + NIR处理逆转了OGD/R刺激的HT22中NLRP3和IL-1β的表达,并显著下调了Caspase-1和GSDMD-N蛋白水平。此外,CMPd(H)U + NIR的干预将OGD/R刺激的HT22上清液中IL-1β的浓度降低了约三分之二(图6g)。总之,这些结果强有力地表明,CMPd(H)U + NIR通过快速清除ROS抑制了NLRP3炎症体激活介导的神经元焦亡,表明其对CIRI具有良好的治疗效果。
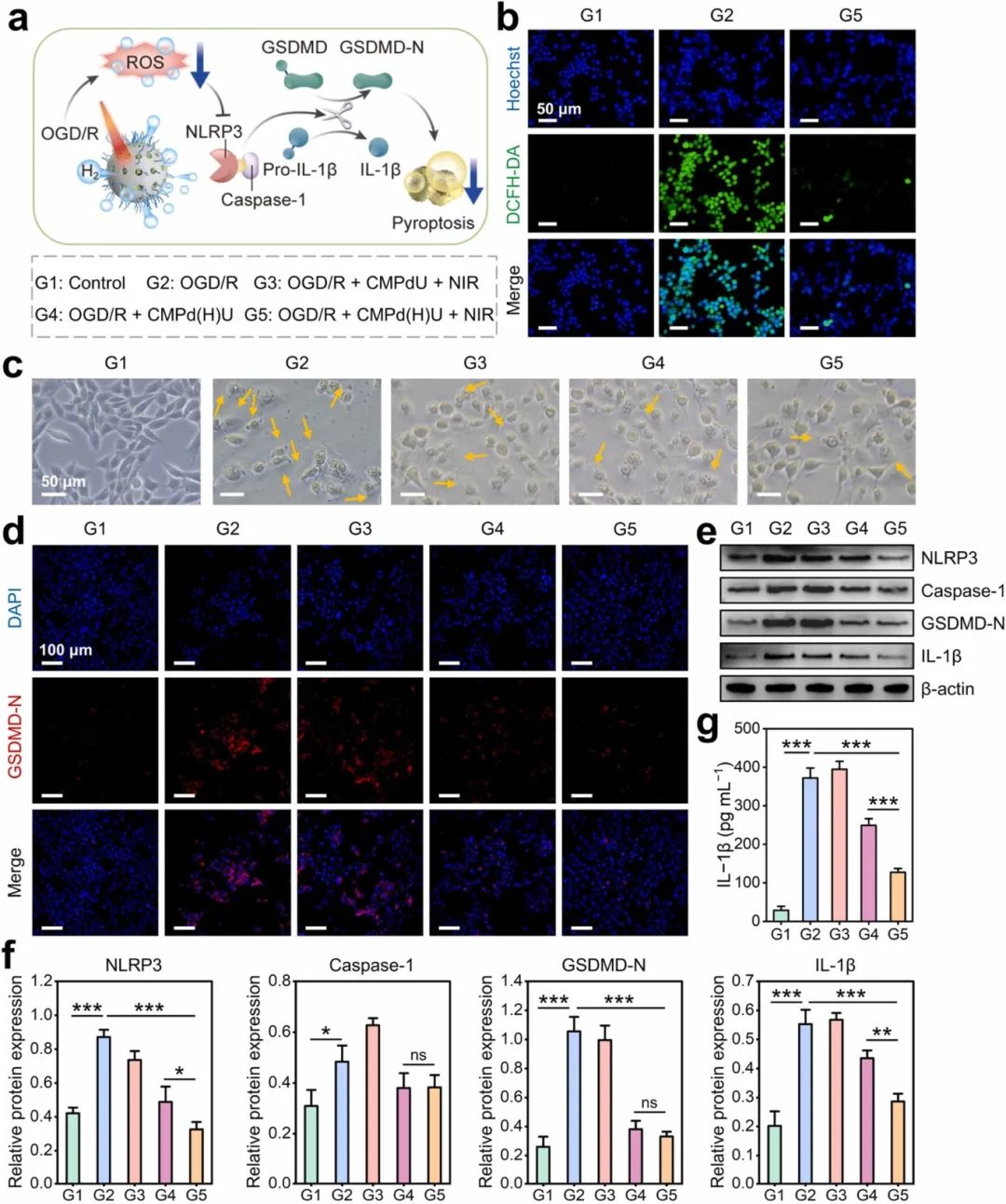
图6 CMPd(H)U的体外活性氧清除和抗焦亡能力。(a)描述CMPd(H)U抑制OGD/R诱导的HT22焦亡机制的示意图;(b)OGD/R刺激后不同组HT22中活性氧(ROS)的荧光图像;(c)HT22的代表性明场显微镜图像,箭头指示焦亡细胞;(d)经处理后OGD/R刺激的HT22中GSDMD-N的免疫荧光染色图像;(e)西方印迹(WB)图像和(f)定量结果显示不同处理下HT22蛋白裂解液中NLRP3、Caspase-1、GSDMD-N和IL-1β水平,β-actin作为加载对照;(g)酶联免疫吸附试验(ELISA)检测不同处理后HT22上清液中的IL-1β水平。数据为平均值±标准差(n≥3)。*p<0.05, **p<0.01, ***p<0.001, ns:不显著
(5)体内治疗效果
我们利用RB染料和532 nm绿色激光构建了小鼠PT缺血性中风模型,以评估纳米酶的体内治疗效果(图7a)。小鼠在预设时间点被安乐死,收集大脑进行离体荧光成像。CMPd(H)U纳米酶可以快速靶向脑缺血部位的血栓(图7b和c)。图6d所示,Cy5 - CMPd(H)U的红色荧光与纤维蛋白的黄色荧光的重叠强度最高,表明纳米酶可以准确靶向血栓。通过LSI在给药前后不同时间点对小鼠进行rCBF成像,并根据rCBF的恢复评估其体内的溶栓效果(图7e)。与其他组相比,CMPd(H)U + NIR组在给药后2小时或6小时显示出最佳的血流恢复(图7f和g)。纳米酶由于其出色的血栓靶向能力结合NIR刺激的uPA和快速释放的H2,可以增强溶栓效果。
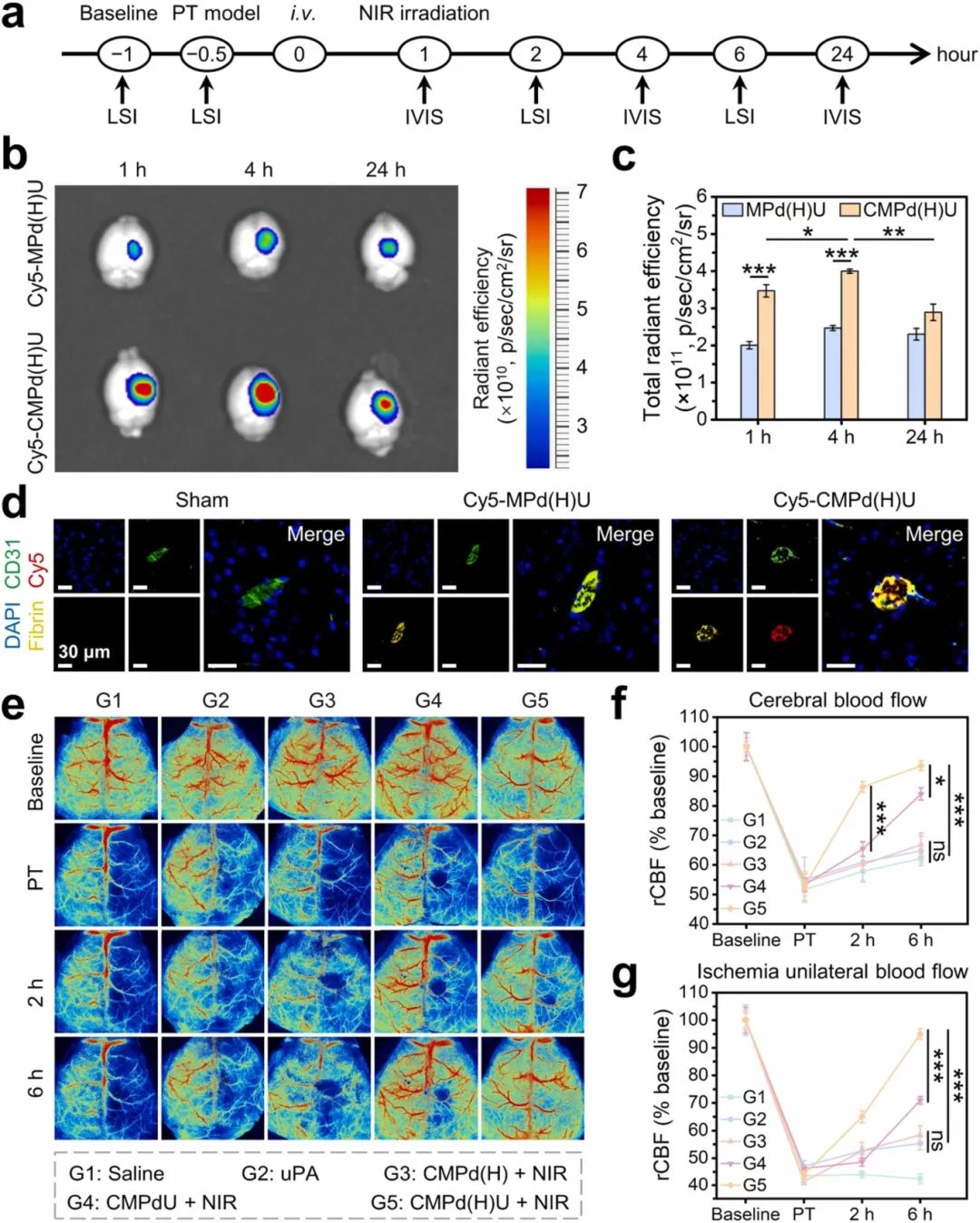
图7 CMPd(H)U的体内靶向溶栓效果。(a)激光散斑成像(LSI)和活体成像系统(IVIS)的时间安排;(b)脑组织的离体荧光图像和(c)相应的定量分析;(d)血栓形成和CMPd(H)U靶向血栓能力的免疫染色(蓝色:DAPI;绿色:CD31用于标记血管;黄色:纤维蛋白用于标记血栓;红色:标记有Cy5的MPd(H)U和CMPd(H)U);(e)小鼠在缺血前(基线)、缺血期间(PT)以及不同处理后的代表性激光散斑图像,以及(f−g)平均血流的定量分析。数据为平均值±标准差(n≥3)。*p<0.05, **p<0.01, ***p<0.001, ns:不显著
进一步探索CMPd(H)U纳米酶的体内治疗效果(图8a)。用TTC溶液对脑切片进行染色,定量评估CMPd(H)U的脑保护效果(图8b),CMPd(H) + NIR组的梗死面积略有减少(约5.1 mm3)(图8c)。H&E染色的病理检查结果表明,CMPd(H)U + NIR减少了坏死区域的面积,而没有对脑组织造成损伤(图8d)。免疫荧光检测结果表明,在PT中风损伤组织边缘Iba-1高表达,表明小胶质细胞在缺血半暗带被激活(图8e和f)。随后通过NeuN/GSDMD-N研究了溶栓和再灌注后神经元的焦亡情况(图8g),CMPd(H)U + NIR治疗可以最大限度地减少GSDMD-N的表达,证明抑制了神经元焦亡。上述结果表明,NIR增强的快速溶栓结合持续的H₂治疗是减轻脑梗死的有效策略。
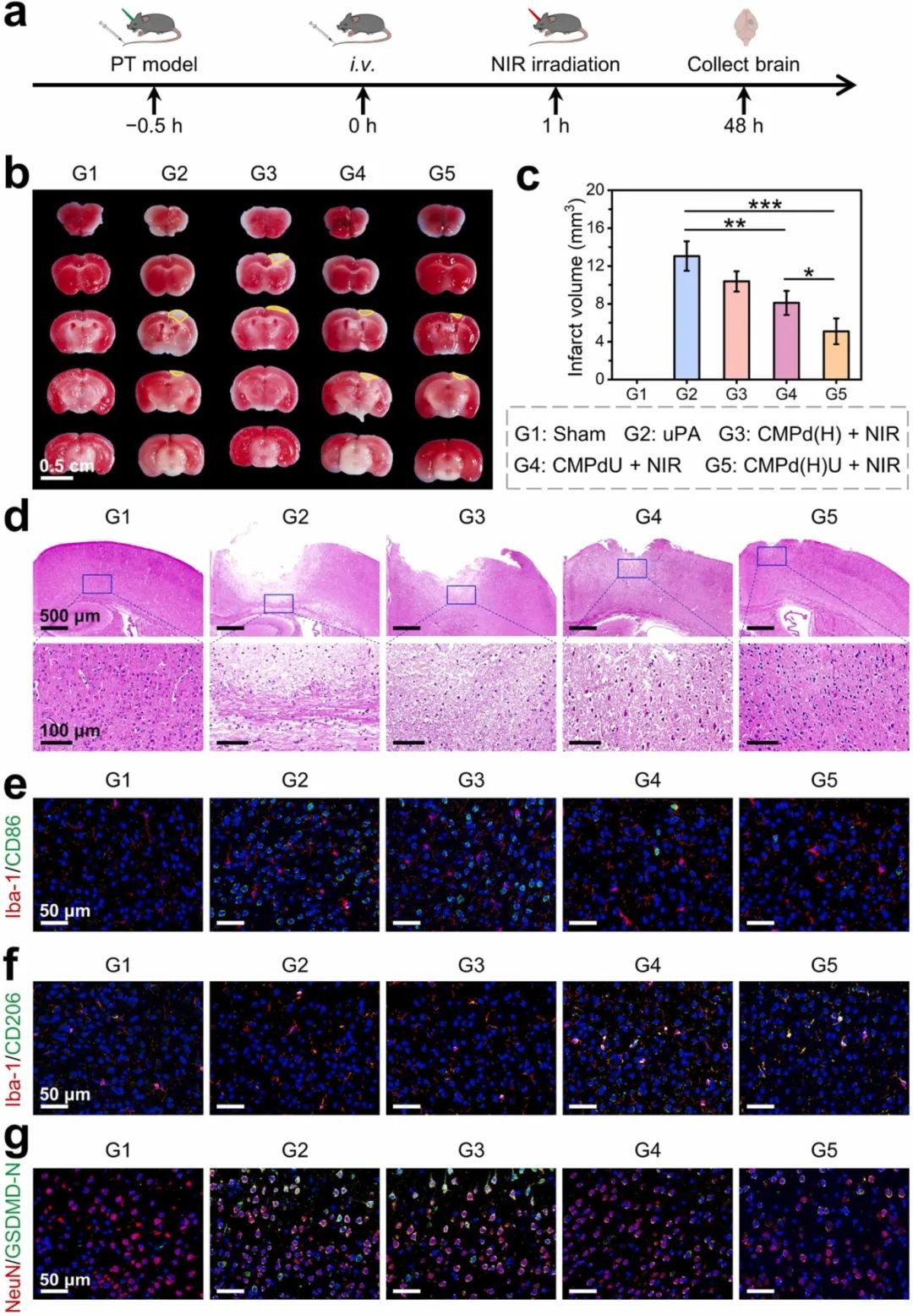
图8 CMPd(H)U在缺血性中风小鼠中的治疗效果。(a)治疗评估的时间安排;(b)TTC染色脑切片的代表性图像和(c)梗死体积的定量分析,右侧大脑半球的白色区域(黄色圆圈)代表梗死区域;(d)H&E染色脑切片的代表性图像;(e)在损伤部位周围CD86(M1标记物,绿色)和(f)CD206(M2标记物,绿色)的免疫荧光染色图像,Iba-1(小胶质细胞标记物)染成红色,细胞核染成蓝色;(g)在损伤部位周围NeuN(红色)和GSDMD-N(绿色)的免疫荧光染色图像,细胞核染成蓝色,每张图像的上下部分分别为边界组织和正常组织。数据为平均值±标准差(n≥3)。*p<0.05, **p<0.01, ***p<0.001
(6)神经运动功能评估
在治疗后不同时间点进行了包括旷场实验、旋转杆实验和圆柱实验的行为测试(图9a)。图9b-f所示,治疗后第三天,小鼠变得更加活跃,表明其运动能力得到恢复。CMPd(H)U + NIR治疗后,小鼠的运动协调能力显著提高,这些小鼠能够在旋转杆上停留更长时间(图9g和h)。图9i和j所示,经过CMPd(H)U + NIR治疗的PT小鼠在治疗7天后,在圆柱实验中前肢不对称性得分显著低于其他组。上述结果表明,CMPd(H)U纳米酶结合NIR治疗有助于中风后神经功能的康复。
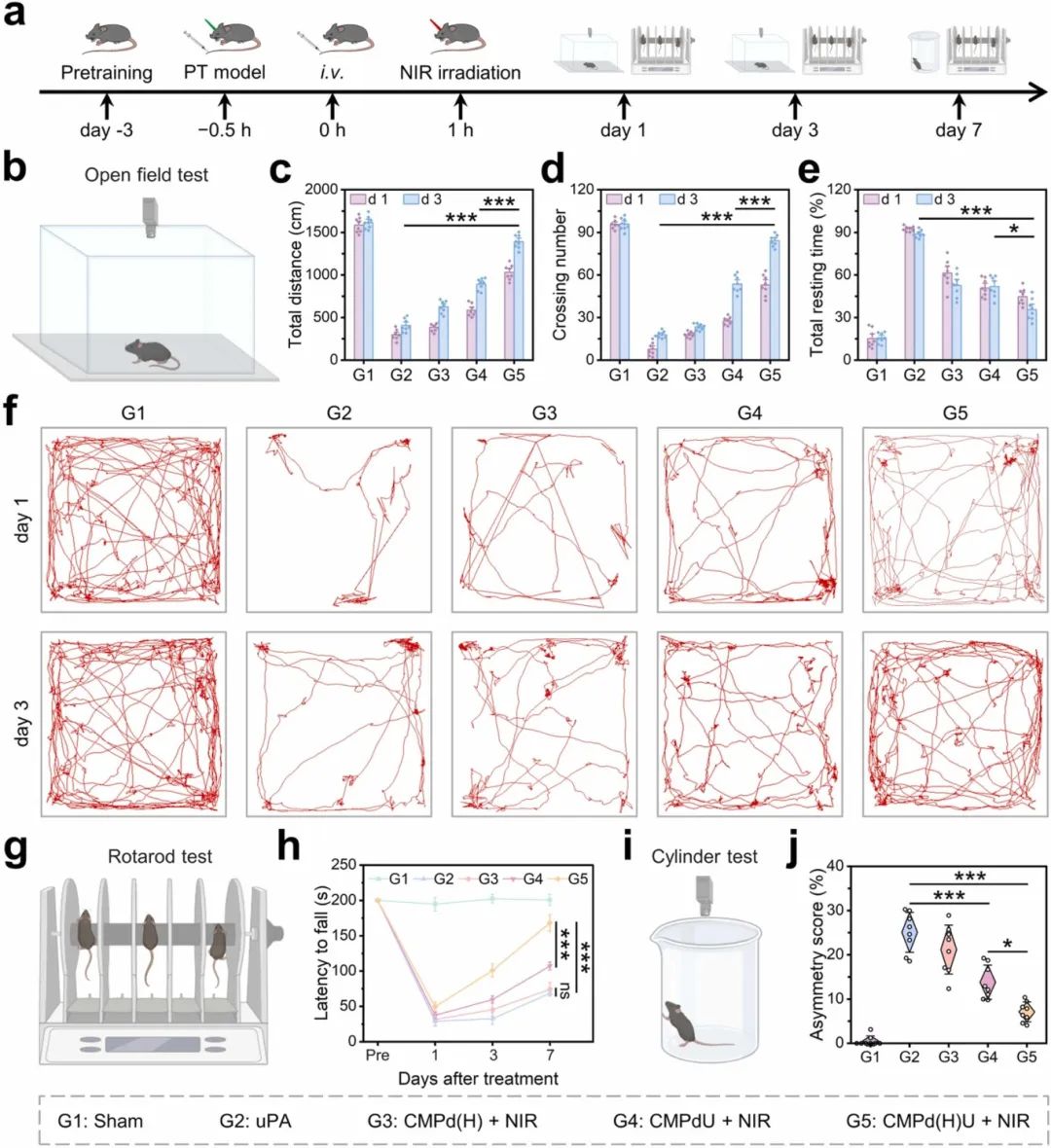
图9 CMPd(H)U治疗后中风后的神经运动功能恢复。(a)行为测试时间线的示意图;(b)开放场测试的示意图;(c)运动距离,(d)穿越格子的次数,(e)休息时间,以及(f)不同组小鼠在开放场测试中的运动轨迹图;(g)旋转杆测试的示意图,以及(h)跌落潜伏期;(i)圆柱体测试的示意图,以及(j)前肢使用不对称评分。数据为平均值±标准差(n≥8)。*p<0.05, **p<0.01, ***p<0.001, ns:不显著
该研究团队开发了一种多功能纳米酶(CMPd(H)U),用于缺血性中风的治疗,能够实现快速血栓清除和持久的氢气(H2)疗法。该纳米酶基于有序介孔金属有机框架(MOF),通过Hofmeister离子介导的软模板法合成,并锚定了具有光热性能和抗氧化功能的Pd纳米颗粒。此外,通过CREKA肽的修饰,使纳米酶能够特异性靶向血栓,负载的uPA和H₂则分别用于溶栓和抗氧化应激。 纳米酶在NIR照射下,能够加速uPA的释放并产生还原性H₂气泡,同时其内部的Pd纳米颗粒具有类超氧化物歧化酶和过氧化氢酶活性,可有效清除ROS,减轻再灌注损伤。此外,CMPd(H)U纳米酶能够穿过受损的血脑屏障,调节小胶质细胞极化至抗炎的M2表型,并抑制神经元焦亡,从而提供神经保护作用。在动物实验中,CMPd(H)U纳米酶显著提高了缺血性中风的治疗效果,缩小了脑梗死体积,并改善了神经功能恢复。该研究提供了一种新的治疗缺血性中风的策略,具有临床转化的潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

