
研究背景:
骨质疏松症是一种常见的全身性骨骼疾病,其特征是骨强度降低和骨折风险增加。随着人口老龄化加剧,骨质疏松相关的骨损伤发病率上升,给公共卫生带来了挑战。异常炎症反应所导致的不利微环境会阻碍骨修复过程,影响血流、代谢酶活性以及药物分布。治疗性支架通过装载生物活性化合物,能够改善骨微环境、减轻炎症并促进骨形成。传统金属和陶瓷材料虽然可以提供机械支撑,但可能会对脆弱的骨质疏松骨造成损害;可生物降解聚合物支架更适合用于骨修复,但普遍存在刚度过高和疏水性问题,影响细胞的粘附与增殖。
水凝胶由于其高含水量和低杨氏模量,降低了对骨组织的机械和生物风险,因此成为一种优选材料。其中,明胶水凝胶因其生物相容性和可降解性适用于骨修复,但传统类型的机械强度有限,易碎且不利于3D打印。尽管双网络结构或霍夫迈斯特效应可以增强其强度,但可能会延长凝胶化时间或引发渗透压问题,从而限制了其应用。鉴于炎症微环境调节对骨修复的重要性,支架需要结合药物调控系统。水凝胶具有良好的药物负载与缓释能力,合理选择抗炎剂至关重要。传统皮质类固醇可能会加剧骨质疏松,而靶向HIF-1α的策略则更为安全有效。例如,HIF-1α稳定剂罗沙司他可以抑制炎症并增强成骨细胞活性,是一种优化微环境的有前景的方案。

针对上述问题,上海交通大学林秋宁研究员团队开发了一种高强度明胶水凝胶支架,负载罗沙司他以重塑炎症微环境并增强骨质疏松性骨修复(图 1)。该支架采用甲基丙烯酸酯透明质酸 (HAMA) 和邻硝基苄基功能化明胶 (GelNB) 通过快速交联机制合成,该机制结合了传统自由基聚合与新型光触发瞬时自由基和持久自由基偶联 (PTPC) 反应。该支架采用数字光处理 (DLP) 3D打印制造,兼具高强度、生物相容性和可降解性,可促进细胞粘附、迁移和增殖。在负载罗沙司他的情况下,支架通过激活 HIF-1α通路有效重塑炎症微环境。这种协同方法在增强骨质疏松性骨修复方面显示出显著的功效。该文章于2025年2月19日以“High-Strength Gelatin Hydrogel Scaffold with Drug Loading Remodels the Inflammatory Microenvironment to Enhance Osteoporotic Bone Repair”为题发表于《Advanced Materials》(DOI:10.1002/adma.202501051)。
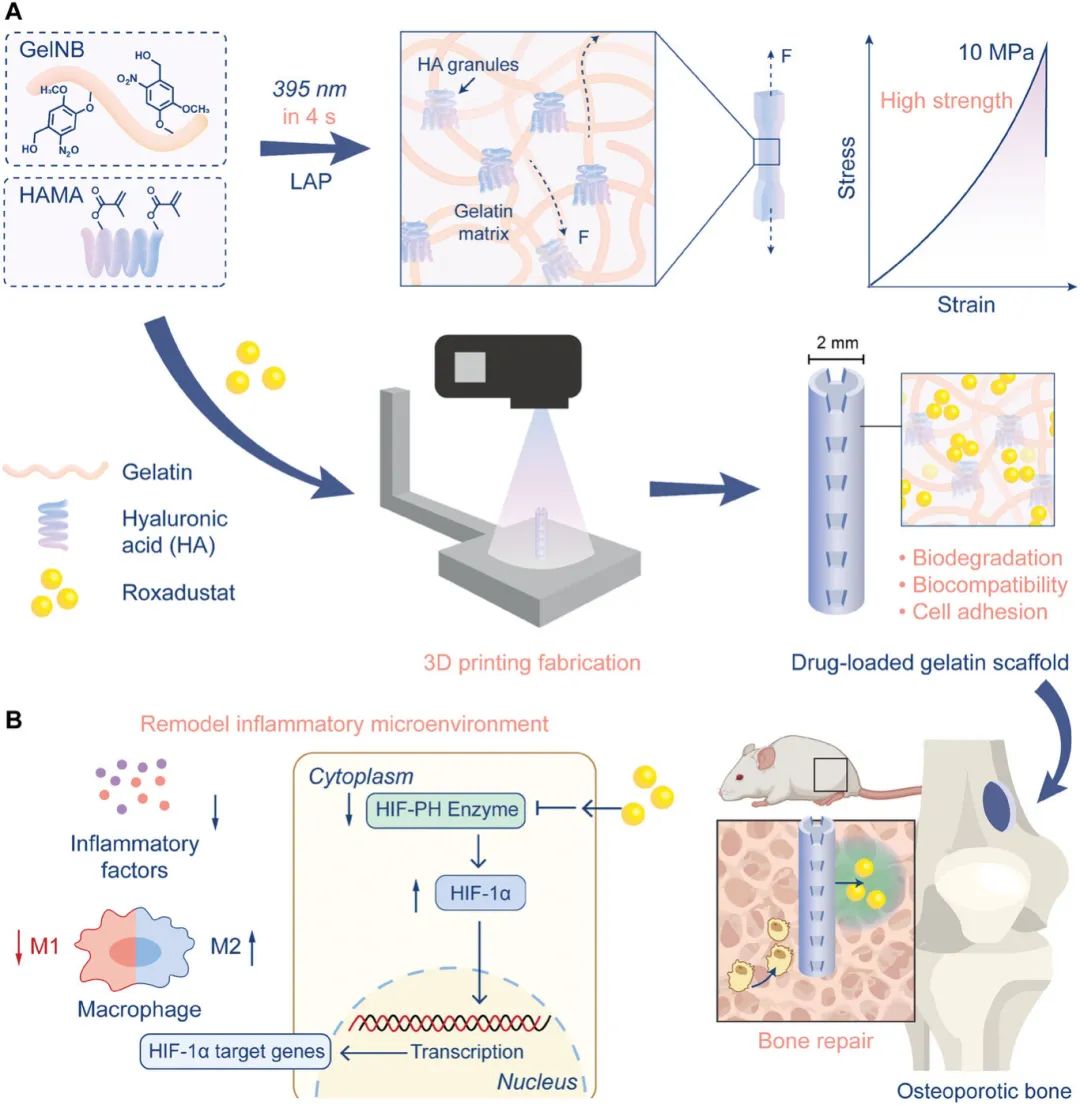
图1. 研究示意图
(1)高机械性能明胶水凝胶的构建
为保留明胶的优势(如生物降解性和细胞粘附性),选择透明质酸(HA)作为硬相材料,并采用PTPC反应进行交联。该反应有助于在水凝胶内原位形成分散相,增强硬相与基质的界面结合,从而提高关节强度和韧性。通过光照射GelNB、HAMA和光引发剂LAP溶液制备水凝胶。通过原子力显微镜(AFM)和扫描透射电子显微镜(STEM)表征,确认了HA的分布与硬颗粒相对应。调整HAMA含量以优化机械性能,发现随着HAMA含量增加,拉伸应变显著降低,杨氏模量相应增加。GelNB凝胶展现出优异的机械性能,可承受5公斤负载,且拉伸强度和韧性高于普通水凝胶。GelNB凝胶在强度与韧性之间保持良好平衡,并且具有优异的弹性和形状恢复能力,能在多次拉伸后保持超过80%的强度。它的抗压性能也突出,断裂强度达33.8 MPa。此外,GelNB凝胶在高含水量下仍保持良好强度和韧性,适合作为骨质疏松骨修复支架,展现出金属、陶瓷等传统材料无法比拟的优越性能。
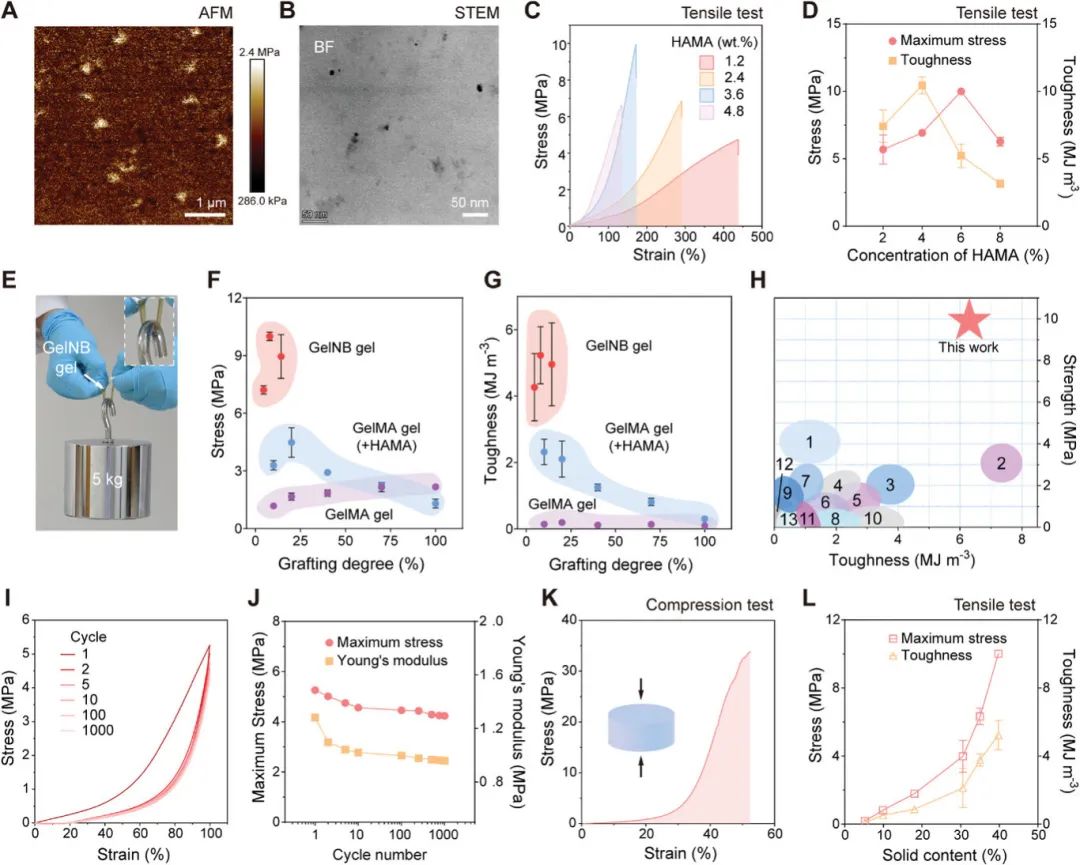
图2. GelNB凝胶的微观结构和机械性能。(A)AFM评估GelNB凝胶的杨氏模量分布;(B)STEM图像揭示了GelNB凝胶的微观结构;(C)具有不同HAMA含量(wt.%)的GelNB凝胶的代表性应力-应变曲线;(D)通过(C)中的拉伸测试确定GelNB凝胶的最大应力和韧性;(E)横截面积为5 mm²的GelNB凝胶图像;(F)GelNB凝胶与具有不同甲基丙烯酸酯接枝的GelMA凝胶和补充了HAMA的GelMA凝胶之间的应力比较;(G)GelNB凝胶与上述凝胶之间的韧性比较;(H)GelNB凝胶与各种先前报道的明胶水凝胶的综合强度和韧性对比;(I)GelNB凝胶在循环加载-卸载拉伸试验中的代表性应力-应变曲线;(J)GelNB凝胶在加载-卸载循环试验中指定循环次数后的最大应力和杨氏模量;(K)GelNB凝胶在压缩试验中的代表性应力-应变曲线;(L)具有不同固体含量的GelNB凝胶的最大应力和韧性
(2)通过 3D 打印制造明胶水凝胶支架
GelNB 凝胶在提供优异机械性能的同时,保持了卓越的细胞相容性,并且制备时间与传统的GelMA凝胶相当,且凝胶化速度很快(4秒),使其适用于DLP 3D打印等先进制造技术。通过这种技术,该团队成功打印了专为骨质疏松修复设计的空心管状支架,展现出GelNB凝胶优异的自支撑性和对外力的抵抗力,能够保持结构完整性。GelNB 凝胶支架在生物降解性方面表现突出,5天内完全降解,支持骨组织再生,并且降解时间较GelMA凝胶更长,能更持久地提供药物输送和结构支持。相比传统聚合物支架,GelNB 支架在支持细胞粘附和迁移方面也更为优秀,细胞在其表面均匀增殖和迁移。在大鼠植入模型中,GelNB凝胶表现出较低的免疫细胞浸润,表明其生物相容性优于PCL和PLA。总体而言,GelNB凝胶结合了高机械强度、理想的加工性、细胞支持能力、生物降解性和组织顺应性,是骨质疏松骨修复支架的理想材料,超越了金属材料、合成聚合物及传统GelMA凝胶的性能。

图3 GelNB凝胶支架的制造、降解、生物相容性和细胞粘附。(A)L929细胞暴露于GelNB凝胶和GelMA凝胶的浸出液24小时后的活力;(B)GelNB凝胶的流变学分析表明,GelNB凝胶的胶凝时间(G’>G’’;G’,储能模量;G’’,损耗模量)小于4秒;(C)使用GelNB凝胶制造3D打印空心管状支架和局部放大特征;(D)使用GelNB凝胶制造的支架在扭曲和拉伸下的抵抗力;(E)GelNB凝胶和GelMA凝胶在酶溶液(胶原酶I 50 U mL⁻¹,HAase 200 U mL⁻¹)中的降解曲线;(F)在GelNB凝胶、PCL和PLA支架表面共培养时HUVEC细胞粘附性的比较;(G)GelNB凝胶、GelMA凝胶、金属和可生物降解聚合物之间的机械性能、可加工性、柔顺性、细胞粘附性、降解性和生物相容性的比较
(3)GelNB凝胶支架负载并逐渐释放药物,促进骨质疏松大鼠骨修复
该团队将罗沙司他添加到GelNB凝胶前体中,制备了载药支架(Gel@Rox)并评估了其药物释放性能。通过剧烈搅拌将罗沙司他粉末混合进水凝胶前体,形成均匀悬浮液后辐照固化。由于罗沙司他在中性pH下溶解度有限,预计药物会逐渐从凝胶基质中释放。我们制备了不同罗沙司他浓度(0、20、40、80 mM)的Gel@Rox支架,随着药物浓度增加,支架变为乳黄色,药物形成微粒,并在第一周表现出稳定的释放。药物释放最高(80 mM)的支架可维持一个月,累积释放量最大。通过扫描电子显微镜(SEM)观察药物释放对支架形态的影响,结果显示Gel@Rox支架释放药物后保持孔隙结构,形成分级多孔结构,显示出长期药物释放的潜力。为了评估其骨修复效果,我们在骨质疏松大鼠股骨缺损模型中植入Gel@Rox支架,并在第4周和第8周通过micro-CT、H&E和Masson染色评估骨修复情况。Gel@Rox 40和Gel@Rox 80组在第4周空洞面积明显减少,第8周进一步减小,且骨体积(BV)和骨小梁数量(Tb.N)增加,修复效果与药物浓度正相关。组织学染色结果显示,Gel@Rox支架具有良好的生物相容性,并能促进新骨生成,尤其在Gel@Rox 40和Gel@Rox 80组,纤维骨痂逐渐转化为新骨。到第8周,Gel@Rox组显示更多的新骨形成,并与水凝胶支架融合,展现出优异的骨修复能力。基于最佳成骨效果,Gel@Rox 80支架被选为后续研究材料。
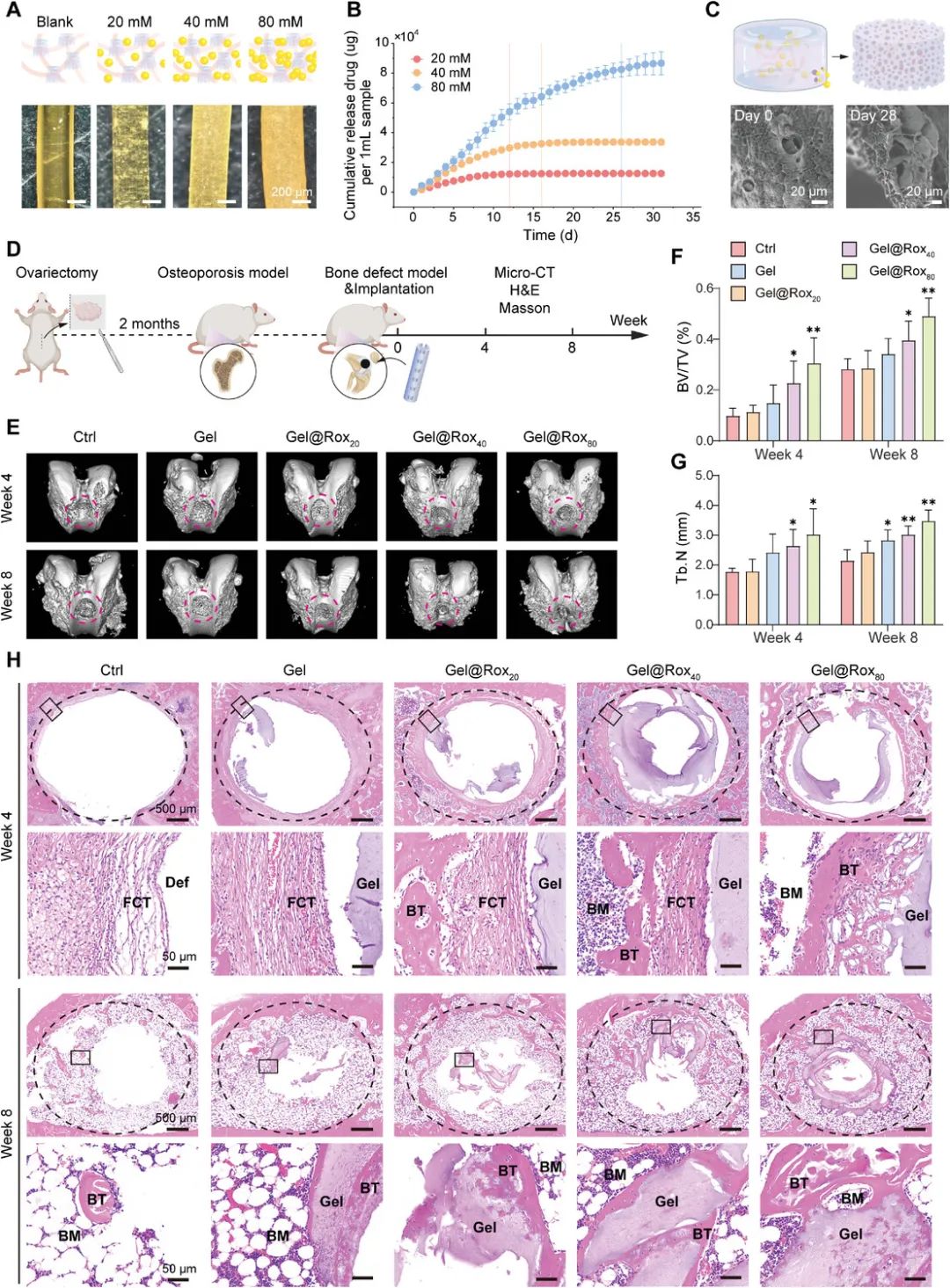
图4 GelNB凝胶支架的药物负载和释放性能及其对骨质疏松性骨修复的功效。(A)负载不同浓度罗沙司他的GelNB凝胶的形态;(B)评估不同浓度罗沙司他负载的GelNB凝胶支架的释放性能;(C)在药物释放前(第0天)和在PBS中大量释放后(第28天)捕获负载80 mM罗沙司他的GelNB凝胶的SEM图像;(D)在植入或不植入支架的情况下在骨质疏松大鼠中创建骨缺损的过程示意图;(E)使用各种方法在治疗后第4周和第8周通过微型计算机断层扫描(micro-CT)3D重建评估股骨缺损修复情况;对(E)中的骨体积与总体积(BV/TV)比率(F)和小梁数(Tb.N)(G)进行统计分析;(H)使用各种方法对治疗后第4周和第8周的骨质疏松大鼠股骨缺损进行H&E染色
(4)Gel@Rox支架有效重塑炎症微环境促进骨生成
该团队认为Gel@Rox支架能显著促进骨缺损修复,主要通过调节炎症微环境。过度和长期的炎症通常会延迟愈合,因此研究了Gel@Rox支架对炎症因子表达和免疫细胞募集的影响。在骨质疏松大鼠的炎症因子TNF-α和IL-6水平的比较中,他们发现骨质疏松组在四个时间点的炎症因子水平显著升高,表明其炎症状态持续较长。与Gel组相比,Gel@Rox 80支架显著降低了整个炎症期的TNF-α和IL-6水平。通过H&E染色分析,Gel@Rox 80组免疫细胞密度显著下降,推测其通过降低趋化因子水平抑制免疫细胞的募集。这一机制与HIF-1α通路的激活相关,HIF-1α已知能下调趋化因子的表达。进一步通过蛋白质印迹和免疫荧光分析评估了M1(促炎)和M2(抗炎)巨噬细胞的极化情况。结果显示,在Gel@Rox 80组中,M1/M2比率显著降低,表明其有效地促进了抗炎状态。最后,RNA-seq和Western blot分析表明,Gel@Rox 80支架通过激活HIF-1α信号通路,有助于微环境的重塑,这一发现与已有研究一致。

图5 Gel@Rox支架对骨缺损骨质疏松大鼠炎症微环境的影响。(A、B)使用各种方法治疗后第1、4、7和10天骨缺损部位TNF-α(A)和IL-6(B)的基因表达水平;(C)免疫荧光染色显示使用各种方法治疗后第10天骨缺损部位CD68、INOS和CD163的表达水平;(D、E)损伤后第4天骨缺损部位HIF-1α信号通路基因集富集分析和热图分析,(D)中数据比较了骨质疏松组和健康组(n=4),(E)中数据比较了Gel@Rox 80组和骨质疏松组(n=4);(F)代表性蛋白质印迹结果显示第1、4、7和10天骨缺损部位HIF-1α的表达水平
综上所述,该团队通过将分散相引入明胶网络,成功开发出一种高强度明胶水凝胶。这些分散相通过 HAMA 聚合形成,并通过 PTPC 反应与明胶紧密连接。这种水凝胶在几秒钟内完成光固化,具有出色的可加工性。利用 DLP 3D 打印,该团队用这种水凝胶设计了一种空心管状支架,专门用于修复骨质疏松性骨缺损。水凝胶支架具有明胶固有的优势,包括完全生物降解性和支持细胞粘附和迁移的能力。植入后,与由 PCL 和 PLA 制成的先进支架相比,它表现出更优异的组织顺应性和生物相容性。 为了应对由骨质疏松症的炎症微环境引起的骨缺损修复挑战,这种水凝胶支架利用了其载药和缓释能力,结合了材料固有的优势。它通过HIF-1α信号通路有效促进炎症微环境向有利于骨再生的微环境转变,最终增强骨质疏松性骨修复。该团队的研究不仅验证了微环境重塑对骨质疏松性骨缺损的治疗潜力,还引入了一种专门针对炎症微环境的新型支架和药物联合疗法。这种创新方法为改善骨质疏松性骨修复提供了一种有效的策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

