
干眼病(DED)是一种常见的眼表疾病,影响全球5%–50%的人群,主要特征包括慢性炎症、上皮损伤和泪膜不稳定。尽管其临床表现已有详细描述,但其发病机制仍不清楚。T细胞介导的免疫反应,特别是分泌白细胞介素 17(IL-17)的Th17细胞与调节性T细胞(Tregs)之间的平衡,在DED的进程中起关键作用。然而,针对该平衡在DED患者中的研究仍较少。
P物质(SP)是一种由角膜神经分泌的神经肽,在角膜健康中起着双刃剑的作用。其生理水平可促进角膜愈合,但过量的SP会通过神经激肽1受体(NK1R)激活Th17细胞并抑制Tregs功能,从而加剧神经源性炎症。研究表明,使用CP-99994或Spantide I等NK1R拮抗剂可抑制Th17激活,维持Tregs功能,并缓解DED症状。尽管这一通路具有治疗潜力,但传统眼部给药方式存在生物利用度低和毒副作用等问题。

针对上述问题,四川医学科学院张瑞帆团队研究开发了一种针对SP/NK1R通路的新型靶向药物,通过丝素蛋白(SF)负载NK1R拮抗剂(CP99,994)构建纳米颗粒药物递送系统,并结合水凝胶用于眼部给药。结果表明,SF@CP@Gel是一种安全有效的抗炎修复药物,可调节Th17/Treg平衡,修复角结膜损伤,并显著缓解实验性DED的症状和体征。尽管已有研究探索纳米颗粒负载水凝胶在眼表给药中的应用,但本研究首次将SF纳米颗粒与NK1R拮抗剂相结合,构建长效药物递送系统,不仅调节Th17/Treg平衡,还促进眼表组织修复,为DED治疗提供了新的解决方案。该文章于2025年02月22日以《A Silk Fibroin Nanoparticle Hydrogel Loaded With NK1R Antagonist Has Synergistic Anti-Inflammatory and Reparative Effects on Dry Eye Disease》为题发表于《Advanced Science》上。(DOI: org/10.1002/advs.202404835)。
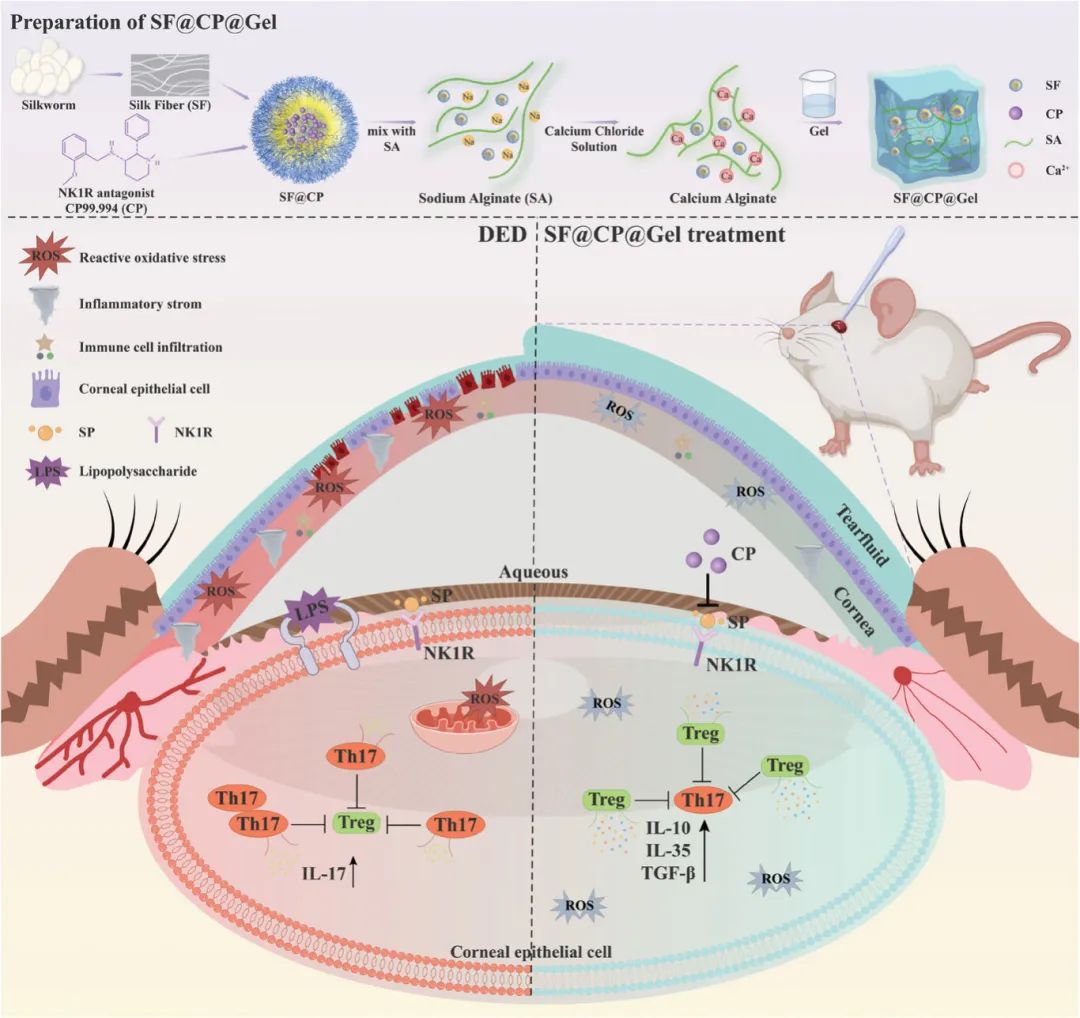
图1. SF@CP@Gel的研究示意图
(1)载药SF凝胶的制备和表征
首先,对SF@CP纳米系统进行表征,以评估其稳定的载药和释药性能。动态光散射(DLS)测得SF@CP水合直径为122 nm(图2A),透射电子显微镜(TEM)观察到其球形结构,尺寸约120 nm(图2B),与DLS结果一致。稳定性测试表明SF@CP在7天内保持145 nm,显示良好的体内循环与缓释能力(图2C)。电位滴定和紫外光谱(UV)分析证实CP成功负载(图2D,E),载药率和包封率分别为71.7%和15.2%(图2F)。SF@CP@Gel的物理化学性质进一步表征。扫描电镜(SEM)显示SF@CP@Gel呈现3D网络结构(图2G,H),表明水凝胶成功负载CP。物理图像显示其透明均匀,无明显颗粒沉淀(图2I)。核磁共振(NMR)分析表明SF@CP@Gel形成π–π相互作用(图2J)。流变学测试(图2K)表明凝胶主要呈液态,随剪切应变增加,储能模量(G′)下降,且无“凝胶点”,说明其流动性较强。凝胶在PBS中快速吸水膨胀,最大膨胀率达800%(图2M)。释药曲线(图2N)显示,6 h释放60%,12 h达平衡(80%),并可维持25 h。结果表明,SF@CP@Gel具备稳定载药、控制释放及良好流变特性,有望用于药物递送。

图2. 载药纳米系统的特征及载药SF水凝胶的物理化学性质。(A)SF@CP的DLS直径;(B)SF@CP的TEM图像;(C)SF@CP在7天内的尺寸稳定性;(D)SF、CP和SF@CP的Zeta电位;(E)SF、CP和SF@CP的紫外光谱分析;(F)SF@CP的载药效率及CP的包封效率;(G)凝胶的SEM图像;(H)凝胶的SEM图像;(I)SF@CP@Gel的实物图像;(J)Gel、SF@Gel和SF@CP@Gel的质子核磁共振(¹H-NMR)谱图;(K)凝胶、SF@Gel和SF@CP@Gel的流变性能测试;取15 mL样品,使用微红外流变仪进行振荡速率扫描(25 °C ± 0.2 °C,γ = 0%–1000%,f = 1 Hz);(L)凝胶、SF@Gel和SF@CP@Gel的粘度-时间关系曲线;固定温度25 °C,应变γ = 1%,频率f = 1 Hz;(M)凝胶、SF@Gel和SF@CP@Gel的溶胀比;(N)药物释放行为
(2)载药 SF 水凝胶的体外细胞毒性
新药开发的首要条件是无害或低细胞毒性。该团队使用CCK-8实验评估了载药材料的生物相容性,并检测了人角膜上皮细胞(HCECs)的活性。如图3A所示,空白组与SF组的光密度(OD)值几乎相同,表明SF不会影响细胞活力。此外,进一步研究了凝胶材料对细胞活力的影响。结果显示,空白组和凝胶组的细胞随时间稳步增殖,且不同浓度SF@CP@Gel浸提液处理的细胞活力均未显著下降,与空白组相比无明显差异。这表明纳米载体和凝胶材料均具有良好的安全性。
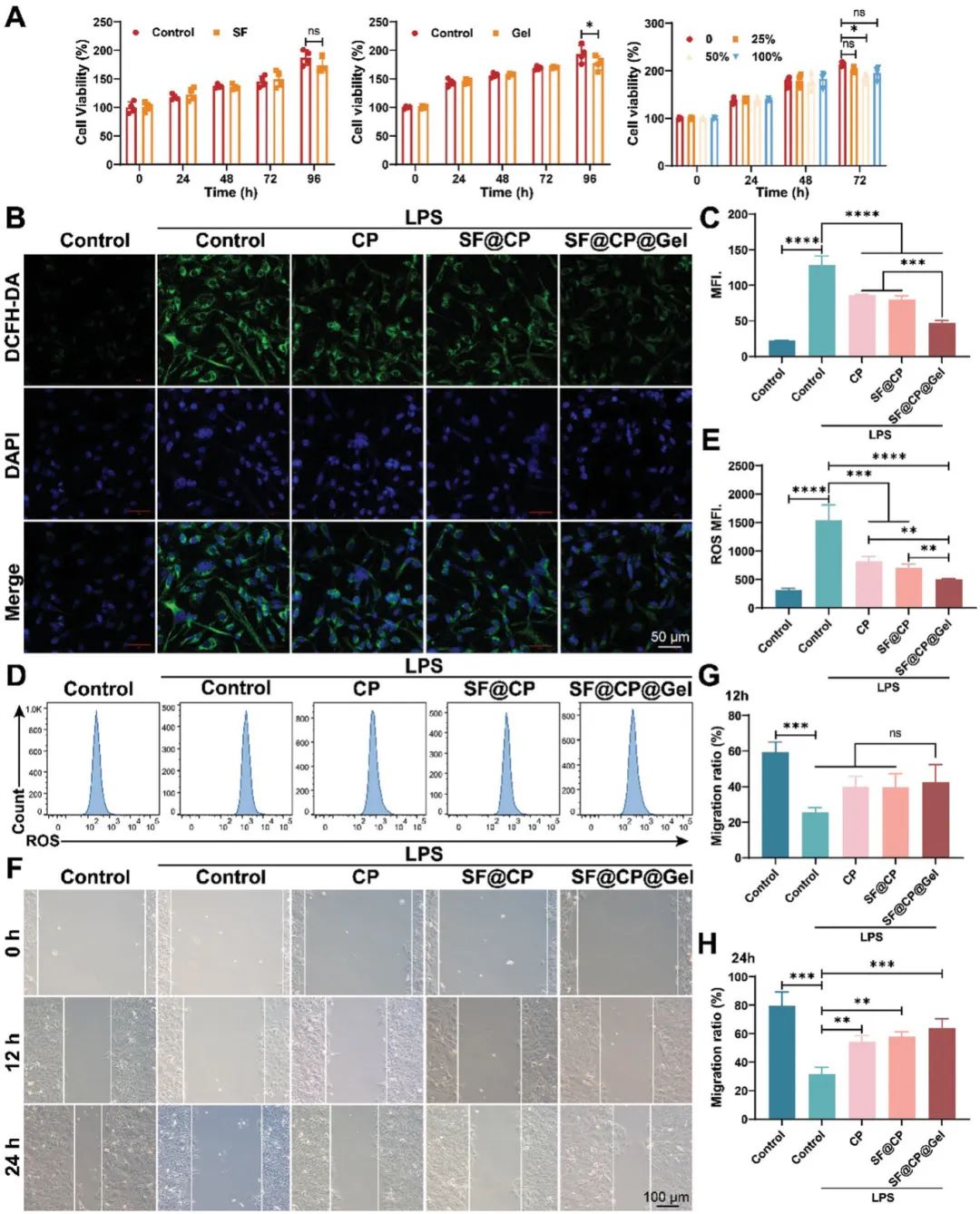
图3. 不同载药生物材料的体外细胞毒性、抗氧化和细胞迁移测试。(A)细胞活力评价;(B)DCFH-DA标记的细胞ROS图像;(C)使用DCFH-DA监测ROS生成的半定量分析;(D)使用流式细胞仪监测ROS的生成;(E)使用流式细胞仪监测ROS生成的半定量分析;(F)细胞划痕实验;(G)划痕面积统计
(3)有效的抗氧化和促细胞迁移能力
该研究利用生长良好的原代HCECs评估了不同药物亚组的抗氧化能力和迁移能力。首先,通过检测活性氧(ROS)含量评估细胞氧化损伤程度(图3B)。二氯荧光素(DCF)探针与ROS结合后,在共聚焦显微镜下呈现绿色荧光,荧光强度越高,ROS含量越高,细胞核则以DAPI标记。从共聚焦图像可见,CP、SF@CP和SF@CP@Gel(CP浓度5 µg/mL)处理组的ROS荧光水平较对照组显著降低,统计结果见图3C。其中,SF@CP@Gel组ROS含量显著低于其他两组(p < 0.001)。此外,流式细胞术通过FITC通道检测绿色荧光,以定量评估细胞氧化损伤程度(图3D),其半定量结果见图3E。结果表明,三种处理组的ROS水平均显著低于对照组,且虽无显著性差异,但呈下降趋势。通过划痕实验进一步探讨SF凝胶载药对细胞迁移能力的影响(图3F),并在12 h和24 h时分别进行定量分析(图3G,H)。结果显示,12 h时各处理组细胞迁移率均有所增加,但差异无统计学意义;24 h时,所有处理组细胞迁移率均显著高于对照组,且三组间无显著性差异。
(4)治疗效果的体内评估
实验小鼠药物给药时间表见图4A。通过临床指标(如泪液分泌量和角膜荧光素染色(CFS))评估CP组、SF@CP和SF@CP@Gel治疗组在干眼症小鼠模型中的疗效。图4B显示,正常组和模型组的泪液分泌量分别为0.62 mm和0.25 mm,表明干眼症模型成功构建。治疗14天后,SF@CP和SF@CP@Gel组的棉线长度接近0.39 mm。通过CFS评估角膜上皮损伤,图4C显示角膜上皮缺损为黄色绿色区域。14天后,SF@CP@Gel组CFS评分比DED组降低93.2%,优于其他组。ELISA检测Treg细胞功能,图4D显示DED模型组与正常组在IL-10、IL-35和TGF-β1水平上差异显著(p < 0.0001)。SF@CP@Gel组的IL-10水平是DED组的5.01倍(p < 0.001),且IL-35和TGF-β1水平显著上调。HE染色分析显示药物在体内具有生物安全性。
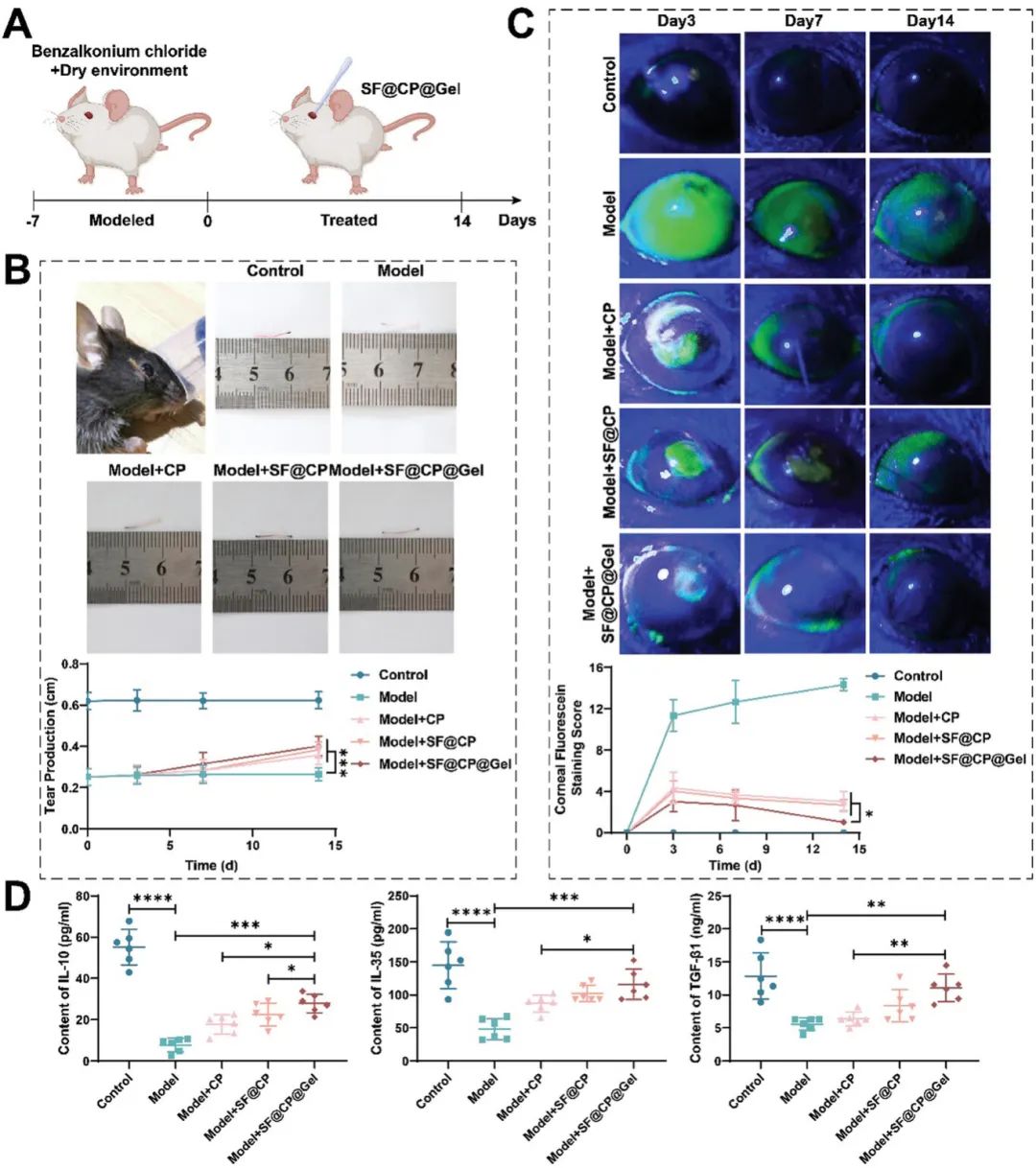
图4. 不同给药系统的给药时间线及体内治疗效果。(A)治疗实验时间线;(B)对照组、DED模型组、CP治疗组、SF@CP治疗组和SF@CP@Gel治疗组的泪液分泌情况及统计分析;(C)不同组别的角膜荧光素染色评分(CFS)及统计分析:对照组、DED模型组、CP治疗组、SF@CP治疗组和SF@CP@Gel治疗组;(D)用ELISA法测定结膜组织中IL-10、IL-35和TGF-β1的含量
(5)治疗效果的组织学评估
为评估药物治疗后干眼小鼠的损伤组织恢复情况,收集眼球、角膜和结膜样本进行组织学检查。HE染色(图5A)显示,干眼模型组角膜上皮细胞排列紊乱、数量增多,基质层胶原纤维肿胀且与上皮层交织,结膜严重损伤。治疗后,各治疗组角膜上皮细胞数量减少,胶原纤维排列逐渐整齐,结膜细胞排列恢复。SF@CP@Gel组角膜形态接近正常组,效果优于CP和SF@CP组。Masson染色(图5B)显示,模型组角膜胶原纤维交织肿胀,治疗组胶原纤维排列恢复,肿胀消失。TUNEL实验(图5C)显示,模型组角膜上皮细胞凋亡显著高于正常组(p < 0.0001)。治疗后,CP、SF@CP和SF@CP@Gel组凋亡细胞百分比分别减少26.29%、63.98%和87.43%,表明SF@CP@Gel具有显著的抗氧化和组织修复效果。
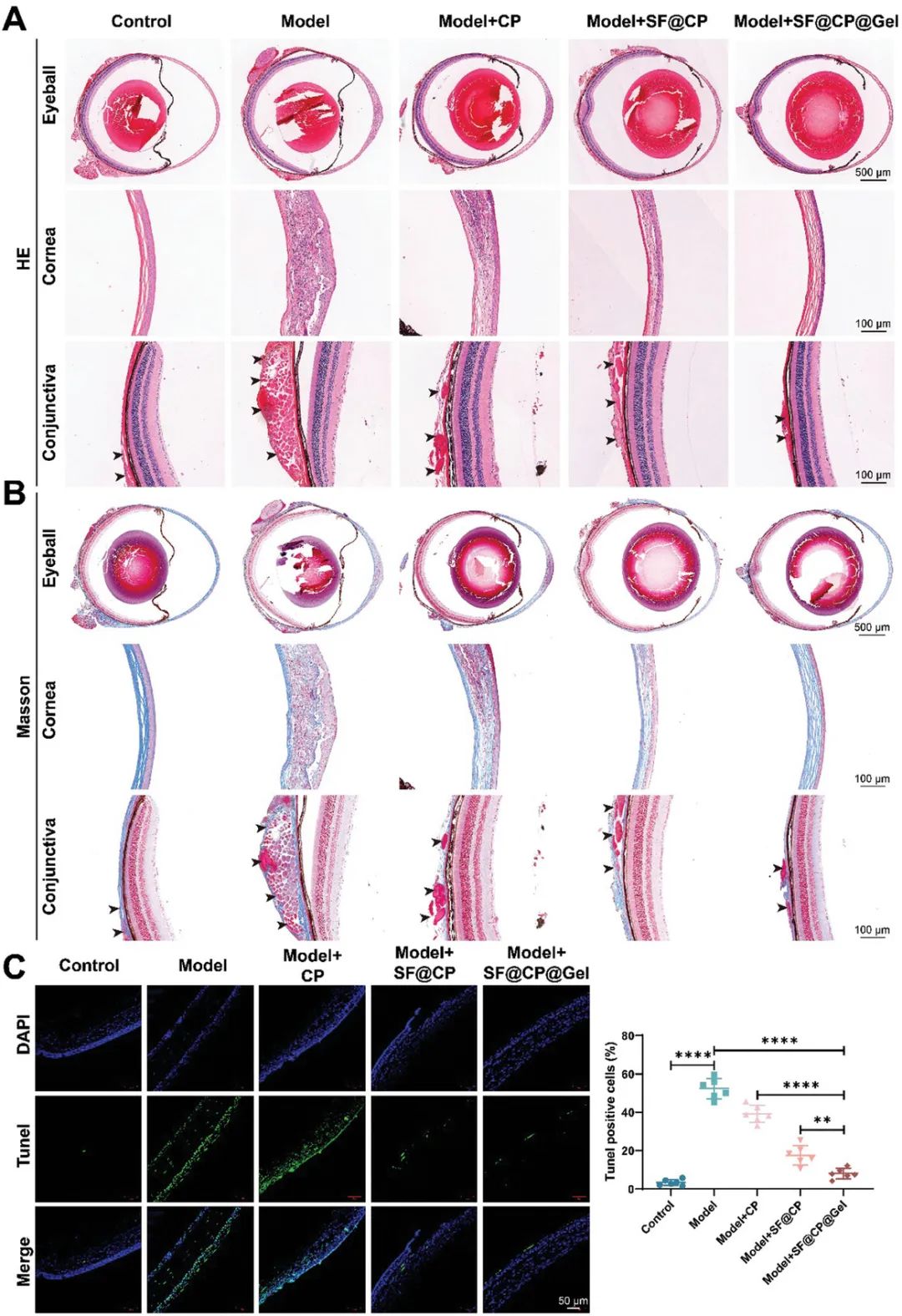
图5.不同药物递送系统的组织学分析。(A)角膜的HE染色;(B)角膜的Masson染色;(C)角膜的TUNEL染色和定量
(6)SF@CP@Gel 调控 SP/NK1R 信号通路
为确认SF@CP@Gel的疗效,对治疗前后角膜和结膜中的SP和NK1R进行DAPI复合染色(蓝色为阴性,黄色为阳性),并用荧光显微镜观察(图6)。通过ImageJ定量SP(图6A)和NK1R(图6B)的综合光密度(IOD)。正常组与模型组的SP和NK1R IOD差异显著(均p < 0.0001),证实干眼模型成功构建。图6显示,各治疗组与模型组相比,SP和NK1R在角膜和结膜中的下调均显著。SF@CP@Gel治疗后,干眼小鼠角膜中SP的IOD减少43.74%(p < 0.0001),结膜中减少48.30%(p < 0.0001)。角膜中NK1R的IOD减少46.12%(p < 0.0001),结膜中减少44.00%(p < 0.0001)。CP和SF@CP治疗也显著降低了SP和NK1R水平,但SF@CP@Gel效果最佳,使其表达接近正常组水平。
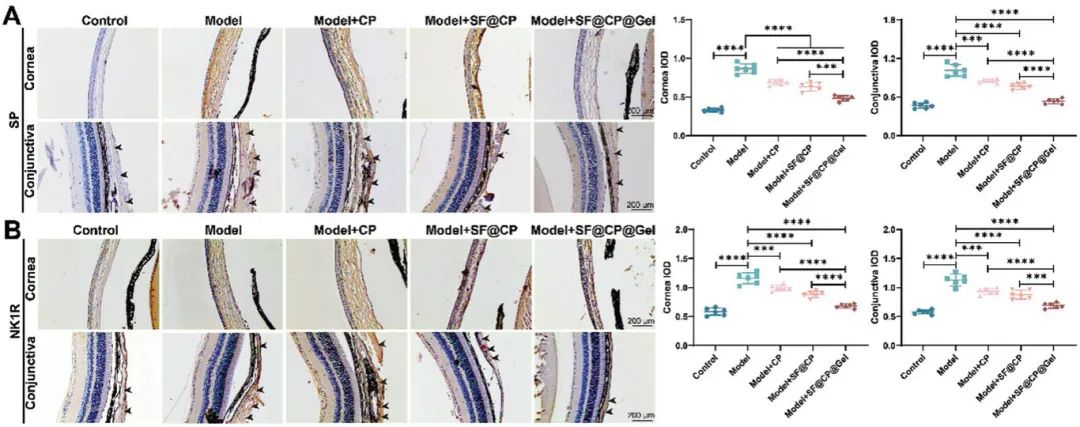
图6. 角膜和结膜中 SP 和 NK1R 表达的免疫组织化学分析。(A)角膜的SP免疫组化染色和定量统计;(B)角膜的NK1R免疫组化染色和定量统计
(7)SF@CP@Gel能有效调节Th17/Treg细胞平衡
通过流式细胞术分析了角膜、结膜和淋巴结中Th17和Treg细胞的百分比(图7)。所有治疗组中,角膜、结膜和淋巴结中CD4[+]IL-17[+] T细胞的频率显著低于干眼小鼠模型(p < 0.0001)。SF@CP@Gel在DED模型中的治疗效果最佳,角膜、结膜和淋巴结中分别减少了73.56%、64.01%和55.94%。在角膜和结膜中(图 7A,B),SF@CP@Gel组的CD4[+] IL-17[+] T细胞频率显著低于CP和SF@CP治疗组(p < 0.001)。在淋巴结中(图 7C),SF@CP@Gel组Th17细胞的减少也显著高于CP组(p < 0.01)。Treg细胞分析显示,SF@CP@Gel治疗后,角膜、结膜和淋巴结中的CD25[+] Foxp3[+] T细胞频率显著增加。在结膜中,SF@CP@Gel组Treg细胞的上调显著高于CP和SF@CP组(p < 0.0001)。尽管角膜和淋巴结中三组间无显著差异,但仍显示上调趋势。通过实时PCR分析了IL-17A和Foxp3转录因子的mRNA表达(图7D,E)。角膜中,SF@CP@Gel组IL-17A mRNA的表达显著低于其他组(p < 0.0001)。结膜中,SF@CP@Gel治疗组IL-17A mRNA表达比DED模型组低55.04%(p < 0.001)。在角膜和结膜中,SF@CP@Gel组Foxp3 mRNA的表达显著高于其他组,表现出强烈的Treg细胞功能标志Foxp3的上调。
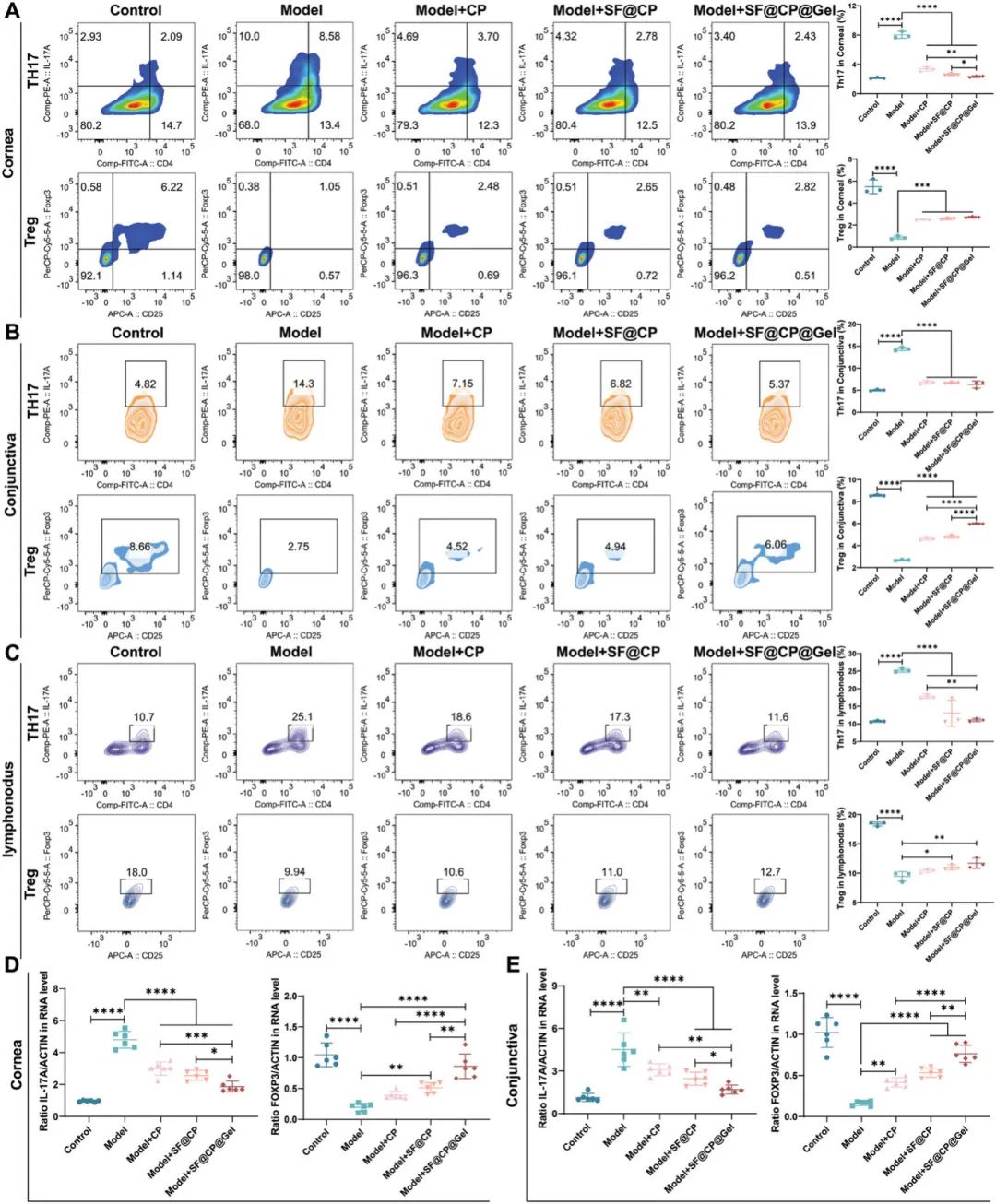
图7. 流式细胞术分析Th17和Treg细胞,以及PCR分析不同组织中的IL-17A和Foxp3。(A)在DED诱导后第14天,流式细胞术评估角膜中IL-17A⁺Th17和Foxp3⁺Treg细胞的频率;(B)流式细胞术检测小鼠结膜中IL-17A⁺Th17和Foxp3⁺Treg细胞的频率;(C)流式细胞术检测小鼠淋巴结中IL-17A⁺Th17和Foxp3⁺Treg细胞的频率;(D)角膜中IL-17A和Foxp3的RNA水平;(E)结膜中IL-17A和Foxp3的RNA水平
干眼症(DED)是全球范围内发病率较高的公共卫生问题,严重影响患者生活质量并造成经济负担。近年来,针对干眼症的抗炎药物不断开发,但鲜有药物能同时解决炎症和修复眼表损伤。 本研究开发了一种载有丝素蛋白(SF)和NK1R拮抗剂(CP)的眼用凝胶(SF@CP@Gel),并验证了其长期缓释能力。在干眼症小鼠模型中,SF@CP@Gel通过持续释放CP有效改善了泪膜稳定性和角膜上皮损伤,同时SF协同增强了修复效果。研究还表明,SF@CP@Gel通过阻断SP/NK1R通路调节Th17/Treg细胞平衡,显著恢复Treg细胞功能,抑制Th17细胞介导的炎症反应。此外,SF@CP@Gel显著降低了角膜和结膜中SP和NK1R的表达,进一步证实其通过SP/NK1R信号通路调控眼表炎症的能力。 SF作为FDA批准的生物材料,具有良好的生物相容性和药物缓释特性,结合水凝胶系统可支持角膜组织再生。研究结果表明,SF@CP@Gel是一种具有抗炎和修复功能的长效缓释眼部制剂,为干眼症的临床治疗提供了新策略,具有广阔的转化应用潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

