
骨缺损由于老化、严重创伤和疾病而普遍存在,对患者的生活质量造成重大影响。尽管传统的骨替代材料如自体移植、同种异体移植和异种移植在临床上被广泛用于骨缺损修复,但它们可能引发免疫反应和局部炎症,导致治疗失败并可能加剧病情。炎症微环境在骨缺损修复初期的重要性,以及巨噬细胞在调节骨髓间充质干细胞(BMSC)成骨分化中的关键作用。同时,在炎症环境下,BMSC的线粒体功能障碍会导致能量代谢异常,阻碍骨再生过程。
然而,目前的治疗方法并不能解决由局部炎症引起的BMSC能量支持不足和线粒体功能障碍问题。巨噬细胞作为先天性免疫细胞,其在骨损伤响应中的极化转变对正常骨再生至关重要,但目前的治疗方法无法有效调节这一过程。因此,研究者正在寻求新的治疗材料和机制,以更有效地控制炎症反应并促进骨再生。

针对上述问题,浙江大学杨国利、浙江工业大学杨晋涛及佐治亚理工学院张冬团队合作开发一种工程化的分层水凝胶,该水凝胶能够响应免疫环境,通过靶向线粒体转移来恢复BMSC的线粒体生物能量,从而促进骨再生。这种水凝胶结合了抗炎药物和巨噬细胞靶向的纳米凝胶,旨在通过调节巨噬细胞的极化和增强线粒体功能,为骨缺损治疗提供新策略。这项研究不仅提供了新的治疗思路,而且对于理解线粒体转移在骨缺损修复中的作用以及免疫和生物能量调节治疗策略在组织再生中的重要性具有研究价值和实际应用前景。该文章于2024年09月11日以《An Engineered Hierarchical Hydrogel with Immune Responsiveness and Targeted Mitochondrial Transfer to Augmented Bone Regeneration》为题发表于《Advanced Science》(DOI:10.1002/advs.202406287)。
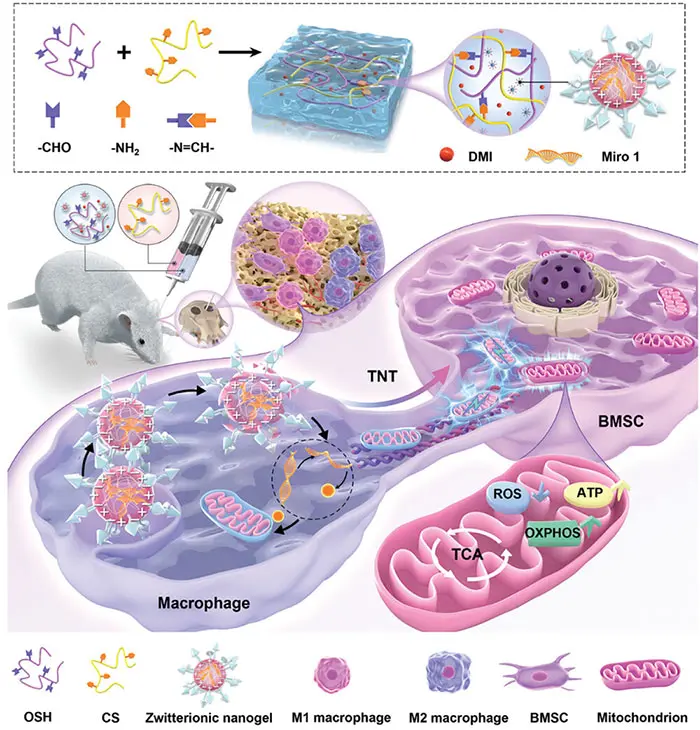
图1. 示意图显示了实现靶向生物调节的工程分层水凝胶。工程化分层水凝胶可以提供适合成骨的机械环境,并通过调节炎症和促进细胞间线粒体转移来调节BMSC的能量代谢。转移的线粒体可以通过降低 BMSC 中的 ROS 水平并增加 ATP 和 OXPHOS 水平来增强成骨分化和骨修复
(1)隧道纳米管介导巨噬细胞和 BMSC 之间的线粒体转移 该段展示了巨噬细胞与骨髓间充质干细胞(BMSC)之间的线粒体转移机制,揭示了这一过程在骨缺损修复中的潜在作用。通过单细胞RNA测序分析(图2a),研究人员发现巨噬细胞分泌的信号蛋白如SPP1、TGF-β和GDF对成骨细胞系细胞具有显著的靶向作用,而图2b和c的热图进一步强调了巨噬细胞在骨修复过程中与其他细胞群体的密切相互作用。利用扫描电子显微镜(SEM)图像(图2d和e),观察到巨噬细胞与BMSC之间通过隧道纳米管(TNT)形成了物理连接,并且在巨噬细胞膜上形成了多个接触点。免疫标记实验(图2f)证实了Sec3和Sec5蛋白在TNT募集的肌动蛋白骨架处的共定位,以及Tom20-GFP标记的线粒体在TNT中的共定位。图2g的免疫荧光图像显示了Miro1与Tom20-GFP标记的线粒体在TNT中的共定位,进一步证实了Miro1在线粒体转移中的作用。通过敲除Miro1的实验(图2h和i),研究人员发现线粒体转移效率显著降低,这证实了Miro1介导的巨噬细胞向BMSC的线粒体转移。这些发现表明,巨噬细胞与BMSC之间的线粒体转移是通过TNT介导的,并且Miro1在这个过程中起着关键作用,对于维持细胞功能和促进骨缺损修复具有重要意义。

图2. 巨噬细胞和BMSC通过隧道纳米管连接。a) 热图说明巨噬细胞发出的信号强度。b) 圆形图显示巨噬细胞与其他各种群体之间相互作用强度的直观描述。c) 热图显示 GDF 通路在不同细胞群之间传递信号的功能。d) SEM 图像显示巨噬细胞(绿色)和 BMSC(蓝色)之间的 TNT(白色箭头)。e) SEM 图像显示 TNT 和巨噬细胞之间的相互作用(红色箭头)。黄色箭头显示与巨噬细胞融合的 TNT 芽。f) 代表性共焦图像显示 TNT 介导的 Tom20-GFP 标记线粒体从巨噬细胞转移至 BMSC。TNT 内胞外蛋白 Sec3(粉红色)和 Sec5(灰色)的共定位。肌动蛋白用鬼笔环肽红染色。g) 免疫荧光图像显示 Miro1(粉色)与 Tom20-GFP 标记的线粒体(绿色)的共定位。用Tom20-GFP转染的巨噬细胞与BMSC共培养。将共培养物固定 24 小时并用抗 Miro1 抗体(粉红色)进行免疫标记。使用鬼笔环肽红对肌动蛋白进行染色(红色)。图像显示 TNT 中线粒体(绿色)和 Miro1(粉色)的共定位。h, i) 显示巨噬细胞中 shRNA 介导的 Miro1 部分敲低后线粒体转移减少的图 (h)。孵育前,用 Mitotracker Deep Red(红色)标记巨噬细胞。数据标准化为对照中的线粒体转移(i)。 *P < 0.05,**P < 0.01,***P < 0.001
(2)用于骨再生策略的工程分层水凝胶 这种水凝胶通过结合抗炎药物二甲基异戊二烯酸(DMI)和靶向巨噬细胞的两性离子纳米凝胶(MDV),旨在调节免疫反应并促进细胞间的线粒体转移。图3a的原理图展示了植入式可注射水凝胶的基本生物学要求,突出了适宜的弹性模量对于组织工程的重要性。通过图3b的杨氏模量测试,研究人员发现MDV纳米凝胶的加入显著增强了水凝胶的机械强度,为骨修复和再生提供了适宜的细胞外基质环境。图3c展示了水凝胶在模拟体内条件下对罗丹明B的释放行为,其中MDV纳米凝胶显示出较高的药物释放百分比,实现了高效的基因转染和降低的细胞毒性。图3d的流变学分析表明,水凝胶具有快速的溶胶-凝胶转变能力,适合作为注射材料。图3e的自我愈合测试证明了水凝胶通过可逆席夫碱键具有良好的自我修复能力。图3f和图3g的降解实验显示了水凝胶在不同酶和pH值条件下的降解效率,以及随时间变化的孔隙结构,表明水凝胶具有良好的生物降解性。图3h的释放曲线显示了水凝胶在不同pH值环境下对DMI和Miro1的控释能力,这在炎症环境中尤为关键。 特别是,载有Miro1的MDV纳米凝胶能够促进从巨噬细胞到BMSC的线粒体转移过程,调节BMSC中的ROS、ATP和OXPHOS水平,从而影响细胞内线粒体功能和代谢状态,促进骨再生组织的形成和生长。这些发现强调了细胞间线粒体转移在骨缺损修复中的重要性,并突出了免疫和生物能量调节治疗策略在组织再生中的潜力。
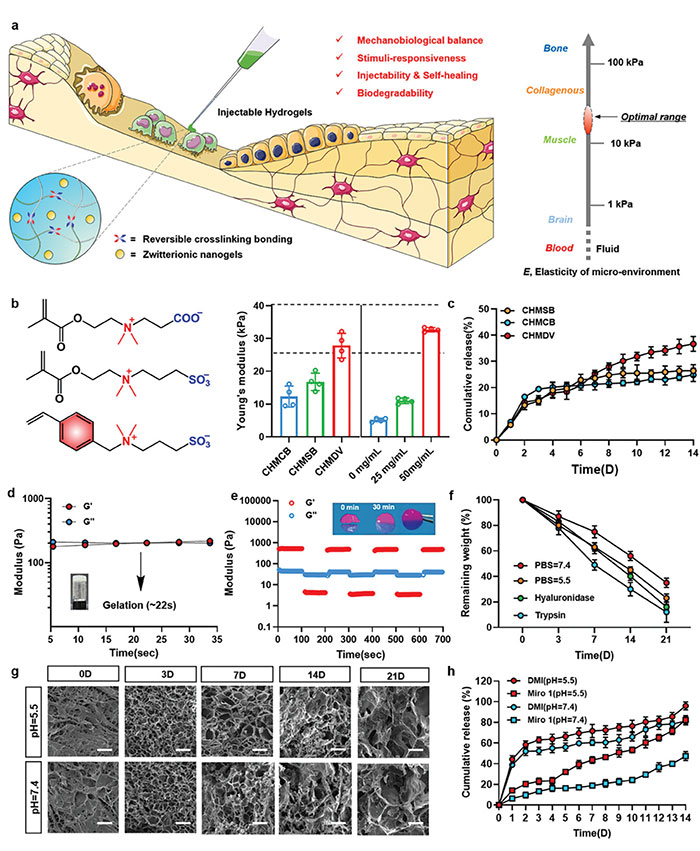
图3. 用于骨再生策略的工程分层水凝胶。a) 示意图阐明了组织工程中具有可逆交联键合特征的植入可注射水凝胶的基本生物学先决条件。b) 不同分级水凝胶(CHMCB、CHMSB 和 CHMDV)以及不同 MDV 纳米凝胶含量(0、25 和 50 mg/mL)的 CHMDV 的杨氏模量。插图显示了 CBMA、SBMA 和 DVBAPS (n = 3) 的化学结构。c) 37°C 生理盐水(0.9 wt%)中罗丹明 B 从分层水凝胶中的释放曲线。d) 短时间尺度凝胶行为和 e) 分层水凝胶连续步进应变扫描的流变学分析 (n = 3)。f) 分级水凝胶在胰蛋白酶、透明质酸酶和磷酸盐缓冲盐水(PBS,pH = 5.5 和 7.4)中的降解速率-时间曲线 (n = 3)。g) 干燥分层水凝胶的时间依赖性 SEM 图像和 h) DMI 和 Miro 1 在不同 pH 环境下的释放曲线 (n = 3)。比例尺为 20 μm(第 0 天)和 100 μm(第 3-15 天)
(3)装载 Miro1-DNA 的 MDV 纳米凝胶可以靶向巨噬细胞并调节线粒体转移 研究人员深入探讨了MDV纳米凝胶在靶向巨噬细胞和调节线粒体转移中的作用。通过图4a的CCK-8细胞活性分析,研究人员证实了MDV纳米凝胶在较高浓度下仍然保持低细胞毒性,表明其良好的生物相容性。图4b的SEM图像进一步展示了MDV纳米凝胶能够特异性地被巨噬细胞摄取,而不是BMSC,揭示了其出色的巨噬细胞靶向能力。 研究人员还评估了MDV纳米凝胶作为基因载体的潜力。图4c的荧光图像显示,与常用的PEI和Lipo3000转染试剂相比,MDV纳米凝胶在转染Miro1-DNA时展现出更高的效率。免疫荧光图像(图4d和e)以及共聚焦图像(图4f)共同证实了MDV纳米凝胶能够促进Miro1的表达,并增强从巨噬细胞到BMSC的线粒体转移。此外,流式细胞仪分析(图4g和h)定量地证明了MDV纳米凝胶处理后,巨噬细胞向BMSC的线粒体转移效率显著提高。这些结果表明,MDV纳米凝胶不仅能有效靶向巨噬细胞,还能作为有效的基因载体提高Miro1-DNA的转染效率,并通过促进线粒体转移来增强受损细胞的修复能力。
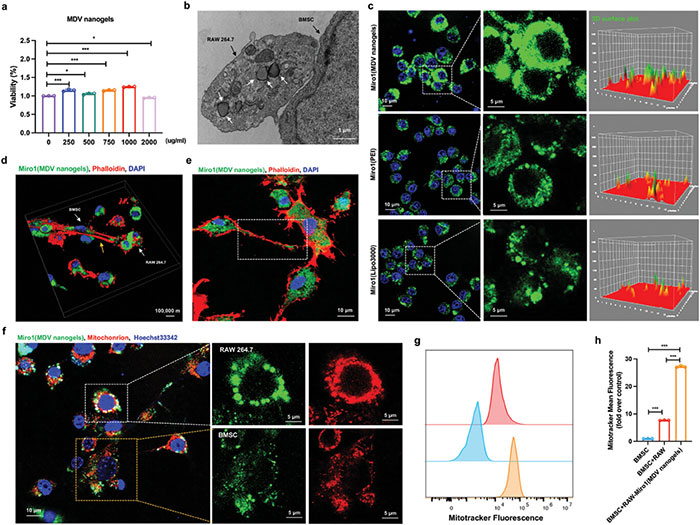
图4. 两性离子 MDV 纳米凝胶介导的线粒体转移。a) CCK-8 分析显示 MDV 纳米凝胶 (250–2000 μg mL−1) 与巨噬细胞共培养 24 小时的浓度依赖性。b) SEM 图像显示 MDV 纳米凝胶对巨噬细胞的特异性靶向(由白色箭头表示)。c) 荧光图像显示 MDV 纳米凝胶、PEI 或 Lipo3000 对 Miro1 质粒的转染效率。d, e) 免疫荧光图像显示,在应用 MDV 纳米凝胶后,Miro1 和 TNT 共定位。肌动蛋白用鬼笔环肽红染色。f) 代表性共聚焦图像显示 Miro1(MDV 纳米凝胶)介导的线粒体从巨噬细胞转移到 BMSC。巨噬细胞与 BMSC 共培养前,使用 MitoTracker Deep Red 标记巨噬细胞线粒体(红色)。g, h) 该图显示通过引入 Miro1(MDV 纳米凝胶)增加了从巨噬细胞到 BMSC 的线粒体转移。使用流式细胞术监测线粒体转移,并根据对照条件下的线粒体转移标准化数据。*P < 0.05,**P < 0.01,***P < 0.001
(4)Gel@MDI通过调节BMSC的能量代谢来调节其成骨分化能力 研究人员深入分析了Gel@MDI水凝胶对BMSC成骨分化能力的影响,特别关注了其在调节BMSC能量代谢方面的作用。图5a和b的结果揭示了Gel@MDI水凝胶能够降低BMSC中的活性氧(ROS)水平,这是通过MitoSox染色来评估的,并且通过荧光强度的量化进一步证实了这一点。图5c和d中的共聚焦图像和分析显示,与M1型巨噬细胞共培养的BMSC表现出较低的线粒体膜电位(MMP),反映了线粒体功能的损害,而Gel@MDI水凝胶的应用则有助于恢复BMSC的MMP水平。 通过海马XF分析平台进行的代谢分析(图5e)表明,Gel@MDI水凝胶上的BMSC展现出更高的基础呼吸率、备用呼吸能力和ATP产量,这表明Gel@MDI通过调节巨噬细胞的极化和促进线粒体转移,增强了BMSC的代谢状态。此外,图5f至i的结果进一步证实了Gel@MDI水凝胶能够提高BMSC的线粒体呼吸和能量产生,这对于BMSC的成骨分化至关重要。 图5j至m展示了Gel@MDI水凝胶显著提高了BMSC的成骨能力,包括增加的ALP水平、更多的矿化结节以及成骨相关基因的表达。这些结果直接证明了Gel@MDI水凝胶通过改善BMSC的能量代谢和调节巨噬细胞的极化,显著促进了BMSC的成骨潜力。Gel@MDI水凝胶作为一种新型的骨再生材料,通过精细调控免疫微环境和细胞代谢,展现出了在促进骨缺损修复方面的巨大潜力。

图5. 线粒体转移的代谢效应。a) 荧光图像显示分层 Gel@MDI 水凝胶上 BMSC 的 ROS 水平。MitoSox 染色(黄色)表示 BMSC 中的 ROS 水平。MitoTracker Deep Red 在共培养前标记巨噬细胞线粒体(红色)。b) 用于定量 ROS 产生的荧光标记强度的平均值 (n = 6)。c, d) 代表性共焦图像和相应的分析,以量化 Gel@MDI 上 BMSC 中的 MMP 水平。TMRM 染色反映 MMP 水平 (n = 6)。e) 示意图显示海马平台的代谢分析,以研究线粒体转移对 BMSC 的影响。在 Gel@MDI 水凝胶上共培养 24 h 后,通过 FACS 分离巨噬细胞和 BMSC,并进一步利用 seahorse xfe96 平台测量 BMSC 的代谢状态。f) Seahorse XF Mito 应激测试中 BMSC 的耗氧率 (OCR) 显示线粒体呼吸增加 (n = 8)。g) 基础呼吸,h) 备用呼吸能力,i) BMSC 中的 ATP 产生 (n = 8)。j) 成骨分化后 7 天和 14 天在 CH(纯凝胶)或分级水凝胶(Gel@MDI)上培养的 BMSC 的 ALP 染色和茜素红 S 染色。k–m) 成骨分化后 7 天成骨相关基因 Col1a1、Alp、Runx2 和 Sp7 的表达 (n = 3)。*P < 0.05,**P < 0.01,***P < 0.001
(5)具有免疫调节和靶向线粒体转移的分层水凝胶促进临界尺寸颅骨缺损的再生 研究人员通过在小鼠模型中植入Gel@MDI水凝胶,评估了其在体内促进临界尺寸颅骨缺损修复的能力。结果显示,与对照组和纯CH水凝胶组相比,Gel@MDI处理组在8周后显示出显著的骨再生,其特点是更多的钙化和复杂的组织形成。通过micro-CT扫描图像(图6a和b),观察到Gel@MDI组的骨体积/总组织体积(BV/TV)和小梁厚度(Tb.Th)显著高于其他组,而小梁分离/间隙(Tb.Sp)则显著更低(图6c-e)。此外,H&E染色和Masson三色染色(图6h)揭示了Gel@MDI组新形成的骨骼分布均匀且结构紧密。免疫荧光分析进一步表明,Gel@MDI促进了M2型巨噬细胞标记物CD206的表达,并降低了M1型巨噬细胞标记物iNOS的表达(图6f-j),这表明Gel@MDI通过调节免疫微环境,促进了骨缺损的修复。
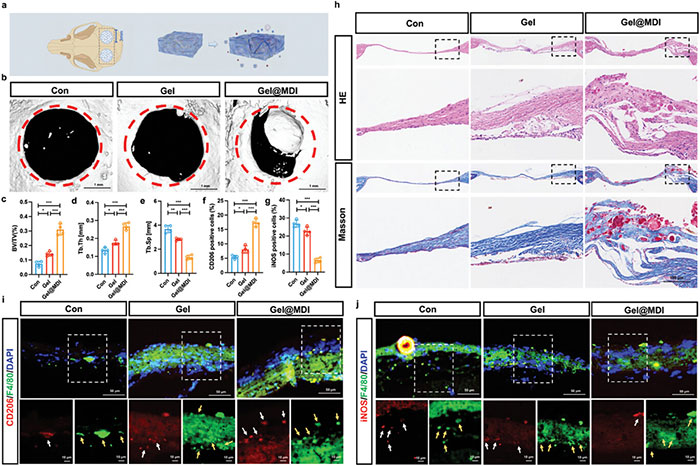
图6. Gel@MDI 移植促进临界尺寸骨缺损的再生。a) 颅骨缺损手术后水凝胶植入的图示。b–e) 分别在术后 2 周对仅手术组 (Con)、CH(纯凝胶)和分级水凝胶 (Gel@MDI) 组的骨再生进行显微 CT 评估。新再生骨组织的定量分析,包括 c) BV/TV、d) Tb.Th 和 e) Tb.Sp (n = 3)。f) CD206 阳性染色区域和 g) iNOS 阳性染色区域的定量分析 (n = 4)。h) 颅骨缺损后 8 周,Con、Gel 或 Gel@MDI 组石蜡切片的 H&E 染色和 Masson 三色染色。i, j) iNOS 阳性染色区域和 CD206 阳性染色区域的共免疫荧光染色图像 (n = 4)。*P < 0.05,**P < 0.01,***P < 0.001
研究人员还深入探讨了Gel@MDI水凝胶调节的生物学过程。通过比较手术对照组和Gel@MDI组之间的差异表达基因,研究人员鉴定了449个差异表达基因,涉及神经再生、成骨分化和代谢相关途径的富集(图7a-c)。基因集富集分析(GSEA)确认了Gel@MDI在“骨成熟”和“骨吸收”中的显著作用。热图和箱线图分析显示,与对照组和Gel组相比,Gel@MDI组中成骨、抗炎和代谢基因的表达增加(图7d),突出了其在骨免疫调节中的作用。这些结果表明,Gel@MDI水凝胶通过精细调控免疫反应和促进线粒体转移,显著提高了BMSC的能量代谢和成骨潜力,从而在体内对骨缺损修复具有显著的促进作用,展现出在骨再生和修复方面的巨大潜力和应用前景。

图7. 组织再生中与线粒体转移调节相关的生物过程的探索。a) 火山图显示仅手术组 (Con) 和分层水凝胶 (Gel@MDI) 组之间差异表达的基因。b) 仅手术组 (Con)、CH 水凝胶 (Gel) 和分层水凝胶 (Gel@MDI) 组之间基因表达的热图。c) 生物过程(BP)、分子功能(MF)、KEGG、反应组和 Wiki 途径富集分析揭示了差异表达基因可能参与的潜在途径。d) “成骨”、“抗炎”和“代谢”途径的热图和箱线图分析。e) 示意图显示了 Gel@MDI 诱导的 BMSC 中促进成骨的可能机制
研究小结:
本研究创新性地开发了一种具有免疫响应和靶向线粒体转移功能的工程化分层水凝胶(Gel@MDI),用于促进骨再生。Gel@MDI通过整合抗炎药物DMI和巨噬细胞靶向的两性离子纳米凝胶(MDV),不仅能在炎症环境中调节巨噬细胞的极化,还能提高巨噬细胞向骨髓间充质干细胞(BMSC)的线粒体转移效率。
实验结果显示,Gel@MDI显著增强了BMSC的代谢状态,提高了成骨分化能力,并在小鼠的临界尺寸颅骨缺损模型中展现出卓越的骨再生效果。这些发现为骨缺损治疗提供了新的策略,证明了Gel@MDI在调节免疫微环境和促进骨组织修复中的潜力,为未来的骨再生材料设计和临床应用提供了重要的指导。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

