
在探讨传统手术缝合方法的局限性时,研究者们指出了其在临床应用中存在的一系列问题,包括手术过程中可能出现的二次出血、对正常组织的损伤、耗时以及穿孔组织泄漏的风险。
与皮肤伤口愈合相比,因体内的环境极为复杂,开发用于修复内部软组织缺陷的有效水凝胶生物粘合剂面临着更大的挑战。特别是在腹部和胸部等动态变化的体内环境中,水凝胶需要同时具备对湿组织缺陷的强粘附性和对其他正常组织的抗粘附性,以避免术后粘连。
尽管已有研究致力于解决术后粘连或提高组织粘附强度,但这些水凝胶往往表现出无选择性的双面粘附,容易引起缺陷和正常组织之间的严重术后粘连。因此,开发具有粘附和抗粘附双重性能的不对称Janus水凝胶成为了一个有效的解决方案。

针对上述问题,华南农业大学刘珍珍教授开发了一种新型的具有粘附和抗粘附性能的不对称janus水凝胶,通过控制水凝胶两侧自由羧基团的界面分布来实现内部软组织缺陷修复,同时解决术后粘连问题。该文章于2023年04月07日以《An Integrally Formed Janus Hydrogel for Robust Wet-Tissue Adhesive and Anti-Postoperative Adhesion》为题发表于《Advanced Materials》(DOI:10.1002/adma.202300394)。
(1)MAH水凝胶的设计与表征 图1a展示了MAH Janus水凝胶生物粘合剂的制备流程图,以及其在胃损伤修复中同时预防术后粘连的示意图。光学显微镜图像(图1b)和3D轮廓图像(图1c)分别展示了MAH-600水凝胶的顶部和底部表面,揭示了在600转/分钟搅拌速度下形成的不对称表面结构,其中顶部表面观察到较大的乳液滴,而底部表面则显示出更密集的互连3D微结构。相比之下,图1d和1e中的MAH-3000水凝胶在3000转/分钟搅拌速度下制备,显示出较为均匀且光滑的表面结构,表明搅拌速度对水凝胶表面微观结构具有显著影响。即通过调控搅拌速度来精确控制水凝胶两侧自由-COOH基团的分布,从而实现对湿润组织的强大粘附和对其他正常组织的抗粘附性能。
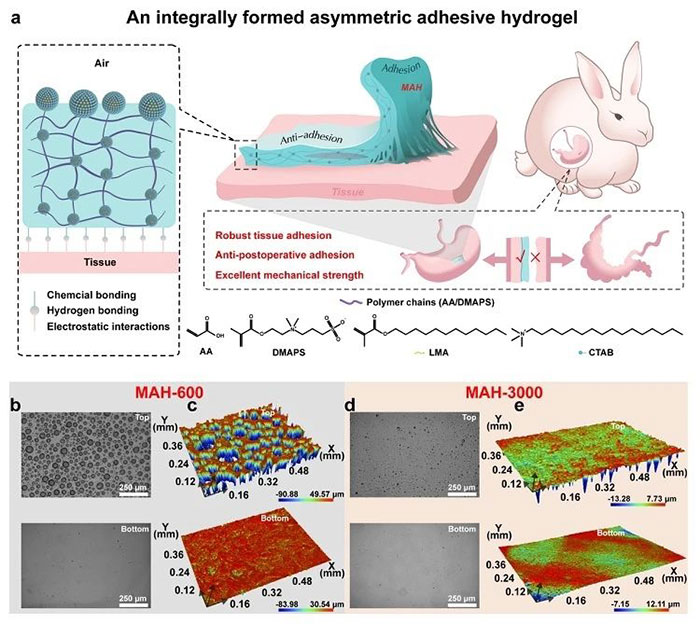
图1 MAH水凝胶的设计与表征。(a)MAH Janus水凝胶制备示意图及其在胃创面愈合同时防止术后粘连的应用。(b)MAH-600和(d)MAH-3000上下表面光学显微镜图。(c)MAH-600和(e)MAH-3000上下表面三维轮廓图
(2)MAH水凝胶不对称机制
图2a和2b展示了MAH-600水凝胶的表面和截面的扫描电子显微镜(SEM)图像,揭示了顶部表面的明显多孔结构和底部的密集互连3D微结构。图2c的能谱(EDS)元素映射图像显示了C和N元素在MAH-600顶部表面的分布,表明了CTAB在顶部表面的富集。相比之下,图2d-2f展示了MAH-3000水凝胶的表面和截面的SEM图像以及C和N元素的EDS元素映射图像,显示了在3000转/分钟搅拌速度下制备的水凝胶具有均匀的3D微结构和元素分布。图2g为MAH水凝胶在600和3000转/分钟搅拌速度下的不对称结构示意图,说明了不同搅拌速度下形成的乳液滴大小差异,以及这些乳液滴如何作为物理交联点影响水凝胶的不对称性。即通过控制搅拌速度来调节水凝胶前体液中乳液滴的大小和分布,进而精确控制水凝胶两侧自由-COOH基团的界面分布,实现对湿润组织的强粘附和对其他正常组织的抗粘附性能。
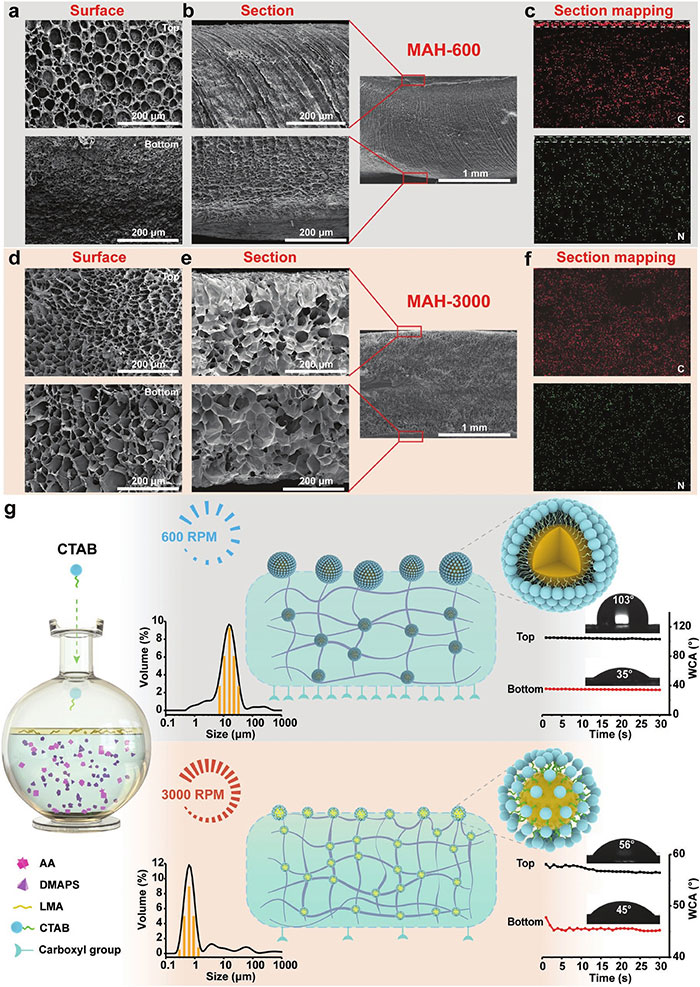
图2 MAH水凝胶不对称机制的表征。(a)MAH-600表面和(b)截面形貌SEM。(c)MAH-600的C、N的元素映射图。(d)MAH-3000的表面和(e)截面形貌SEM。(f)MAH-3000的C、N的元素映射图。(g)MAH水凝胶在600和3000RPM时的不对称结构示意图
(3)MAH水凝胶力学性能 图3a显示了不同搅拌速度下制备的MAH水凝胶的拉伸应力-应变曲线,表明MAH-3000水凝胶具有最高的拉伸强度,而MAH-600水凝胶由于其不对称结构和较低的交联密度,展现出相对较低的机械性能。图3b探讨了不同表面活性剂对MAH水凝胶机械性能的影响,发现以CTAB为表面活性剂时,水凝胶展现出最长的拉伸应变。图3c比较了MAH水凝胶与其他已报道的水凝胶生物粘合剂的机械韧性,证实了MAH-600水凝胶的优越性。图3d展示了MAH-600水凝胶的连续阶梯拉伸应力-应变曲线,证明了其出色的自恢复能力。图3e的循环拉伸测试进一步证实了MAH-600水凝胶的卓越韧性和耐久性。图3f至3i通过直观的实验照片展示了MAH-600水凝胶的卓越机械性能,包括承受2kg重量、抵抗尖锐物体刺激、充气至20倍体积以及被手术刀切割的能力。这些结果共同证明了MAH-600水凝胶在内部生物粘合应用中具有足够的恢复力和耐受最大腹压的能力,同时保持了良好的机械韧性和耐用性。
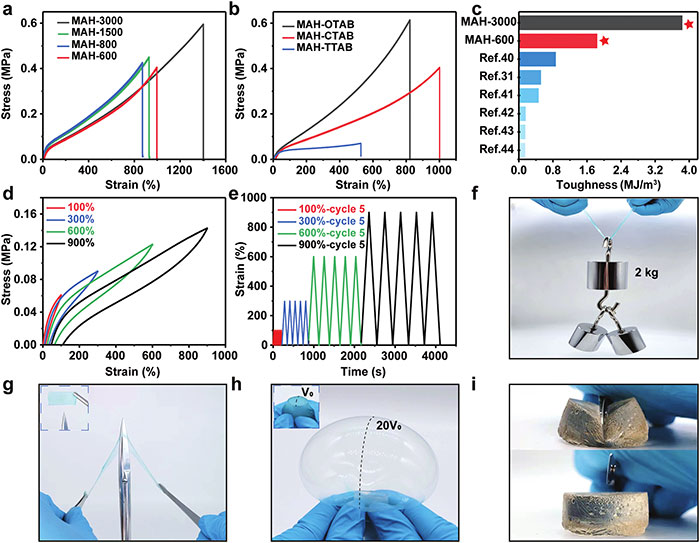
图3 MAH水凝胶力学性能表征。(a)以CTAB为表面活性剂的MAH水凝胶在600~3000RPM不同搅拌速度下的拉伸应力-应变曲线。(b)600RPM下不同表面活性剂的拉伸应力-应变曲线。(c)MAH水凝胶与生物粘合剂的机械韧性比较。(d)水凝胶的逐次拉应力-应变曲线。(e)不同应变下MAH水凝胶的循环拉伸试验。(f)MAH-600水凝胶承重2公斤照片。对MAH-600水凝胶膜进行尖锐刺激(g)或泵气(h)。(i)MAH-600水凝胶被手术刀切割的图片
(4)MAH-600水凝胶的不对称粘附特性
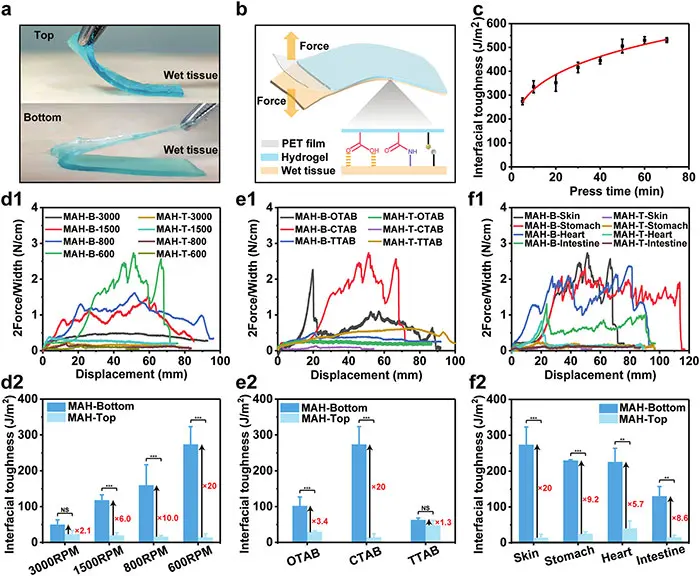
图4 MAH-600水凝胶的不对称粘附特性。(a)显示上/下表面对湿猪皮粘附行为的照片。(b)MAH水凝胶剥离试验。(c)不同压制时间下MAH-600水凝胶对猪皮的界面韧性。不同搅拌速度下水凝胶结合猪皮的剥离力曲线(d1)和界面韧性(d2)。不同表面活性剂对600RPM下猪皮剥离力曲线(e1)和界面韧性(e2)的影响。MAH-600水凝胶粘附不同湿组织的剥离力曲线(f1)和(f2)界面韧性
图4a展示了MAH-600水凝胶顶部和底部表面对湿猪皮的粘附行为,其中底部表面显示出比顶部表面更强的粘附性。图4b说明了180°剥离测试的示意图,用于定量评估MAH水凝胶对猪皮的粘附强度。图4c展示了不同按压时间对MAH-600水凝胶与猪皮粘附强度的影响,随着按压时间的增加,粘附强度逐渐增强。图4d和e分别展示了不同搅拌速度和不同表面活性剂对MAH水凝胶粘附性能的影响,其中MAH-600水凝胶在600 RPM搅拌速度和CTAB表面活性剂条件下,底部与顶部表面的粘附强度差异最为显著。图4f展示了MAH-600水凝胶底部表面对不同湿组织的粘附强度,包括胃、心脏和肠组织,显示出良好的粘附性能。
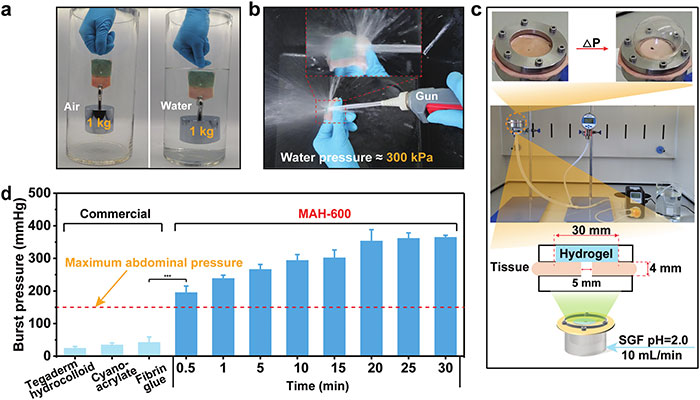
图5 MAH-600水凝胶的水下粘附性能。(a)MAH-600水凝胶粘附猪皮在水下可以承受1公斤的重量。(b)水枪冲洗MAH-600粘接猪皮的粘接界面。(c)MAH-600水凝胶破裂压力测试。(d)不同按压时间下MAH-600水凝胶与部分商用生物胶粘剂的破裂压力比较
图5a中MAH-600水凝胶粘附的猪皮能够在水中承受1kg的重量,证明了其在水下具有出色的粘附强度。图5b使用水枪冲洗MAH-600粘附的猪皮结合界面,结果显示水凝胶的粘附界面能够承受强烈的水流冲击而不脱落,进一步证实了其在湿润环境下的稳定性。图5c自制设备用于测试MAH-600水凝胶通过泵入模拟胃液(SGF)来承受动态压力的能力,即爆破压力测试。图5d比较了不同按压时间下MAH-600水凝胶的爆破压力与一些商业生物粘合剂的性能,结果表明,即使在短时间的按压(30秒)后,MAH-600的爆破压力也达到了195 mmHg,超过了最大腹压(150 mmHg),并且当按压时间超过20分钟时,爆破压力增加到362 mmHg。

图6 MAH-600水凝胶的体内外应用。MAH-600水凝胶对漏气猪肺叶(a)和漏液猪胃(b)的体外封闭。(c)MAH-600型水凝胶应变传感器在体内监测兔心脏跳动的照片。(d)MAH-600应变传感器检测到的兔心脏跳动随时间的归一化电信号
图6a展示了MAH-600水凝胶对猪肺叶损伤的密封效果,其中MAH-600成功阻止了空气泄漏,证明了其在水下形成气密密封的能力。图6b展示了MAH-600水凝胶对充满水的穿孔胃的密封效果,即使在持续水流输入的情况下也能保持密封,显示了其在流体密封方面的卓越性能。图6c展示了MAH-600水凝胶作为应变传感器,直接粘附在活体兔子心脏的动态和弯曲表面上,用于实时监测心跳,这表明了其在生物医学监测设备中的潜在应用。图6d展示了通过MAH-600水凝胶传感器监测到的活体兔子心脏跳动的归一化电信号,其中监测到的心率约为每分钟210次,处于正常理论范围内,进一步证实了MAH-600水凝胶对湿组织的强粘附能力。这些结果共同证明了MAH-600水凝胶在内部伤口修复和生物医学监测设备中的潜在应用价值,展现了其在临床应用中的广泛前景。 (5) 体内胃损伤修复及术后抗黏连 图7a展示了在新西兰白兔模型中建立的胃损伤(直径5mm)后,使用MAH-600水凝胶进行治疗的效果,与手术缝合相比,MAH-600水凝胶能够快速、简单地实现完全贴合的密封。图7b显示了手术缝合组在术后第7天和第14天观察到的明显的网膜粘连和白色肉芽组织,这是由于胃液或血液从伤口泄漏引起的炎症反应。相比之下,MAH-600水凝胶治疗的胃损伤在第14天几乎完全愈合,表面光滑且无粘连,显示出优异的促进伤口愈合和抗术后粘连的性能。图7c和7d分别展示了使用苏木精-伊红(H&E)和Masson染色评估MAH-600水凝胶和手术缝合组在术后第7天和第14天的修复效果,结果显示MAH-600水凝胶治疗的组织在早期展现出更好的胶原表达,表明更高的伤口愈合效率,并且在第14天,MAH-600水凝胶治疗的伤口周围的炎症细胞数量显著减少。这些结果共同证明了MAH-600水凝胶作为一种生物粘合剂,在内部伤口修复中具有显著的优势,包括简便的一步法制备、出色的不对称粘附性能、高机械韧性以及促进伤口愈合的能力。
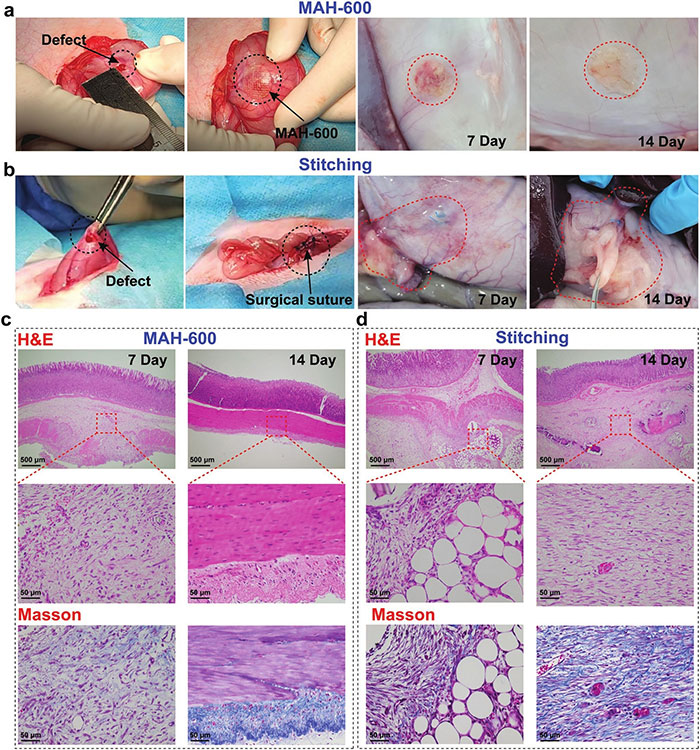
图7 MAH-600水凝胶作为胃创面修复的组织粘连和术后抗粘连物理屏障。术后第7、14天建立家兔胃创面模型(直径5 mm),观察MAH-600(a)和手术缝合(b)治疗组的创面愈合效果。HE和Masson染色评估MAH-600(c)和手术缝合(d)治疗组第7天和第14天的修复效果
研究小结:
本研究提出了一种创新的、整体形成的Janus水凝胶,旨在解决传统手术缝合方法的局限性,并改善内部软组织损伤修复的临床效果。该水凝胶通过精确控制界面分布的自由羧基团(-COOH),实现了对湿组织的强粘附性和对其他正常组织的抗粘附性,这一不对称粘附性能是通过调节水凝胶制备过程中的搅拌速度来实现的。
研究中,MAH-600水凝胶展现了其在模拟体内环境中对湿组织的卓越粘附能力,同时在体内兔子实验中验证了其在胃缺陷修复中的效果,不仅减少了术后粘连,还促进了伤口愈合。
该研究通过创新的材料设计和制备方法,成功开发了一种具有不对称粘附性能的Janus水凝胶,为内部伤口修复和生物医学监测提供了新的材料选择。未来的研究可以进一步探索该水凝胶的生物降解性、长期生物相容性以及在不同临床应用中的效果,以期实现其在医学领域的广泛应用。此外,这种通过调控材料微观结构来实现特定性能的方法,也为其他高性能生物材料的开发提供了新的思路。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

