
【研究背景】
脊髓损伤(SCI)常导致运动障碍或瘫痪,严重影响生活质量。SCI的病理过程分为原发性和继发性损伤,继发性损伤包括炎症反应和神经再生。继发性损伤可逆且持续数周至数月,提供治疗窗口,但脊髓损伤后血脊髓屏障迅速恢复,治疗窗口极短。目前,唯一公认的治疗方法是在损伤后8小时内使用大剂量糖皮质激素,但副作用较大。生物活性材料移植作为潜在治疗方法,存在进一步损伤或感染的风险。因此,开发有效的微创药物治疗方法仍是挑战。内源性刺激响应纳米粒子(智能纳米粒子)能响应病理微环境变化,在SCI中通过自我调节实现微创药物输送。SCI的病理微环境中,炎症和活性氧(ROS)引发胶质瘢痕和神经凋亡,抑制再生。尽管缺乏准确的治疗时机,但ROS水平和炎症因子为智能纳米粒子药物输送提供了机会。这些纳米粒子能适应病理环境,向靶细胞释放所需药物,是SCI治疗的有前景方法。

针对上述问题,中国解放军总医院张雪松教授团队开发了一种微环境自适应纳米粒子,采用聚(乳酸-乙醇酸)(PLGA)作为药物载体,便于大规模载药。通过功能化透明质酸(HA)和使用延长的Se-Se修饰聚乙二醇(PEG)链(RHNP),将RVG29间接连接到纳米粒子上。研究表明,RVG29提高了纳米粒子在血脊髓屏障(BSCB)中的渗透性。在早期阶段,RVG29-PEG链在ROS作用下脱落,露出HA,增强巨噬细胞/小胶质细胞的内化;在晚期,RVG29促进神经细胞摄取。随着BSCB修复和再生进程,RHNP通过Se-Se响应ROS动态调整细胞靶向和摄取,实现自适应。最后,使用具有抗炎、抗氧化和神经再生作用的姜黄素(Cur),通过系统应用RHNP-Cur在创伤性脊髓损伤模型中观察到运动功能部分恢复,这通过抑制免疫细胞浸润和促进神经保护来实现。该文章于2024年10月31日以“Microenvironment Self-Adaptive Nanomedicine Promotes Spinal Cord Repair by Suppressing Inflammation Cascade and Neural Apoptosis”为题发表于《Advanced Materials》(DOI:10.1002/adma.202307624)。
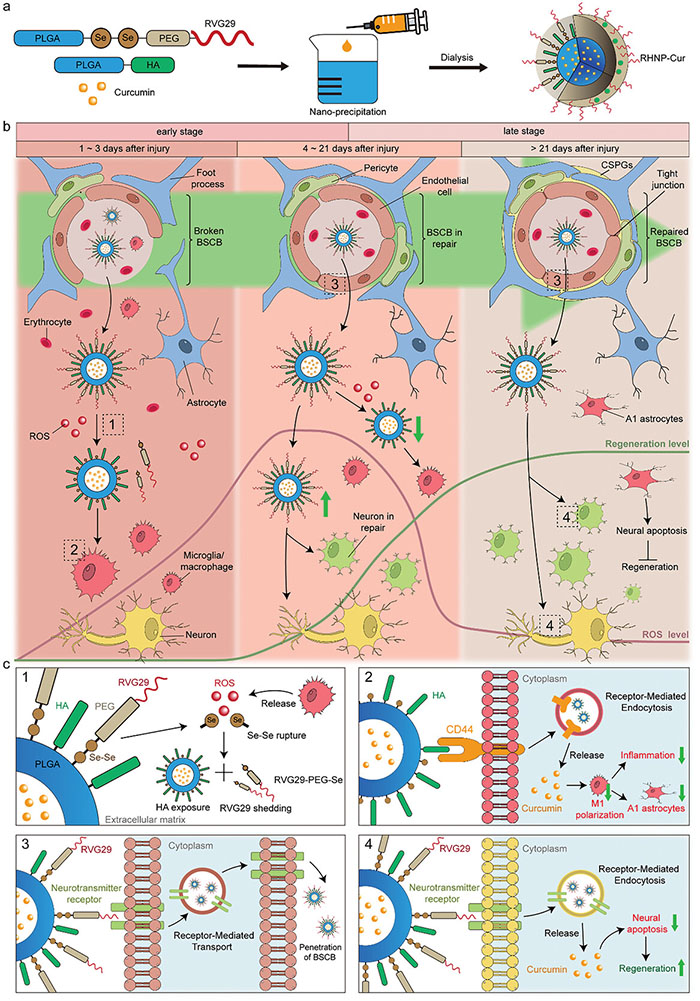
图1. RHNP-Cur 纳米粒子的合成及其治疗 SCI 的机制。 (a) RHNP-Cur 纳米粒子示意图和使用纳米沉淀法合成 RHNP-Cur 的程序; (b) RHNP-Cur 在不同病理阶段治疗 SCI 的机制示意图; (c) 示意图阐明了 RHNP-Cur 在自适应过程中的机制,靶向细胞并穿过 BSCB
(1) RHNP的合成与表征
以PLGA-Se-Se-PEG-RVG29 和 PLGA-HA比例为1:1制备纳米胶束RHNP,成功制备了直径为84 nm、表面电荷为−16 mV的球形RHNP。暴露于H2O2后,RHNP的尺寸增大,透射电子显微镜显示纳米颗粒粘附,表明RVG29修饰对RHNP稳定性至关重要。作为对照,制备了缺少Se─Se键、尺寸和表面电荷与RHNP相似的i-RHNP。RHNP和i-RHNP溶液的RVG29修饰浓度相当。为了评估RHNP对H2O2的响应能力,该研究团队将荧光标签FAM与RVG29偶联,结果表明,暴露于100 µM H2O2后,FAM信号在约10分钟后减弱。RHNP的表面电荷略微增加至−21.82 mV,而i-RHNP的尺寸和表面电荷不变。进一步实验表明,暴露于H2O2后,RHNP中的Cy5.5信号逐渐增强,而i-RHNP中没有,表明PEG-RVG29分离和HA暴露。BCA试剂盒检测也显示相同趋势。能量色散X射线光谱分析显示RHNP表面氧元素为30.83%,RVG29为21.07%;而在暴露H2O2后,RHNP的表面氧含量增至45.95%,与HA接近,S和Se含量显著下降,表明RVG29消失并暴露HA。
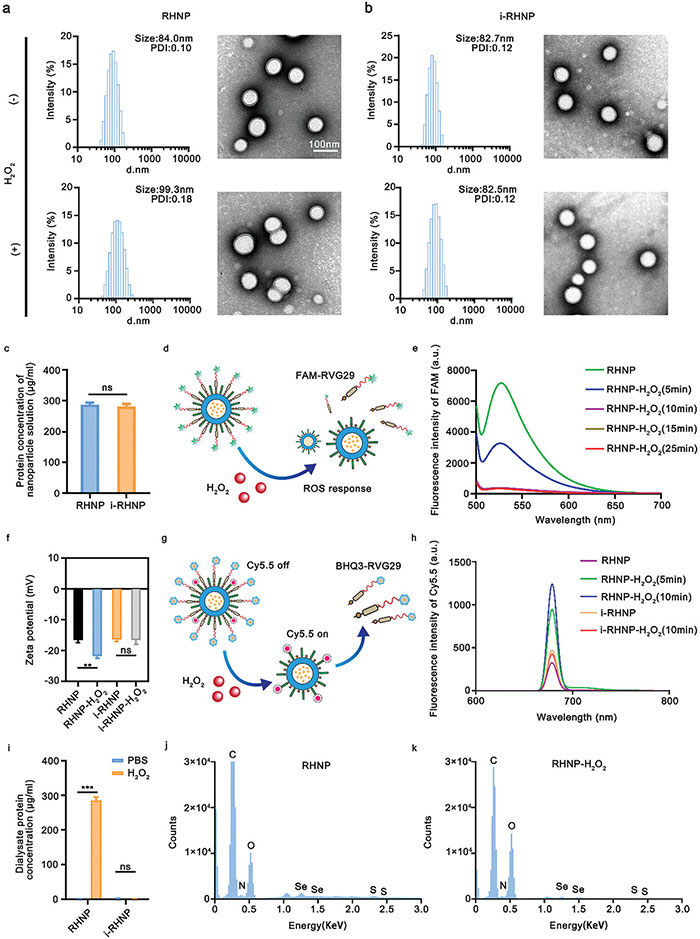
图2. 微环境自适应纳米粒子(RHNP)的合成与表征。 (a) RHNP 和用 100 µM H2O2 处理的 RHNP 的尺寸和形貌。比例尺为 100 nm; (b) 用 100 µM H2O2 处理的 i-RHNP 和 i-RHNP 的尺寸和形貌; (c) BCA 分析中 RHNP 和 i-RHNP 纳米粒子溶液(4 mg mL⁻¹)的蛋白质浓度; (d) RHNP(用 FAM 修饰的 RVG29)对 H2O2 刺激的响应示意图; (e) 用 H2O2(100 µM)处理不同时间后 RHNP 的 FAM 荧光强度; (f) 用或不用 100 µM H2O2 预处理的 RHNP 和 i-RHNP 的 Zeta 电位分析,n = 3; (g) RHNP 或 i-RHNP(用 BHQ3 修饰的 RVG29,用 Cy5.5 标记的 HA对 H2O2 刺激作出反应的示意图; (h) 用 H2O2(100 µM)处理不同时间后 RHNP 和 i-RHNP 的 Cy5.5 荧光强度; (i) BCA 分析中 RHNP、用 PBS 和 100 µM H2O2 处理的 i-RHNP 的透析液蛋白浓度; (j, k) RHNP (j) 和用 100 µM H2O2 (k) 处理的 RHNP 的能量色散 X 射线光谱(EDS)光谱
(2)RHNP 的体外研究
该研究团队通过体外实验研究了RHNP的自适应能力。与HNP-Cy5.5和RHNP-Cy5.5+RVG29相比,RHNP-Cy5.5对bEnd.3内皮细胞的亲和力和渗透性显著增强,增强效果归因于RVG29肽的存在。进一步研究发现,在氧化应激条件下,RHNP在BV2小胶质细胞和HT22神经元细胞中的摄取增加,尤其是在H₂O₂预处理后。免疫荧光和流式细胞术分析表明,未脱落RVG29的RHNP组内吞效率较低,说明RVG29的脱落有助于HA的暴露,促进细胞摄取。在Raw264.7细胞中也观察到类似现象。此外,RVG29修饰显著促进了SH-SY5Y细胞对纳米粒子的摄取。总的来说,RVG29修饰对RHNP在神经细胞中的内化至关重要。
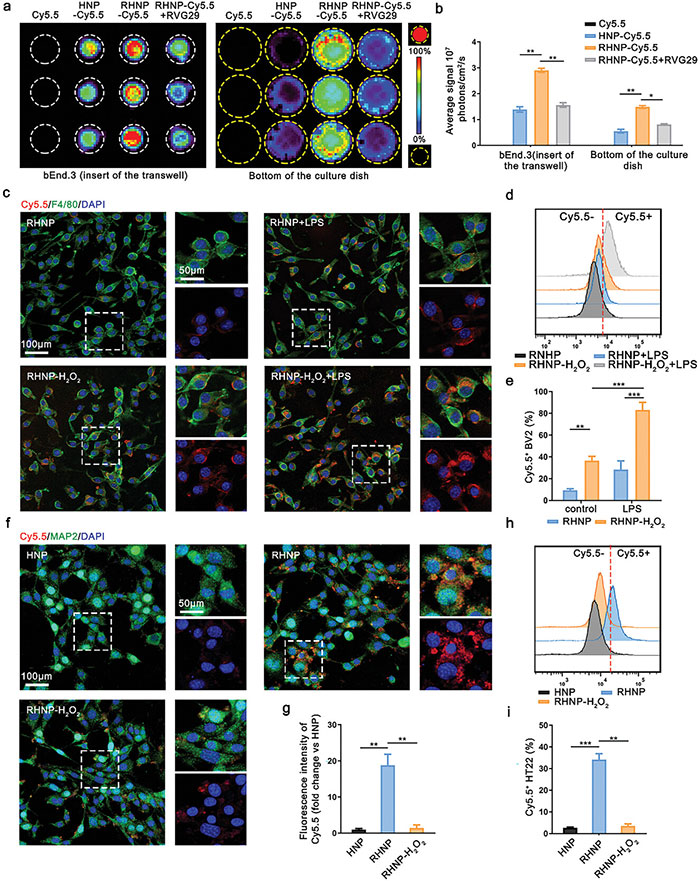
图3. 微环境自适应纳米粒子 (RHNP) 的体外研究。 (a, b) 与 Cy5.5、HNP-Cy5.5、RHNP-Cy5.5 或 RHNP-Cy5.5 与 RVG29 一起孵育后的 bEnd.3 单层和基底外侧室的荧光图像; (c) 用 RHNP-Cy5.5(用 100 µM H₂O₂ 预处理 10 分钟)处理 4 小时的 BV2(用 100 ng mL⁻¹ LPS 预处理 24 小时)的代表性共聚焦图像。例尺分别为 100 µm 和 50 µm(放大); (d, e) 使用流式细胞术分析 (d) 和定量分析 (e) 在 BV2 细胞中评估 RHNP-Cy5.5 的细胞靶向性,在之前在 (c) 中描述的相同刺激下进行; (f) 用 HNP-Cy5.5、RHNP-Cy5.5 或 RHNP-Cy5.5-H₂O₂ 处理 4 小时的 HT22 细胞(以 MAP2 为特征,绿色)的代表性共聚焦图像。比例尺分别为 100 和 50 µm(放大); (g) 使用 ImageJ 1.43 量化 (f) 中 Cy5.5 的荧光密度(与 HNP 组相比的倍数变化); (h, i) 使用流式细胞术分析 (h) 和定量分析 (i) 在 (f) 中先前描述的相同刺激下对 HT22 细胞中含有 Cy5.5 的不同纳米系统的细胞靶向性进行评估
(3)RHNP 在 SCI 不同阶段的体内生物分布
受体外研究结果启发,该研究团队进一步研究了RHNP在SCI小鼠体内的生物分布。静脉注射后,RHNP在SCI早期(7天)病变区域显示最强的Cy5.5信号,明显高于HNP和i-RHNP。该研究团队推测,在ROS作用下,RHNP的Se-Se键断裂,暴露HA,促进了小胶质细胞/巨噬细胞的吸收。免疫荧光成像证实,RHNP显示出明显的脊髓浸润并与小胶质细胞/巨噬细胞(F4/80标记)有较强亲和力。受伤区域的神经元未观察到明显的纳米颗粒摄取,显示RHNP对免疫细胞的精确靶向。进一步研究发现,在SCI晚期,RHNP和i-RHNP在脊髓和受伤区域显示强荧光信号,而HNP的渗透性较低。尽管星形胶质细胞在损伤区域增生,但强烈的Cy5.5信号仍在修复中的神经元(GAP43标记)中被检测到,显示RHNP能够适应不同病理阶段并靶向特定细胞群。该设计有望提高抗炎和神经再生药物的疗效。
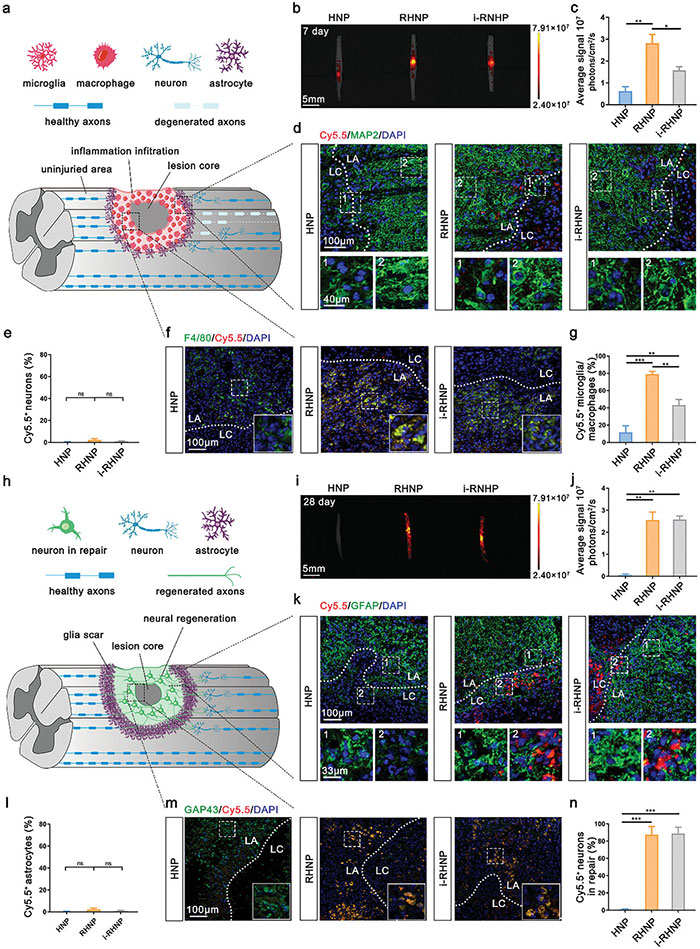
图4. RHNP 在脊髓损伤不同阶段的体内生物分布。 (a) 脊髓损伤早期病理微环境示意图; (b, c) 脊髓损伤后 7 天小鼠的脊髓 IVIS 荧光图像,静脉注射 HNP-Cy5.5、RHNP-Cy5.5 或 i-RHNP-Cy5.5 6 小时(b),并估算平均相对荧光(c); (d, e) 脊髓损伤早期区域中 Cy5.5 和神经元(以 MAP2 为特征)的代表性共聚焦图像(d),以及 Cy5.5+ 神经元比例的半定量分析(e); (f, g) 脊髓损伤区域中 Cy5.5 和小胶质细胞/巨噬细胞(以 F4/80 为特征)的代表性共聚焦图像(f),以及 Cy5.5+ 小胶质细胞/巨噬细胞比例的半定量分析(g); (h) 脊髓损伤晚期病理微环境示意图; (i, j) 脊髓损伤后 28 天小鼠的脊髓 IVIS 荧光图像,静脉注射 HNP-Cy5.5、RHNP-Cy5.5 或 i-RHNP-Cy5.5 6 小时(i),并估算平均相对荧光(j); (k, l) 脊髓损伤区域晚期 Cy5.5 和星形胶质细胞(以 GFAP 为特征)的代表性共聚焦图像(k),以及 Cy5.5+ 星形胶质细胞比例的半定量分析(l)。比例尺分别为 100 µm 和 33 µm(放大); (m, n) 脊髓损伤区域修复过程中 Cy5.5 和神经元(以 GAP43 为特征)的代表性共聚焦图像(m),以及修复中的 Cy5.5+ 神经元比例的半定量分析(n)
(4)RHNP-Cur 的特征及其在 SCI 模型中的疗效
该团队将姜黄素包覆在RHNP中,得到球形RHNP-Cur纳米药物,尺寸为90.2 nm,表面电荷为-16.32 mV。暴露于100 µM H₂O₂后,RHNP-Cur的尺寸和表面电荷略增至103.2 nm和-23.44 mV,表现出与RHNP相似的行为。RHNP-Cur在PBS中稳定一个月,包封率为85.5%。在不同溶液中的释放曲线表明,在100 µM H₂O₂和模拟SCI的酸性环境下,姜黄素释放加速,24小时内释放约90%。接着,在创伤性SCI小鼠模型中,RHNP-Cur治疗显著加速了组织修复,BMS评分显示治疗组在第7天后表现优于对照组,并持续至14天。步态分析显示,RHNP-Cur组小鼠恢复更快,运动协调性更好,H&E染色结果显示治疗组的病变面积明显小于其他组。总之,RHNP-Cur有助于SCI后运动功能的恢复。
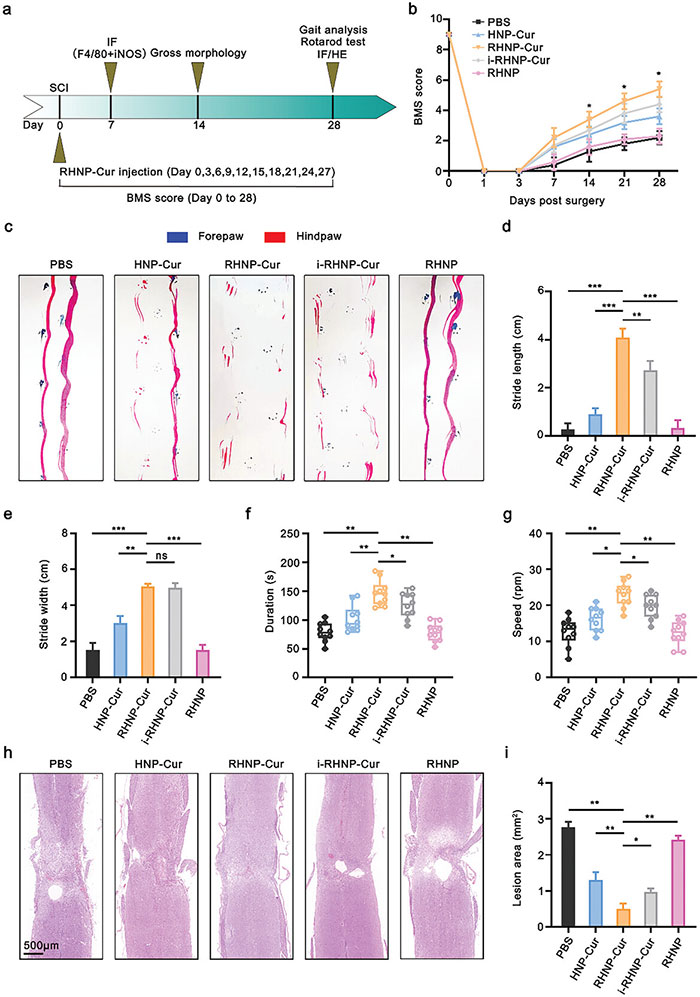
图5. RHNP-Cur 在创伤性脊髓损伤模型中的疗效。 (a) 创伤性脊髓损伤模型中治疗实验的时间线; (b) 脊髓挫伤后不同时间点的 Basso 小鼠评分(BMS); (c-e) 脊髓损伤后第 28 天进行足迹分析的代表性图像(c),以及后肢足迹的长度(d)和宽度(e)定量分析。蓝色为前肢足迹,红色为后肢足迹; (f, g) 损伤后第 28 天各组的旋转杆实验结果。小鼠被放置在旋转杆上,旋转速度从 0 加速到 40 rpm,记录小鼠保持在旋转杆上的时间(f)以及它们跌落的旋转速度(g)。每只小鼠测试两次; (h, i) 损伤后第 28 天脊髓冠状切片的苏木精-伊红(H&E)染色图像(h),以及损伤区域的定量分析(i)
(5)RHNP-Cur 增强脊髓损伤后的神经再生并抑制炎症级联反应
脊髓损伤后,残留神经元通过再生轴突修复神经连接。免疫荧光分析显示,RHNP-Cur组和i-RHNP-Cur组表现出明显的神经和轴突再生,前者有更多的NF200阳性轴突。相比之下,PBS和RHNP组未见显著再生,HNP-Cur组虽有再生,但较弱。RHNP-Cur有效促进神经再生,并在炎症级联反应中发挥作用,显著抑制M1小胶质细胞极化和星形胶质细胞的瘢痕形成,减少神经毒性A1星形胶质细胞的分化。此外,RHNP-Cur显著减少SCI病变区CSPG沉积,证明其减轻炎症反应。相比之下,姜黄素负载的脂质体(脂质体-Cur)在SCI治疗中的效果不如RHNP-Cur,后者在长期治疗中表现更优,表明脂质体在靶向性和BSCB穿透方面有限制。
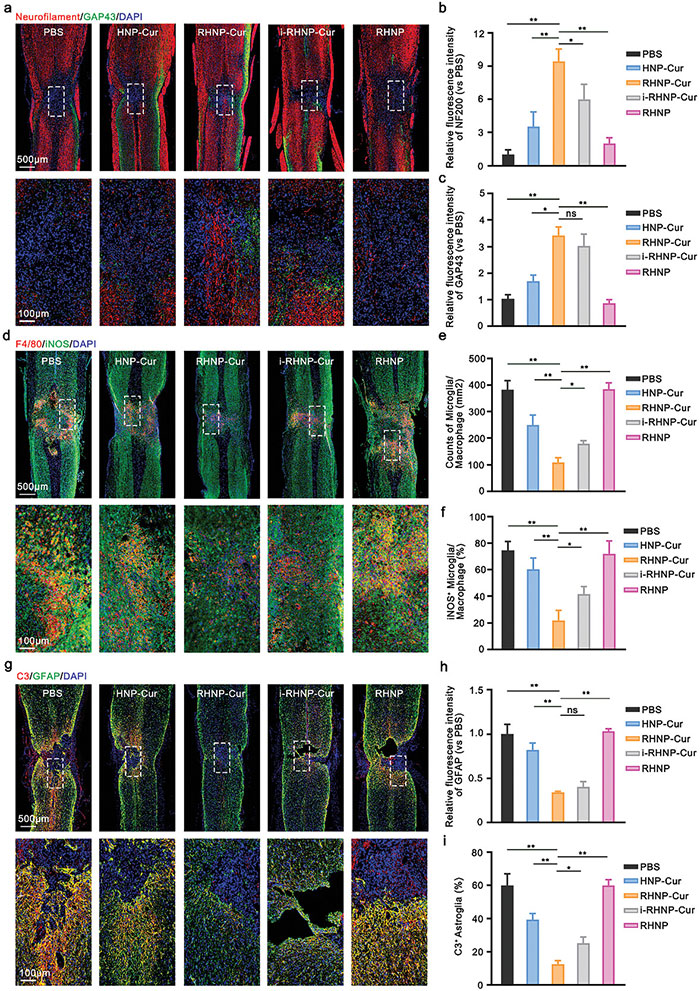
图6.RHNP-Cur 抑制炎症级联反应并促进脊髓损伤后的神经修复。 (a-c) 脊髓损伤后第 28 天脊髓损伤区域神经纤维(标记为 NF200,红色)和新生成神经细胞(标记为 GAP43,绿色)免疫荧光染色的代表性共聚焦图像(a),以及 NF200 荧光强度的半定量分析(与 PBS 组的倍数变化)(b)和 GAP43 荧光强度的半定量分析(与 PBS 组的倍数变化)(c)。实线框划定的区域在下方放大; (d-f) 损伤后第 7 天脊髓损伤区域小胶质细胞/巨噬细胞(标记为 F4/80,红色)和 M1 极化(标记为 iNOS,绿色)的代表性共聚焦图像(d),以及损伤区域小胶质细胞/巨噬细胞计数(e)和 iNOS+ 小胶质细胞/巨噬细胞比例的半定量分析(f); (g-i) 损伤后第 28 天脊髓损伤区域星形胶质细胞(标记为 GFAP,绿色)和神经毒性 A1 极化(标记为 C3,红色)的代表性共聚焦图像(g),以及 GFAP 荧光强度的半定量分析(与 PBS 组的倍数变化)(h)和损伤区域 C3+ 星形胶质细胞比例的半定量分析(i)
(6)RHNP-Cur抑制炎症级联的机制
为评估RHNP-Cur对炎症级联的影响,该研究团队建立了bEnd.3细胞、极化BV2细胞和原代星形胶质细胞的体外共培养模型。RHNP-Cur能够穿越BSCB,显著抑制LPS诱导的BV2细胞M1极化,并减少iNOS荧光信号。ELISA结果显示,RHNP-Cur有效降低了BV2上清液中的炎症因子水平(如TNF-α、IL-6等),进一步证实了其抗炎作用。与其他组相比,RHNP-Cur的效果最为显著。HNP-Cur因无法穿透内皮细胞屏障,其抗炎作用受限;i-RHNP-Cur则因RVG29的存在,导致内化受阻,效果减弱。RHNP-Cur还显著抑制了M1上清液诱导的A1星形胶质细胞分化,减少了C3、TNF-α、IL-6、IL-1β的表达,并下调了磷酸化STAT3和C3蛋白水平。总之,RHNP-Cur通过抑制M1小胶质细胞极化和A1星形胶质细胞分化,有效抑制了炎症级联反应。
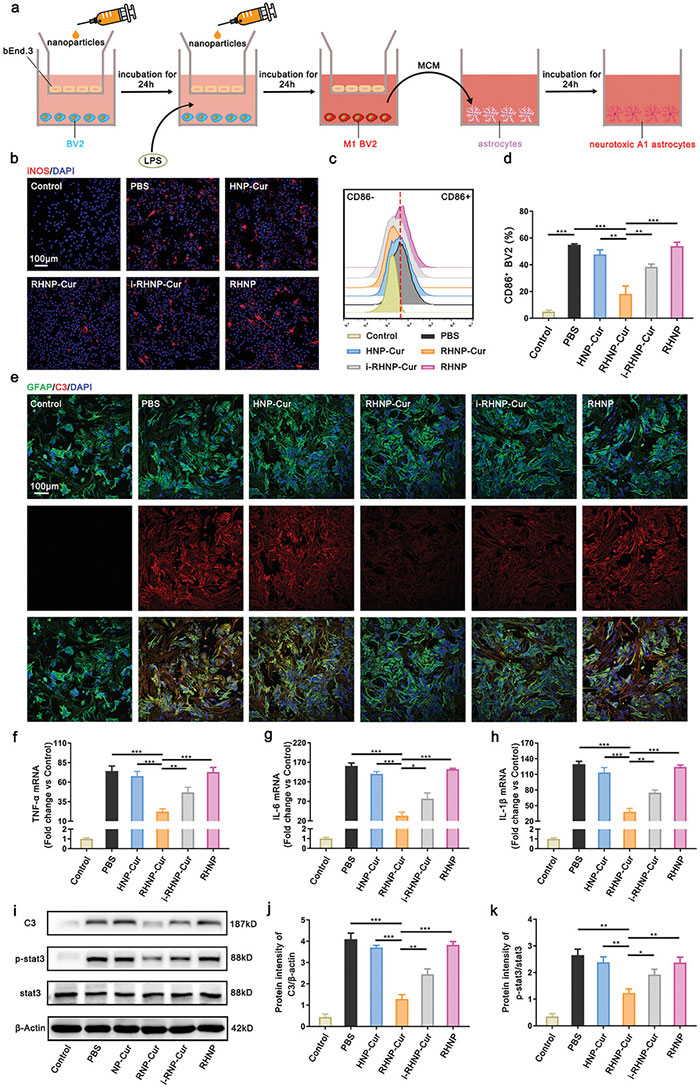
图7.RHNP-Cur 抑制炎症级联反应的机制。 (a) 用于评估 RHNP-Cur 对炎症级联反应作用的体外共培养模型示意图。MCM,微胶质细胞条件培养基; (b) BV2 细胞(用 iNOS 染色,红色)在 LPS(100 ng mL⁻¹)刺激下,与 PBS、HNP-Cur、RHNP-Cur、i-RHNP-Cur 和 RHNP 孵育 24 小时后,在基底外侧室培养的代表性共聚焦图像。额外的组别为不加任何刺激的对照组。细胞核用 DAPI(蓝色)染色。比例尺为 100 µm; (c,d) 流式细胞术分析 CD86+ M1 型 BV2 细胞(c)以及定量分析(d),在 (b) 中描述的相同刺激下进行; (e) 用 BV2 细胞培养上清液孵育 24 小时后的原代星形胶质细胞(用 C3-红色和 GFAP-绿色染色)的代表性共聚焦图像; (f-h) 用 RT-qPCR 检测神经毒性 A1 型星形胶质细胞中炎症相关基因 TNF-α、IL-6 和 IL-1β 的 mRNA 表达水平(n = 3); (i) 对 A1 型星形胶质细胞中的 C3、磷酸化的 Stat3(p-stat3)以及 Stat3 的 Western blot 分析; (j,k) C3 蛋白相对于 β-肌动蛋白的半定量分析以及 p-stat3/stat3 的分析
(7)RHNP-Cur 保护神经细胞免受神经毒性 A1 星形胶质细胞损伤的机制
为进一步研究RHNP-Cur对神经细胞的保护作用,该研究团队建立了共培养模型,模拟神经毒性A1星形胶质细胞诱导的HT22细胞凋亡。RHNP-Cur和i-RHNP-Cur显著减少了细胞凋亡,TUNEL染色和流式细胞术分析均证实了这一点。蛋白质印迹分析显示,RHNP-Cur治疗有效逆转了ACM诱导的促凋亡蛋白Bax上调和抗凋亡蛋白Bcl-2下调。与其他组相比,HNP-Cur和游离RHNP未显示显著效果。总的来说,RHNP-Cur通过抑制炎症级联反应表现出明显的神经保护作用,表明其在SCI治疗中具有关键作用。
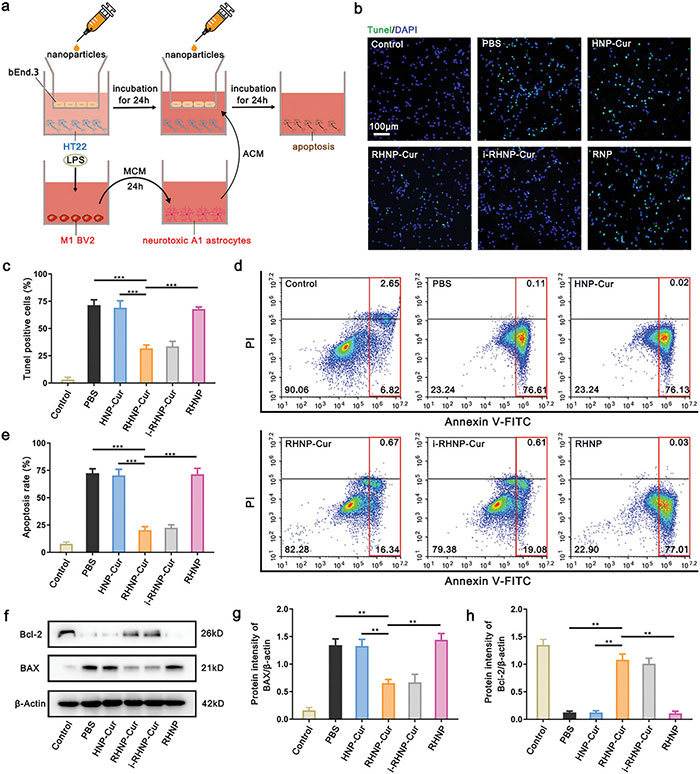
图8. RHNP-Cur 保护神经细胞免受神经毒性 A1 型星形胶质细胞的影响的机制。 (a) 用于展示 RHNP-Cur 对神经细胞保护作用的体外共培养模型示意图; (b,c) HT22 细胞(用 TUNEL 染色,绿色)在 ACM 孵育 24 小时后,与 PBS、HNP-Cur、RHNP-Cur、i-RHNP-Cur 和 RHNP 孵育的代表性图像(b)及 TUNEL+ 细胞的定量分析(c)。TUNEL 染色用于检测细胞凋亡。另设无任何刺激的对照组。细胞核用 DAPI(蓝色)染色。比例尺为 100 µm; (d,e) 流式细胞术检测 HT22 细胞的凋亡率(Annexin V-FITC/PI 双重染色)(d)及凋亡率定量分析(红框圈出的区域),包括早期凋亡(FITC+PI+)和晚期凋亡(FITC+PI−)(e); (f) HT22 细胞中凋亡相关蛋白 Bcl-2 和 Bax 的 Western blot 分析; (g,h) Bax 和 Bcl-2 蛋白相对于 β-肌动蛋白的半定量分析
【研究小结】
该研究团队成功开发了一种用于脊髓损伤药物治疗的微环境自适应纳米粒子。通过利用长链 RVG29-PEG,该研究团队实现了对脊髓的靶向递送,并在整个治疗过程中增强了 BSCB 的渗透性。纳米粒子对脊髓损伤早期病理微环境氧化应激的响应性,得益于 Se-Se 的敏感性,使长链 RVG29-PEG 脱落,短链 HA 暴露,促进免疫细胞的吸收。相反,在脊髓损伤晚期,完整的纳米粒子结构促进了神经元的内化。此外,将姜黄素封装在刺激响应纳米粒子中,作为一种微环境自适应或“智能”纳米药物,可有效促进脊髓损伤后的运动功能恢复。这是通过抑制炎症级联和保护神经再生免受炎症诱导的细胞凋亡而实现的。该研究团队的纳米药物的多功能性作为一种安全、有效且对患者友好的综合 SCI 治疗策略具有重大前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

