
研究背景:
糖尿病(DM)是一种以高血糖为特征的慢性代谢性疾病,其发病率逐年上升,糖尿病骨缺损作为其并发症之一因复杂的病理机制受到广泛关注。高糖环境会通过抑制线粒体氧化磷酸化(OXPHOS),减少ATP生成并导致活性氧(ROS)过量产生,进一步引发细胞衰老和成骨抑制。同时,ROS还能影响巨噬细胞极化,破坏骨生成与骨吸收的平衡,细胞衰老分泌的衰老相关分泌表型(SASP)因子亦会恶化周围微环境,抑制骨愈合。纳米酶作为天然酶的模拟物,具有酶催化活性,可通过清除ROS缓解氧化应激。二氧化锰(MnO2)与铁蛋白纳米笼结合形成的MnO2-铁蛋白纳米酶(MF纳米酶)表现出优异的ROS清除能力,但易在细胞溶酶体内降解,限制了其应用。SS31阳离子肽作为线粒体靶向药物,可稳定电子传递链、减少mtROS泄漏,并与纳米颗粒结合以增强疗效。此外,3D打印技术在糖尿病骨缺损修复中展现出重要价值,低温沉积建模(LDM)技术可制备多孔骨再生支架,有利于细胞黏附、迁移和营养扩散,同时避免高温对生物活性物质的影响。

针对上述问题,上海交通大学附属第六医院陶诗聪团队设计了一种基于PAEK-COOH和45S5生物活性玻璃(BG)的低温沉积建模(LDM)3D打印多级孔隙支架(PBG),并与MF@SS31(MF@S)纳米酶结合,用于加速糖尿病骨缺损的修复。该PBG-MF@S(PAEK-COOH/45S5 BG-MF@SS31)支架可填充骨缺损区域,提供机械支撑,同时45S5 BG增强了支架的骨整合性能。随着PBG-MF@S支架的逐步降解,MF@S纳米酶渗透到糖尿病骨缺损的微环境中,并靶向周围细胞的线粒体,从而维持线粒体功能,减少ROS的泄漏与积累。同时,衰老细胞被激活再生,免疫功能失调通过减少SASP因子和炎症因子的分泌,以及调节巨噬细胞极化逐步恢复,进而加速骨缺损区域的骨沉积。该文章于2024年04月13日以《3D Cryo-Printed Hierarchical Porous Scaffolds Harmonized with Hybrid Nanozymes for Combinatorial Mitochondrial Therapy: Enhanced Diabetic Bone Regeneration via Micromilieu Remodeling》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202403145)。
(1)MF@S 纳米酶的合成和表征
研究表明,人重组铁蛋白重链(HFn)具有出色的蛋白支架性能,其笼状结构可原位包裹MnO₂颗粒,模拟生物酶的功能。透射电子显微镜(TEM)的结果如图1A所示,空铁蛋白(APF)具有中空结构,而MF纳米酶的中空结构消失,表明MnO2颗粒已成功嵌入APF内。进一步测试MF纳米酶的生物酶功能,结果如图1B、C所示,其具有类似过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的活性,并且酶活性随MF纳米酶浓度增加而增强,同时其过氧化物酶(POD)活性较低。此外,MF纳米酶与带正电荷的肽SS31通过静电相互作用结合形成MF@S纳米酶(图1D)。动态光散射(DLS)和尺寸分布结果如图1E、F所示,SS31、MF纳米酶和MF@S纳米酶的Zeta电位分为19.47 ± 10.12 mV、−24.59 ± 4.67 mV和−0.04 ± 0.48 mV,SS31、MF纳米酶和MF@S纳米酶的平均直径分别为425.70 ± 85.78、30.59 ± 2.16 和203.90 ± 62.91 nm,证实了两者的电荷相互作用。TEM进一步观察了SS31、MF纳米酶和MF@S纳米酶的形态特征,结果如图1G所示,MF纳米酶为均匀的球形,而MF@S纳米酶表面包覆了一层SS31。通过拉下实验和表面等离子体共振(SPR)实验验证了SS31与MF纳米酶的结合能力,结果显示SS31与HFn的解离常数(KD)为4.381 µm,表明二者结合紧密(图1H-J)。
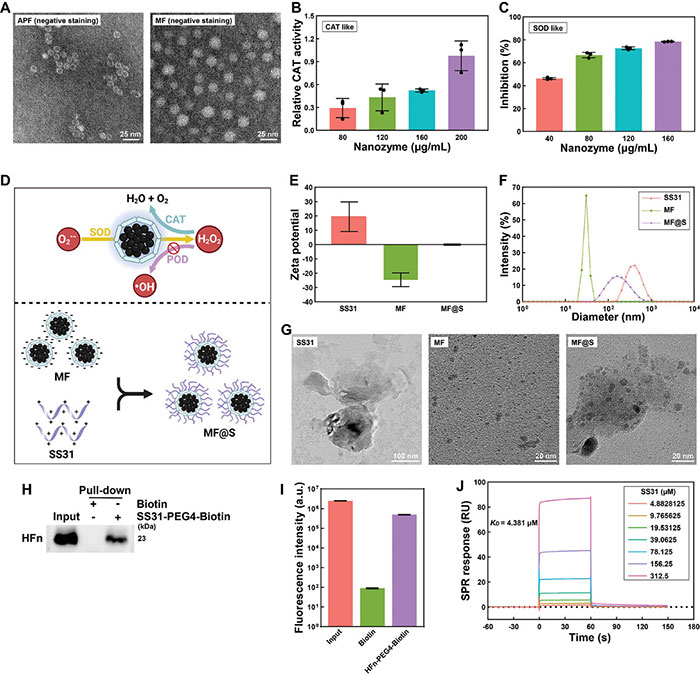
图1. SS31增强的二氧化锰(MnO2)-铁蛋白生物仿生纳米酶(MF@S纳米酶)的特性。A. 铁蛋白(APF)和仿生设计的二氧化锰-铁蛋白纳米酶(MF纳米酶)的TEM图像;B. MF纳米酶的类似过氧化氢酶(CAT)的相对活性;C. MF纳米酶的相对超氧化物歧化酶(SOD)样活性;D. MF纳米酶的催化活性和MF@S纳米酶的合成示意图;E. SS31、MF纳米酶和MF@S纳米酶的Zeta电位;F. SS31、MF纳米酶和MF@S纳米酶的粒度分布;G. SS31、MF纳米酶和MF@S纳米酶的TEM图像;H. 用Western印迹法检测重组人铁蛋白重链(HFn);I. SS31-FITC 的荧光强度;J. SPR检测显示了HFn与SS31的相互作用
(2)探索MF@S纳米酶的生物学功能
为了揭示MF@S纳米酶的潜在生物功能,采用RNA-seq分析其对人骨髓间充质干细胞(HBMSCs)基因转录的影响,发现188个显著差异表达基因(DEGs),其中57个显著下调,131个显著上调(图2A)。通过GO(图2B)、KEGG(图2C)、WikiPathways(图2D)和Reactome(图2E)进行通路富集分析,结果显示与炎症及抗炎相关通路、血管生成相关通路、成骨相关通路、氧化应激相关通路等。此外,GSEA分析进一步表明,除血管生成、炎症和成骨通路外,还涉及细胞迁移、细胞粘附、细胞分裂及氧化应激诱导的衰老通路(图2F)。这些结果表明,MF@S纳米酶可能影响成骨、血管生成、炎症、氧化应激及衰老等多种生物学通路。
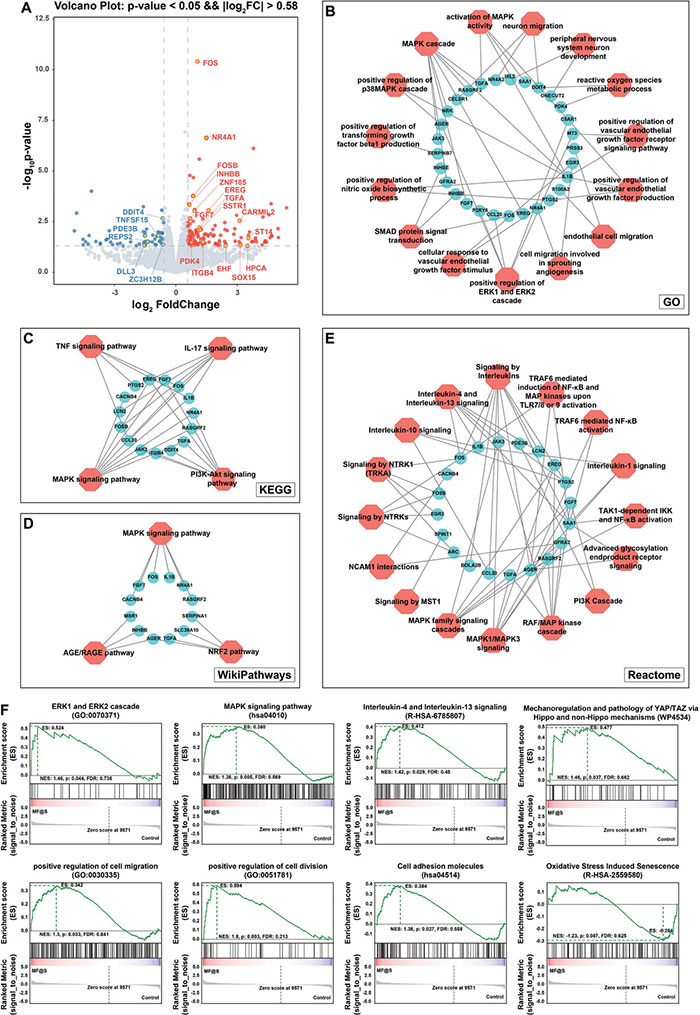
图2. 使用 RNA-seq 探索MF@S纳米酶的生物学功能。A. 响应 MF@S 纳米酶处理的差异表达基因的火山图;B-F. RNA-seq 后 GO、KEGG、WikiPathways、Reactome 和 GSEA 通路富集分析的结果
(3)MF@S纳米酶的抗氧化、迁移、血管化和抗衰老作用
在糖尿病中,高血糖微环境会诱导大量活性氧(ROS)的生成,显著影响细胞功能。为模拟高ROS水平的病理环境,研究采用叔丁基过氧化氢(TBHP)处理细胞,并通过2′,7′-二氯二氢荧光素二乙酸盐(DCFH-DA)检测MF@S纳米酶的ROS清除能力,结果如图3A所示,TBHP显著提高了细胞内ROS水平,而SS31、MF纳米酶和MF@S纳米酶均能够显著降低ROS水平,表明其具有优异的抗氧化性能。在高ROS条件下,Transwell实验结果显示,TBHP处理显著抑制了HMEC-1和HBMSCs的迁移能力,而SS31、MF纳米酶和MF@S纳米酶均能恢复细胞迁移能力,其中MF@S纳米酶效果最为显著(图3B)。在血管生成能力测试中,管腔形成实验表明,ROS显著降低了HMEC-1形成毛细血管样结构的能力,而MF@S纳米酶显著恢复了这一能力(图3C)。基于RNA-seq分析,还研究了MF@S纳米酶对氧化应激诱导的细胞衰老的影响,衰老相关β-半乳糖苷酶(SA-β-gal)活性检测如图3D所示,TBHP处理显著增加了SA-β-gal阳性细胞的比例,而SS31、MF纳米酶和MF@S纳米酶能够有效抑制ROS诱导的细胞衰老,其中MF@S纳米酶的效果最为显著。这些结果表明,MF@S纳米酶具有卓越的抗氧化、促进细胞迁移和血管生成能力,并能有效抑制氧化应激引起的细胞衰老。
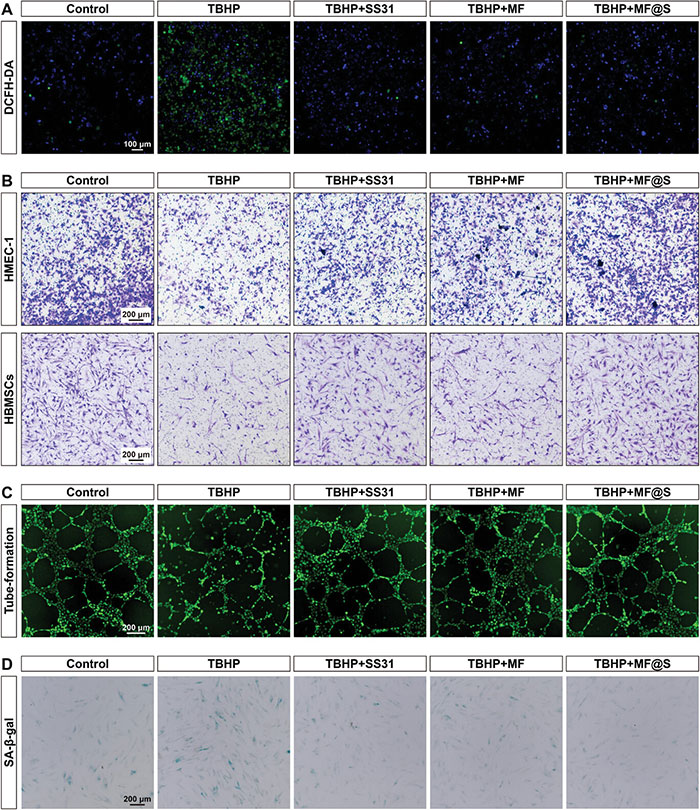
图3. MF@S纳米酶对抗氧化、迁移、血管形成和抗衰老的影响。A. 2',7'-二氯荧光素二乙酸酯(DCFH-DA)测定不同处理后叔丁基过氧化氢(TBHP)刺激的永生化人微血管内皮细胞(HMEC-1)细胞内活性氧(ROS)水平的荧光图像分析;B. 不同处理后HMEC-1和人骨髓间充质干细胞(HBMSCs)与TBHP刺激细胞的迁移评估;C. 不同处理后TBHP刺激细胞的HMEC-1的成管测定;D. SA-β-gal染色显示TBHP刺激细胞在不同处理后HBMSCs的细胞衰老
(4)MF@S 纳米酶的体外年轻化作用
EdU增殖实验验证了MF@S纳米酶的细胞年轻化作用。结果显示,在对照组和MF@S组中,细胞核均呈现大量绿色荧光标记,而TBHP组的绿色荧光细胞显著减少;但在TBHP+MF@S组中,细胞核的EdU标记显著增加(图4A)。同时,免疫荧光检测衰老标志物γ-H2AX的实验表明,TBHP组显示大量绿色荧光标记,提示DNA损伤,而TBHP+MF@S组绿色荧光显著减少(图4B)。这些结果表明,高ROS环境会抑制DNA合成、增加DNA损伤并加速细胞衰老,而MF@S纳米酶可以减少ROS引起的DNA损伤,从而在高ROS环境下实现HBMSCs的年轻化。此外,通过检测衰老标志物p16和p21的mRNA相对表达水平,进一步确认了MF@S纳米酶的年轻化效果,结果如图4C所示,ROS诱导后,p16和p21的表达水平显著升高,而与TBHP组相比,TBHP+MF@S组显著降低了这两种基因的表达。同时,检测分泌性表型相关因子(SASP)包括基质金属蛋白酶(MMP1、MMP10)、IL-1β、肿瘤坏死因子α(TNF-α)、IL-8及C-X-C基序趋化因子配体3(CXCL3)的mRNA表达水平显示,TBHP刺激显著增加了SASP因子的表达,而MF@S纳米酶能够显著抑制这些因子的表达。这些结果表明,MF@S纳米酶在高ROS微环境下通过降低DNA损伤、抑制衰老相关基因和SASP因子的表达,具有显著的细胞年轻化作用。

图4. MF@S纳米酶在HBMSCs中的年轻化作用。A. 不同处理后EdU分析的荧光图像;B.γ-H2AX染色检测不同处理后的DNA损伤;C. 不同处理后p16、p21和SASP因子(MMP1、MMP10、IL-1β、TNF-α、IL-8、CXCL3)的相对mRNA表达水平
(5)体外MF@S纳米酶对HBMSCs的成骨分化
通过碱性磷酸酶(ALP)染色和茜素红S(ARS)染色评估HBMSCs的成骨分化能力。ALP活性是成骨分化的早期标志,结果显示,与正常条件(对照组)相比,高ROS微环境(TBHP组)显著抑制了ALP的表达。然而,与TBHP组相比,SS31、MF纳米酶和MF@S纳米酶显著增强了ALP的表达,其中MF@S纳米酶组的ALP活性最高(图5A)。茜素红S染色用于评估钙结节的形成,结果与ALP染色一致,MF@S纳米酶组在所有高ROS环境组中显示最强、分布最广的钙结节染色(图5B)。此外,通过RT-qPCR检测了高ROS环境下MF@S纳米酶对成骨相关基因(如I型胶原COL1A1和RUNX2、骨形态发生蛋白2(BMP2)和骨桥蛋白(OPN))表达的影响。结果如图5C所示,TBHP显著抑制了这些基因的表达,而SS31、MF纳米酶和MF@S纳米酶均能够减轻高ROS对成骨相关基因表达的抑制作用,其中MF@S纳米酶效果最为显著。
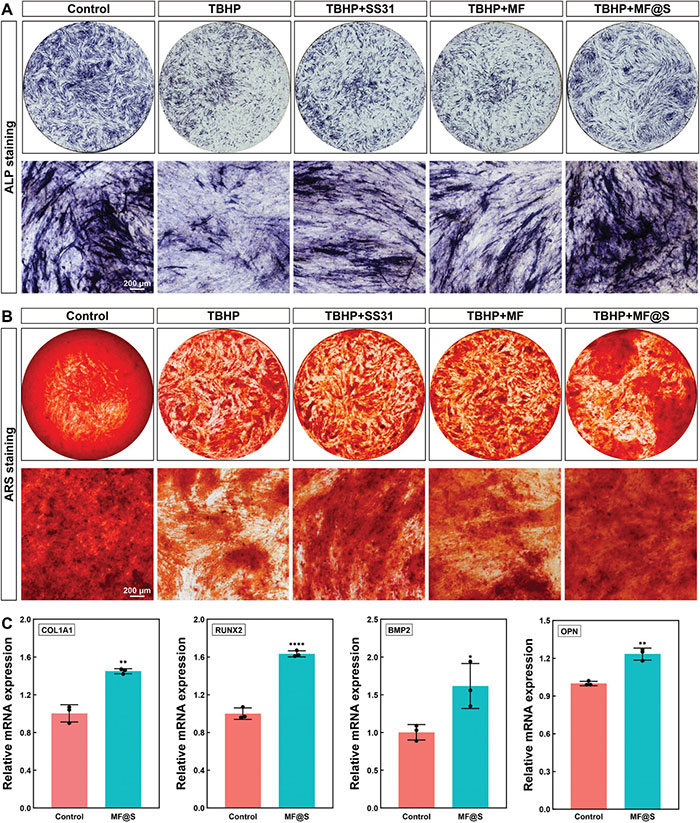
图5. 体外MF@S纳米酶对HBMSCs的成骨分化。A. ALP染色用于评估HBMSCs在高ROS条件下不同处理14 d后的成骨能力;B. ARS染色评估了在高ROS条件下14 d的不同处理后的成骨能力;C. 正常条件下MF@S纳米酶处理后成骨相关基因(COL1A1、RUNX2、BMP2、OPN)的相对mRNA表达水平
(6)MF@S 纳米酶的体外抗破骨细胞分化作用
骨骼系统是一个动态且持续重塑的结构,在正常情况下,骨吸收与骨形成之间保持平衡,从而维持骨骼的完整性和强度,在骨缺损修复过程中,抑制破骨细胞的形成可以减少缺损部位的骨吸收,从而促进骨缺损的愈合。通过TRAP染色评估破骨细胞的酶活性,结果如图6A所示,在分化培养7天后,TBHP组中TRAP阳性破骨细胞数量最多,其次是对照组,而TBHP+MF@S组和MF@S组中破骨细胞数量明显减少。使用FITC-鬼笔环肽(F-actin)和DAPI染色进一步评估破骨细胞的多核化和F-actin环的形成,结果如图6B所示,TBHP组显示出大量巨大的多核细胞和荧光F-actin环,而MF@S组和TBHP+MF@S组仅观察到少量小型多核细胞和F-actin环,这些结果表明,高ROS微环境促进了破骨细胞的分化,而MF@S纳米酶能够抑制破骨细胞的分化,即使在高ROS条件下亦如此。进一步通过骨切片评估破骨细胞诱导的骨吸收,结果显示,TBHP组和对照组的骨切片上存在大量骨吸收陷窝,其吸收面积和深度显著高于TBHP+MF@S组和MF@S组(图6C)。这表明,MF@S纳米酶能够有效抑制破骨细胞介导的骨吸收,从而有助于骨缺损的修复。
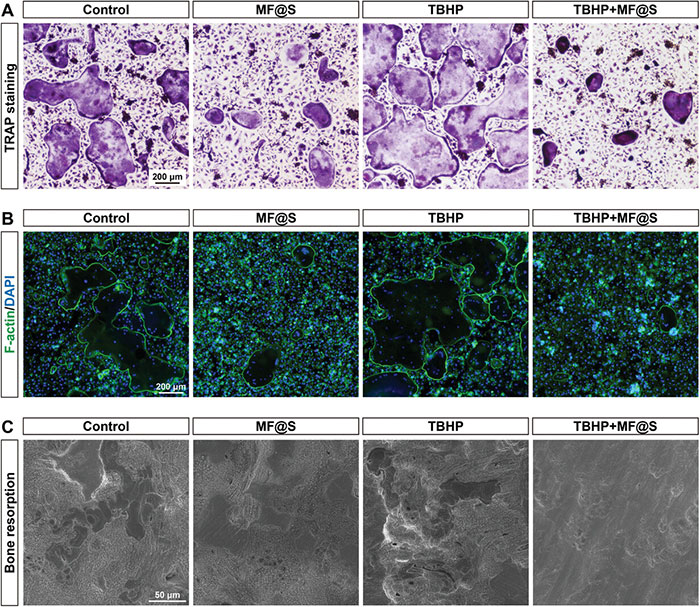
图6. MF@S纳米酶的体外抗破骨细胞分化作用。A. TRAP染色用于评估破骨细胞分化;B. 破骨细胞的荧光图像;C. 破骨细胞挖掘的吸收空隙的SEM图像
(7)MF@S纳米酶体外调节巨噬细胞极化
在糖尿病骨缺损的高血糖微环境中,失调的巨噬细胞极化在慢性炎症中起关键作用,因此,研究了MF@S纳米酶对巨噬细胞极化的影响。通过免疫荧光染色标记不同亚型的巨噬细胞,使用iNOS标记M1型巨噬细胞,CD206标记M2型巨噬细胞。结果如图7A所示,与对照组相比,经SS31、MF纳米酶或MF@S纳米酶处理的细胞中,iNOS阳性细胞数量减少,其中MF@S组的iNOS阳性细胞最少。在M2型巨噬细胞极化实验中,MF@S组观察到大量CD206阳性细胞,SS31组和MF组也有部分CD206阳性细胞,而对照组中仅有少量CD206阳性细胞。进一步通过流式细胞术评估MF@S纳米酶对M1型巨噬细胞极化的影响,结果显示,MF@S组的CD86阳性细胞比例最低,其次是SS31组、MF组和对照组;在M2型巨噬细胞极化实验中,MF@S组的CD206阳性细胞比例最高,其次是SS31组、MF组和对照组(图7B)。这些结果表明,MF@S纳米酶能够显著抑制M1型巨噬细胞的极化,同时促进M2型巨噬细胞的极化,有助于缓解炎症并改善骨缺损微环境。
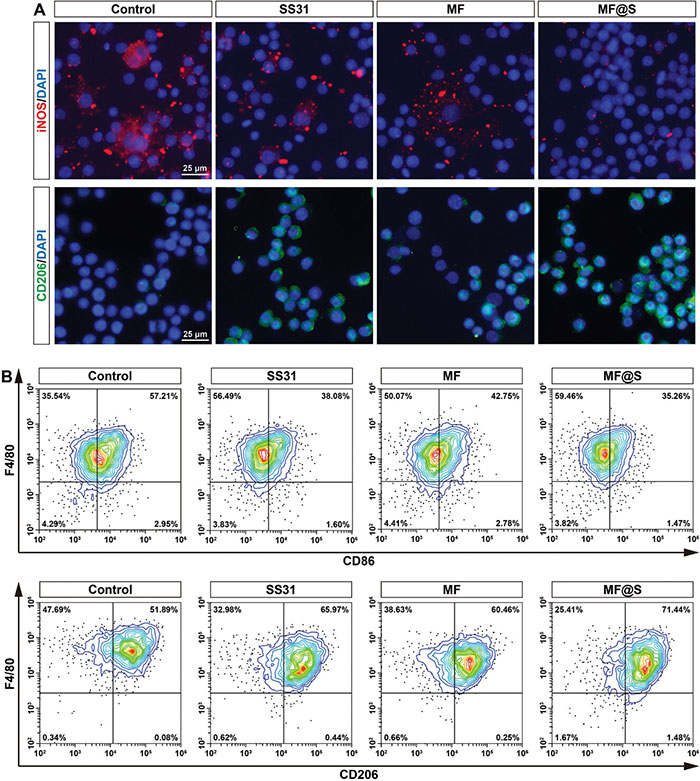
图7. 体外通过MF@S纳米酶调节巨噬细胞极化。A. 不同处理后巨噬细胞极化的荧光图像;B. 不同处理后M1巨噬细胞(F4/80和CD86)和M2巨噬细胞(F4/80和CD206)极化的流式细胞术分析
(8)低温三维打印分层多孔支架
通过LDM技术制备了PBG、PBG-SS31、PBG-MF和PBG-MF@S支架(图8A),其整体外观如图8B所示,扫描电子显微镜(SEM)用于分析支架的表面形貌,结果表明,这些支架由正交排列的纤维构成,纤维表面分布有微孔,形成分级多孔的海绵状结构(图8C)。进一步对纤维内部结构进行SEM分析,结果显示如图8D所示,所有支架的纤维横截面呈蜂窝状,支架的孔隙率分别为75.90±1.75%(PBG)、71.96±4.62%(PBG-SS31)、75.01±1.48%(PBG-MF)和76.19±1.61%(PBG-MF@S)。
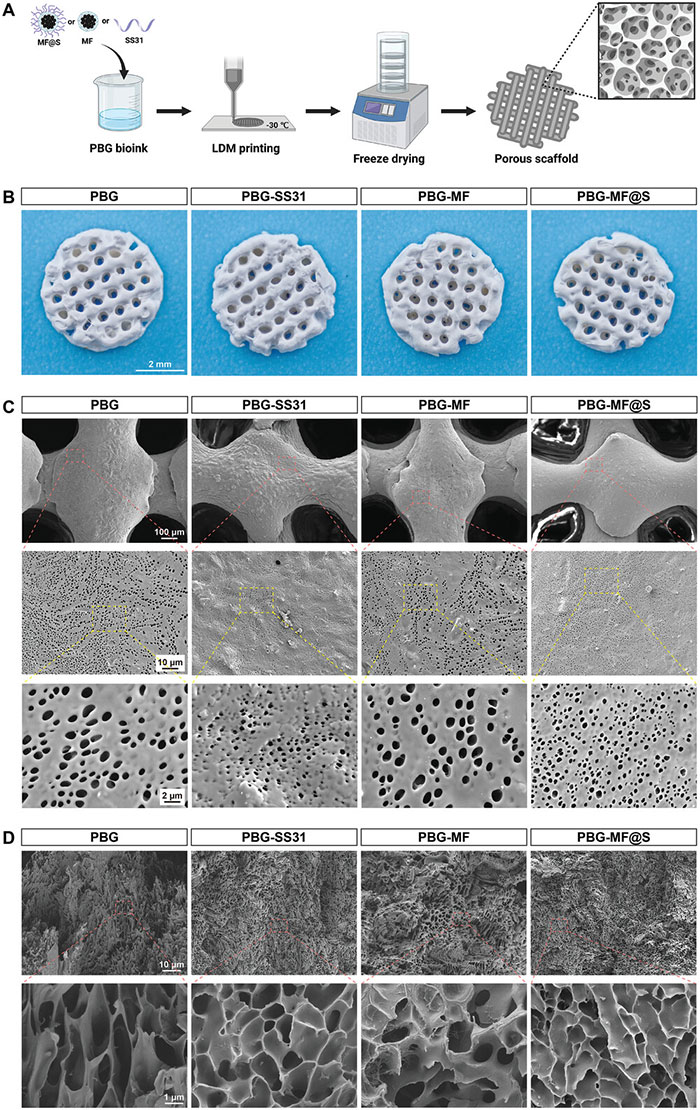
图8. PAEK-COOH/45S5 BG-MF@SS31(PBG-MF@S)支架的特性。A. PBG-MF@S支架制造过程示意图;B. 四种支架的照片;C. 四种支架表面形态的SEM图像;D. 纤维横截面的SEM图像
(9)PBG-MF@S 支架的生物相容性
在四种支架(PBG、PBG-SS31、PBG-MF和PBG-MF@S)支架上培养HMEC-1和HBMSCs 3天后,使用Live/Dead试剂盒对其进行染色。结果如图9A所示,支架上几乎没有死亡细胞,绝大多数细胞存活并呈绿色荧光。随后,通过扫描电子显微镜(SEM)观察细胞在支架上的黏附和形态特征,结果如图9B所示,细胞在支架的微孔作用下牢固黏附并铺展,四种支架之间在生物相容性上没有显著差异,表明它们均具有优异的细胞相容性。

图9. PBG-MF@S支架的体外生物相容性。A. 在不同支架上培养3天后HMEC-1和HBMSCs的活/死染色;B. HMEC-1和HBMSCs在不同支架上培养3天后的SEM图像
(10)PBG-MF@S 体内骨再生作用
该研究评估了PBG-MF@S支架对糖尿病大鼠5毫米关键尺寸颅骨缺损骨再生的影响。通过微型计算机断层扫描(micro-CT)分析植入12周后的新骨形成情况,结果如图10A所示,三维重建和横截面视图表明,对照组的骨缺损未修复,而所有支架组(PBG、PBG-SS31、PBG-MF和PBG-MF@S)均显著增加了骨组织的再生量,其中PBG-MF@S组的新骨再生量最多,该结果表明,在糖尿病大鼠的关键尺寸骨缺损中,自行修复难以实现,而PBG-MF@S支架在促进骨组织再生方面表现出卓越的效果。通过苏木精-伊红(H&E)染色(图10B)和Masson三色染色(图10C)进一步评估骨生成能力,结果显示,对照组在骨缺损处几乎没有新骨组织和胶原沉积,而PBG-MF@S支架的新骨形成和胶原沉积水平最高,其次是PBG-MF、PBG-SS31和PBG支架。此外,PBG-MF@S支架在支架内部和周围区域均表现出丰富的纤维结缔组织和再生骨组织,而其他支架组的再生骨组织主要集中在支架的内部或周围区域。通过免疫荧光(IF)染色用于评估I型胶原(COLI)的表达,结果如图10D所示,PBG-MF@S支架的COLI表达水平最高且最为成熟,其次是PBG-MF、PBG-SS31和PBG支架,而对照组的COLI表达最少。这些结果表明,PBG-MF@S支架在糖尿病关键尺寸骨缺损模型中具有显著促进新骨形成的能力。
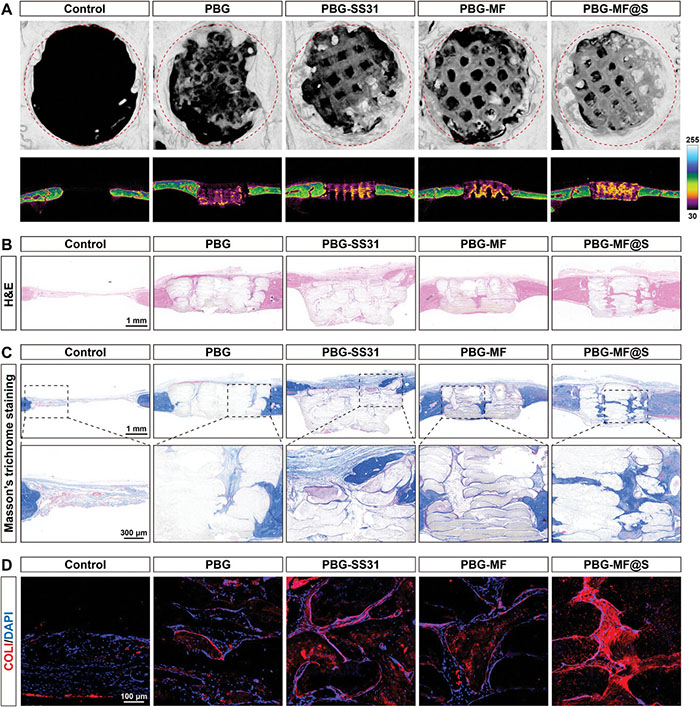
图10. PBG-MF@S支架对体内促进骨再生的影响。A. 植入支架12周的显微CT图像;B. 颅骨缺损组织切片的H&E染色图像;C. 颅骨缺损的Masson三色染色组织切片的组织学图像;D. COLI的免疫荧光(IF)染色
血管生成在成骨过程中起着重要作用,通过提供营养和氧气支持骨组织的形成。通过Micro-CT扫描Microfil灌注的血管以可视化新生血管,结果如图11A所示,对照组的血管生成水平最低,PBG支架组的血管生成仍较差,而PBG-SS31、PBG-MF和PBG-MF@S支架组均表现出显著增强的血管生成,其中PBG-MF@S支架组效果最为显著。此外,通过免疫荧光(IF)染色评估血管内皮生长因子(VEGF)的表达(图11B),对照组(无支架植入)显示出最低的荧光强度,而植入支架后VEGF表达显著增加。相比PBG支架组,PBG-SS31、PBG-MF和PBG-MF@S支架组的VEGF表达水平更高,其中PBG-MF@S支架组的表达量最高。这些结果表明,PBG-MF@S支架能显著促进血管生成。为了研究巨噬细胞的极化,采用免疫荧光染色标记M1型巨噬细胞(CD86)和M2型巨噬细胞(CD206)(图11C、D)。结果显示,PBG-MF@S组中CD206阳性细胞最多,而CD86阳性细胞最少;PBG-MF和PBG-SS31组也表现出大量CD206阳性细胞,依次高于PBG组和对照组。此外,对照组和PBG组检测到大量CD86阳性细胞,而PBG-MF和PBG-SS31组仅检测到少量CD86阳性细胞。这些数据表明,PBG-MF@S支架具有最强的免疫调节作用,能够促进M2型巨噬细胞极化并抑制M1型巨噬细胞极化。
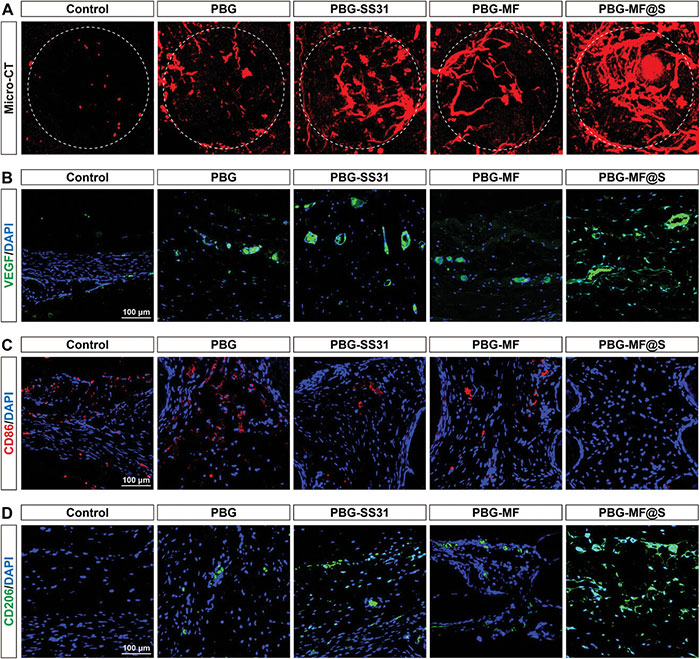
图11. PBG-MF@S支架对体内促进新生血管形成和调节巨噬细胞极化的作用。A. 支架植入7周后通过显微CT重建新形成的血管;B. VEGF的IF染色;C,D. CD86(红色)、CD206(绿色)和DAPI(蓝色)的IF染色
研究小结:
该团队成功制造了一种3D冷冻打印的分层多孔支架,与杂交纳米酶相协调,它提供了一种组合线粒体治疗系统,以重塑糖尿病微生物并促进糖尿病骨骼再生。该支架具有多级多孔结构,为细胞向内生长、粘附、迁移和营养交换提供了良好的条件。MF@S纳米酶有效清除ROS,改善线粒体功能,使衰老细胞恢复活力,调节巨噬细胞极化,促进成骨细胞分化,并抑制破骨细胞分化。PBG-MF@S 支架促进胶原纤维沉积、新生血管形成和骨沉积,并加速骨缺损修复。研究结果表明,PBG-MF@S 支架在治疗糖尿病骨缺损方面具有巨大潜力。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

