
糖尿病是全球十大慢性代谢性疾病中的第一位,并伴有许多严重的并发症。约20%的糖尿病患者创面愈合不良。过多的ROS,如过氧化氢(H2O2)、羟基自由基(-OH)和超氧阴离子(O2-),已被证明可诱导氧化应激,从而影响细胞活性和延缓伤口愈合。由于CeO2表面存在丰富的氧空位,Ce3+和Ce4+可以可逆转化,因此CeO2可以作为一种ROS清除剂。此外,CeO2材料可以刺激细胞增殖和迁移,在治疗糖尿病伤口上显示出巨大的潜力。细菌感染是阻碍糖尿病伤口愈合的另一个关键因素。光热疗法是替代传统抗生素治疗的一种方法,因此该研究选择硫化钼(MoS2)这种光热转化能力强的光热剂达高效抗菌的作用。同时,MoS2可以通过与额外的ROS反应来清除ROS。pH值与细菌感染和血管生成等生理过程有关。监测伤口pH值可以明确伤口状态,为细菌的感染提供早期预警。基于碳量子点(CDs)的pH传感器具有操作简单、响应速度快和生物相容性好的特点。因此,通过诊疗结合,实时监测伤口组织的pH值变化,及时进行精准治疗,促进糖尿病创面愈合。

针对上述问题,武汉理工大学戴红莲教授,通过酰胺化反应构建了硫辛酸修饰壳聚糖(LAMC)水凝胶,并将具有多巴胺结构的氧化铈-二硫化钼纳米颗粒(C@M@P)和水热合成的碳量子点(CDs)一起负载到水凝胶中,从而开发出一种诊断和治疗水凝胶(LAMC/CD-C@M@P)。通过引入CDs,该水凝胶在紫外光下表现出对pH的高度敏感性和可逆性。此外,水凝胶的图像可以使用智能手机收集并转换为伤口pH信号,为早期检测细菌感染提供了一种方法。同时,LAMC/CD-C@M@P水凝胶对金黄色葡萄球菌和大肠杆菌具有光热抗菌能力,并具有显著的抗氧化和抗炎能力,以缓解氧化应激和减轻炎症反应。该成果于2024年04月21日以《A Multifunctional Hydrogel with Photothermal Antibacterial and Antioxidant Activity for Smart Monitoring and Promotion of Diabetic Wound Healing》为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202402531)。

图1.构建糖尿病伤口愈合诊断和治疗水凝胶的示意图
(1)复合水凝胶的智能pH监测能力
如图1A所示,在紫外光(365 nm)下,水凝胶的荧光强度随pH的变化而变化。利用波长290 nm ~ 350 nm的激发光评价LAMC/CD-C@M@P水凝胶的激发依赖性(图1B)。随着激发波长从290 nm增加到320 nm,荧光强度大大增强,在320 nm处达到最大。同时,随着激发波长从330 nm增加到350 nm,荧光强度下降,并伴有红移。随后,当激发光波长为365 nm时,评估水凝胶的pH敏感性。有趣的是,随着pH值从4增加到9,荧光强度呈增加趋势(图1C)。进一步的详细研究了归一化荧光强度与pH值的关系,结果表明,得到的线性曲线可以很好地拟合(图1D)。此外,CDs在不同pH值下的荧光强度变化具有高度可逆性(图1E)。综上所述,荧光强度随pH值的线性变化有利于伤口状态的实时监测。为了克服肉眼下荧光强度变化的差异,将图像转换为RGB信号,构建pH值与RGB值的对应方程,通过智能方法轻松获得pH值(图1F)。在紫外光(365 nm)下,随着pH的增加,R值逐渐减小,G值保持不变,B值逐渐增大。通过G+B与pH值的拟合得到相应的方程(图1G)。

图2.水凝胶的智能pH监测功能。A)水凝胶在紫外光(365 nm)下的荧光强度变化。B)水凝胶在不同激发波长下的荧光强度。C)水凝胶在不同pH值(365 nm激发波长)下的荧光强度。D)荧光强度与pH值之间的线性关系。E)水凝胶在pH值为4至9(365 nm激发波长)内的可逆性。F)将图像转换成RGB信号。G)G+B与pH值的拟合曲线
(2)物理性质和活性氧清除能力
通过搭接剪切强度实验测量复合水凝胶的剪切黏结力(图2A)。结果表明,随着NPs的加入,粘附力增加(图2B)。在图2C中,与LAMC水凝胶相比,LAMC-P水凝胶的压缩性能下降,主要是由于PDA的良好粘附性能,这导致水凝胶对外力的抵抗力下降。图2D表明,LAMC水凝胶迅速溶胀,最终溶胀比为18.85±0.73。21天后,图2E显示,LAMC、LAMC-P、LAMC-C@P、LAMC-M@P、LAMC-C@M@P和LAMC/CDC@M@P的降解率分别为56.89±2.78%、62.93±1.48%、68.15±0.80%、46.54±2.91%、48.92±0.71%和55.22±1.80%。这种变化可能归因于带正电荷的P和CeO2与LAMC中的羟基之间的相互作用,这可能导致水凝胶内交联密度的差异。如图2F所示,LAMC水凝胶显示出5.21±1.87%的H2O2清除能力,而LAMC-P、LAMC-C@P、LAMC-M@P、LAMC-C@M@P和LAMC/CDC@M@P水凝胶显示出越来越高的清除能力,分别为38.10±0.48%、44.58±1.93%、40.85±4.48%、55.66±1.34%和55.29±0.32%。对于-OH和O2-清除能力也观察到类似的趋势。在图2G,H中,显示了LAMC水凝胶显示出分别为23.65±2.91%和22.19±6.33%的-OH和O2-清除能力,并且对于LAMC/CD-C@M@P水凝胶,进一步增加到53.67±0.86%和57.93±6.89%。

图3.复合水凝胶的表征。A)粘合强度试验示意图。B)水凝胶的粘合强度。C)复合水凝胶的可压缩性。D)水凝胶在pH为7.4的PBS中的溶胀比。E)水凝胶在pH为7.4的PBS中的降解性能。水凝胶的ROS清除率:F)H2O2 、G)-OH 和 H)O2-
(3)光热性能和近红外辅助抗菌性能
在1.0w cm-2的功率下,水凝胶的温度逐渐升高,而LAMC水凝胶保持在25.0°C至26.7°C的温度范围内(图3A)。复合水凝胶的抗菌性能通过直接接触菌液来测定。如图3D所示,在对照组和对照组+ NIR组中,固体培养基平板上出现了大量的活细菌菌落,表明NIR辐射对金黄色葡萄球菌和大肠杆菌(的生长没有影响。在LAMC组中,LAMC水凝胶对金黄色葡萄球菌和大肠杆菌的抗菌率分别为25.83±6.43%和17.71±6.48%,这主要归因于带正电荷的壳聚糖吸引了细菌的负电荷,破坏了细菌细胞膜的通透性和流动性(图3B-C)。在图3E中,在对照组和对照组+ NIR组中,细菌保持光滑完整的球形或杆状。当用808 nm NIR处理LAMC/CD-C@M@P水凝胶10分钟时,细菌细胞膜被严重破坏,内容物从细胞中流出。因此,C@M@P NPs产生的光热效应在抗菌过程中发挥了关键作用,显示出降低伤口感染风险的巨大潜力。

图4.复合水凝胶的光热和抗菌性能。A)水凝胶的光热升温曲线。B-D)金黄色葡萄球菌和大肠杆菌抗菌实验中的图像和定量数据。E)金黄色葡萄球菌和大肠杆菌的SEM图像
(4)生物相容性和细胞迁移
如图4A所示,在第一天和第三天没有观察到明显的细胞毒性。然而,L929细胞在所有水凝胶组中的存活率超过95%,显示出复合水凝胶良好的生物相容性,活/死染色结果(图4D)进一步证实了细胞相容性。细胞迁移是伤口愈合过程中的重要步骤。因此,通过细胞计数试剂盒-8 (CCK-8)分析和细胞划痕实验,使用人脐静脉内皮细胞(HUVECs)来评估水凝胶对细胞迁移的影响(图4B,E)。从图4E可以看出,对照组和LMAC组的细胞迁移结果大体一致,而LAMC/CDC@M@P组在促进细胞迁移方面表现出最佳影响。定量结果(图4C)显示,LAMC治疗/CD-C@M@P水凝胶在24小时后导致细胞划痕覆盖率为65.24±1.13%,超过了对照组(37.07±2.16%)和LAMC组(43.19±2.27%)。

图5.复合水凝胶的体外细胞相容性和细胞迁移。A)L929细胞B)HUVECs孵育1、3、5天后的细胞存活率。D)孵育24小时后L929细胞的活/死染色。E)不同时间(0、12、24 h)的细胞迁移照片和C)相应的定量数据
(5)抗氧化和抗炎能力
为了验证复合水凝胶在体内的抗氧化能力,H2O2处理的L929细胞被用作氧化应激模型。与正常组相比,对照组和LAMC组的OD值显著降低,存活率分别为23.57%和31.58%,并且在荧光显微镜下观察到更多的死亡细胞(图5A)。在用H2O2刺激后,在对照组中观察到细胞中的荧光强度,表明细胞内ROS水平升高(图5B)。相比之下,LAMC组显示出较弱的荧光强度,LAMC/CD-C@M@P组的活性氧水平进一步下降。为了评价复合水凝胶的抗炎活性,研究了它们在脂多糖(LPS)诱导后对RAW264.7细胞的M1/M2表型相关基因表达的影响。在LPS刺激后,M1相关基因(IL1β、iNOS和TNF-α)急剧增加(图5D–F)。在LAMC组,IL-1β和TNF-α的表达略有抑制,而iNOS的表达略有增加。重要的是,LAMC/CD-C@M@P组显著抑制了炎症状态下IL-1β、iNOS和TNF-α的表达。对于M2相关基因(Arg-1、TGF-β和IL-10),与LPS和LAMC组相比,LAMC/CD-C@M@P组增加了这些基因的表达,如图5G-I所示。在LAMC组中,观察到轻微程度的分化,定量荧光强度是正常组的1.55±0.23倍。值得注意的是,LAMC/CD-C@M@P组表现出明显的神经分化,定量荧光强度达到正常组的4.98±0.27倍(图5J)。
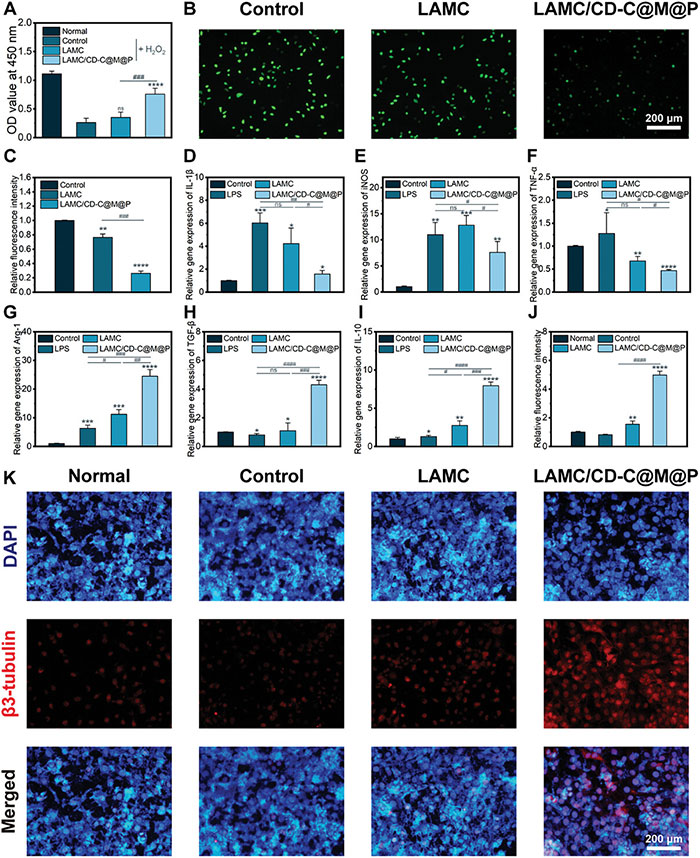
图6.复合水凝胶的抗氧化和抗炎作用。A)H2O2处理的L929细胞的细胞存活率。B)H2O2处理后L929细胞内ROS水平。C)细胞内ROS水平的荧光强度。D)白细胞介素-1β(IL-1β)、E)诱导型一氧化氮合酶(iNOS)、F)TNF-α、G)人精氨酸酶-1(Arg-1)、H)转化生长因子-β(TGF-β)和I)白细胞介素-10(IL-10)的相关基因表达。K)第7天PC12细胞的免疫染色图像。J)β3-微管蛋白的荧光强度
(6)体内pH监测和伤口愈合
通过腹腔注射链脲佐菌素(STZ)建立SD大鼠糖尿病模型。该研究的进展详见图6A。在血糖水平高于16.7 mM达7天后,将大鼠随机分为对照组、LAMC组和LAMC/CD-C@M@P组。在感染初期,伤口的pH 值从酸性逐渐升高到碱性,提示细菌感染的发生。通过近红外光照射,水凝胶的光热治疗功能激活,降低了伤口的 pH值并消除了感染。实验显示,水凝胶不仅能够有效实时监测伤口的pH,还能通过光热效应杀灭细菌。此外,水凝胶在14天的伤口愈合过程中表现出优异的促进效果。与对照组和单纯LAMC组相比,LAMC/CD-C@M@P组的伤口愈合速度更快,愈合率达到94.73%。这些结果表明,LAMC/CD-C@M@P水凝胶能够显著加快糖尿病伤口的愈合,减小感染的风险,并促进整体伤口修复过程。

图7.水凝胶在糖尿病伤口中的体内研究。A)治疗大鼠糖尿病伤口的实验程序。B)糖尿病伤口的建立、监测和治疗的示意图。C)不同时期伤口的代表性照片。D)体内pH监测。E)第3天各组的细菌存活率。F)不同时期不同组的伤口愈合率。G)不同组的伤口愈合过程示意图
(7)组织学和免疫荧光分析
通过免疫荧光染色和组织学分析评估LAMC/CD-C@M@P水凝胶的组织再生能力。苏木精-伊红(H&E)染色证明,LAMC/CD-C@M@P组在第14天后显示最小的伤口长度(959.33±13.05微米),并且显示更少的炎性细胞以及更高程度的伤口闭合(图7A,C)。图7B显示了Masson染色的结果,显示与其他组相比,LAMC/CD-C@M@P组中胶原沉积的蓝色增加且加深。数据的定量分析进一步表明,LAMC/CD-C@M@P组的胶原沉积率(60.14±2.18%)高于对照组(27.24±2.41%)和LAMC组(43.88±4.35%)。进行白细胞介素-6 (IL-6)和CD31的免疫荧光试验,以评估第7天的皮肤伤口修复。如图8A、E所示,与对照组和LAMC组相比,LAMC/CD-C@M@P组表现出最低的IL-6表达,表明炎症反应减少。此外,图8B、F显示了LAMC中CD31的高表达/CD-C@M@P组,提示促进新血管形成。随后,在第14天对CD86和CD206表达的评估显示,LAMC中M1相关生物标志物减少,M2相关生物标志物质增加/CD-C@M@P组与其他组相比,表明LAMC/CD-C@M@P水凝胶可以促进巨噬细胞向M2的分化,并表现出抗炎作用。为了评估神经发生和血管生成,在第14天进行了CD31和β3tubulin的免疫荧光染色(图8D,I,J)。CD31的表达出现在对照组和LAMC组,表明有一定的血管生成,几乎没有观察到β3-tubulin.的表达在LAMC/CD-C@M@P组中,CD31和β3-tubulin的荧光强度最明显,表明可观察到神经和血管的整合再生。

图8.伤口组织的组织学分析A)H&E染色和B)Masson染色在第14天的显微照片。C)伤口长度和D)胶原沉积的统计分析

图9.A)IL-6、B)CD31在不同组织创面中第七天的免疫荧光染色结果。C)巨噬细胞、D)CD31和β3-微管蛋白在不同创面组织中第14天的免疫荧光染色结果。E)IL-6、F)CD31、G)CD86、H)CD206、I)CD31和J)β3-微管蛋白在第14天的荧光强度
研究小结:
该研究提出了一种具有pH监测、光热抗菌、抗氧化和抗炎性能的新型诊断和治疗水凝胶。在壳聚糖基水凝胶中掺入CDs使其具有光致发光,其荧光强度随pH值的变化而变化。这一特性使水凝胶可以作为pH传感器,通过荧光信号精准地检测伤口的pH值,为评估伤口状态提供了一种方法。LAMC/CD-C@M@P水凝胶在体外表现出良好的机械性能、光热转换能力和近红外下对金黄色葡萄球菌和大肠杆菌的抗菌性能。此外,复合水凝胶还能有效缓解氧化应激,减轻炎症反应,改善糖尿病创面微环境,促进糖尿病创面愈合。因此,该研究为糖尿病创面提供了一种新的诊疗一体化治疗策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

