
三阴性乳腺癌(TNBC)是乳腺癌亚型中预后最差的类型,面临着高恶性度、复发和治疗难度等问题。常用的化疗药物多柔比星(DOX)作为TNBC的一线治疗方案,与免疫检查点抑制剂联合使用显示出更好的疗效。这是因为DOX能够诱导免疫原性细胞死亡,促进树突状细胞的成熟及细胞毒性T淋巴细胞的浸润。然而,由于肿瘤微环境的异质性和多种致癌信号的超激活,联合疗法往往面临肿瘤耐药和复发的挑战。信号转导和转录激活因子3(STAT3)作为多条致癌信号通路的交汇点,与肿瘤免疫抑制微环境密切相关,因此针对STAT3的干预可能有助于逆转TNBC的免疫抑制。尽管已有针对STAT3的抑制剂,但由于其水溶性和细胞渗透性差,临床效果不佳。

针对上述问题,第三军医大学齐晓伟团队采用小鼠三阴性乳腺癌细胞衍生的肿瘤外泌体(TEV)作为载体,开发了功能化的siSTAT3和多柔比星(DOX)联合治疗制剂(siSTAT3-DOX@TEV)。实验结果表明,该制剂能够精确靶向肿瘤组织,显著下调STAT3表达,并有效诱导肿瘤免疫原性细胞死亡,逆转免疫抑制微环境。此外,免疫组织化学和质量细胞术分析显示,在肿瘤组织中M1巨噬细胞及CD4+和CD8+ T细胞的水平显著增加,表明该策略在临床TNBC治疗中的潜力。该文章于2024年10月30日以《Tumor-Derived Extracellular Vesicles Enable Tumor Tropism Chemo-Genetherapy for Local Immune Activation in Triple-Negative Breast Cancer》为题发表于《ACS Nano》(DOI:10.1021/acsnano.3c12967)。
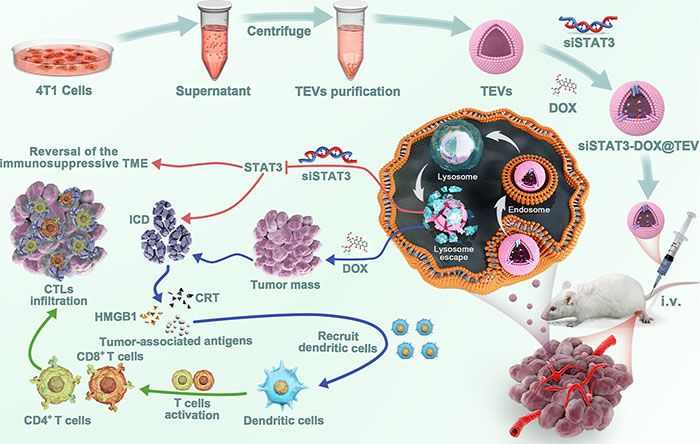
siSTAT3-DOX@TEV制备及TNBC治疗示意图:siSTAT3-DOX@TEV有效诱导ICD逆转免疫抑制的TME,从而介导强烈的抗肿瘤免疫反应
(1)siSTAT3-DOX@TEV的制备与表征
从4T1细胞培养上清液中收集肿瘤来源外泌体(TEVs),并通过透射电子显微镜(TEM)、西方印迹和纳米颗粒跟踪分析(NTA)进行表征。图1A和B显示,TEVs呈现典型的双膜结构和约95.6 ± 5.5 nm的直径。WB结果(图1C)表明TEVs中含有增加的外泌体蛋白标志物TSG101、CD63和Flotillin-1,表明外泌体分离成功。接着,通过商业试剂Exo-Fect转染Cy5标记的siSTAT3(siSTAT3-cy5),图1D显示混合后,siSTAT3@TEV的荧光光谱与纯siSTAT3-cy5相同,封装效率约为70%(图1E)。对siRNA完整性的检测(图1F)表明,TEVs能够保护siRNA免受核酸酶的快速降解。随后,采用共孵育法制备siSTAT3-DOX@TEV,将DOX加载到siSTAT3@TEV中。图1H显示,siSTAT3-DOX@TEV的紫外/可见光谱与纯DOX相同,表明DOX被有效加载。对不同初始DOX输入浓度的封装效率计算(图1I)显示,从77.68%到93.36%不等。
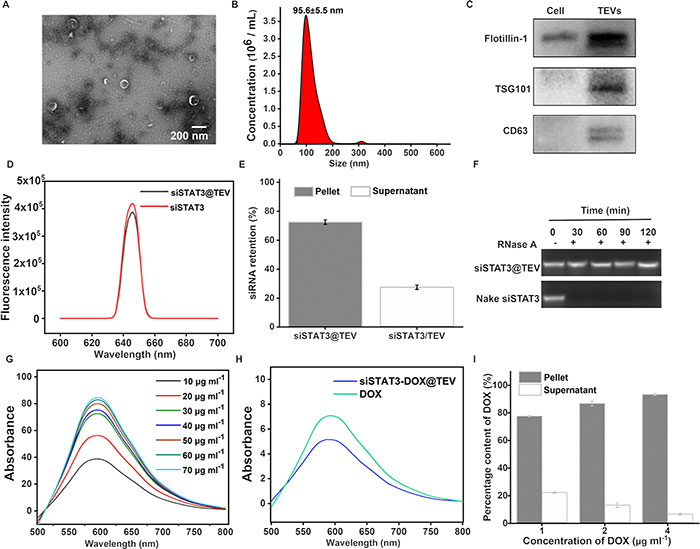
图1. siSTAT3-DOX@TEV 的表征。(A)TEV 的代表性 TEM。比例尺:200 nm。(B)通过 NTA 检测到的 TEV 的粒度分布。(C)4T1 细胞裂解物和 TEV 的外泌体蛋白生物标志物(Flotillin-1、TSG101 和 CD63)表达的蛋白质印迹分析。(D)siSTAT3 和 siSTAT3@TEV(siSTAT3-Cy5)的荧光光谱。(E)siSTAT3 的包封效率。(F)与 RNase A 孵育后裸露的 siSTAT3 和 siSTAT3@TEV 的琼脂糖凝胶电泳。(G)具有梯度浓度的 DOX 的 UV/vis 光谱。(H)DOX 和 siSTAT3-DOX@TEV 的 UV/vis 光谱。(I)不同浓度点的 DOX 包封效率
(2)TEV介导的体内外靶向效能
为了评估TEVs作为药物递送载体的靶向肿瘤细胞的能力,研究将TEVs标记上荧光探针Dil,并与4T1细胞共同孵育。共聚焦显微镜显示,4T1细胞有效内化了TEVs(图2A)。为探索TEVs在体内的肿瘤靶向能力,研究将Dil标记的TEVs通过静脉注射到原位4T1肿瘤小鼠模型中。治疗后6、12、24和48小时收集肿瘤及主要器官,测量和定量荧光强度(图2B、C)。在肿瘤组织中持续强烈的荧光信号表明,TEVs作为TNBC治疗的递送载体具有良好的肿瘤靶向能力。
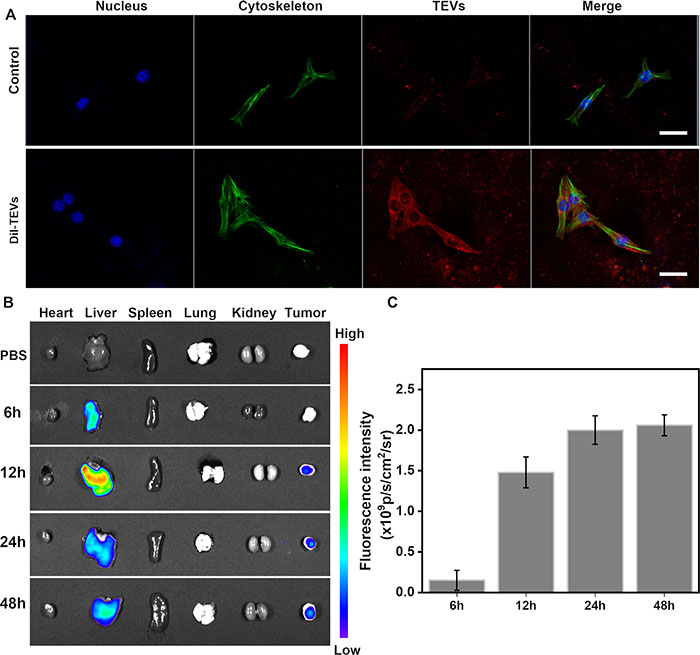
图2. TEVs 在体内和体外的特定肿瘤趋向性行为。(A)在 37 oC 下用 PBS 和 TEVs 处理 4 小时的 4T1 细胞的共聚焦显微镜图像。TEVs 用 Dil(红色)标记,细胞骨架用 Actin-Tracker Green-488 染色。(B)PBS 或 TEV 静脉注射后小鼠主要器官和肿瘤的荧光图像。TEVs 用 Dil 标记。(C)肿瘤组织荧光强度的量化
(3)TEV的细胞摄取机制
为了探索TEVs的细胞摄取途径,研究对4T1细胞进行了内吞抑制剂的预处理。结果显示,氨氯地昂(Na+/H+泵相关微内吞抑制剂)和M-β-CD(克拉胜内吞抑制剂)并未阻碍TEVs的摄取(图3A),而dynasore(动力蛋白依赖性内吞抑制剂)显著抑制了TEV的摄取。这表明TEVs主要通过动力蛋白依赖的途径内吞,而这种途径被认为是外泌体摄取的主要方式。当siRNA进入细胞后,容易被大量溶酶体吞噬,使其难以顺利转运到细胞质中。因此,能否在体内逃脱溶酶体吞噬是递送载体能否实现细胞内输送的关键。为了评估TEVs的溶酶体逃逸能力,研究将siSTAT3-Cy5加载到TEVs中,与细胞共同孵育后再用溶酶体追踪剂染色。共聚焦显微镜观察显示,siSTAT3-Cy5在进入细胞后4小时内完全被困在溶酶体中,但随着时间的推移,siSTAT3-Cy5与溶酶体的重叠逐渐减少(图3B)。这些结果表明,TEVs能够成功逃脱溶酶体。
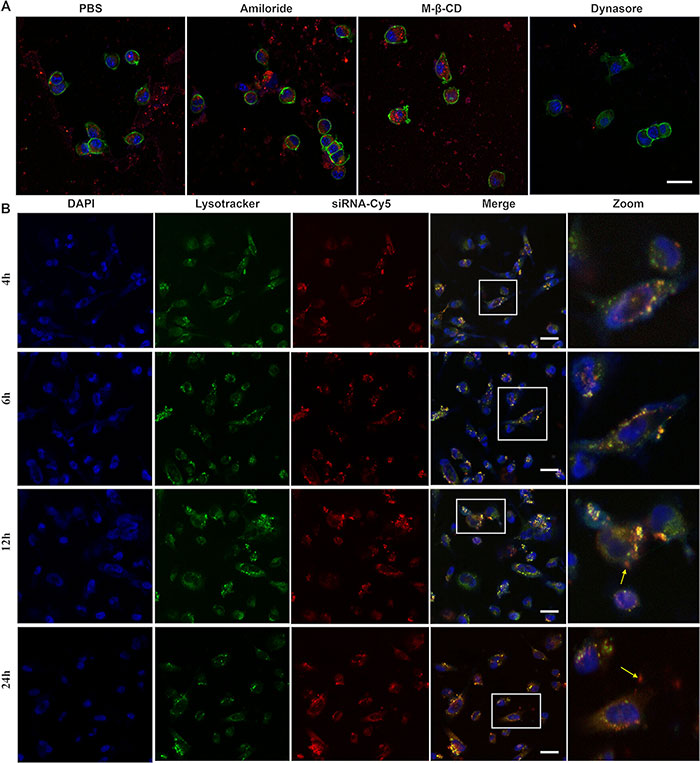
图3. TEV 的细胞摄取机制和货物转运能力。(A)4 小时后 4T1 细胞中 TEV(Dil-TEV,红色)的细胞摄取的共聚焦显微镜图像(TEV 浓度:30 μg/mL)。细胞核用 DAPI(蓝色)染色。(B)与 siSTAT3@TEV(Cy5,红色)孵育的 4T1 细胞的共聚焦显微镜图像。在 37 °C 下进一步孵育 4、6、12 和 24 小时后,用 LysoTracker(绿色)染色细胞
(4)体外协同化疗-基因疗法效果
该研究将多柔比星(DOX)引入siSTAT3@TEV,以验证其协同抗肿瘤效果。通过CCK-8检测在48小时后的抗肿瘤增殖活性。所有组别均表现出剂量依赖性的细胞毒性,特别是协同治疗的siSTAT3-DOX@TEV组显示出最低的增殖活性(图4A)。与对照组(PBS)相比,裸siSTAT3和siSTAT3@TEV组的细胞活力没有显著变化。DOX组和siSTAT3-DOX组的细胞增殖活性均有所降低,但协同治疗组的残存存活细胞仅为4.5%(图4B)。细胞凋亡结果显示,Control组、siSTAT3组、DOX组、siSTAT3@TEV组和siSTAT3-DOX组的凋亡率分别为21.73%、19.62%、29%、48.2%和43.2%,而siSTAT3-DOX@TEV组的凋亡率高达64.9%(图4C、D)。这些结果表明,协同的siSTAT3-DOX@TEV组具有更好的抗肿瘤效率。
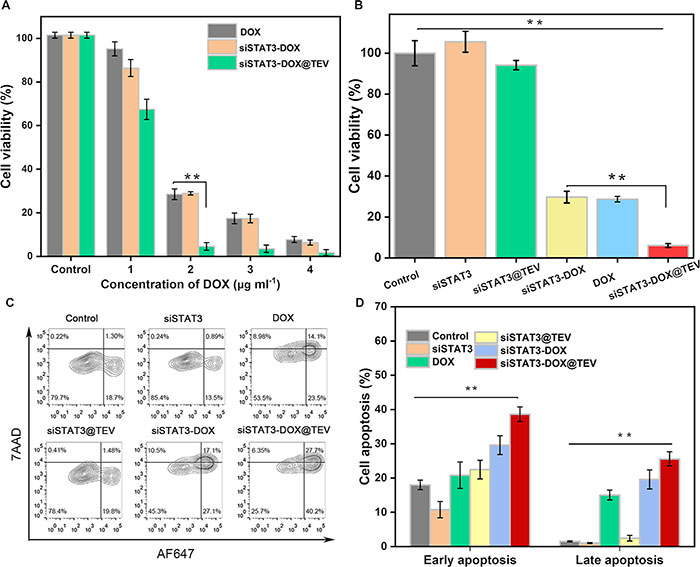
图4. siSTAT3-DOX@TEV 体外协同治疗。(A)用 DOX、siSTAT3-DOX 或 siSTAT3-DOX@TEV 处理 48 小时后的 4T1 细胞活力。(B)用对照、siSTAT3、siSTAT3@TEV、siSTAT3-DOX、DOX 或 siSTAT3-DOX@TEV 处理 48 小时后的 4T1 细胞活力。(C)用对照、siSTAT3、siSTAT3@TEV、siSTAT3-DOX、DOX 或 siSTAT3-DOX@TEV 处理 48 小时后,通过 AF647/7AAD 染色流式细胞术分析细胞凋亡率。(D)细胞凋亡率的量化
(5)协同化学基因治疗促进体内 ICD
为探究siSTAT3-DOX@TEV协同治疗在诱导肿瘤细胞免疫原性死亡(ICD)中的作用,研究采用免疫组化方法检测肿瘤中CRT和HMGB1的表达。图5A展示了治疗方案。结果显示,对照组、siSTAT3组和siSTAT3@TEV组的CRT和HMGB1表达较低。而在siSTAT3-DOX@TEV组中,CRT转位至细胞膜和HMGB1的表达显著增加,且与DOX组和siSTAT3-DOX组相比均有显著差异(图5B–D)。上述结果表明,siSTAT3-DOX@TEV协同治疗增强了肿瘤细胞的免疫原性死亡。
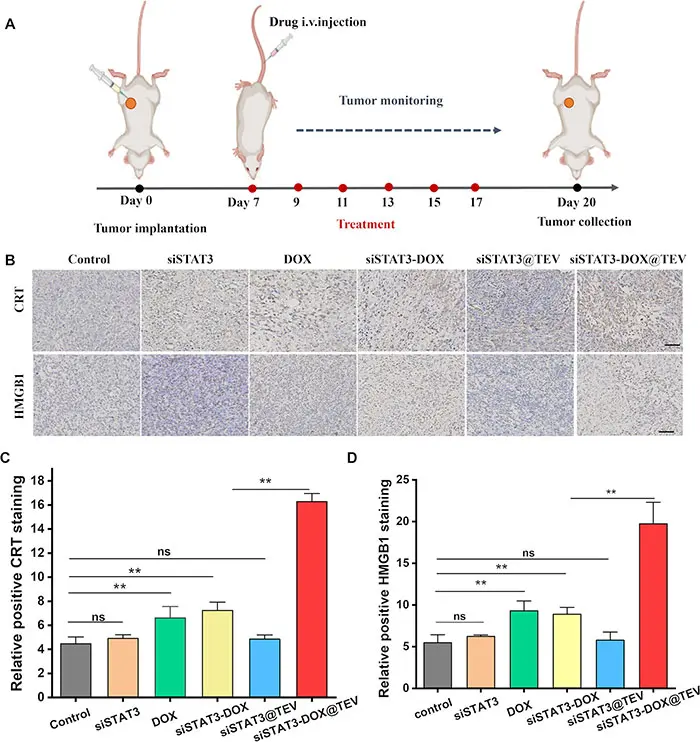
图5. siSTAT3-DOX@TEV 体内协同治疗。(A)指示治疗方案,iv,静脉注射。(B)肿瘤中 CRT 和 HMGB1 表达的免疫组织化学分析。在抗肿瘤研究结束时对肿瘤组织中 (C) CRT 和 (D) HMGB1 的阳性率进行免疫组织化学分析
(6)协同化疗-基因疗法抑制体内TNBC生长
在肿瘤生长1周后,当肿瘤体积接近50 mm³时,通过尾静脉注射对照组、siSTAT3组、DOX组、siSTAT3-DOX组、siSTAT3@TEV组或siSTAT3-DOX@TEV组。结果显示,对照组和siSTAT3组之间的肿瘤体积几乎没有差异,而DOX组和siSTAT3-DOX组对肿瘤生长的抑制效果适中,但不足以显著抑制。值得注意的是,siSTAT3@TEV组由于TEVs的肿瘤靶向能力,其抗肿瘤效果明显强于单独的siSTAT3。siSTAT3-DOX@TEV组显示出最佳抗肿瘤效果,表明DOX和siRNA在体内具有协同效应。这一结果通过肿瘤组织大小得到了验证(图6C–E),siSTAT3-DOX@TEV组的平均肿瘤重量仅为0.23 g(图6D),显著低于其他组。H&E染色结果显示,siSTAT3-DOX@TEV组的肿瘤细胞最为稀疏(图6F)。免疫组化分析表明,siSTAT3@TEV和siSTAT3-DOX@TEV组的STAT3表达水平显著降低,且Ki67染色显示siSTAT3-DOX@TEV组的细胞增殖率最低(图6F)。Western blot结果进一步验证了STAT3表达的显著降低(D)。免疫组化分析显示,CCL2和α-SMA在对照组和siSTAT3组中高度表达,而在siSTAT3-DOX@TEV组中表达减少最显著(图6G),表明siSTAT3-DOX@TEV在肿瘤微环境中减少了细胞外基质的形成,增强了药物的渗透效果并提高了抗肿瘤效果。
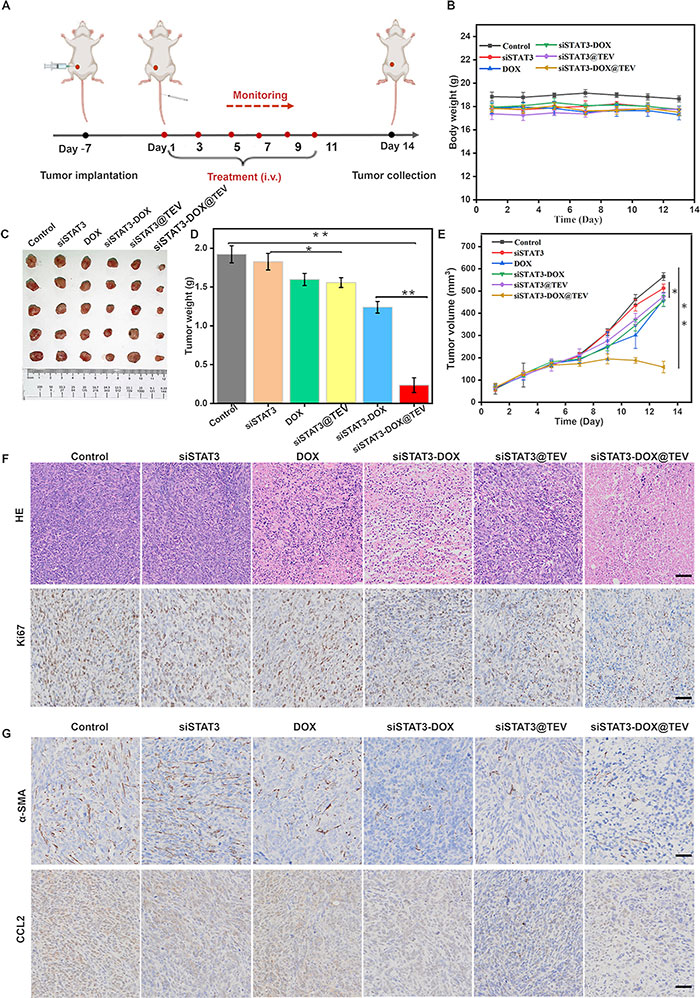
图6. siSTAT3-DOX@TEV 体内协同治疗。(A)指示的治疗方案,iv,静脉注射。(B)治疗后 4T1 荷瘤小鼠的体重。(C)治疗后第 14 天的代表性肿瘤图像和(D)切除的肿瘤重量。(E)治疗期间 4T1 荷瘤小鼠的肿瘤生长曲线。(F)抗肿瘤研究结束时小鼠肿瘤组织的 H&E 和 Ki67 染色。(G)研究结束时肿瘤组织中 α-SMA 和 CCL2 表达水平的免疫组织化学分析
(7)siSTAT3-DOX@TEV的局部免疫激活作用
通过对肿瘤免疫景观的CyTOF分析(图7A),进一步探讨了siSTAT3-DOX@TEV治疗对肿瘤微环境(TME)的影响。原位模型样本经分析后确定了26个细胞簇,利用42个免疫标记物进行标记(图7B)。根据典型标记物识别了已知细胞类型(图7C)。对肿瘤浸润淋巴细胞的T细胞重新聚类分析显示,siSTAT3-DOX@TEV组的CD4+ T细胞和CD8+ T细胞数量显著增加(图7D,E)。总体来说,免疫景观分析表明,siSTAT3-DOX@TEV改变了免疫豁免的TME,使其向有利于免疫治疗的TME转变,表现为M2极化巨噬细胞减少、M1极化巨噬细胞、CD4+ T细胞和CD8+ T细胞数量增加,从而可能激活局部抗肿瘤免疫反应。为进一步验证siSTAT3-DOX@TEV的协同免疫激活效果,通过免疫组化分析评估了治疗后免疫细胞的变化。这些数据表明siSTAT3-DOX@TEV有效促进了免疫细胞浸润,并产生了强烈的抗肿瘤免疫反应。
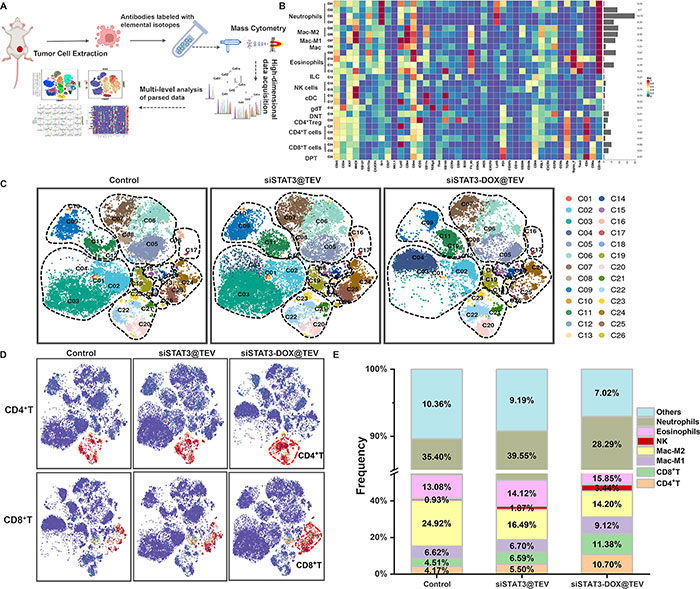
图7. 治疗后肿瘤浸润免疫细胞的 CyTOF 分析。(A)CyTOF 分析示意图。(B)免疫细胞中表达的标志物标准化表达热图。左侧和右侧分别显示免疫细胞的类型和比例。(C)t-SNE 绘制了主要免疫细胞类型的标志物颜色编码表达。(D)t-SNE 绘制了 CD4 + T 细胞和 CD8 + T 细胞的标志物颜色编码表达。主要免疫细胞类型用红色框标记。(E)免疫细胞亚群的频率图
(8)生物相容性评估
为验证该共递送体系的生物相容性,该研究进行了溶血实验,以评估TEV的溶血活性。结果显示,TEV在1–5 mg/mL浓度范围内的溶血率均低于5%(图8A,B),满足静脉注射药物递送的安全性要求。此外,为进一步评估siSTAT3-DOX@TEV的生物相容性,在体内实验结束后取出主要器官(心脏、肝脏、脾脏、肺和肾脏)进行H&E染色。结果显示,这些器官均未出现显著的组织病理学变化(图8C)。这些结果表明,siSTAT3-DOX@TEV具有良好的生物相容性。
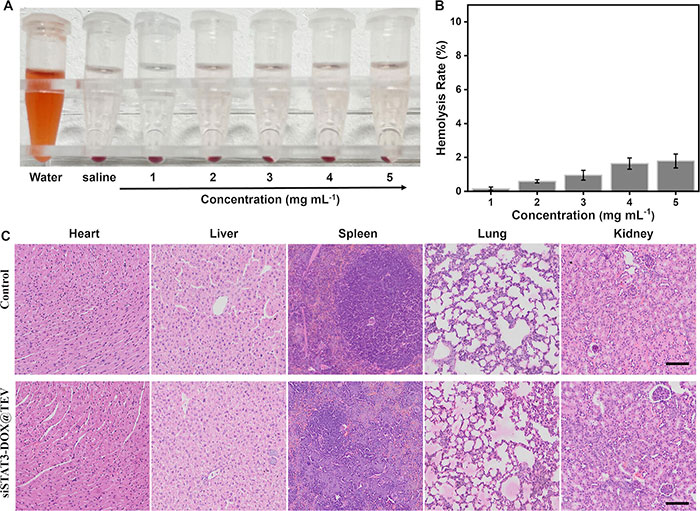
图8. siSTAT3-DOX@TEV 生物相容性概况。(A)与 siSTAT3-DOX@TEV 一起孵育的红细胞图像。(B)与 siSTAT3-DOX@TEV 一起孵育的红细胞溶血率。(C)抗肿瘤研究结束时主要器官的 H&E 染色
研究小结:
综上所述,该研究提出并优化了一种基于TEV共载siSTAT3和DOX的肿瘤趋向性协同化疗-基因治疗策略。通过CyTOF和免疫组化分析揭示了其协同抗肿瘤免疫效应。该策略显著下调了肿瘤内部的STAT3表达,增强了DOX诱导的肿瘤免疫原性细胞死亡(ICD),消除了肿瘤周围的物理屏障,促进了免疫细胞的充分浸润,激活了抗肿瘤免疫反应,并实现了有效的肿瘤消退。该策略为精准治疗高度异质性的TNBC提供了一种有效的化疗-基因治疗方法,并可推广至其他类型的肿瘤。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

