
创伤性脑损伤(Traumatic Brain Injury, TBI),这是一种由外力引起的大脑功能障碍,它是一个全球性的健康挑战。每年大约有5000万人因TBI导致残疾,全球负担高达4000亿美元。当前,全球的动荡和冲突导致更多的军人TBI患者,以及长期精神功能障碍的患病率增加。越来越多的证据表明,TBI从急性期过渡到慢性期时的复杂病理变化(如炎症、水肿等)会逐渐导致长期的神经功能障碍,甚至增加死亡率。因此,早期干预对于改善TBI的进展和幸存者的预后至关重要。然而,目前TBI的治疗受限于治疗选择有限、口服和静脉给药的循环时间延长,以及血脑屏障(BBB)的阻碍。这些因素往往严重损害患者的康复。因此,迫切需要先进的局部给药技术和材料来克服这些限制,并进一步促进对创伤后大脑区域急性期的及时干预。

近期,中南大学湘雅医院的王杨教授领导的研究小组验证了一种新型水凝胶(命名为甘草酸G-黄连素B-大黄素R复合凝胶,简称GBR凝胶)的概念。这种水凝胶是由黄连素(B)和大黄素(R)构成的纳米粒子溶液,并内嵌甘草酸(G)。研究表明,GBR凝胶能够促进谷氨酸能神经传递途径的强化,保持神经元功能的正常运行,支持少突胶质细胞前体(OPCs)的分化与成熟,最终减轻大脑内的炎症反应。这一发现为在创伤性脑损伤(TBI)的急性阶段进行局部药物治疗提供了一种潜在的有效策略。这项研究的成果于2024年10月9日以《中药小分子药物载药水凝胶在创伤性脑损伤治疗中的增强作用》为题,在《ACS Nano》杂志上发表(DOI:doi.org/10.1021/acsnano.4c09097)
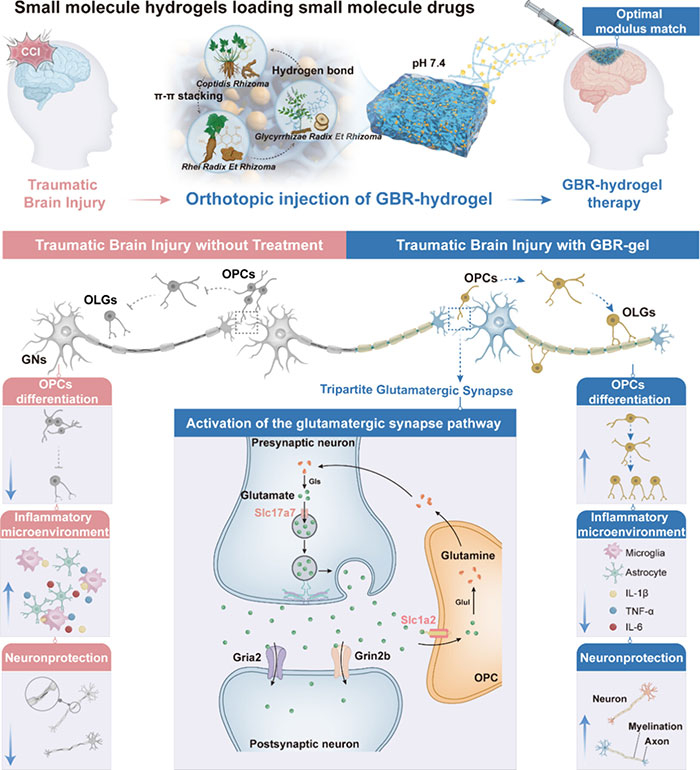
图1 全小分子自组装小分子水凝胶局部给药增强治疗 TBI 的示意图
研究结果:
(1) GBR-凝胶的制备、优化、筛选与特性表征
在中医中,甘草、黄连和大黄常被组合使用来治疗TBI。大黄和黄连的主要活性成分分别是大黄酸(Berberine)和小檗碱(Rhein)(图2A)。大黄酸和小檗碱被制成黄色 BR 颗粒溶液,二者并不能形成水凝胶,随后通过调节甘草酸(glycyrrhizic)的含量产生不同浓度的 GBR 凝胶(图2B)。在室温下储存 90 天后,未观察到 GBR 凝胶的物理外观发生变化(图 2C)。GBR 凝胶形成多孔网络结构,BR 颗粒负载在表面(图2D)。此外,GBR 凝胶具有出色的注射性(图2E、F),这是局部给药的重要先决条件。这有助于适应各种不规则的损伤区域。然后,作者评估了 GBR 凝胶的流变特性。应变扫描表明,当应变超过 11% 时,G’’超过 G’,表明 GBR 凝胶从凝胶转变为溶液状态(图 2G)。自愈性测试显示(图2H),GBR 凝胶出色自修复特性。图2I显示大脑弹性模量相匹配的值。
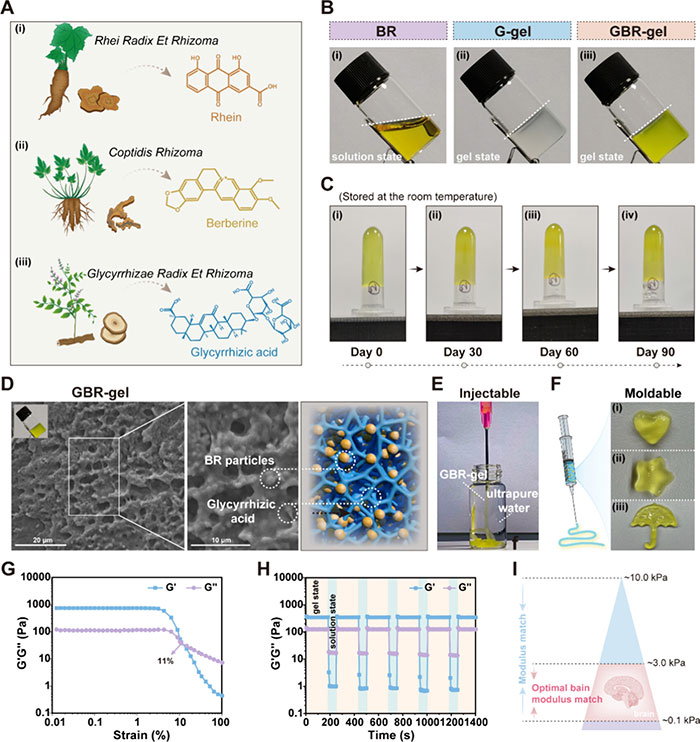
图2 GBR-gel的特性。(A) 大黄、黄连和甘草的中药图像,以及大黄素、小檗碱和甘草酸的化学结构。(B) BR颗粒溶液(i)、G-gel(ii)和GBR-gel(iii)的代表性图像。(C) 在室温下不同时间的同一GBR-gel的图像。(D) GBR-gel的代表性扫描电子显微镜(SEM)图像(左、中)和示意图(右)。(E) 将GBR-gel用注射器注入超纯水中,呈现出条带状配置。(F) 代表性图像展示了通过注射GBR-gel形成各种几何形状。(G) GBR-gel的应变依赖性振荡剪切流变性质。(H) GBR-gel自愈性测试。(I)大脑弹性模量相匹配的值
(2) GBR-Gel 的自组装机制
阐明分子间相互作用对于理解 GBR 凝胶的自组装过程至关重要。利用圆二色谱 (CD) 光谱比较 GBR 凝胶和 G 凝胶,显示 GBR 凝胶的峰有轻微的红移,但具有相似的峰形(图 3A)。使用质谱法对 GBR-凝胶的组装结构进行进一步分析,均检测出大黄酸和小檗碱的单体形式,在 BR 溶液中,检测出大黄酸-小檗碱组合。GBR 凝胶的质谱鉴定出大黄酸-小檗碱复合物以及甘草酸单体的存在(图3B-D)。这一过程为理解GBR-凝胶的自组装机制提供了重要依据。
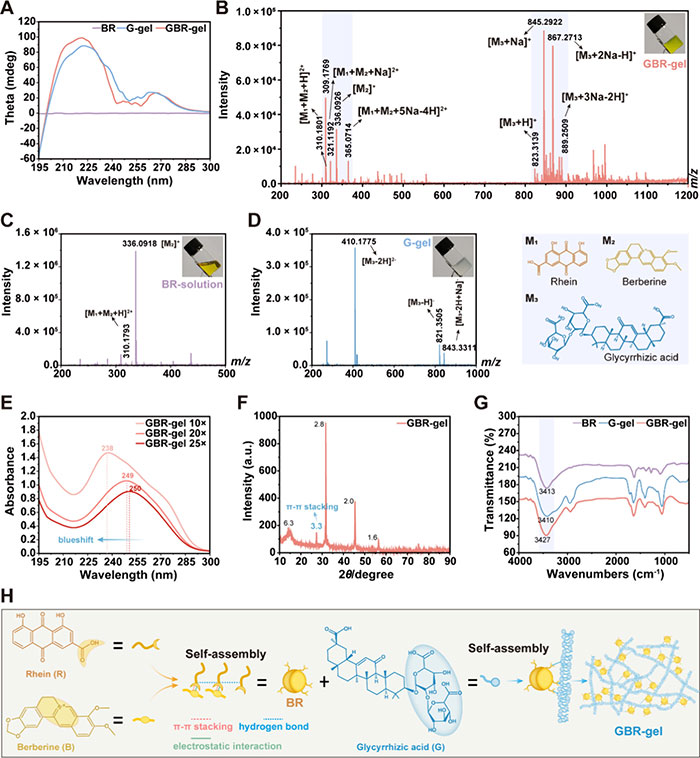
图3 (A) BR颗粒溶液、G-gel和GBR-gel的圆二色光谱(CD)。(B) GBR-gel的高分辨率质谱。(C) BR溶液的高分辨率质谱。(D) G-gel的高分辨率质谱。(E) 不同浓度下GBR-gel的紫外-可见光谱(UV-vis)。(F) GBR干凝胶的XRD图谱。(G) BR颗粒溶液、G-gel和GBR-gel的傅里叶变换红外光谱。(H) GBR-gel自组装过程的图解
(3)GBR-凝胶相比G-凝胶在TBI后表现出更优的抗炎性能
通过局部给药评估了 GBR 凝胶和 G-凝胶在 CCI 诱导的 TBI 模型中的治疗效果(图 4A、B)。与 CCI 组相比,GBR 凝胶给药后第 3 天和第 7 天的神经功能缺损改善得更好(图 4C)。GBR-gel 和 G-gel 给药均显着降低了第 1 天的足误率(图 4D)。组织病理学染色显示,GBR凝胶能减轻CCI导致的神经元坏死和核溶解(图4E)。Nissl染色显示,GBR凝胶显著增加存活神经元数量,并显著减少凋亡神经元数量,而G凝胶效果不显著(图3F-I)。总的来说,GBR凝胶在TBI治疗中展现出更显著的治疗效果。
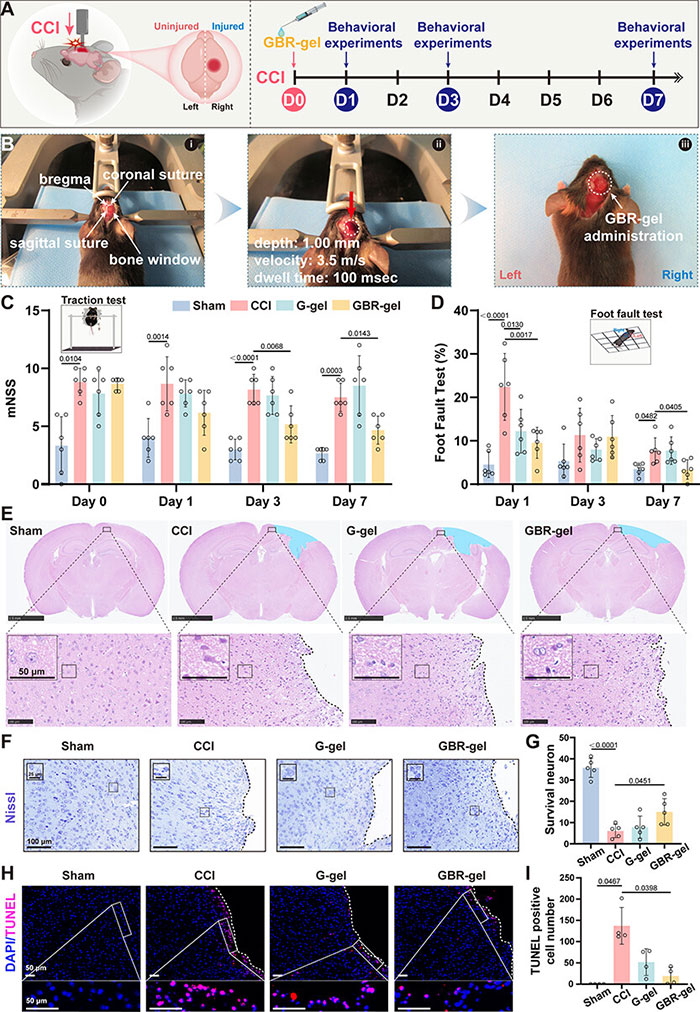
图4 局部GBR-gel给药治疗TBI的整体效果优于G-gel。(A) 实验设计的示意图。实验进行了7天。行为实验包括mNSS(改良的神经学严重程度评分)和足误测试。(B) 由CCI(控制性皮质撞击)诱导的TBI模型和局部水凝胶给药的代表性图像。(C) 在给药后不同时间点的mNSS。第0天代表在模型诱导的同一天进行的评估。每组6只小鼠。(D) 在Sham、CCI、G-gel和GBR-gel组中,在不同时间点进行的足误测试。每组6只小鼠。(E) 在第7天,每组的脑组织中H&E染色的全切片图像(上)和放大的脑周损伤皮层图像(下)。右半球的蓝色区域表示损伤腔区域。黑色虚线右侧代表损伤腔区域。插图是对局部区域放大的视图。(F) 第7天脑周损伤皮层Nissl染色的代表性图像。黑色虚线右侧代表损伤腔区域。插图是对局部区域放大的视图。(G) 对每组脑周损伤皮层中存活神经元进行计数。每组5只小鼠。在40倍放大下,对每样本的脑周损伤皮层中的五个视觉场进行计数,平均值用于表示该样本中存活神经元的数量。(H) 第7天脑周损伤皮层的Tunel染色的代表性图像(上)。白色虚线右侧表示损伤腔区域。下图显示了放大的视图。(I) 在第7天,通过Tunel染色对每组脑周损伤皮层中的凋亡阳性细胞进行计数
(4) GBR-Gel 比 G-Gel 改善了 TBI 后的抗炎特性
炎症在加剧 TBI 后神经损伤和其他继发性损伤方面起着关键作用。作者检测了星形胶质细胞、小胶质细胞标志物及炎症因子表达。结果显示,第7天GBR 凝胶组损伤皮层中过度活化的星形胶质细胞和小胶质细胞显着减少(图5A-D),IL-6、IL-1β和TNF-α水平也显著降低(图5G-J)。使用ELISA测试也获得了类似的结果(图 5K-N)。综上所述,这些结果都证实了GBR 凝胶的卓越抗炎作用。
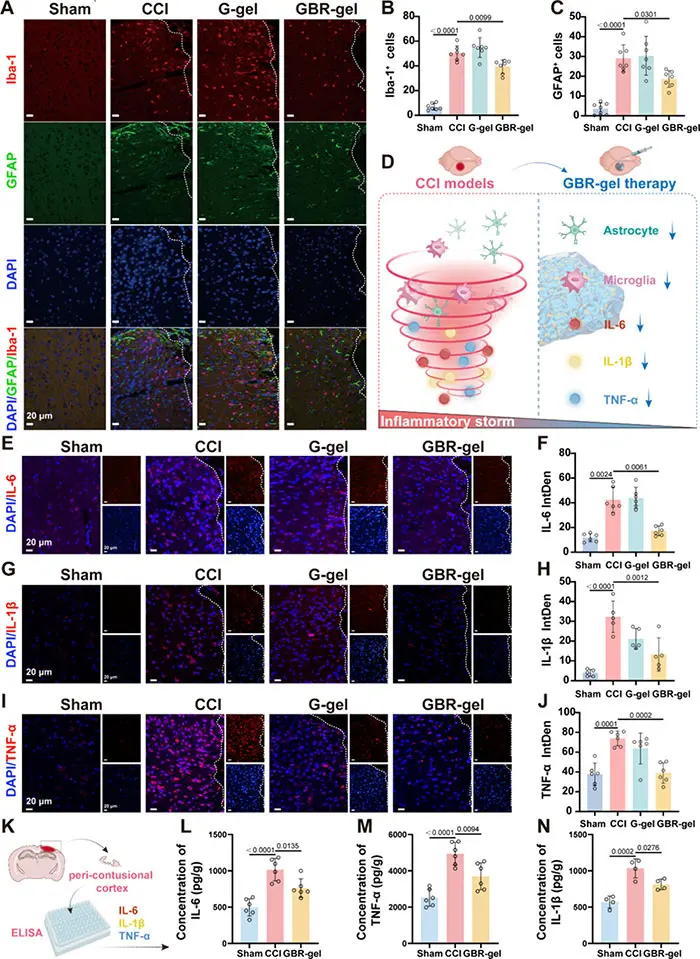
图5 在TBI后,局部使用GBR-gel治疗增强了抗炎特性,而G-gel则没有这种效果。 (A) 在第7天,对Sham组、CCI组、G-gel组和GBR-gel组的脑损伤周围皮质进行了免疫荧光染色分析,使用Iba-1(红色)、GFAP(绿色)和DAPI(蓝色)进行标记。白色虚线右侧表示损伤腔区域。 (B) 计算了每组脑损伤周围皮质中Iba-1+细胞的数量(n=7)。 (C) 计算了每组脑损伤周围皮质中GFAP+细胞的数量(n=7)。(D) 用示意图表示GBR-gel治疗后减弱的炎症微环境。在第7天,对每组的损伤皮质周围进行了IL-6(E)、IL-1β(G)和TNF-α(I)的免疫荧光染色。白色虚线右侧表示损伤腔区域(n=5或6)。(K) 在第7天,使用酶联免疫吸附测定(ELISA)分析了脑损伤周围皮质中的炎症细胞因子。在假手术组、CCI组和GBR-gel组中,第7天围绕损伤皮质的IL-6(L)、TNF-α(M)和IL-1β(N)的浓度(n=5)
炎症是导致 TBI 后继发性脑水肿加重的关键决定因素。作者还进行了一系列实验,以评估 GBR 凝胶减轻炎症相关脑水肿的能力(图 6A)。与 CCI 组相比,GBR 凝胶处理在第 7 天有效增加了脑湿干重比(图 6B,C)。所有小鼠在第 3 天和第 7 天接受了MRI脑部扫描,GBR凝胶能降低CCI诱导的小鼠在T2加权图像中的高信号范围(图6D)。T2映射提供了更直观的可视化效果(图6E,F)。同时,GBR凝胶能降低AQP-4与GFAP的共定位程度,进一步减轻脑损伤后的水肿(图6G, H)。简而言之,GBR-gel 表现出出色的抗炎活性,有效缓解 TBI 后的继发性脑水肿(图 6H)。
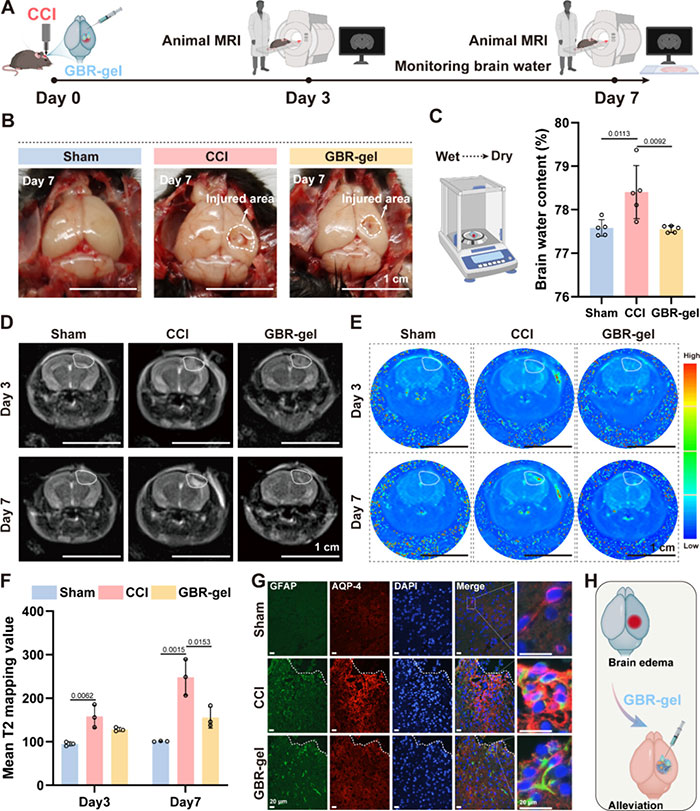
图6 GBR-gel减轻了TBI后炎症相关的脑水肿。(A) 体内脑水肿测试的示意图。(B) 不同组别在第7天的全脑代表性图片。(C) 在局部应用GBR-gel后第7天,评估了脑水含量(n=5)。(D) 在Sham、CCI组和GBR-gel组中,分别在第3天和第7天进行了T2加权成像(T2WI)。受伤区域用虚线圆圈标示。(E) 在Sham、CCI和GBR-gel组中,分别在第3天和第7天进行了T2图测。受伤区域用虚线圆圈标示。(F) 计算了平均T2图测值(n=3)。 (G) 在第7天,评估了每组伤周皮层中AQP-4和GFAP的共定位。白色虚线右上方表示受伤腔体。最右侧的图像是局部放大图。(H) 通过GBR-gel对TBI后炎症相关脑水肿的示意图
(5)GBR-凝胶减轻了少突胶质前体细胞(OPC)分化的抑制作用
为了研究 TBI 后 GBR 凝胶影响的关键机制,在第 7 天对 Sham、CCI 和 GBR 凝胶组小鼠的挫伤周围皮层进行了单细胞 RNA 测序 (图7 A)。为了捕获 GBR 凝胶干预后变化最大的细胞类型,作者计算了每种细胞类型的相对变化率(图 7B)。与 Sham 组相比,CCI 明显增加了 OPCs 的比例,而GBR-gel 逆转了这种异常变化。伪时间轨迹分析(图 7C)。GBR凝胶能缓解TBI后未分化前体细胞的异常状态,促进OPC分化为OLG(少突胶质细胞)。对成熟 OLG 标志物 CC1 和 OLG 标志物 Olig2 进行免疫荧光共染色,进一步验证了GBR凝胶在体内促进OPC分化、髓鞘形成和轴突再生的能力(图7D- F) 。LFB染色来观察损伤周围皮层的阳性染色区域,发现TBI后这一区域比Sham组小鼠减少,但在GBR-gel治疗后有所增加(图7G,H)。在检测髓鞘蛋白脂质蛋白的分析中也得到了类似的结果(图7I,K)。通过评估NF-H神经丝蛋白的表达来进一步检查轴突再生。TBI后损伤周围皮层NF-H的显著降低表明轴突损伤(图7J,L)。然而,GBR-gel上调了NF-H的表达,对轴突再生发挥了保护作用。简而言之,GBR-gel给药后OPC的分化和成熟有助于TBI后的髓鞘形成和轴突再生(图7M)。
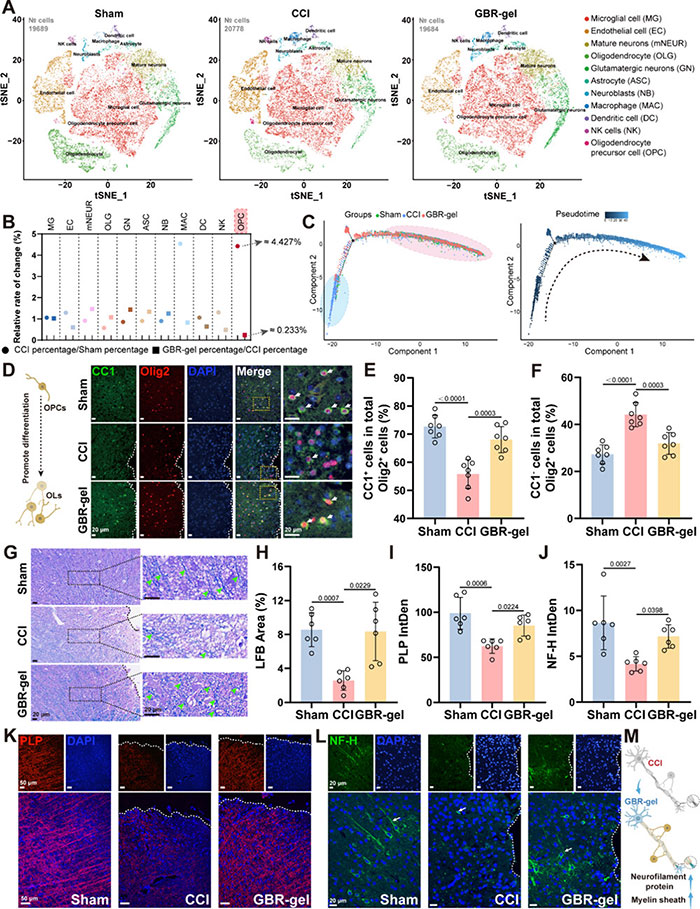
图7 GBR-gel减少异常升高的OPCs数量以及促进OPCs分化。(A) 使用t分布随机邻域嵌入(t-SNE)技术对11种细胞类别进行可视化。不同颜色的球体代表不同的细胞类别,每个点代表一个单独的细胞(n = 15个皮层,5个假手术组,5个CCI组,和5个GBR-gel组)。(B) 每种细胞类型的相对变化率。(C) OPCs和少突胶质细胞(OLG)的伪时间轨迹图。细胞根据它们的Seurat聚类进行标记。(D) 在第7天,每个组的围损伤皮层中CC1和Olig2的共定位。白色虚线右侧表示损伤区域。最右侧的图像是局部放大图。箭头指向CC1+/Olig2+细胞。围损伤皮层中CC1+/Olig2+细胞(E)和CC1-/Olig2+细胞(F)的百分比被量化。每组7只小鼠。(G) 在第7天,围损伤皮层的LFB(蓝色)染色的代表性图像。箭头指向代表性的LFB阳性位置。(H) 使用ImageJ量化LFB阳性区域(n=6)。 (I) 使用ImageJ量化PLP的IntDen(积分密度)。每组6只小鼠。在20倍放大下分析了围损伤皮层的两个视野,平均值作为该样本的IntDen。(J) 使用ImageJ量化NF-H的IntDen(n=6) (K) 在第7天,围损伤皮层的PLP免疫荧光染色。(L) 在第7天,围损伤皮层的NF-H免疫荧光染色。(M) GBR-gel干预后促进OPCs分化的示意图
(6) GBR-凝胶通过Gria2和Grin2b增强谷氨酸能突触通路以促进三方突触
研究揭示了GBR凝胶在维持神经元正常功能和促进OPC分化方面的显著效果。通过单细胞RNA测序分析,发现使用GBR凝胶治疗后,谷氨酸能神经元的数量有所上升(见图7B)。与对照组相比,GBR凝胶治疗组在谷氨酸能神经元和OPC中发现了多个基因表达的差异。深入分析表明,GBR凝胶主要通过提高特定基因及其相关通路的表达来发挥其作用,其中谷氨酸突触通路的表现尤为显著(图8A-C)。这些发现暗示GBR凝胶可能通过增强谷氨酸突触通路来促进OPC的分化和成熟(图8D,E)。
在GBR凝胶的作用下,OPC通过Slc1a2转运蛋白吸收谷氨酸,以维持其分化能力,并减轻创伤性脑损伤(TBI)后的谷氨酸毒性。同时,谷氨酸在谷氨酰胺合成酶和谷氨酰胺酶的催化下转化为谷氨酰胺,并被送回谷氨酸能神经元,以补充其正常生理活动所需的谷氨酸。此外,GBR凝胶还增强了谷氨酸能神经元中Gria2和Grin2b的表达(图8F),这两种受体对于维持中枢神经系统的信号传递至关重要。同时,GBR凝胶也提高了关键的VGLUTs(例如Slc17a7)的表达,这对于谷氨酸能神经传递至关重要。相应地,在TBI模型小鼠中,Gria2+/Slc17a7+和Grin2b+/Slc17a7+细胞的数量显著下降,而在GBR凝胶治疗的小鼠中则有所增加(图8I,J)。
总体而言,GBR凝胶通过激活谷氨酸能突触通路,保持了神经元的正常活动,增强了OPC的分化,并建立了谷氨酸能神经元、OPC以及下一个谷氨酸能神经元之间的三方调控网络,从而进一步抑制了炎症反应(图8K)。
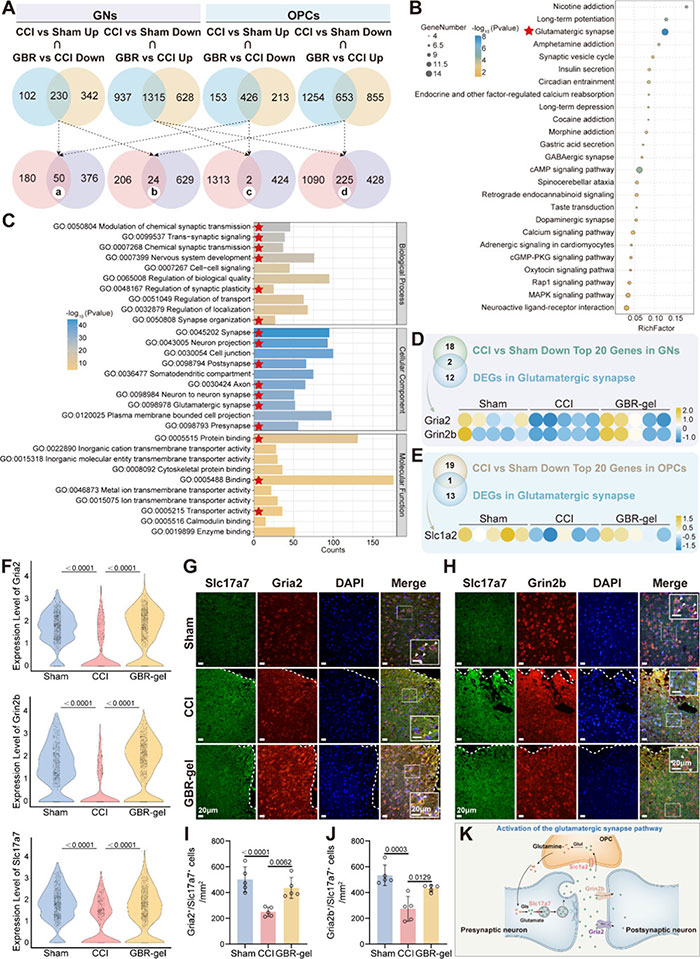
图8 GBR-gel给药增强了谷氨酸能突触途径。(A) 在GNs(感觉神经元)到OPCs的DEGs(差异表达基因)之间的重叠。确定了四类DEGs。(a) 在GNs和OPCs中均下调的差异基因。(b) 在GNs中下调但在OPCs中上调的差异基因。(c) 在OPCs中下调但在GNs中上调的差异基因。(d) 在GNs和OPCs中均上调的差异基因。(B) 使用STRING数据库对GNs和OPCs中上调的DEGs进行了KEGG通路分析。(C) 使用STRING数据库对GNs和OPCs中上调的DEGs进行了GO分析。结果根据假发现率(FDR)进行排序,突出显示了前10个生物过程(BP)、细胞组分(CC)和分子功能(MF)。(D) 维恩图显示了CCI特异性下调DEGs与基于scRNA-seq数据的GNs中谷氨酸能突触途径中的DEGs之间的共同DEGs。不同组别中GNs中Gria2和Grin2b的差异表达。(E) 维恩图显示了CCI特异性下调DEGs与基于scRNA-seq数据的OPCs中谷氨酸能突触途径中的DEGs之间的共同DEGs。不同组别中OPCs中Slc1a2的差异表达。(F) 小提琴图显示了来自scRNA-seq数据的Gria2、Grin2b和Slc17a7的定量。(G, H) 在第7天,对周围梗死皮层的Slc17a7和Gria2或Slc17a7和Grin2b进行了免疫荧光染色。白色虚线右侧表示受损区域。(I, J) 量化了Slc17a7+/Gria2+细胞或Slc17a7+/Grin2b+细胞的数量。每组5只小鼠。每个样本在40倍放大下观察了五个视野。平均值被视为该样本的Slc17a7+/Gria2+细胞或Slc17a7+/Grin2b+细胞。(K) 示意图展示了GBR-gel通过谷氨酸能突触途径促进OPCs和神经元恢复正常功能
研究小结:
该研究提出了一种由三种小分子药物自组装形成的小分子水凝胶(GBR-gel),实现了对TBI的潜在治疗增强。在神经科学领域,这种水凝胶展现出了调节GN-OPC-GN三元突触单元的能力,从而恢复了TBI后下调的谷氨酸能突触通路。这种调节效应促进了OPCs的分化和成熟,有助于髓鞘形成和轴突再生,并发挥了免疫炎症调节和神经保护功能。最终,GBR-gel作为一种局部应用系统,对TBI的治疗具有潜在的影响,可能会改变管理TBI的药物选择。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

