
【研究背景】
在多发性硬化症等脱髓鞘疾病中,慢性病变中的炎症组织环境阻止了祖细胞的有效募集,导致少突胶质细胞再生和髓鞘再生失败。虽然将高髓鞘形成性胎儿或诱导性多能干细胞来源的人类少突胶质细胞祖细胞 (hOPC) 进行移植是一种有效的方法,但供体细胞的低存活率和OPC命运维持率低是临床治疗的主要障碍。现有的细胞注射方法由于剪切应力导致细胞膜损伤,移植后存活率仅为1%至32%,并加剧了局部炎症,从而增加移植物失败的可能性。剪切稀化水凝胶 (STH) 被认为是减少细胞死亡的有希望的候选材料。此类水凝胶在剪切应力下流动,并在应力消除后恢复,使其适合用于细胞注射。

针对上述问题,布法罗大学Stelios T. Andreadis的研究团队开发了一种创新的注射性剪切稀化水凝胶(STHs)。这些水凝胶具有可调节的粘弹性和生物活性,通过最小侵入性注射,将hOPCs注射到先天性低髓鞘病的小鼠模型中。这种小鼠模型模拟了人类的先天性低髓鞘疾病,如Pelizaeus-Merzbacher病,已成为评估髓鞘化细胞制剂的金标准。研究结果表明,使用STHs显著提高了移植后hOPCs的存活率,支持其分化为形成髓鞘的少突胶质细胞,并增加了小鼠大脑的髓鞘化程度,展示了STHs作为hOPCs输送有效载体在治疗髓鞘疾病中的潜力。相关研究在2024年7月12日以“Injectable shear-thinning hydrogels promote oligodendrocyte progenitor cell survival and remyelination in the central nervous system”为题发表于《Science Advances》(DOI: 10.1126/sciadv.adk9918)。
(1)超分子STH的合成与表征
水凝胶的构建单元包括透明质酸硫醇(HA-SH)、肝素硫醇(Hep-SH)、β-环糊精马来酰亚胺(βCD-Mal)和8臂聚乙二醇金刚烷(PEG-Ad)。水凝胶的开发涉及两个关键步骤。首先,通过8臂PEG-Ad与单功能化的βCD-Mal在1:1的化学计量比下形成宿主-客体复合物,工程化多臂马来酰亚胺终止的超分子聚合物(SMP-Mal)。其次,在pH=7.4下,8臂SMP-Mal与HA-SH之间进行Michael加成反应,形成三维网络(图1)。为了固定生存信号(HBD-RGD5融合肽和血小板源性生长因子),Hep-SH与肝素结合双域肽和/或血小板源性生长因子(PDGF-AA)预混,并在与SMP-Mal交联前添加到HA-SH中。
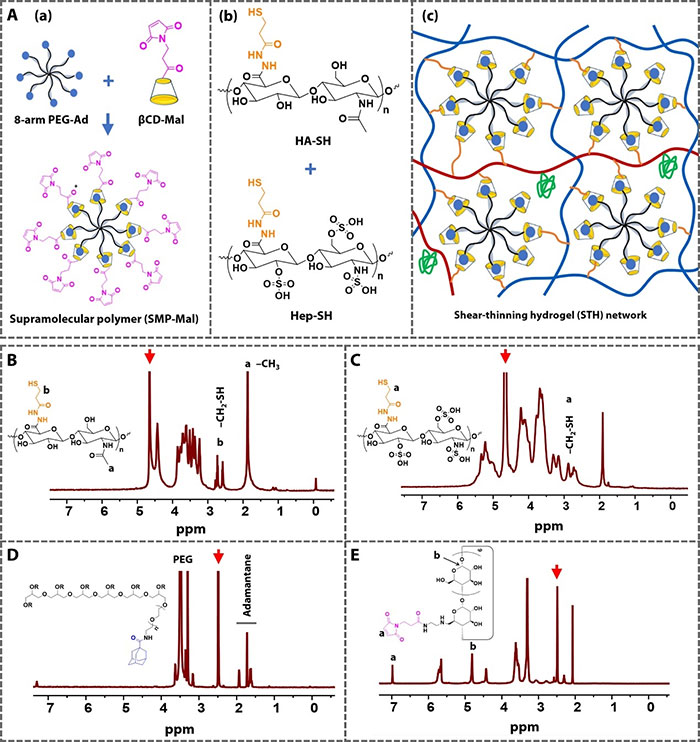
图1 STH设计的示意图和水凝胶前体的1H NMR表征
(2)水凝胶的剪切稀化和自我修复特性
STHs通过透明质酸硫醇(HA-SH)和肝素硫醇(Hep-SH)与SMP-Mal在pH=7.4下通过Michael加成反应形成。根据HA-SH和SMP-Mal的不同配比,制备了不同硬度的水凝胶(STH-1、STH-2和STH-3)。这些超分子水凝胶由于宿主-客体动态键的可逆性,表现出剪切稀化和自我修复特性,使其适合于治疗物的注射。流变学测量显示,STHs在高剪切率下表现出较低的粘度,说明主-客体键的解离和更流体化的行为。在低剪切率下,水凝胶迅速恢复初始粘度,显示出自我修复特性。这种快速从固态到流体态的转变对于成功注射和细胞保护至关重要,因为它使注射过程中水凝胶能够耗散能量,并在注射后恢复储存模量以稳定注射部位的材料(图2)。
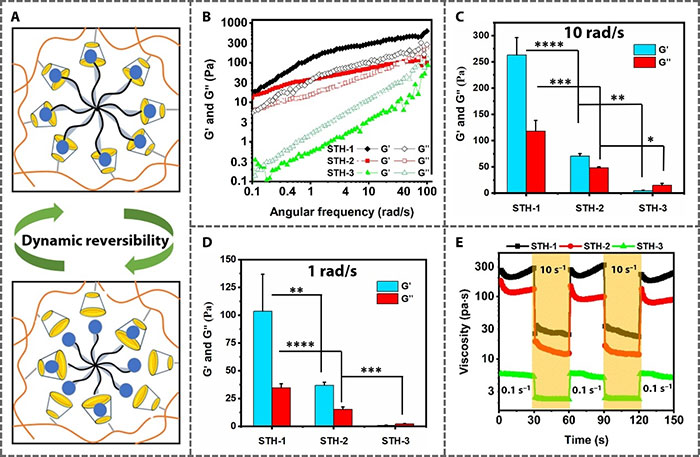
图2 STH的粘弹性和流变性质
(3)剪切应力下STHs显着提高hOPCs的存活率
成功的细胞移植治疗神经退行性疾病的一个主要障碍是供体细胞在微创注射时的低存活率。研究发现,超过95%的神经祖细胞(NPCs)在脊髓损伤(SCI)模型中移植后会死亡,这很可能是由于剪切应力对细胞膜的作用。在研究中,通过细拉玻璃针(内径:100至200微米,相当于28至32G针头)注射时,测量了在有或没有STHs的情况下细胞死亡率。结果表明,在盐溶液中注射时,鼠少突胶质前体细胞(CG-4细胞系)和人胎儿CD140a分选的少突胶质前体细胞(hOPCs)的细胞死亡率分别为29.47± 3.15%和25.13±3.23%,而在无剪切应力条件下分别仅为6.63±1.60%和6.57±0.71%。所有三种STH配方显着降低了CG-4和hOPCs的细胞死亡率(图3)。研究表明,STH-2在注射剪切应力下对细胞死亡的保护效果最好。
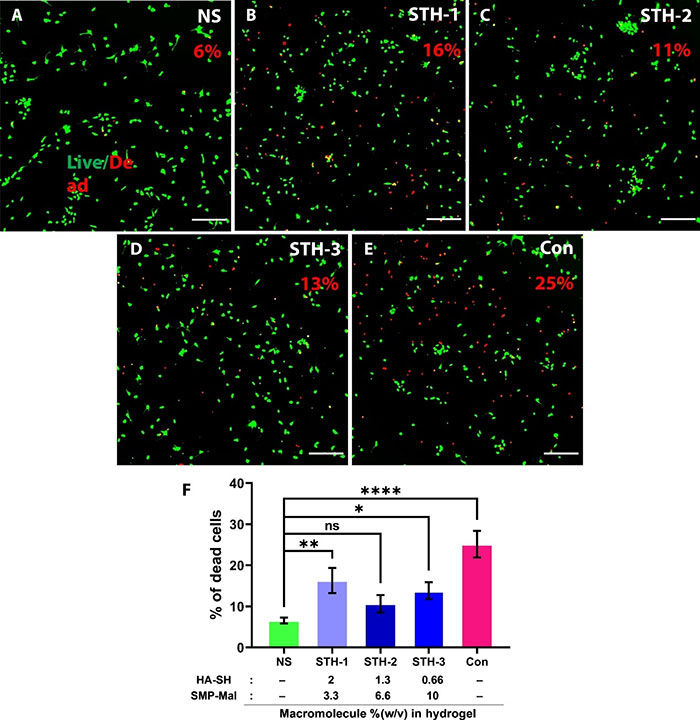
图3 注射 STH 后 hOPC 存活率的体外评估
(4)生物信号的评价促进hOPCs的存活
研究团队假设STHs中固定的生物信号可能进一步促进移植后hOPCs的存活和增殖。无论是前体细胞还是成熟的少突胶质细胞都高度表达αv/α6/α7和β1/β5/β8整合素,指导其存活、增殖和终末分化以髓鞘化神经元轴突。通过RNA测序,研究团队确定了hOPCs中各种整合素的表达。设计了一种创新的双域肽,肝素结合域(HBD)–RGD5,促进细胞通过整合素α5β1、αvβ1或αvβ8结合。实验结果显示,HBD-RGD5显着促进了hOPCs的粘附和扩展,相比对照组,细胞数量和增殖率显着提高(图4)。PDGF-AA通过血小板源性生长因子受体α促进hOPCs的存活和增殖。实验结果表明,PDGF-AA以剂量依赖性方式显着增加了hOPCs的增殖率。
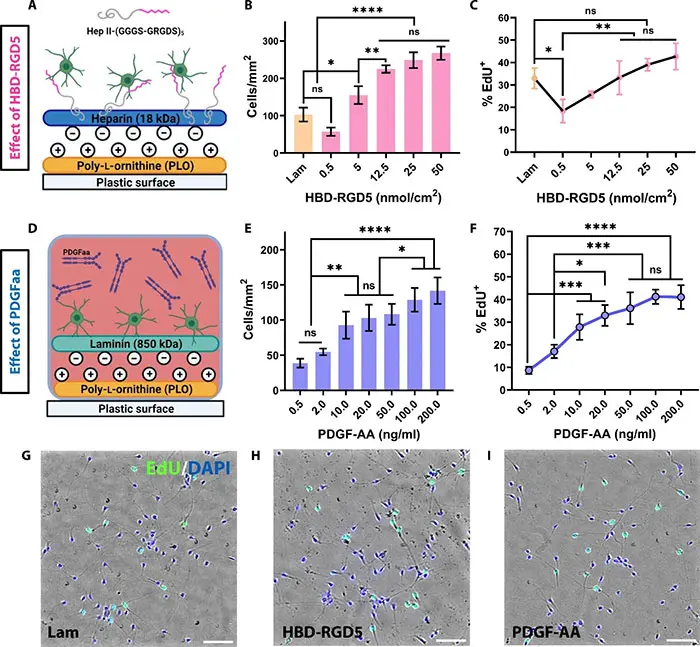
图4 hOPC 响应生物信号而增殖
(5)STH内hOPCs的存活、分化和迁移
研究团队评估了hOPCs在3D水凝胶环境中的存活情况。所有三种水凝胶都支持hOPCs的存活(细胞死亡率:STH-1:7.10±1.03%,STH-2:5.97±2.19%,STH-3:5.58±0.97%)。尽管总体存活率相似,但三种水凝胶中细胞的分布不同。STH-1和STH-3中的细胞聚集,而STH-2中的细胞分布更加均匀。在3D水凝胶中,STH-2和低硬度的STH-3支持hOPCs的分化,而STH-1则不支持。研究表明,STH-2在注射剪切应力下对CG-4细胞和hOPCs提供了最高水平的保护,维持了更均匀的细胞分布,并支持少突胶质细胞的分化。为了研究移植后hOPCs的迁移,STH-2与不同浓度的HBD-RGD5结合,细胞通过水凝胶迁移,结果表明,HBD-RGD5固定的细胞迁移数量减少,表明细胞在3D水凝胶中的结合增加。
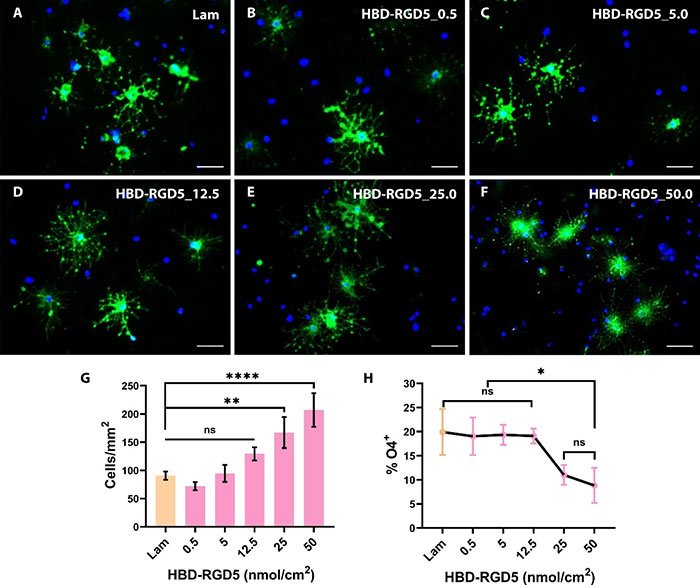
图5 双结构域融合肽HBD-RGD5上hOPC的分化
(6)体内移植中STH显著提高hOPCs的存活率
为了评估体内移植后hOPCs的存活率,研究团队使用了免疫缺陷的NSG小鼠。通过细拉玻璃针将hOPCs单侧注射到2-3天龄的小鼠大脑中。每只小鼠接受0.5微升细胞(每微升100,000个细胞),分别使用HBSS、单独的STH-2或含PDGF-AA和HBD-RGD5的STH-2进行注射。结果显示,与对照组(HBSS)相比,嵌入水凝胶的细胞数量显著增加(P < 0.0001)。PDGF-AA和HBD-RGD5的固定进一步增加了小鼠大脑中hNA+细胞的数量(图6)。研究表明,注射后6周内观察到注射的细胞在前后轴上扩散并迁移了近1500微米,表明迁移速度约为30微米/天。与对照组相比,注射STH-2与PDGF-AA和HBD-RGD5组的细胞存活率提高了52%(图6)。
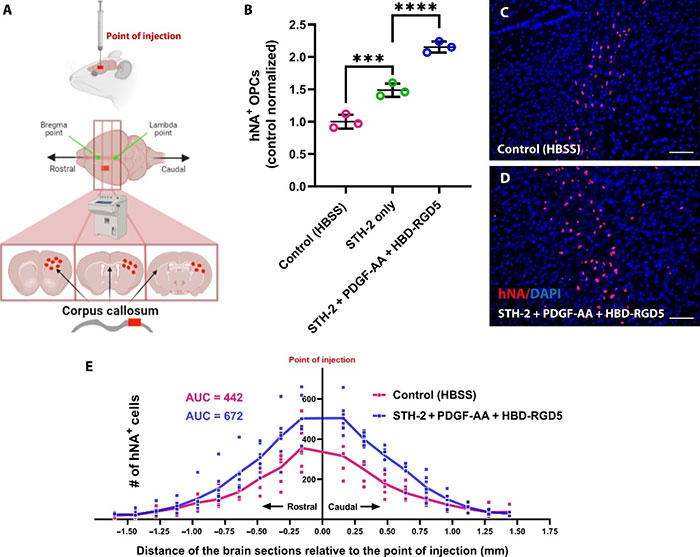
图6 移植STH-2和固定化生物线索后,NSG小鼠脑中的hOPCs存活率提高
(7)通过STHs输送hOPCs改善小鼠大脑的髓鞘化
研究团队评估了通过STHs移植的hOPCs在shiverer/rag2小鼠(先天性低髓鞘疾病模型)中的髓鞘化潜力。将hOPCs(0.5 μL,100,000个细胞/μL)双侧注射到新生小鼠的大脑胼胝体中。12周后,脑切片的免疫染色显示,与HBSS对照组相比,STH-2组的小鼠大脑中髓鞘形成显著增强。注射含有PDGF-AA和HBD-RGD5的STH-2进一步增加了髓鞘形成区域,并显著提高了移植的hOPCs的存活率(图3)。
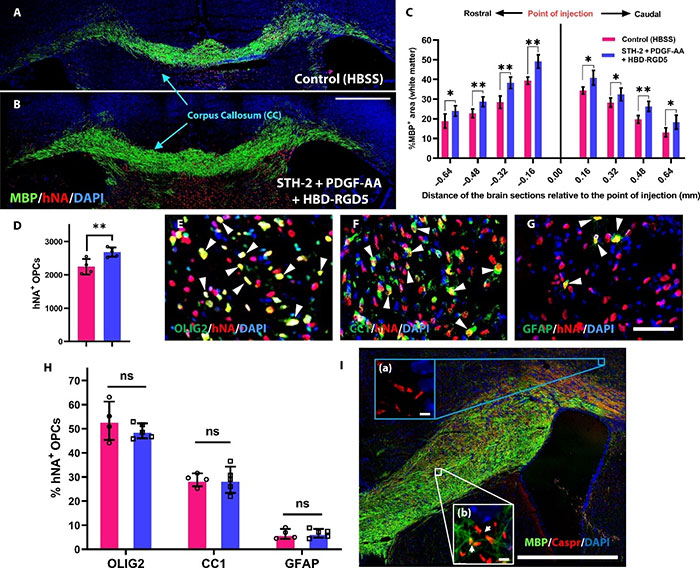
图7 在输送添加了生物信号的STH-2的hOPCs后,shiverer/rag2小鼠大脑的髓鞘形成增加
研究小结:
通过移植到先天性低髓鞘和铜质酮诱导的脱髓鞘小鼠大脑中,hOPCs倾向于迁移到白质通道中并沿其迁移,导致宿主轴突的强劲髓鞘化。这种迁移特性和髓鞘化潜力使hOPCs成为治疗中枢神经系统(CNS)脱髓鞘疾病的有前途的细胞治疗候选者。然而,临床转化受到供体细胞低存活率和维持OPC命运的主要障碍的限制。之前的研究报告指出,注射到盐水或细胞培养基中的细胞只有不到5%的存活率。在本研究中,研究人员假设在剪切应力作用下经历动态凝胶-溶胶转变的STH可以在注射过程中保护hOPCs,并允许移植的hOPCs从注射部位有效迁移,以重新髓鞘化整个胼胝体。为此,该团队设计了一种基于STH的细胞输送系统,该系统可以消散剪切应力,并作为固定生存生物信号的平台,以增强注射后的细胞活力,并随之增加髓鞘化程度。研究结果表明,STHs在促进细胞存活和髓鞘化方面表现出极大的潜力,有望成为治疗多发性硬化症等脱髓鞘疾病的新方法。
原文链接:https://www.science.org/doi/10.1126/sciadv.adk9918
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

