
术后粘连是由于创伤组织与相邻组织或器官之间病理性连接而引起的,最常见于腹腔、心包、肝脏、腱和子宫等部位。其中,腹腔粘连尤为关注,因为其发病率高,且腹部手术的数量逐渐增加。据统计,93%的腹部手术患者会发生腹腔粘连。虽然通过粘连松解术可以机械性地移除粘连,但这也增加了复发性粘连的风险,原因包括手术创伤、出血和感染。腹腔粘连可能导致女性不孕、呕吐、腹痛和小肠梗阻等并发症,每年因此增加了30万次手术,并造成数十亿美元的医疗费用。因此,开发有效的预防腹腔粘连和复发性粘连的策略至关重要。目前,临床上用于预防术后腹腔粘连的策略主要分为药物治疗和物理屏障两类。常见的预防腹腔粘连的药物,如抗炎药物、胶原蛋白抑制剂和纤溶剂,通常效果不佳,因为它们在腹腔内代谢迅速。物理屏障系统通过隔离受创组织和相邻组织,防止粘连的发生。然而,现有的商业化屏障产品在预防效果上表现有限,例如Seprafilm和Interceed等屏障膜由于停留时间短和实际使用限制,无法保证有效结果。同样,Adept(爱得普)聚合物溶液由于粘度低,难以有效附着于腹膜,因此在预防粘连方面效果欠佳。相比之下,水凝胶因其高度适应性和与腹腔镜手术的兼容性,显示出更大的应用前景。

针对上述问题,西安交通大学的王珂团队开发了一种新型抗污注射水凝胶(CGM水凝胶),其通过甲基丙烯酸酯硫酸软骨素(CS-GMA)和2-甲基丙烯酰氧基乙基磷酸胆碱(MPC)单体的自由基聚合制备。CGM水凝胶的加入大大提高了抗污能力和亲水性。此外,硫酸软骨素(CS)通过甲基丙烯酸化破坏分子间氢键,促进快速水化。相关研究表明,CGM水凝胶不仅表现出良好的生物相容性,而且有效地预防了术后腹腔粘连。相关研究在2024年6月8日以“An injectable and antifouling hydrogel prevents the development of abdominal adhesions by inhibiting the CCL2/CCR2 interaction”为题发表于《Biomaterials》(DOI: 10.1016/j.biomaterials.2024.122661)。
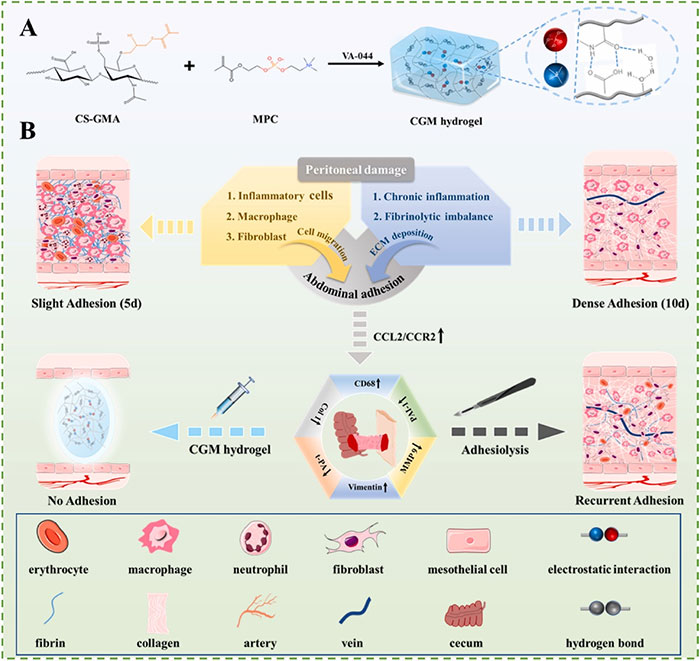
图1 研究示意图
(1)CGM水凝胶的制备与表征
本研究通过热引发共聚合合成了CGM水凝胶,主要成分包括CS-GMA和MPC。水凝胶展示了良好的自愈能力和抗污性能,能够有效减少非特异性蛋白质和细胞吸附。1H NMR和FT-IR分析验证了CS-GMA的成功合成,接枝率为36%。FT-IR显示了氢键的存在和结构变化。流变测试显示,CGM水凝胶在0–300秒内保持稳定的储能模量(G')和损耗模量(G"),展现出优异的剪切稀化行为,适合腹腔镜手术。步进应变扫描测试证实了水凝胶的自愈性能,特别是CGM-2水凝胶表现出更优的机械性能。通过添加尿素和氯化钠,进一步确认了水凝胶中的氢键和静电相互作用。频率扫描和时间扫描测试表明,CGM水凝胶在60 Hz以下表现出良好稳定性,并在50至100秒间完成溶胶-凝胶转变。
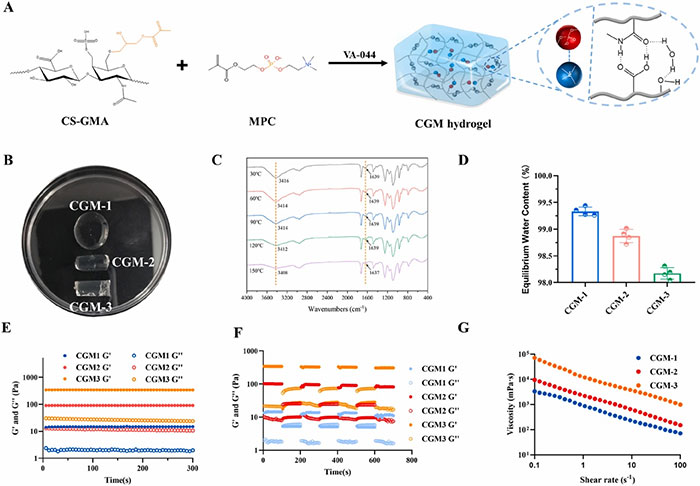
图2 CGM水凝胶的制备与表征
(2)CGM水凝胶的抗污能力
在腹腔植入过程中,非特异性蛋白质吸附和细胞附着是水凝胶面临的主要挑战。为评估CGM水凝胶的抗污能力,实验将L929和RAW264.7细胞与CGM水凝胶和TCPS共同孵育23小时,结果显示TCPS表面有大量细胞附着,而CGM水凝胶表面几乎没有细胞附着。这是因为CGM水凝胶表面的MPC形成了致密的水合层,阻碍了带电蛋白质和细胞的附着。进一步的蛋白吸附测试使用牛血清白蛋白(BSA)和纤维蛋白原进行。结果显示,CGM水凝胶相比纯硫酸软骨素(PCS)水凝胶显著减少了BSA和纤维蛋白原的吸附,尤其是CGM-2水凝胶表现出更强的抗吸附能力。此外,CGM水凝胶对红细胞的附着能力也较低,CGM-2和CGM-1水凝胶的表面颜色明显浅于PCS和CGM-3。这些结果表明CGM水凝胶在防止非特异性蛋白质吸附和细胞附着方面表现优异,CGM-2水凝胶在各项测试中表现最佳,因此被选为后续实验的主要研究对象。
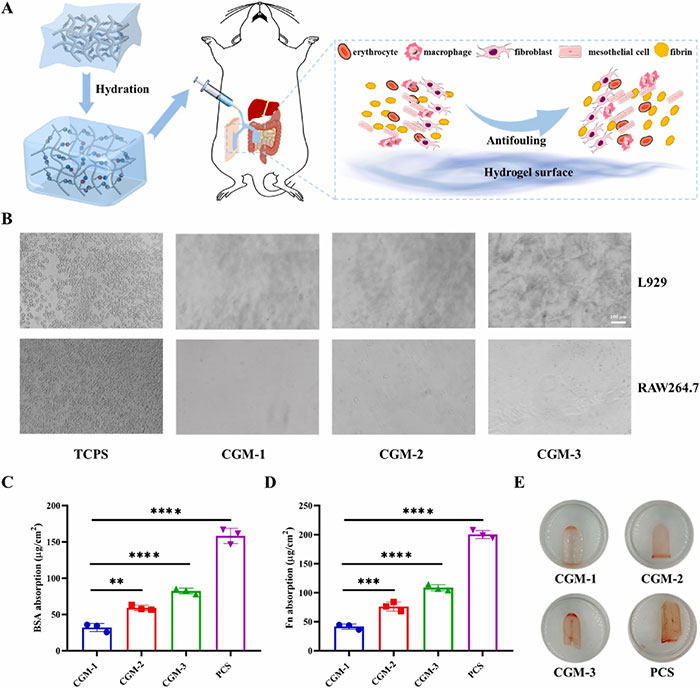
图3 CGM水凝胶的防污能力
(3)CGM水凝胶的生物相容性
CGM水凝胶的生物相容性是其应用于体内的关键因素。MTT测试结果显示,L929和HMrSV5细胞在不同浓度的CGM-2水凝胶中培养后,细胞活力均保持在80%以上,表明CGM-2水凝胶具有良好的生物相容性。活/死细胞荧光染色的共聚焦激光扫描显微镜(CLSM)图像进一步证实了这一点,两种细胞在CGM-2水凝胶中均显示出绿色荧光(活细胞),且与TCPS培养的细胞相比,未见明显的形态和数量差异。此外,CGM-2水凝胶的溶血实验结果显示,红细胞悬液的溶血率低于5%,表明其在术后应用中的潜力。通过对SD大鼠主要器官的H&E染色和Masson三色染色分析,结果显示CGM水凝胶组与正常组相比,无明显的生理差异。心肌细胞排列整齐,无炎症迹象,肝窦无肥大或充血,脾组织正常,肺组织无肺泡扩张或塌陷,肾组织中正常肾小管和肾小球清晰可见。这些结果表明CGM水凝胶具有优异的体内生物相容性,且其成分及其降解产物在体内不会对细胞和器官产生毒性。
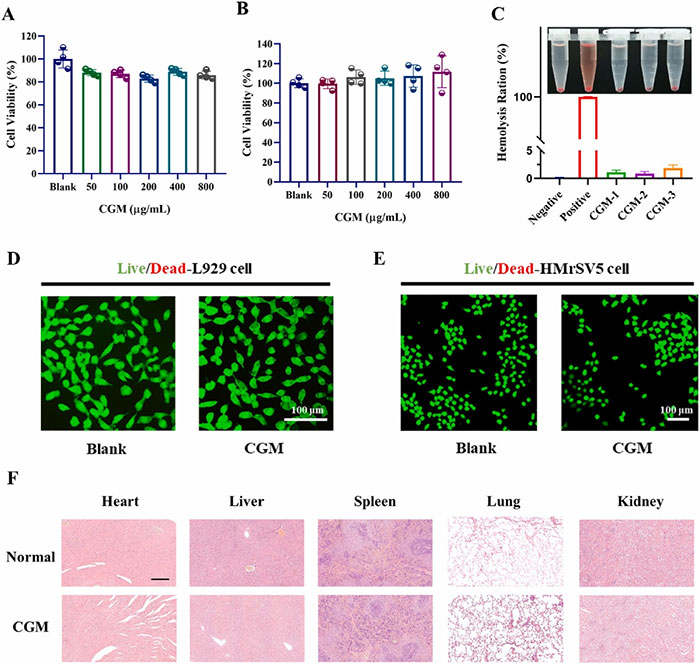
图4 CGM水凝胶的生物相容性
(4)CGM水凝胶预防术后粘连的效果
为了评估CGM-2水凝胶在预防术后粘连中的效果,建立了大鼠体内腹腔粘连模型和复发性腹腔粘连模型。在模型中,通过在受损区域直接涂抹CGM-2水凝胶以预防粘连。研究发现,CGM组在第5天的粘连评分为0.5,显示出较少的粘连形成,而对照组的粘连评分达到9.8,第10天更为严重。相比之下,使用HA水凝胶的组在第5天的粘连评分为3.8,但仍有部分粘连残留。在复发性粘连模型中,对比复发性粘连和初次粘连,复发性粘连通常更加广泛和坚固。研究表明,未接受任何干预的对照组在黏连松解后第5天的粘连评分为10.0,表明复发性粘连几乎不可避免。而HA组的平均粘连评分为5.0,CGM水凝胶组几乎没有粘连。此外,由于CGM-2水凝胶可在10天内完全降解,进一步研究了其在完全降解后的防粘连效果。第14天时,CGM组的平均粘连评分为1.5,显示出较少的粘连形成。血液分析结果进一步证明了CGM水凝胶的体内生物相容性和血液相容性。总体结果表明,CGM水凝胶可以有效预防初次和复发性腹腔粘连。
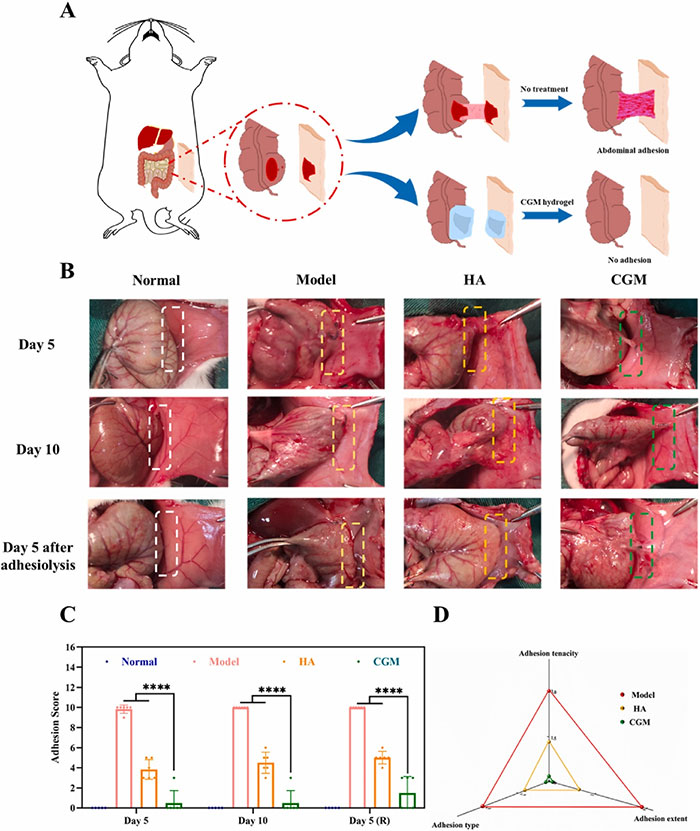
图5 CGM水凝胶在体内预防腹腔形成的效果
(5)CGM水凝胶的病理分析
粘连组织H&E和Masson染色的病理结果显示,第5天,模型组显示出广泛的粘连组织,盲肠肌肉与腹膜紧密粘连,伴有肉芽组织增生、大量新生血管和纤维结缔组织的生长。H&E和Masson染色检测到大量炎性细胞、空泡样结构和胶原沉积。第10天,模型组的胶原和纤维结缔组织变得更厚、更广泛,显示出不可逆的粘连形成。相比之下,HA组在第5天的粘连显著减少,但间皮细胞排列仍然紊乱。第10天,受损的腹膜和盲肠之间仍有部分结缔组织和胶原沉积,表明HA水凝胶在抑制粘连形成方面的效果有限。CGM组的结果显示,腹膜和盲肠在第5天和第10天完全分离,且再生组织类似于正常组,炎性细胞浸润和胶原沉积最少。这些发现表明CGM水凝胶能有效防止初次粘连的形成并促进组织再生。在经历粘连松解手术的大鼠中,观察到更广泛的粘连,伴有纤维结缔组织和新生血管的形成。HA组显示持续的纤维增生反应和炎性细胞积聚,证明商业HA水凝胶缺乏预防复发性粘连的能力。而CGM水凝胶组中,盲肠的间皮细胞层和肌肉与正常组相似,无明显的炎性细胞积聚和胶原沉积。
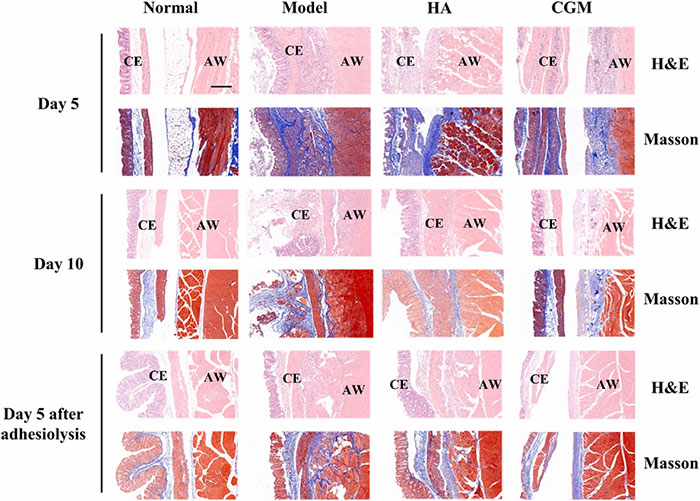
图6 粘连组织在粘连松解后第5天、第10天和第5天经不同处理后的代表性H&E和Masson三色染色。CE:盲肠粘膜;AW:腹壁。比例尺:300 μm
(6)CGM水凝胶防止粘连的潜在机制
为深入探讨CGM水凝胶防止粘连的潜在机制,进行了转录组学和蛋白质组学分析。主成分分析(PCA)显示,正常组与模型组有明显差异。通过转录组学分析鉴定的14144个基因中,11963个基因在所有组中表达,而模型组和CGM组中分别有425和371个特异性表达基因。热图和火山图揭示了一些与粘连形成密切相关的基因,包括TGF-βR1,它可以通过经典的Smad信号通路参与和调节细胞增殖、分化和纤维化过程。蛋白质组学分析进一步证实了这一点,模型组与CGM组和正常组的蛋白表达谱存在显著差异。火山图显示,模型组中CCL2、CCR2、VIM和FN1等基因表达显著上调,而CGM水凝胶显著下调了CCL2和CCR2的表达。CCL2与其受体CCR2的结合可促进细胞迁移,包括巨噬细胞、成纤维细胞等,这是粘连形成的关键因素。
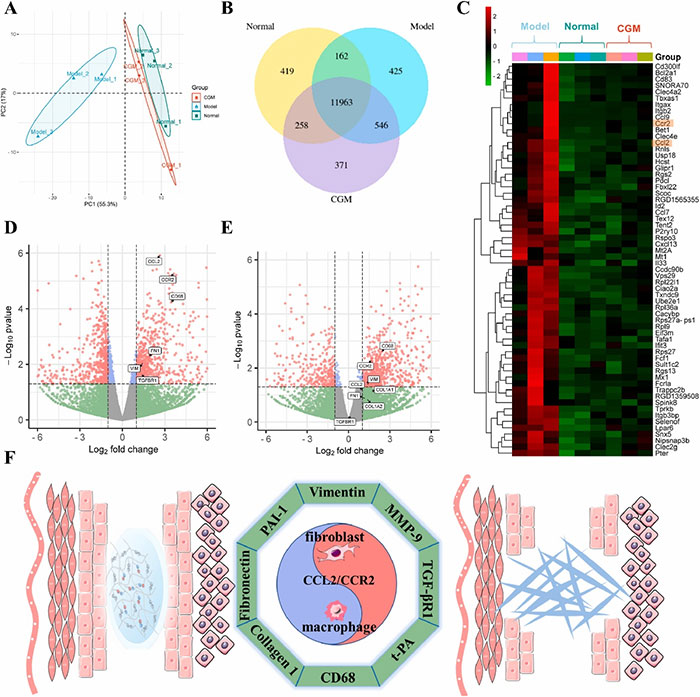
图7 使用转录组学分析分析差异基因表达(n = 3)
免疫荧光染色结果显示,模型组中CCL2和CCR2的表达显著增加,而CGM水凝胶处理组显著减少。此外,Western-blot和RT-PCR结果显示,CGM水凝胶显著抑制了CD68和波形蛋白的表达,这表明其有效地抑制了巨噬细胞和成纤维细胞的迁移。
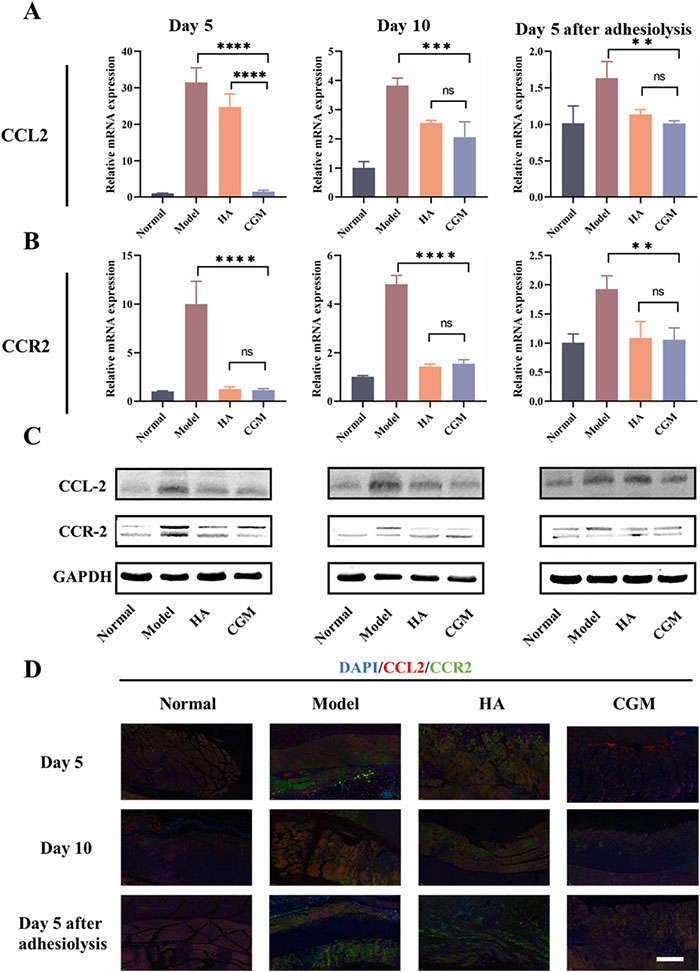
图8 CGM水凝胶对CCL2/CCR2相互作用的影响
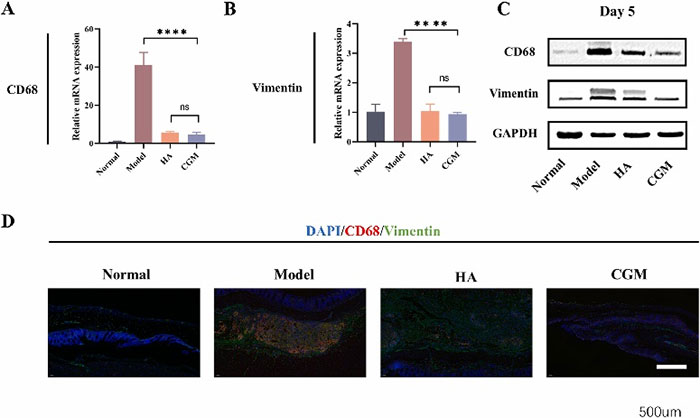
图9 CGM 水凝胶对 CD68/Vimentin 表达的影响
进一步的分析显示,CGM水凝胶处理组中TNF-α的表达显著降低,而IL-10的表达增加,表明其具有良好的抗炎作用。模型组中观察到较少的t-PA表达和大量的PAI-1表达,而CGM水凝胶组则相反。CGM水凝胶处理后,Col I的表达减少,MMP-9的表达增加。此外,CGM水凝胶还显著降低了TGF-βR1的表达。这些结果表明,CGM水凝胶能够调节ECM的降解和纤维蛋白溶解的平衡,从而有效防止腹腔粘连的形成。
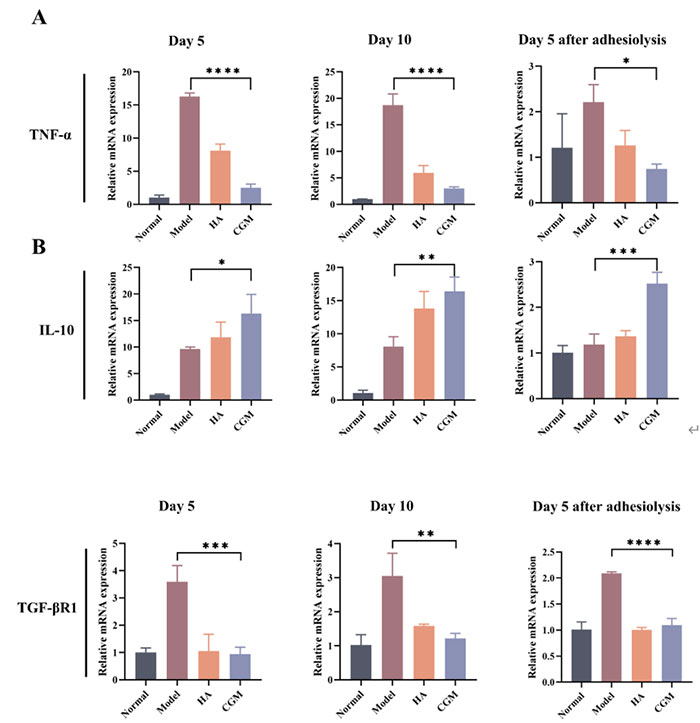
图10 水凝胶处理后粘连组织炎症因子和受体的表达水平
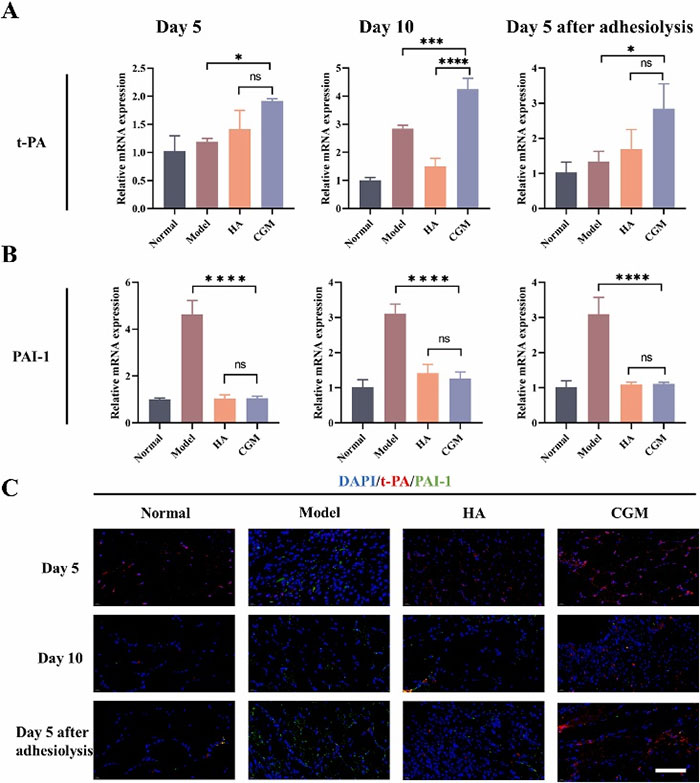
图11 CGM水凝胶对t-PA/PAI-1平衡的影响
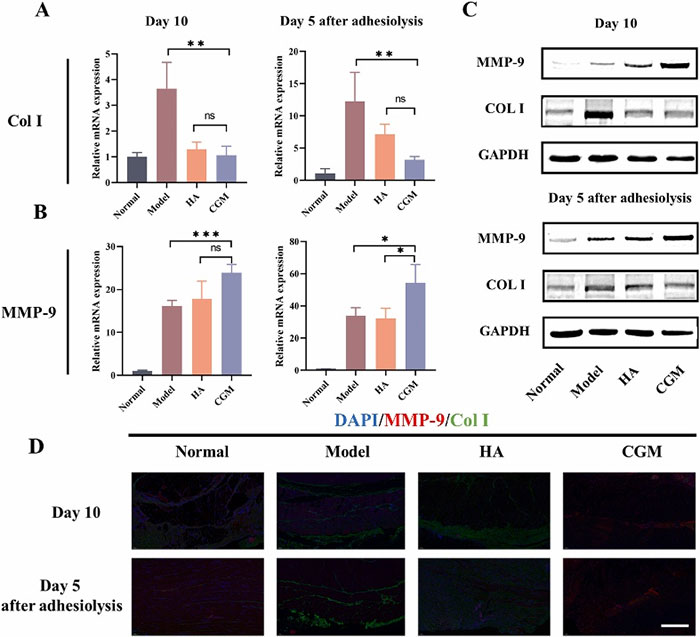
图12 CGM 水凝胶对胶原降解的影响
(7)CGM水凝胶的体内滞留时间
抗粘连屏障的生物降解性是关键因素,滞留时间过短会降低效果,而过长则可能引发异物反应。为了评估CGM-2水凝胶的体内滞留时间,采用了体内成像和磁共振成像(MRI)。在腹腔内注射后,标记有Cy7的CGM-2水凝胶在大鼠腹腔中显示出强烈的荧光信号。结果显示,CGM-2水凝胶在注射3天后残留约37%,7天后残留约24%,表明其在腹腔内逐渐降解。到第10天,荧光信号减弱并几乎消失。为进一步评估体内降解情况,将CGM-2水凝胶植入皮下并进行T1加权信号的MRI评估。结果显示,CGM-2水凝胶的信号从第0天到第7天可观察到,10天时显著减少,14天时几乎不可见,表明CGM-2水凝胶在体内的滞留时间约为10至14天,与活体成像结果一致。此外,还对CGM-3水凝胶的体内成像进行了研究,以探索CGM水凝胶降解的可调性。如图S16A所示,CGM-3水凝胶在腹腔内注射后,3天时残留约76%,7天时残留约56%。第10天时,CGM-3水凝胶的荧光信号减弱到27%,14天时几乎消失。这表明CGM-3水凝胶在体内具有较长的降解时间,可能是由于其更致密的交联网络。该结果显示CGM水凝胶具有良好的降解时间可调性,为其在其他生物领域的应用提供了广阔的前景。
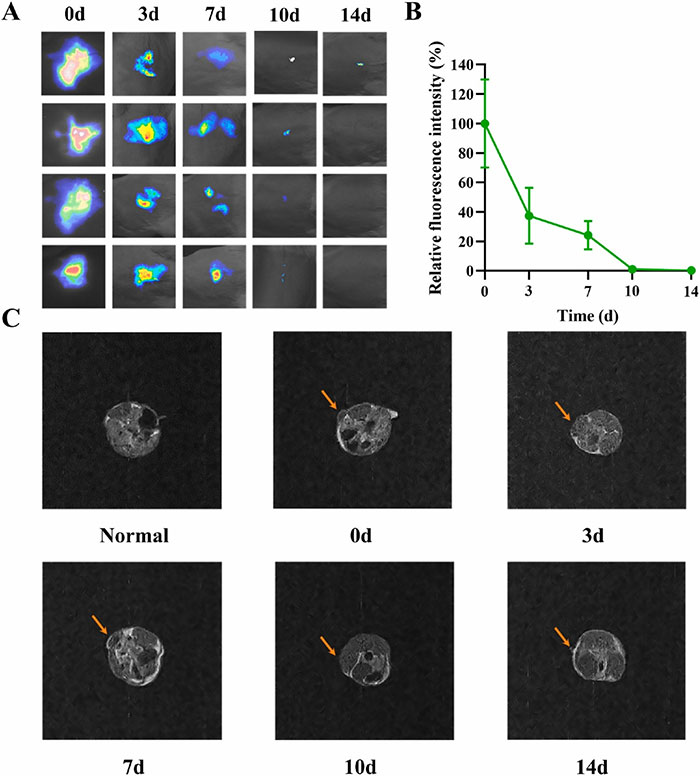
图13 CGM-2 水凝胶的生物降解性
小结:
本研究设计并制备了一种由CS-GMA和MPC单体组成的可注射抗污CGM水凝胶,用于预防术后腹腔粘连和肝脏粘连。CGM水凝胶展示了优异的抗污和自愈特性,这归因于其可逆氢键和静电相互作用网络。此外,MPC的加入在CGM水凝胶周围形成了致密的水合层,显著防止了非特异性蛋白吸附和细胞附着。体外降解和细胞实验证明了该水凝胶的优异生物相容性和理想的降解时间。在腹腔和肝脏粘连模型中,CGM水凝胶有效防止了术后粘连的形成。机制研究表明,CCL2/CCR2的相互作用影响巨噬细胞和成纤维细胞的募集以及ECM的沉积,这些都与粘连的形成有关。CGM水凝胶显著下调了CCL2/CCR2的表达,通过物理屏障和细胞因子调控的协同作用防止了腹腔粘连。这种创新的可注射水凝胶为术后粘连预防提供了一种可行且有前景的策略。
原文链接:https://www.sciencedirect.com/science/article/pii/S0142961224001959#appsec1

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

