
关节软骨缺乏血管、淋巴管、神经和干细胞,因此在受损后无法进行自我修复。传统治疗方法可以在一定程度上恢复关节软骨功能,但其治疗效果往往不尽如人意。软骨组织工程为解决关节软骨缺陷提供了一有前景的解决方案。然而,该领域仍面临诸多挑战,包括需要结构仿生、快速个性化定制和原位诱导软骨组织再生,这些问题阻碍了其向临床实践的转化应用。关节软骨由透明软骨、钙化软骨和软骨下骨三层组成,每一层都具有独特的细胞外基质组成、结构组织和细胞密度。这种复杂的解剖结构导致了物理、机械和生物特性的梯度,这些梯度对骨软骨(OC)缺陷的修复有着重要影响。因此,创造有利于软骨和骨组织再生的微环境对于推进软骨组织工程策略和在骨软骨缺损治疗中取得积极成果至关重要。

针对上述问题和挑战,兰州大学范增杰教授课题组通过3D打印技术开发了一种可快速定制、具有干细胞捕获和归巢能力的仿生软骨支架,该支架由三种预先设计的生物墨水模块单元组成,每个模块单元发挥具有不同的功能。如图1所示,所制备的打印支架不仅准确再现了关节软骨组织的三层结构和材料梯度,还具有良好的获抗压强度(6.3 MPa)。对于该仿生支架的底层墨水模块单元,使用适体HM69通过SA的羧基与HM69的胺基之间的酰胺化反应对SA进行修饰;此外,还引入了70%KH570改性的HANFs。在中间层模块化单元中,没有对水凝胶基底进行改性,而是引入了40%的KH570改性HANFs。至于顶层,将装有 SDF-1α 的 PLGA 纳米颗粒封装入水凝胶基底,没有添加任何 KH570 改性的 HANFs。该支架在其底层和顶层集成了干细胞捕获层和归巢层。这种设计能够通过适体相互作用在体内特异性捕获骨髓间充质干细胞(BMSCs),然后通过SDF-1α浓度梯度的趋化性将其动员到透明软骨层上。在支架的微环境中,这些骨髓间充质干细胞在每一层分化为不同的细胞,有效地促进了关节软骨缺损的修复。
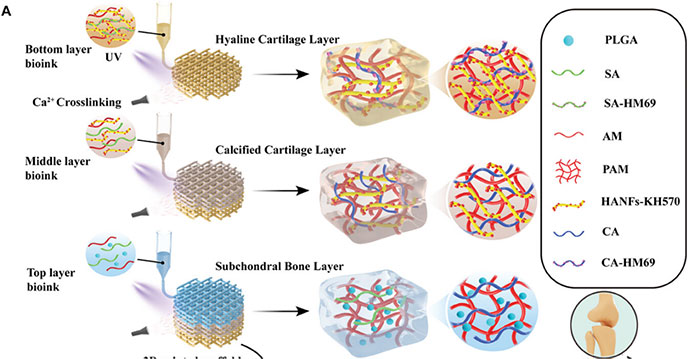
图1 仿生软骨支架生物墨水模块单元组成和制造工艺示意图
(1)仿生软骨支架的物理化学、形态和机械特性
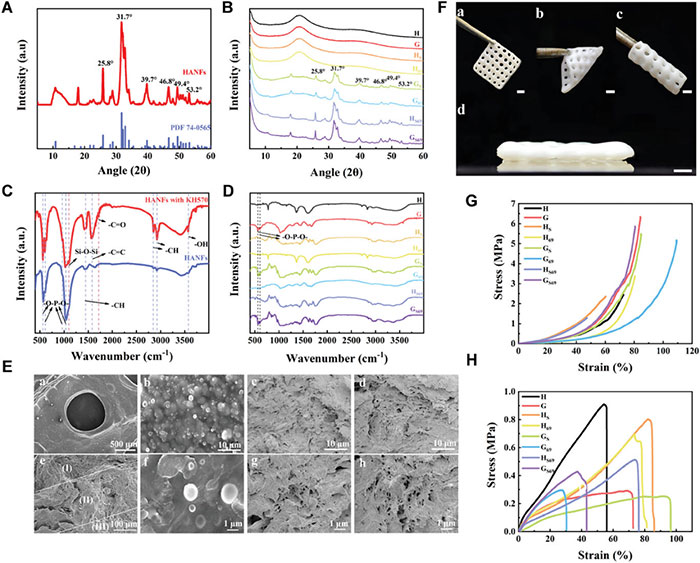
图2 物理化学、形态和机械性能表征
图2A-D中的结果表明制备仿生软骨支架所用材料的成功合成。对于打印出来的支架(图2E),其SEM呈现出明显的三层结构,如在上层,可以清晰地观察到PLGA纳米球尺寸分布均匀。而在中下层,也可以清晰地观察到同质的HANFs。由于HANFs的增强作用以及其与PAM水凝胶的化学交联作用,打印的支架具有较高的形状保持能力和优异的力学性能。即使在折叠和卷曲状态下,它们仍然可以保持结构的完整性(图2F)。应力应变试验进一步验证了其优异的力学性能(图2G,H)。研究者认为HANFs在改善机械支柱方面发挥了非常关键的作用。
(2)仿生软骨支架对BMSCs的招募能力
干细胞捕获是原位诱导再生的第一步。在体外实验组研究人员将BMSCs种在Transwell孔板的上室,而具有招募能力的打印支架则放置在Transwell孔板的下室。结果表明,经SDF-1α包封的HM69和PLGA纳米球功能化后的打印支架(如GS69组)在培养24 h后表现出比其他支架更高的招募能力(图3A)。此外,研究者评估了打印支架在体内BMSCs的募集情况。用免疫荧光染色特异性骨髓间充质干细胞标志物CD44来量化骨髓间充质干细胞的归巢能力。结果表明,在HM69和SDF-1α功能化的打印支架上培养的骨髓间充质干细胞CD44和F-actin的阳性表达量较高,尤其是GS69和HS69组。这证实了HM69和SDF-1的功能化修饰是诱导骨髓间充质干细胞在体内归巢和迁移的有效方法(图3B)。
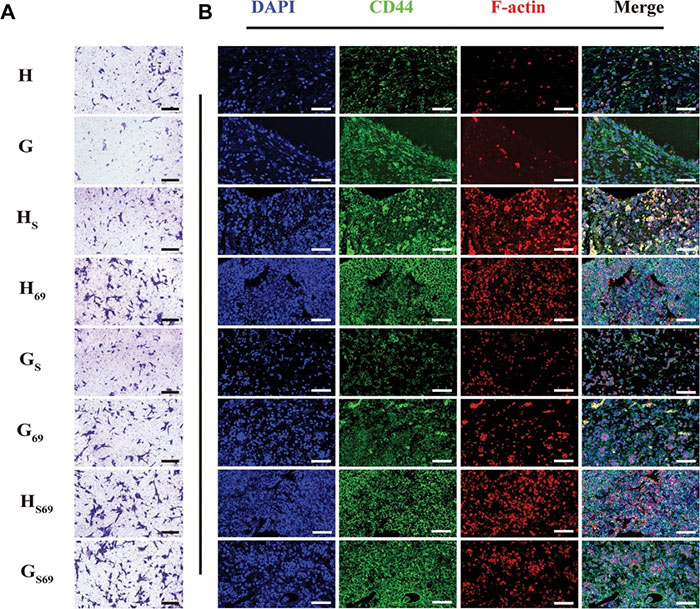
图3 体内BMSCs的招募能力和体外BMSCs的招募能力
(3)仿生软骨支架的生物相容性

图4 打印支架上培养的骨髓间充质干细胞活/死染色、Phalloidin/Hoechst染色、EdU染色
良好的细胞相容性是保证合成材料在体内安全使用的必要条件。骨髓间充质干细胞在不同支架上培养1、3、5、7天,与对照组相比差异不显著,说明所有支架均具有良好的细胞相容性(图4A)。此外,Phalloidin/Hoechst染色观察骨髓间充质干细胞的细胞骨架结构,不同支架上培养的细胞均呈现清晰的细胞骨架形态和正常的扩散状态(图4B)。最后,EdU掺入实验研究了支架对BMSCs体外增殖能力的影响。结果表明,培养24 h后,GS69组与阴性对照组的细胞增殖数量无显著差异,说明该组对细胞增殖无不良影响。
(4)打印支架对兔OC缺陷模型的体内修复效果
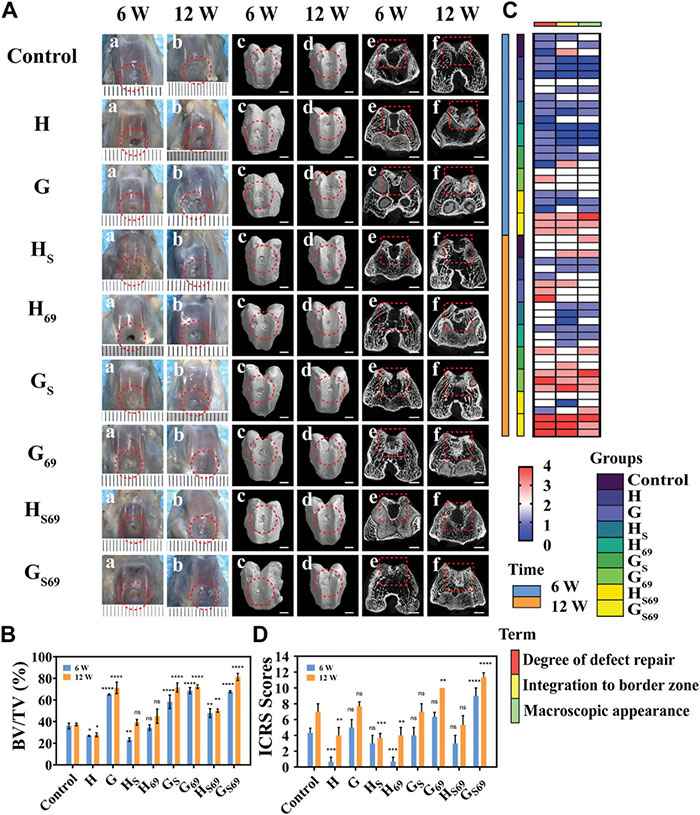
图5 打印支架对兔OC缺陷模型的体内修复效果
通过术后6周的观察,GS69组在软骨缺损区域形成了完整且平滑的软组织,相比之下,其他组只显示出部分软组织修复(图5Aa)。术后12周,对照组、H组、G组、HS组和H69组的修复仍被抑制,缺损表面有不规则软组织覆盖。具有BMSCs募集功能的支架组(如GS、G69、GS69)缺损区显示完整光滑的软骨样组织覆盖,而HS69组由于缺乏HANFs支持,仍有部分塌陷(图5Ab)。此外,研究者通过微型计算机断层扫描(Micro-CT)分析进一步证实了GS69支架在6周和12周时对原位诱导的OC缺陷再生有显著的积极作用,而其他组的修复效果不明显(图5Ac-Af)。对缺损内新形成骨的定量评估证实了上述观察结果(图5B)。梯度水凝胶支架组感兴趣小梁体积的骨体积/总体积(BV/TV)值明显高于对照组,这表明将HANFs加入水凝胶增强了骨的再生能力,使构建物与宿主骨之间形成紧密结合。国际软骨修复协会(ICRS)宏观评估也显示(图5C和5D),对照组第12周的ICRS平均评分≈7.00±0.82,属于III级(异常)。相比之下,GS69组处理动物的ICRS平均评分为≈11.33±0.47,评分为II级(接近正常软骨)。这些结果表明,GS69支架对兔子的骨软骨缺损具有显著的体内修复效果。
(5)修复软骨的组织学分析
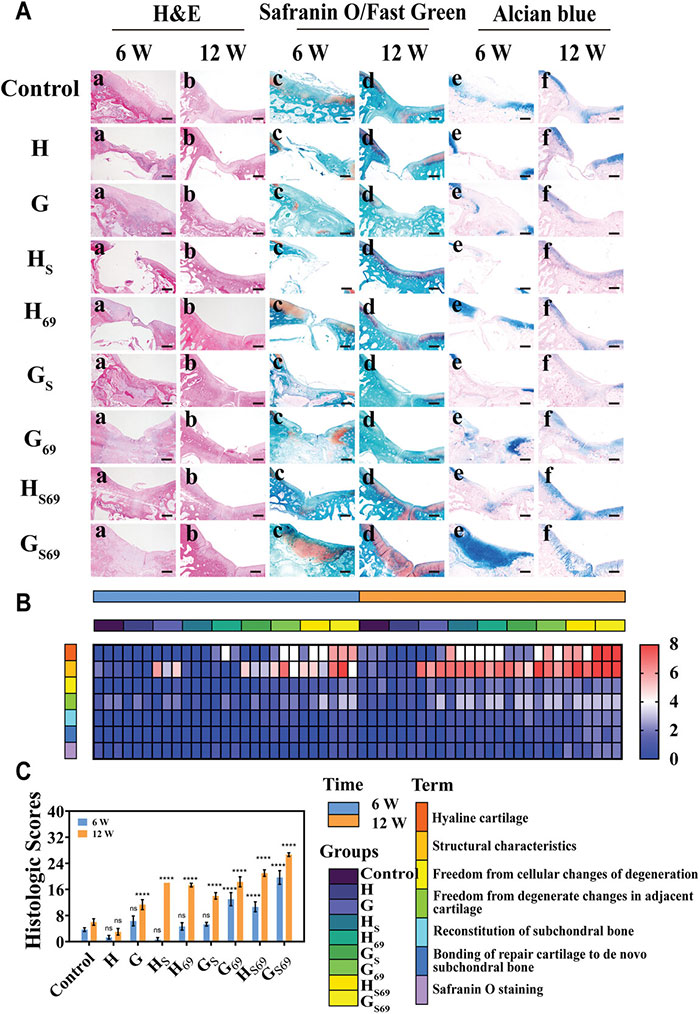
图6 修复软骨的组织学分析
染色结果显示,6周时,对照组缺损区纤维有限,组织修复不成熟。12周时,缺损区有连续的组织,有少量软骨细胞和更多的纤维组织。与其他组相比,GS69组软骨缺损下面板在6周时填充了未降解的支架。12周时,软骨再生成功,组织形态与正常透明软骨相似。再生软骨与周围软骨融合良好,软骨下骨生长良好。此外,O’driscoll组织学评分结果显示,GS69组的评分最高(第6周≈19.67±1.70;第12周≈26.67±0.47)。总体而言,组织学评价进一步证实了GS69支架促进软骨再生的有效性。
(6)修复软骨的免疫荧光分析
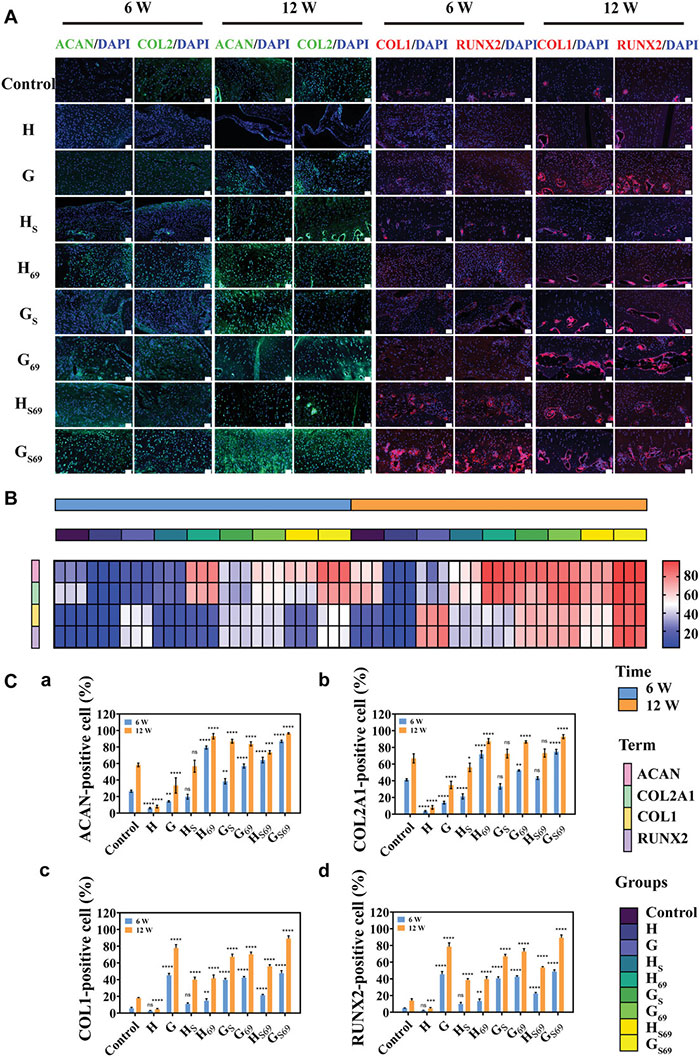
图7 修复软骨的免疫荧光
免疫荧光分析结果显示,6周时,GS69组的ACAN和COL2A1阳性细胞率显著高于其他各组,COL1和RUNX2阳性细胞率接近含HANFs组(图7B、C)。随着修复时间的延长至12周,GS69组中ACAN、COL2A、COL1、RUNX2阳性细胞比例增加。多数软骨细胞分布形态规则,伴有ACAN和II型胶原细胞外基质染色。COL1和RUNX2的高表达可以证实骨髓腔附近有新骨形成。这些结果表明,单独释放SDF-1α对诱导BMSCs成软骨分化的作用并不像之前其他研究显示的那样显著,因此也提示促进干细胞分化的主要原因在于支架的力学性能和微环境的相互协调。
小结:
该研究提出了软骨组织工程领域的几项重大创新。打印的支架不仅准确地再现了关节软骨组织的三层结构和材料梯度,而且通过羟基磷灰石纳米纤维的增强和与水凝胶的化学键的建立,获得了良好的抗压强度。支架的复杂设计,提供了一种独特而有效的方法来捕获和动员骨髓腔内的骨髓间充质干细胞到损伤部位。该方法是后续干细胞粘附、增殖和分化的基本前提。此外,支架的仿生设计结合了材料和结构梯度模拟,为骨髓间充质干细胞在每层内分化成不同的细胞类型建立了理想的微环境。因此,这种方法允许定制受损的关节软骨组织,并通过利用3D打印技术高效生产支架。通过在单个支架内合并多种功能,可以立即植入受损软骨部位,从而避免了体外干细胞共培养的需要。因此,一步式3D打印仿生软骨支架可立即植入并原位诱导骨软骨再生,这在骨软骨修复中具有广泛应用的巨大潜力。
相关工作以“Rapid Customization of Biomimetic Cartilage Scaffold with
Stem Cell Capturing and Homing Capabilities for In Situ Inductive Regeneration of Osteochondral Defects”为题于2024年6月1日发表在《Advanced Functional Materials》上。
原文链接:
https://doi.org/10.1002/adfm.202400608

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

