
研究背景:
糖尿病已经成为全球十大慢性代谢疾病中的第一种,还会引起许多的并发症。糖尿病伤口微环境破坏了正常的伤口愈合阶段,高血糖环境会产生高浓度的活性氧(ROS),导致持续性炎症,进一步促进巨噬细胞极化为M1表型,从而加剧病情。在临床实践中,高血糖和巨噬细胞极化被认为是治疗糖尿病伤口的突破口。细菌感染是导致糖尿病伤口愈合缓慢的另一个关键因素,而伤口部位pH值与细菌感染有关,因此,监测伤口的pH值可以明确伤口状态,为治疗提供早期预警。光热抗菌是一种有望替代抗生素治疗的治疗方式,光热剂将光能转化为热能,破坏细菌的细胞膜和蛋白质,达到消除细菌的目的,其副作用小、可控性强、避免细菌耐药性。

针对上述问题,武汉理工大学戴红莲教授团队设计了一种集合诊断和治疗功能的水凝胶,用于监测伤口部位pH值的变化,结合ROS清除和光热抗菌,调节糖尿病伤口微环境,促进糖尿病伤口愈合。首先,采用水热法制备了氧化铈复合二硫化钼纳米颗粒(C@M),并在C@M上沉积一层聚多巴胺(C@M@P)。随后,通过硫辛酸改性壳聚糖(LAMC),在紫外线(UV)下凝胶化。最后,将碳量子点(CD)和C@M@P掺入LAMC水凝胶中,在pH值4-9的范围内实现荧光响应,使用智能手机监测水凝胶的荧光信号,测量RGB值,产生拟合曲线,实时监测伤口部位的pH值。相关研究在2024年4月21日以“A Multifunctional Hydrogel with Photothermal Antibacterial and AntiOxidant Activity for Smart Monitoring and Promotion of Diabetic Wound Healing”为题发表于《Advanced Functional Materials》(DOI:10.1002/adfm.202402531)上。
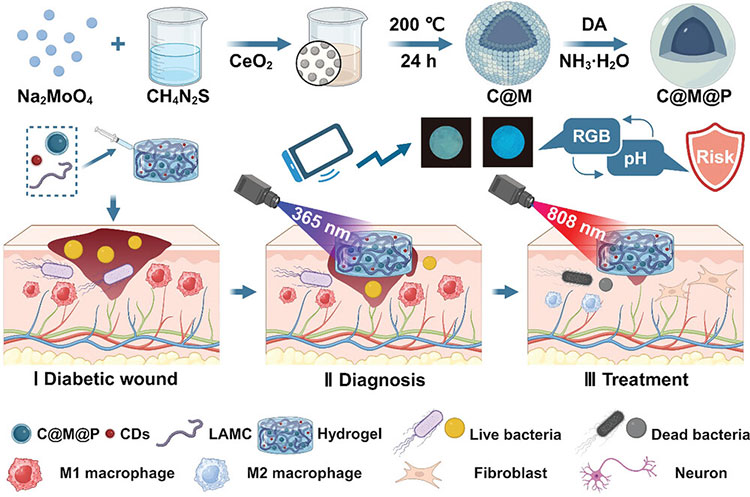
设计示意图
(1) 复合水凝胶的智能pH监测能力
正常皮肤的pH值在5-6之间,而糖尿病伤口可以在碱性条件下维持数月,这会导致严重的炎症和细菌感染,延长伤口愈合时间。在紫外光(365 nm)下,水凝胶的荧光强度随pH值的变化而变化(图1A)。当pH值逐渐增大时,荧光强度也逐渐增强,且荧光强度与pH值的线性曲线可以很好的拟合,可以得出荧光强度与pH值的线性方程,这有助于实时监测伤口状态。为了解决肉眼下荧光强度变化的区别,使用智能手机将图像转换为RGB信号,构建pH值与RGB的关系方程,通过拟合发现pH=0.1328(G+B)-41.66,利用这一方程可轻松获取伤口pH值。
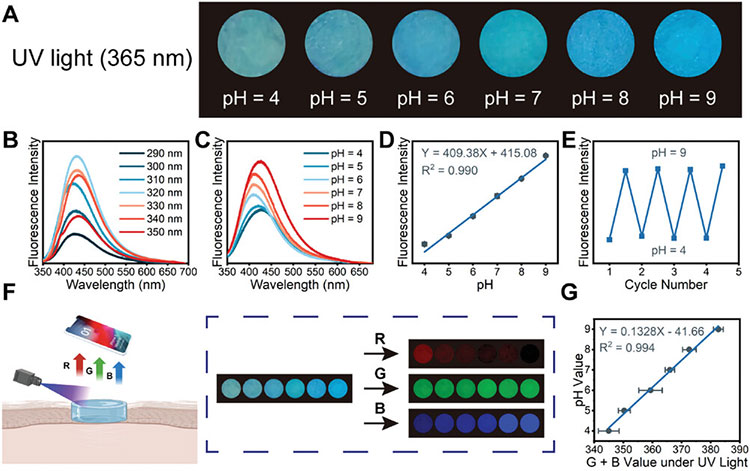
图1 水凝胶的智能pH监测功能
(2)复合水凝胶的物理性质和ROS清除能力
通过搭接剪切强度实验测量复合水凝胶的黏附强度,随着C@M@P NPs的添加,黏附强度增大,且抗压强度得到显著提高。此外,加入C@M@P NPs后,水凝胶表现出更快的溶胀动力学,溶胀性得到提高。利用ROS清除实验评估复合水凝胶对H2O2、·OH、和O2-的清除效果,结果显示,LAMC水凝胶具有一定的清除能力,主要是由于硫辛酸的抗氧化特性。掺入C@M@P NPs后,水凝胶的ROS清除能力得到进一步提高,主要原因是与CeO2表面的氧空位有关。综上,复合水凝胶具有良好的ROS清除活性,具有减轻氧化应激损伤的潜力。
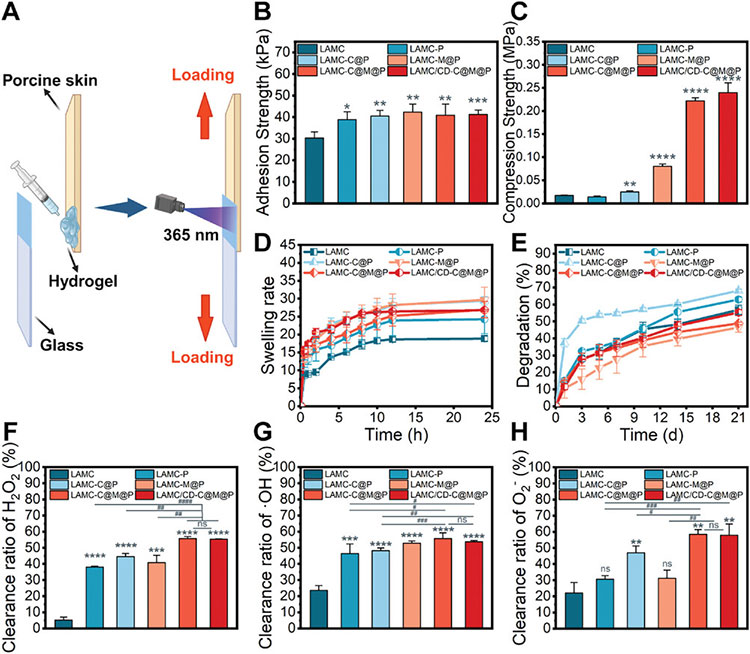
图2 复合水凝胶的物理性质和ROS清除能力
(3)光热性能与近红外辅助抗菌性能
为了评估复合水凝胶的光热效应,使用808 nm近红外激光照射水凝胶,记录温度与时间变化曲线。LAMC水凝胶经过10 min照射后,温度升高不明显,加入C@M@P NPs和CD后,LAMC/CD-C@M@P水凝胶的温度升高至62.3℃。通过平板计数法评估复合水凝胶的抗菌性能,LAMC水凝胶对E. coli和S. aureus的抑制率仅有17.71%±6.48%和25.83%±0.73%,主要是由于带正电荷的壳聚糖吸引带负电的细菌,破坏细菌膜的渗透性。加入C@M@P NPs和CD,并通过NIR照射后,对E. coli和S. aureus的抑制率接近100%。随后通过SEM观察细菌形态,对照组细菌保持光滑且呈完整的球形或棒状,LAMC/CD-C@M@P水凝胶通过NIR照射后,细菌细胞膜受损严重,内容物流出。因此,C@M@P NPs的光热效应在抗菌中起到关键作用。
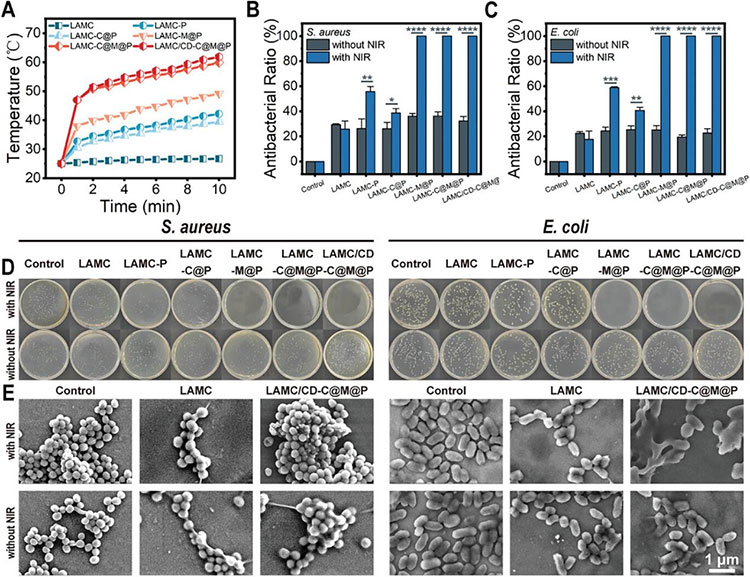
图3 复合水凝胶的光热和抗菌性能
(4)生物相容性和细胞迁移
良好的生物相容性是临床生物材料的基本要求。在第1天和第3天没有观察到明显的细胞毒性,到第5天LAMC/CD-C@M@P水凝胶与对照组开始出现差异,这是由于水凝胶中NPs的释放所致,但是对L929细胞的存活率均超过95%,细胞活死染色也证明了这一点。通过细胞划痕实验评估水凝胶对人脐静脉内皮细胞(HUVEC)迁移的影响,LAMC水凝胶基本与对照组接近,而LAMC/CD-C@M@P水凝胶明显促进了HUVEC的迁移,定量统计也显示,LAMC/CD-C@M@P水凝胶处理24 h后细胞划痕覆盖率达到65.24%±1.13%。这些结果表明LAMC/CD-C@M@P水凝胶可以促进细胞迁移。
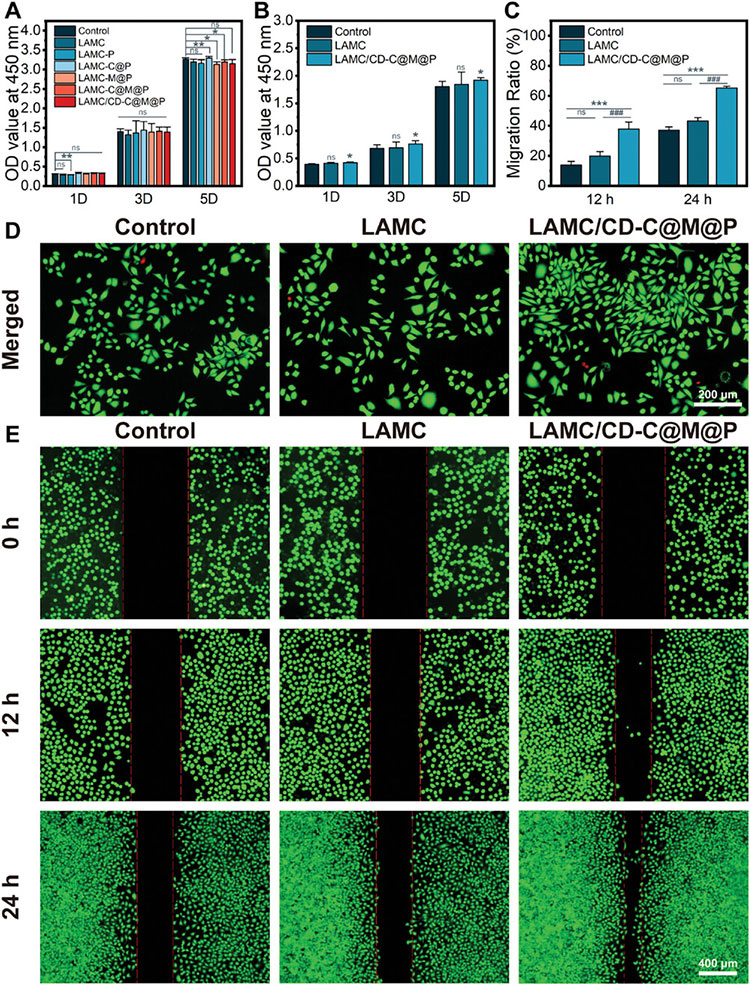
图4 复合水凝胶的体外细胞相容性和细胞迁移
(5) 抗氧化和抗炎能力
使用H2O2处理过的L929细胞作为氧化应激模型,使用DCFH-DA探针研究复合水凝胶在细胞水平上的抗氧化能力。结果显示,对照组的荧光强度为72.37%±7.00%,LAMC水凝胶和LAMC/CD-C@M@P水凝胶的荧光强度降低至54.56%±3.88%和30.41%±4.25%,表明LAMC/CD-C@M@P水凝胶可以有效的防止L929细胞的氧化应激。随后,通过LPS诱导RAW264.7细胞M1/M2表型相关基因的表达评价复合水凝胶的抗炎活性。结果显示,LPS刺激后,M1相关基因(IL-1β、iNOS和IL-10)急剧增加,LAMC/CD-C@M@P水凝胶显著抑制了IL-1β、iNOS和IL-10的表达,促进了与M2相关基因(Arg-1、TGF-β和IL-10)的表达,表现出良好的抗炎活性。
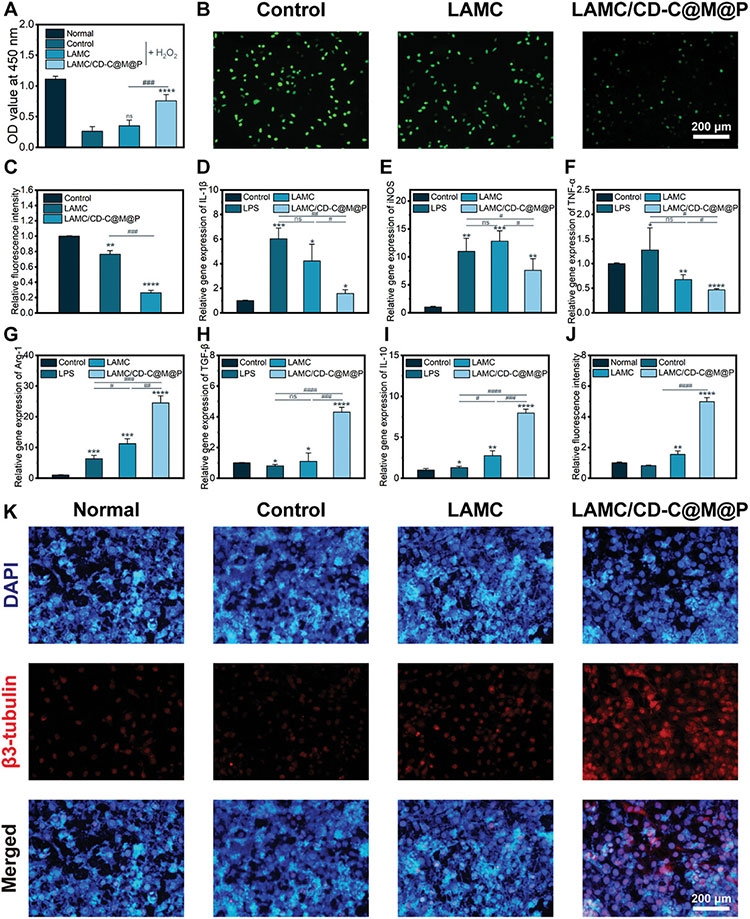
图5 复合水凝胶的抗氧化和抗炎作用
(6)体内pH监测与伤口愈合
通过腹腔注射链脲佐菌素(STZ)构建大鼠糖尿病模型,并在此基础上构建糖尿病感染伤口模型。为了实现实时监测和治疗系统,使用LAMC/CD-C@M@P水凝胶监测0-3天的pH值变化,通过记录荧光强度的变化,并根据公式计算实时pH值。通过NIR照射后,第3天的伤口pH值基本恢复,这意味着有效消除了S. aureus并缓解了细菌感染。在实时监测过程中,使用pH计真实记录伤口的pH值变化,结果显示与监测值具有很强的相关性(图6D)。在第14天LAMC/CD-C@M@P水凝胶的伤口愈合率达到94.73%±3.22%,明显优于对照组。
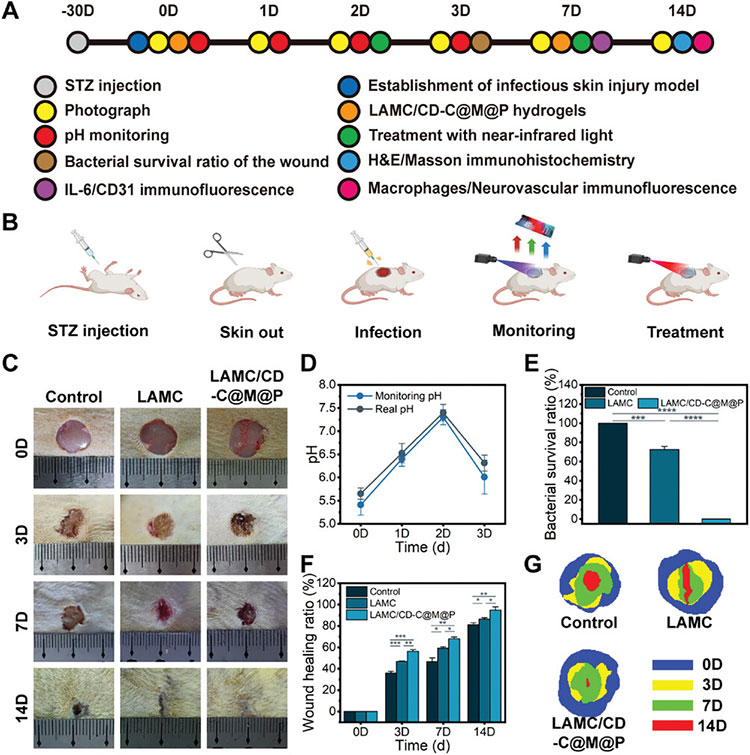
图6 复合水凝胶在糖尿病伤口中的体内研究
(7) 组织学与免疫荧光分析
通过免疫荧光染色和组织学分析评估LAMC/CD-C@M@P水凝胶的组织再生能力。LAMC/CD-C@M@P水凝胶组显示出较少的炎症细胞以及较高程度的伤口闭合,还显示出更多的胶原沉积量,结果表明LAMC/CD-C@M@P水凝胶可有效促进伤口愈合和胶原蛋白沉积。通过IL-6和CD31的免疫荧光染色评估伤口修复情况。LAMC/CD-C@M@P水凝胶组IL-6表达最低,表明验证反应减少,CD31表达量最高,表明血管生成最多。此外,CD86和CD206的免疫荧光染色结果表明,LAMC/CD-C@M@P水凝胶可以促进巨噬细胞分化为M2表型,表现出抗炎作用。
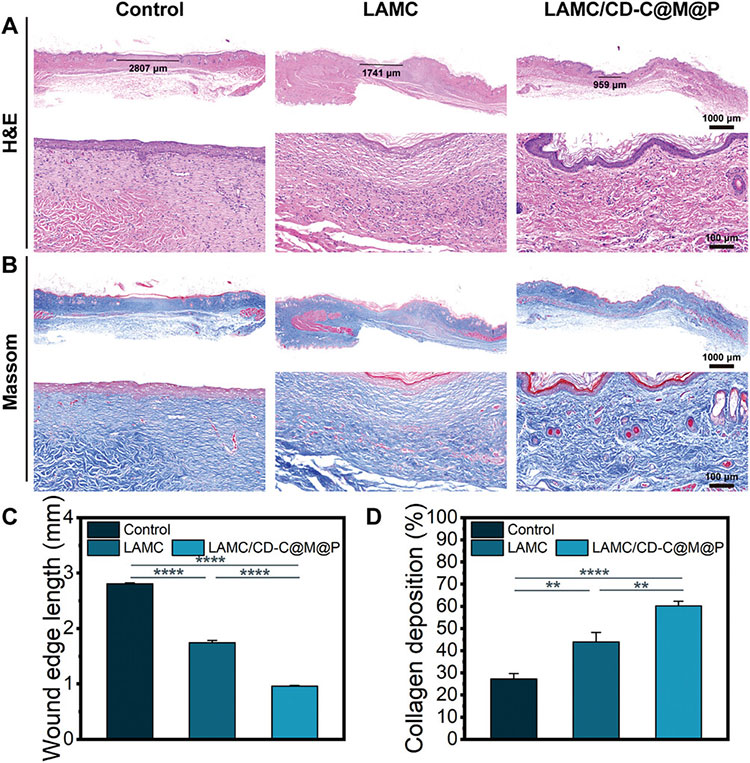
图7 伤口的组织学分析
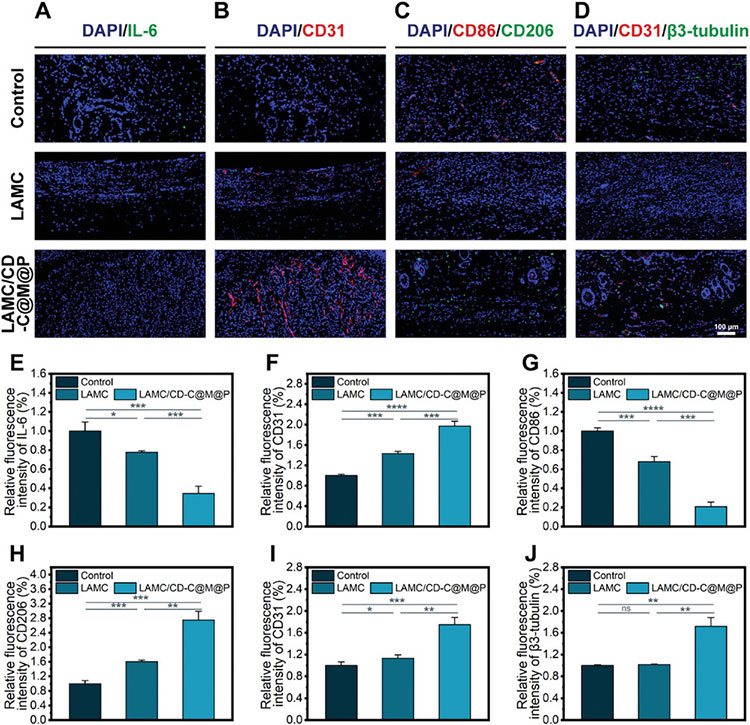
图8 伤口的免疫荧光染色
小结:
该团队设计了一种具有pH监测、光热抗菌、抗氧化和抗炎特性的新型诊断和治疗水凝胶。将CD掺入LAMC水凝胶赋予水凝胶光致发光性能,其荧光强度根据pH值的变化而变化。将C@M@P掺入LAMC水凝胶使水凝胶表现出良好的压缩强度、光热转换能力和近红外辅助抗菌能力。此外,LAMC/CD-C@M@P水凝胶还能有效清除ROS,缓解炎症反应,促进巨噬细胞M2表型转化,促进糖尿病伤口愈合。因此,本研究为糖尿病伤口提供了一种新的监测与治疗多合一的策略。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202402531

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

