
研究背景:
慢性糖尿病伤口由于持续的炎症、血管化受损以及治疗药物滞留不足,带来了巨大的临床挑战,传统疗法因渗出液稀释、组织屏障及微环境动态变化而难以精准递药,疗效受限。近年微针(MN)技术虽能无痛穿透角质层建立给药通道,却多为被动释放,缺乏对伤口pH、酶谱等信号的响应,生物利用度不足30%。同时,间充质干细胞(MSC)及其衍生的无细胞纳米囊泡(MSC-NV)可旁分泌外泌体,多通路协同抗炎、促血管新生与组织重塑,却受活细胞移植瓶颈限制;聚脱氧核糖核苷酸(PDRN)已获批用于糖尿病足溃疡,通过激活 A2A 受体改善灌注并刺激胶原沉积,安全低成本。因此,构建可动态响应伤口信号、整合 MSC-NV 与 PDRN 的微针递送平台,实现“免疫调节+促血管+抗凋亡”时空可控协同,已成为慢性伤口管理亟待突破的核心科学问题。

针对上述问题,韩国汉阳大学Hyun-Do Jung团队联合韩国天主教大学Han Young Kim团队构建的MSC-inspired MN(MSCi@MN)贴片以透明质酸为基体,嵌入MXene纳米颗粒并共载NV-DNA复合物,利用近红外光触发MXene产生温和光热效应,实现NV与DNA的按需释放、局部血管扩张与杀菌三重功能;微针微创投递确保NV-DNA在深部组织持续高浓度滞留,显著抑制炎症、加速血管新生、减少细胞凋亡并促进肉芽及上皮形成。该光响应仿生平台首次将“干细胞自适应分泌”概念融入微针设计,为慢性难愈伤口提供了一种安全、高效、可重复的无细胞治疗新策略,同时拓展了MXene生物材料在再生医学中的精准应用框架。该文章于2025年10月25日以《Mesenchymal Stem Cell-Inspired Microneedle Platform for NIR-responsive Immunomodulation and Accelerated Chronic Wound Healing》为题发表于《Advanced Materials》(DOI:10.1002/adma.202514081)。
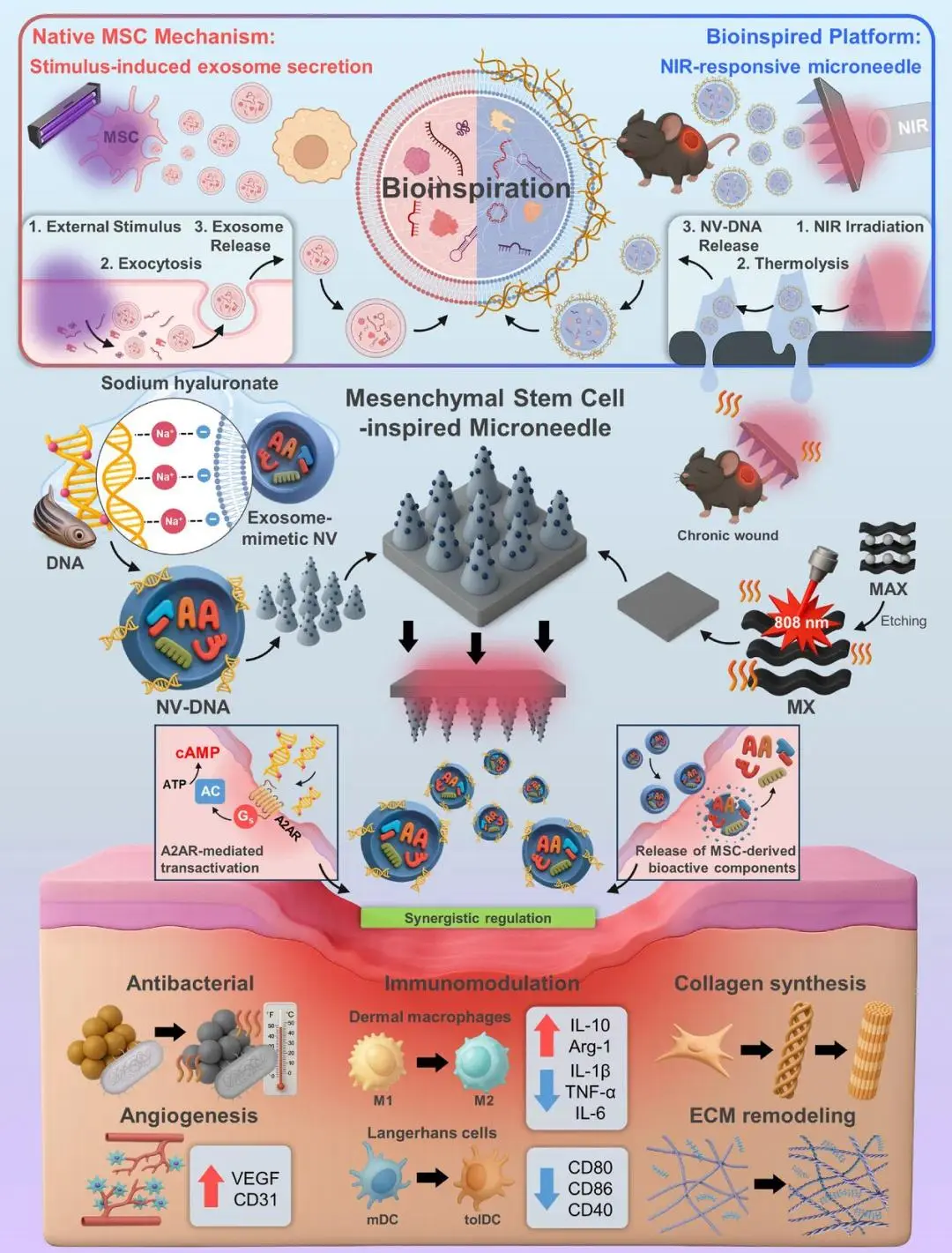
模拟天然外泌体分泌途径的MSCi@MN平台示意图
(1)MSCi@MN的形貌与表征
MSCi@MN贴片采用“先尖端后基部”两步浇注完成区域化装载,首先NV与DNA在Na+屏蔽下通过静电自组装形成复合物,Cryo-TEM显示囊泡保持完整球形但表面粗糙度明显增加,边缘出现高电子密度带,DLS粒径由145.6±1.9 nm增至221.8±2.2 nm,ζ电位由−7.64±0.17 mV负移至−12.03±1.10 mV,NTA亦呈现浓度依赖的尺寸增大,FRET实验在DiI-NV/Dyecycle-DNA体系中观察到供体荧光增强而受体荧光淬灭,证实两者间距<10 nm且未形成新化学键(图1a–c),随后Ti3AlC2 MAX经HF蚀刻与四甲基氢氧化铵插层剥离,SEM显示由致密块状转变为透明、褶皱的少层Ti3C2 MX纳米片,XRD(002)峰由9.5°左移至6.8°对应层间距由9.5 Å增至12.9 Å,(104)、(105)峰消失且(110)峰强度降低,表明Al层被完全移除,TGA曲线中MX在800 ℃残重>90%,而HA-MN仅余6.4%,MX@MN残重与投料量(10 wt%)一致,证实MX在基质内无团聚、无流失(图1d,e);再利用DLP打印母模复制PDMS软模,可反复浇注>50次,所得15×15 mm贴片含20×20阵列共400根圆锥微针,平均高度402.4±12 μm、底径212.6±8 μm、尖端曲率半径≈2 μm,压缩测试显示刺入成功率>95%,几何误差<5%,满足透皮机械强度与剂量重现要求(图1g);SEM-EDX面扫显示尖端区域P、Na元素信号强度分别为基部区域的5.3倍与4.1倍,对应NV-DNA簇密集分布;基部区域Ti、C呈片状特征峰,Ti信号强度为尖端的8.7倍,证实MX选择性定位于基部,形成“尖端NV-DNA+基部MX”空间分离结构,为NIR触发顺序释放与光热-抗菌-促血流多功能协同奠定基础(图1h,i)。
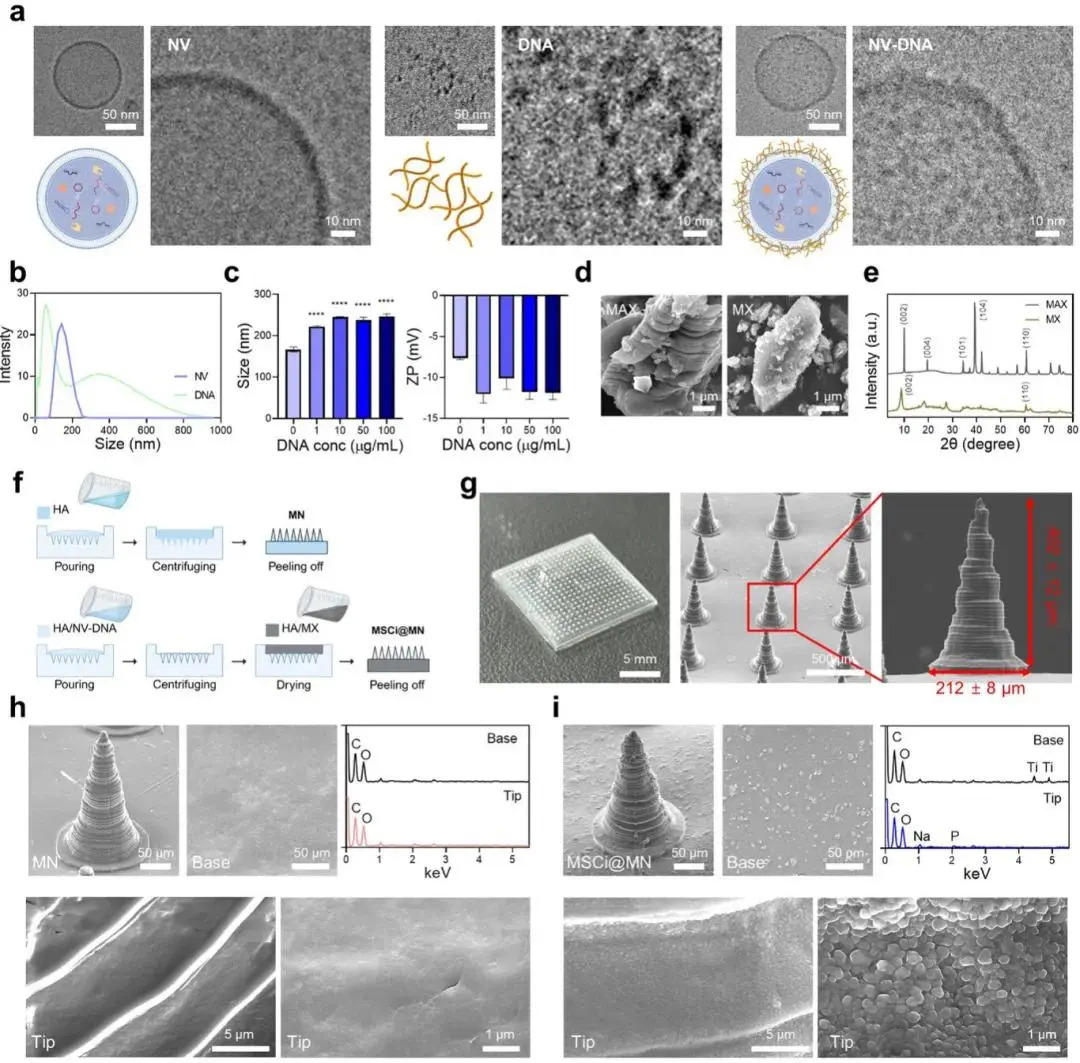
图1. MSCi@MN的结构与组成表征。a)NV、DNA及NV-DNA的冷冻透射电子显微镜(Cryo-TEM)图像;b)NV与DNA的尺寸分布;c)不同DNA浓度下NV的水动力学尺寸及Zeta电位(ZP)的动态光散射(DLS)分析;d)Ti3AlC2 MAX相(MAX)与Ti3C2 MXene(MX)的扫描电子显微镜(SEM)图像;e)MAX相和MXene的X射线衍射(XRD)图谱;f)MN与MSCi@MN的制备过程示意图;g)MN阵列的光学图像及单根微针高度与基底直径的SEM测试结果;h、i)分别为MN(h)与MSCi@MN(i)的SEM图像及能量色散X射线光谱(EDX)元素mapping图
(2)MSCi@MN的力学性能与近红外响应性抗菌活性
为确保MSCi@MN贴片可批量浇注并保持皮肤穿透可靠性,体系流变-机械-光热性能被系统优化:所有前驱液在0.1-100 s-1剪切范围内呈典型剪切变稀,MX的引入仅使黏度由1.3 Pa·s升至2.1 Pa·s,仍远低于浇注上限(图2a);压缩测试显示5 % HA配方在0.262 mm位移即可承受0.51 N/针,刚度达58 N·m-1,显著高于3% HA(42 N·m-1),且4 ℃/20% RH贮存两周后断裂力保持>95 %,而在70% RH下强度衰减35 %,确立低湿冷链为储存标准(图2b-d)。猪皮肤插入实验进一步验证,5% HA与MSCi@MN组成功穿透率分别达98%与96%,显著高于3% HA(83%);组织学测得小鼠与猪真皮插入深度分别为266.6±12.3 µm与214.9±9.7 µm,均超过表皮厚度(≈150 µm),且NV-DNA与MX的掺入未削弱机械性能(图2e-f)。光热方面,1.5 mg·mL-1 MX的MN在1.0 W·cm-2 808 nm照射5 s表面温度即升至46.8±0.9 ℃,10次开-关循环温升曲线重叠,显示MXene能量转换效率>35 %且热稳定性优异;该温和热刺激(45-50 ℃)不仅触发MN 30 s内完全溶解,还使E. coli与S. aureus菌落数下降>99.9 %,SEM见菌膜皱缩、胞壁破裂(图2g-j)。综合以上数据,确定“5% HA-1.5 mg·mL-1 MX-1.0 W·cm-2 NIR”为兼顾插入可靠性、温和光热杀菌与生物活性保全的最优参数组合,为后续慢性创面治疗奠定工程化基础。
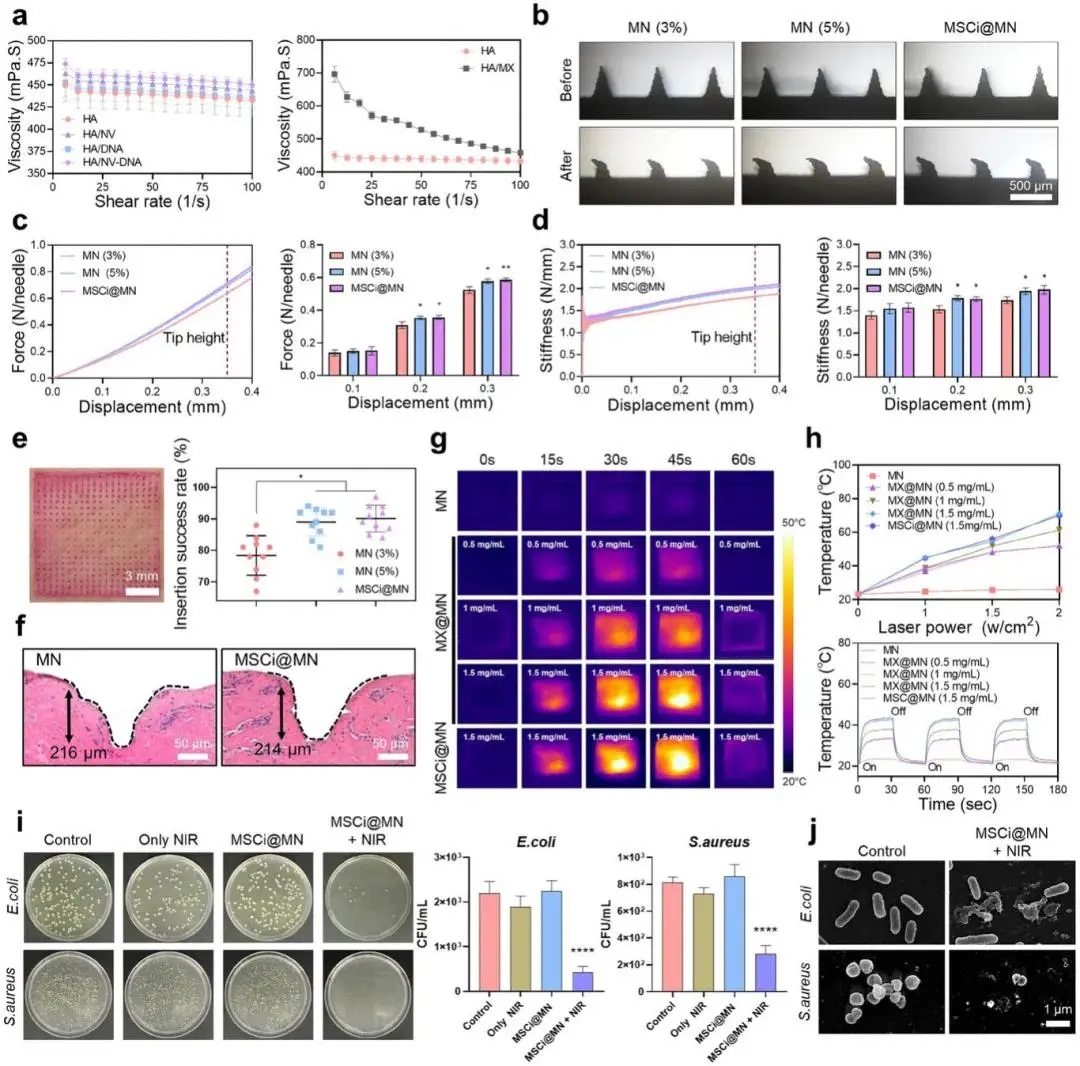
图2. MSCi@MN的力学特性与近红外诱导抗菌特性。a)MSCi@MN溶液的粘度分析;b)MN压缩前后的光学图像;c)不同透明质酸(HA)浓度及载药条件下MN的力-位移曲线;d)不同HA浓度及载药条件下MN的刚度-位移曲线;e)不同HA浓度MN在猪皮肤中的穿刺图像及成功率;f)MN与MSCi@MN嵌入猪皮肤后的组织学图像;g)含不同MX浓度的MN在808 nm近红外照射下的热成像图;h)不同MX浓度的MN在808 nm近红外照射(1 W·cm-2)下的光热升温曲线,含3个连续开关循环;i)展示MSCi@MN抗菌效果的照片及菌落形成单位(CFU/mL)定量结果;j)近红外照射下暴露于MSCi@MN的大肠杆菌(E. coli)与金黄色葡萄球菌(S. aureus)的扫描电子显微镜(SEM)图像
(3)近红外触发MSCi@MN的NV-DNA释放增强体外免疫调节效应
Franz扩散池实验显示,无NIR照射时微针3 min仍部分完整,经808 nm、1.0 W·cm-2照射后3 s内迅速塌陷并同步释放NV(红色)与DNA(蓝色)荧光信号,45 min内辐照组累积释放量显著高于未辐照组,48 h两组均达≈95 %,且NV、DNA结构保持完整(图3a,b)。LPS/IFN-γ诱导的BMDM经NV-DNA处理24 h后,流式显示CD80+/CD86+ M1比例由58.3%降至29.3%,qRT-PCR示IL-1β、TNF-α、IL-6 mRNA分别下调2.45、2.73、2.30倍,Arg-1与IL-10上调2.2与1.3倍;ELISA证实上清IL-6减少3.41倍、IL-10增加1.41倍,免疫荧光显示CD80下降11.5倍、CD163升高7.3倍(图3c-g)。LPS诱导的BMDC经NV-DNA共处理后,CD80、CD86、CD40表达显著降低,呈现耐受性DC表型,提示NV-DNA通过双重免疫调节机制协同抑制炎症并促进组织修复(图3h)。
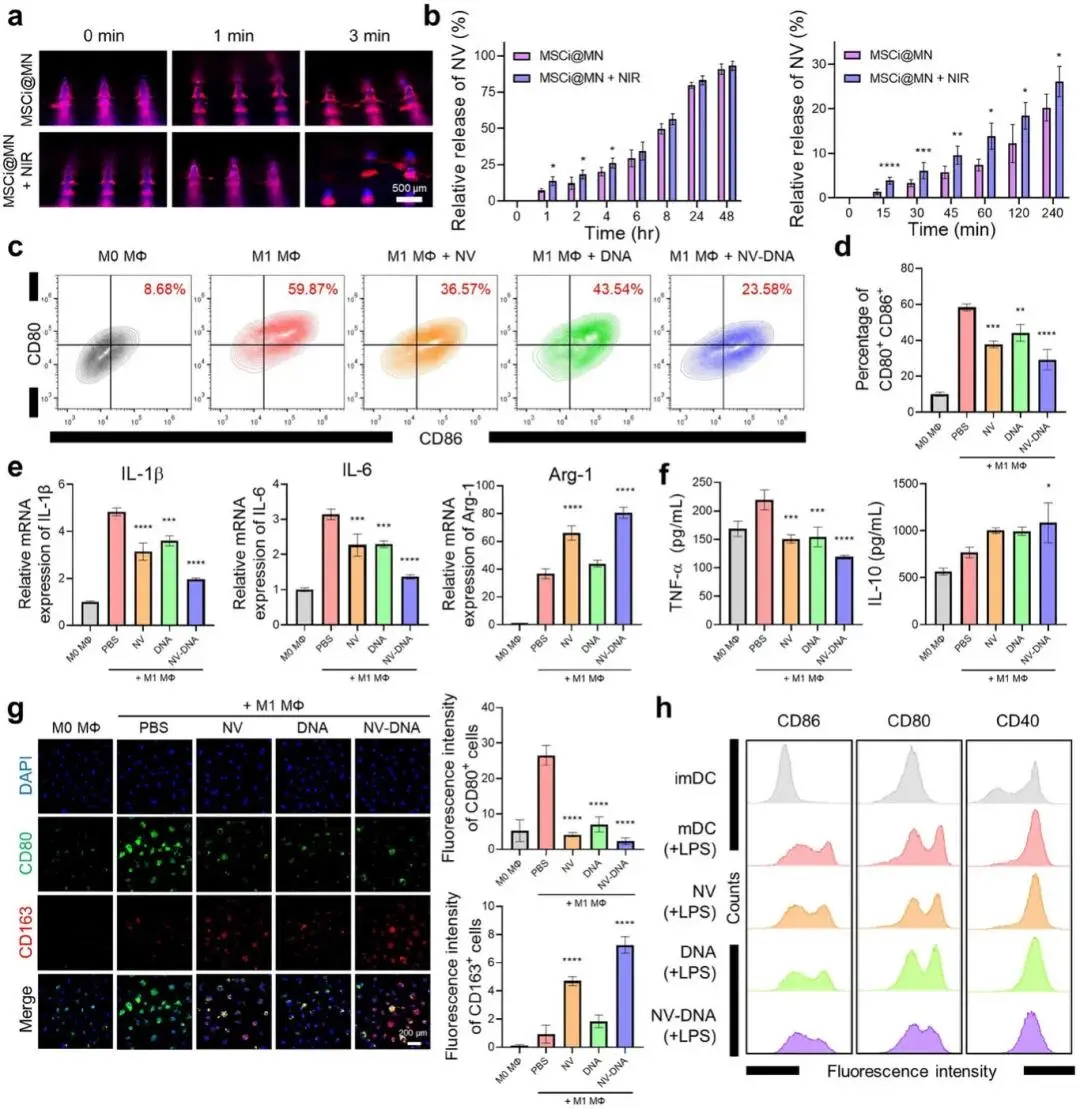
图3. 通过MSCi@MN的近红外响应性NV-DNA释放增强免疫调节。a)荧光图像显示近红外触发MSCi@MN释放DiD标记的NV(红色)和DAPI标记的DNA(蓝色);b)采用Franz扩散池法测定MSCi@MN在有无近红外照射下的NV累积释放行为;c)流式细胞术图显示在脂多糖(LPS)和γ干扰素(IFN-γ)存在下,经NV、DNA或NV-DNA处理后CD86⁺/CD80⁺骨髓来源巨噬细胞(BMDMs)的群体分布;d)各组BMDMs中CD86阳性细胞和CD80阳性细胞的百分比;e)NV、DNA或NV-DNA处理后促炎和抗炎标志物的实时定量聚合酶链反应(qRT-PCR)分析;f)BMDMs培养上清液中肿瘤坏死因子α(TNF-α)和白细胞介素10(IL-10)的酶联免疫吸附测定(ELISA)分析;g)NV、DNA或NV-DNA处理后促炎标志物(CD80,绿色)和抗炎标志物(CD163,红色)的免疫细胞化学分析;h)流式细胞术直方图显示经NV、DNA或NV-DNA处理后CD86⁺、CD80⁺或CD40⁺骨髓来源树突状细胞(BMDCs)的群体分布
(4)RNA测序(RNA-Seq)揭示NV和DNA的独特免疫调节机制及其协同效应
RNA-seq结果显示,NV与DNA未引起整体转录偏移,各自诱导选择性基因改变,NV主要上调抗炎、溶酶体功能及基质重塑相关通路,DNA则显著升高趋化、抗原呈递和白细胞激活相关基因。火山图显示DNA组CHRM4、Gucy2g、GPRC5D、VEGFD、FGFR2、XCR1、YAP1、TSNAXIP1表达上调,A2AR拮抗剂DMPX可逆转其促血管与抗炎效应,证实其作用依赖A2AR-cAMP-PKA/ERK轴并抑制Hippo通路(图4b-f)。NV组激活JAK-STAT3、PI3K-p38及钙-NFAT通路,相关基因CCR4、CXCL5、PDGFRA、ANGPTL4表达上调,提示其参与ECM重塑与免疫调控(图4f)。免疫相关GO聚类分析显示,NV-DNA联合组同时富集免疫调节、适应性免疫、细胞因子活性及创面愈合相关通路,蝴蝶图显示其差异表达基因数量显著高于单药处理,GO评分在免疫调控与抗原呈递通路中显著优于NV或DNA单独处理(图4g-k)。
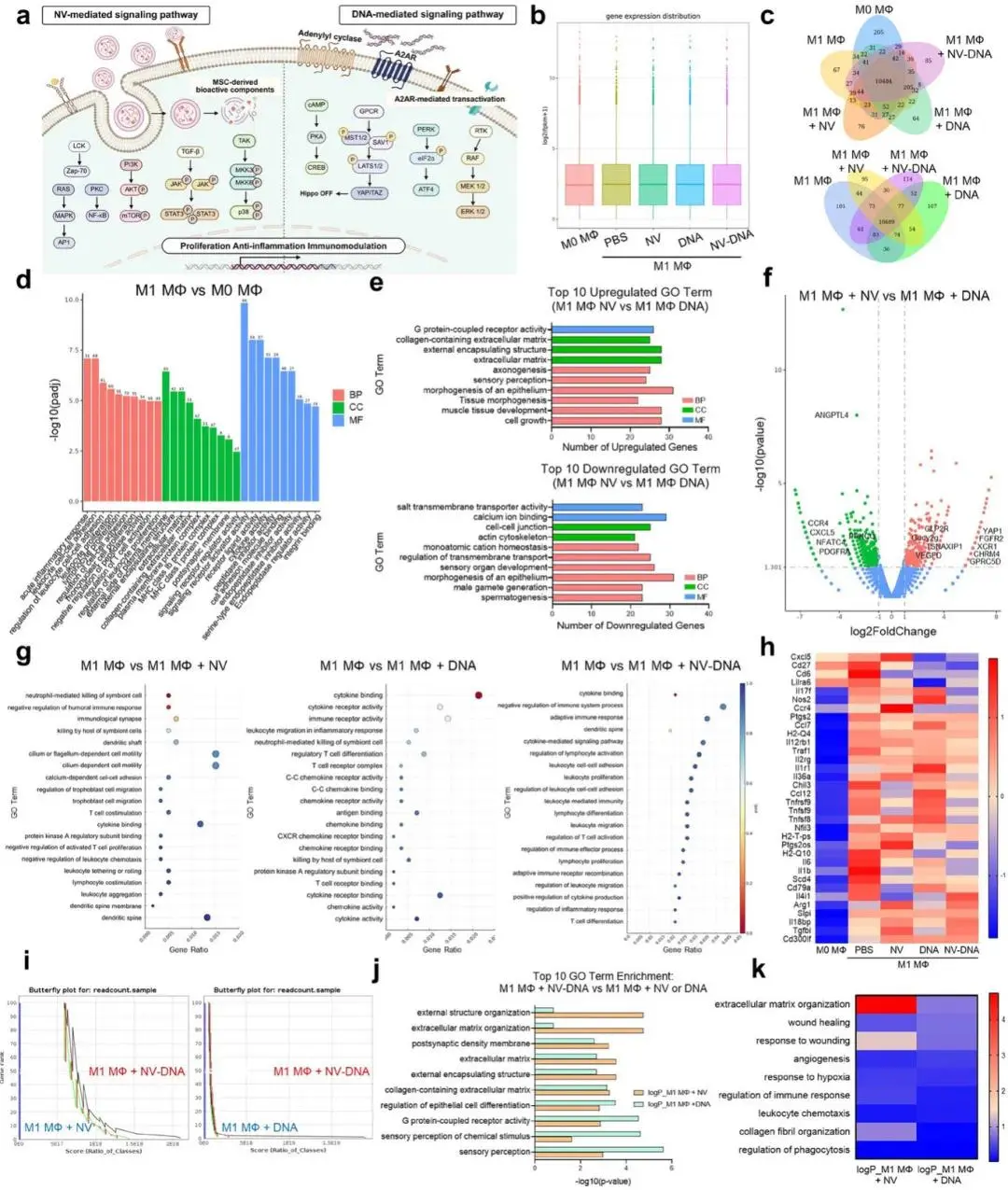
图4. RNA-Seq阐明NV和DNA的独特免疫调节机制及其协同效应;a)NV和DNA在骨髓来源巨噬细胞(BMDMs)中的信号通路示意图;b)箱线图显示基因表达的每百万映射读数中每千碱基转录本的片段数(FPKM)密度分布;c)NV、DNA或NV-DNA处理的巨噬细胞中差异表达基因(DEGs)的韦恩图;d)M0型与M1型巨噬细胞之间基因本体论(GO)生物学过程的条形图;e)前10个上调或下调的GO术语,分为生物学过程(BP)、细胞组分(CC)和分子功能(MF);f)火山图显示差异表达基因数据的统计显著性(校正p值)与表达变化幅度(log2倍变化)的关系;g)NV、DNA或NV-DNA中富集的免疫相关GO术语的点图;h)免疫相关基因中代表性差异表达基因的热图;i)M1型巨噬细胞+NV或DNA组与M1型巨噬细胞+NV-DNA组的基因集富集分析(GSEA)蝴蝶图;j)M1型巨噬细胞+NV-DNA组与M1型巨噬细胞+NV或DNA组中选取的GO术语的比较条形图;k)参与组织重塑、上皮黏附及免疫调节的代表性差异表达基因的热图
(5)近红外激活的MSCi@MN在糖尿病创面愈合中的协同免疫再生效果
糖尿病小鼠创面实验显示,MSCi@MN+NIR组第4天残存面积降至37.6 %,第8天仅9.9 %,第10天接近完全闭合(1.1 %),愈合速度约为DNA/MX@MN+NIR组的7.4倍;H&E与Masson染色示表皮-真皮结构接近正常,胶原沉积量最高,毛囊再生显著,血管密度明显增加(图5a-c)。免疫组化显示该组TGF-β与中性粒细胞标记MPO显著下调,VEGF、CD31上调,提示炎症抑制与新生血管形成;免疫荧光示iNOS降低2.35倍,Arg-1升高3.45倍,CD80⁺/CD11c⁺与CD86⁺/CD11c⁺分别下降2.57与2.15倍,表明M2极化增强且树突细胞趋于耐受表型(图5d-e)。综合指标热图证实MSCi@MN+NIR在再生与免疫调控各参数均最优(图5f)。
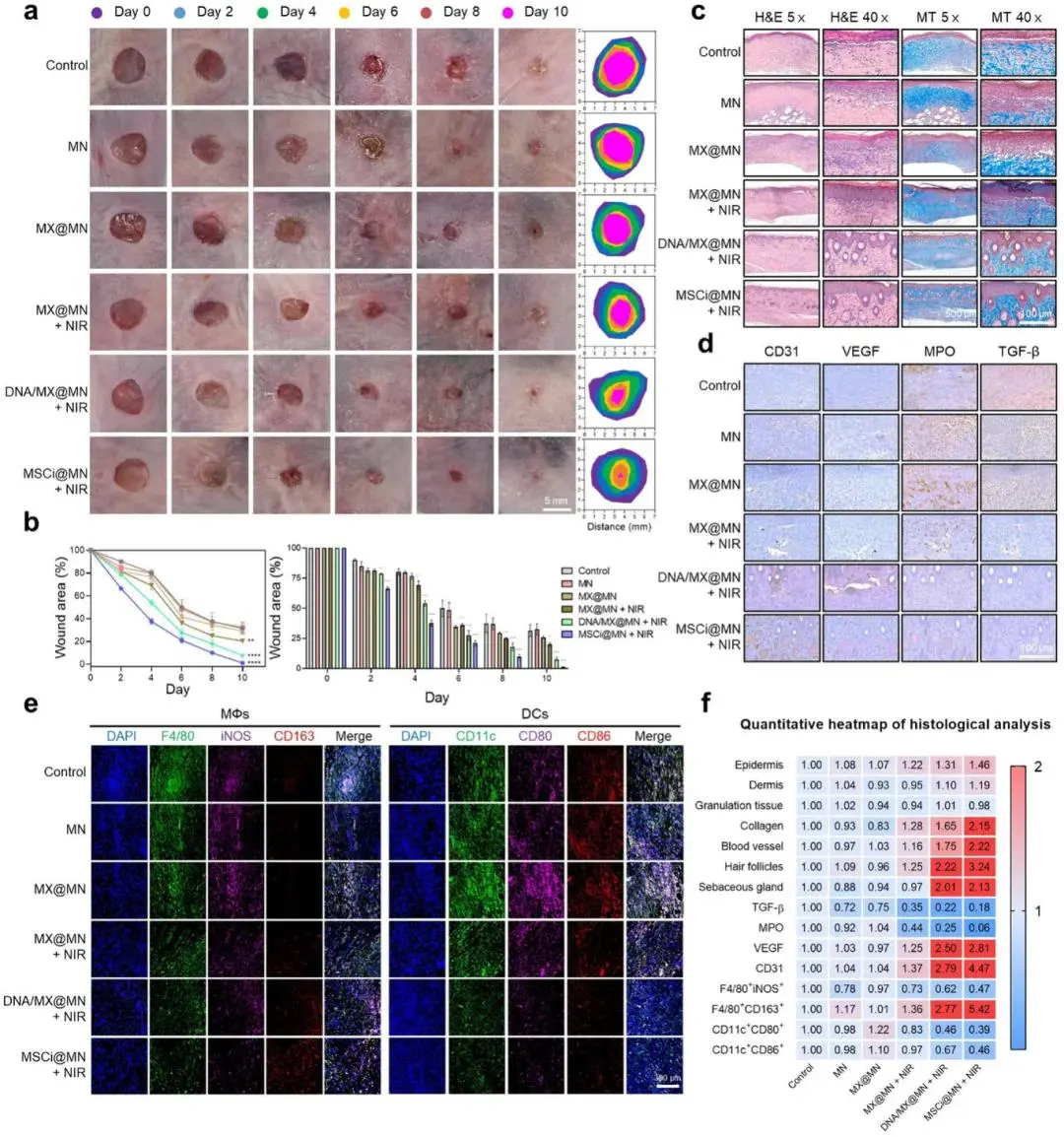
图5. MSCi@MN在糖尿病创面愈合中的协同免疫再生效果。a)糖尿病小鼠经不同MN制剂处理后,直至第10天的创面愈合过程代表性图像;b)创面闭合率随时间变化的定量分析;c)第10天创面组织的苏木精-伊红染色(H&E)和Masson三色染色(MT)组织学图像;d)第10天创面组织中CD31、VEGF、MPO和TGF-β的免疫组织化学(IHC)图像;e)第10天创面区域的免疫荧光(IF)图像:左侧为使用抗F4/80、iNOS和CD163抗体分析巨噬细胞活化;右侧为使用抗CD11c、CD80和CD86抗体分析树突状细胞活化;f)来源于H&E、MT、IHC和IF染色分析的创面组织标志物定量热图
本研究构建的MSCi@MN贴片凭借尖端NV-DNA与基部MX的双区架构,在808 nm、1.0 W·cm-2 NIR照射下于糖尿病小鼠创面实现:①第4天残存面积降至37.6 %,第10天仅1.1 %,愈合速度约为单药组的7.4倍;②H&E与Masson显示表皮-真皮结构接近正常,胶原沉积量最高,毛囊与血管密度显著恢复;③免疫组化TGF-β、MPO下调,VEGF、CD31上调,免疫荧光示iNOS降低2.35倍、Arg-1升高3.45倍,CD80+/CD11c+与CD86+/CD11c+分别下降2.57与2.15倍,证实M2极化增强及耐受性DC形成;④RNA-seq显示NV激活JAK-STAT3/PI3K-ECM轴,DNA经A2AR-cAMP-PKA/ERK轴抑制Hippo,联合组在免疫调控、抗原呈递与创面修复通路富集度显著高于单药,肝肾功能指标(ALT、AST、ALP、BUN、肌酐)及心、肝、脾、肺、肾组织学无异常,验证系统安全性。该平台整合光控释药、免疫微环境重塑、血管新生与组织结构重建,兼具药物-器械组合属性,后续需完成灭菌验证与法规路径设计以推进临床转化。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

