
研究背景:
胶质母细胞瘤(GBM)是临床实践中最凶猛、致死率最高的原发性恶性脑肿瘤,其特征为弥漫性浸润、快速增殖和高度免疫抑制的肿瘤微环境。克服血脑屏障(BBB)以有效递送化疗药物同时最小化全身毒性,仍然是胶质母细胞瘤(GBM)治疗中的一个重大挑战。

针对上述问题,南通大学施金龙联合复旦大学黄容琴、东华大学王义团队,构建了一种共载熊果酸(UA)和阿霉素(DOX)的IL-6受体靶向脂质体(DU@L-I),通过表面修饰I6P8肽实现BBB穿透和胶质瘤靶向富集。该纳米系统增强DOX与UA的协同抗肿瘤作用,抑制IL-6介导的肿瘤增殖,并通过下调NOX4表达、促进NO释放减轻DOX诱导的心脏毒性。该文章于2025年7月10日以《Interleukin-6-taregeted dual-drug nanoparticles enhance glioblastoma chemotherapy by facilitating blood-brain barrier penetration and alleviating cardiotoxicity》为题发表于《Chemical Engineering Journal》(DOI:10.1016/j.cej.2025.165895)。
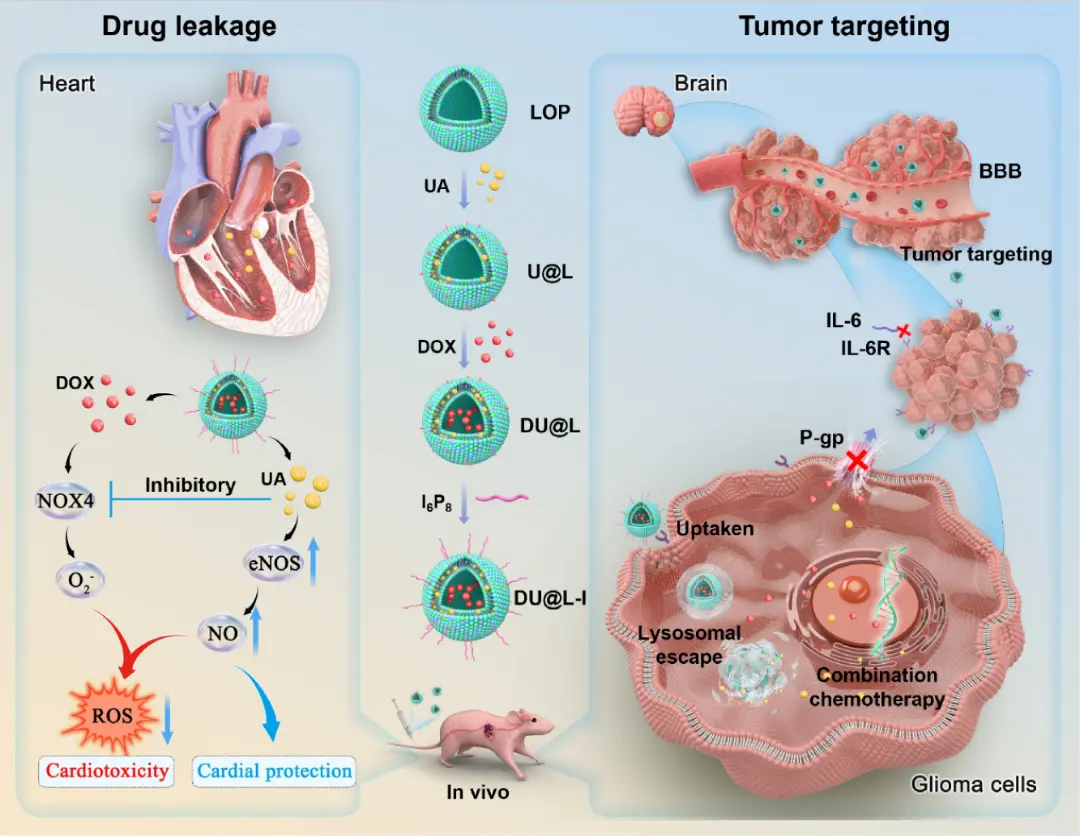
图1.DU@L-I的合成过程示意图及其杀伤胶质母细胞瘤和减轻心脏毒性的机制
(1)DU@L-I的制备、表征和性质
DU@L-I通过薄膜水化-(NH₄)₂SO₄梯度-巯基-马来酰亚胺点击化学三步构建(Scheme S1)。TEM/SEM示均匀球形(图1a);EDX硫信号增强验证I6P8偶联(图1b)。DLS测得粒径90.1 nm、ζ电位−6.4 mV(图1c,d)。UV-Vis在202 nm确认UA负载,特征峰同步出现于最终制剂(图1e);DOX负载亦获证实(图1f)。pH 5.0下24 h释放达平台,pH 7.4延缓释放(图1g);37℃稳定36 h,4℃更长(图1h)。
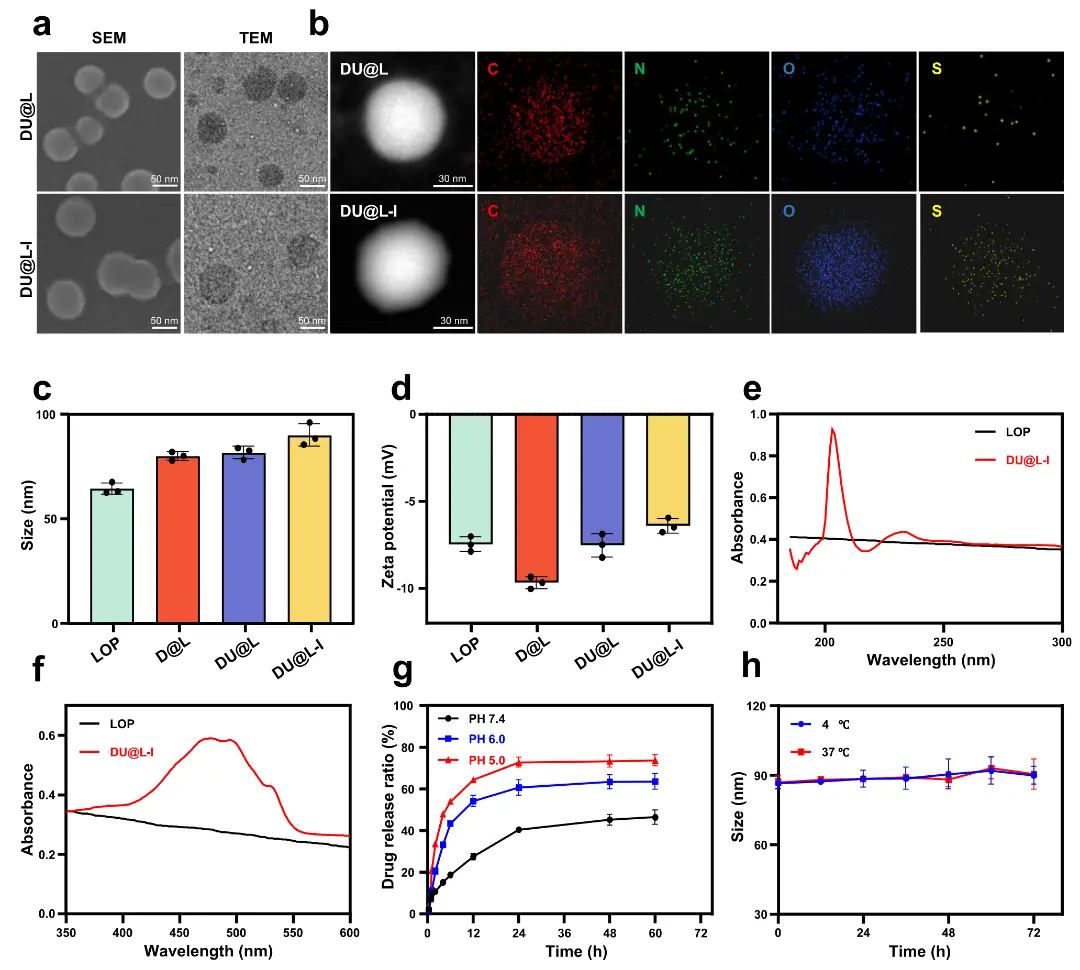
图2.DU@L-I表征。(a)DU@L-I的SEM与TEM图像;(b)DU@L与DU@L-I的C、N、O、S元素EDX分布;(c)各组水合粒径;(d)各组Zeta电位;(e,f)UA与DOX负载后的吸光度变化;(g)不同pH下DOX释放曲线;(h)37℃与4℃储存稳定性
(2)体外细胞摄取、内体逃逸和血脑屏障穿透能力
在Transwell BBB模型中,DU@L-I组下室U87细胞的DOX荧光最强,提示其穿透能力优于其他制剂(图2a–c)。内吞抑制实验表明,阿米洛利、染料木素和MβCD显著降低DOX摄取,提示巨胞饮、小窝和脂筏途径参与(图2d–e)。与正常星形胶质细胞相比,DU@L-I在U87细胞中摄取显著增加,且可被游离I6P8阻断(图2f–h)。3D肿瘤球实验中,DU@L-I渗透深度和荧光强度均优于DU@L(图2i)。共聚焦成像显示DU@L-I可实现溶酶体逃逸并将DOX递送至细胞核(图2j–k)。
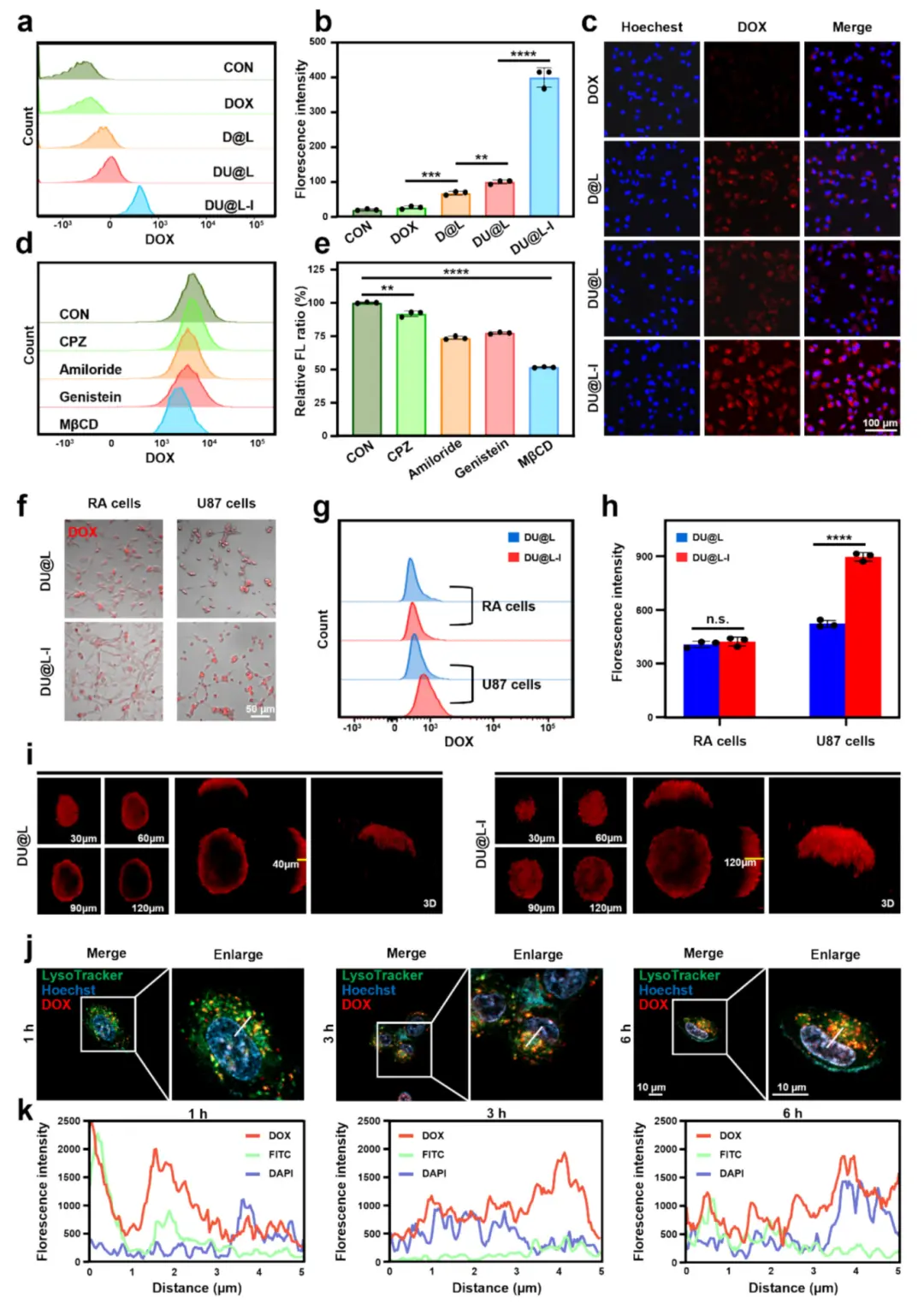
图3.DU@L-I体外摄取、溶酶体逃逸与BBB穿透。(a)跨BBB流式定量;(b)U87细胞平均荧光强度(n=3);(c)跨BBB后U87摄取(标尺100μm);(d)内吞抑制剂预处理后的相对内化;(e)定量分析(n=3);(f)U87与RA细胞共聚焦(DOX红色,标尺50μm);(g,h)流式及定量(n=3);(i)3D肿瘤球穿透(30μm层扫、正交与3D重建);(j)溶酶体-细胞核共定位(标尺10μm);(k)轴向强度线扫
(3)DU@L-I的体外抗肿瘤作用DU@L-I
为确认DOX和UA是否表现出加合或协同作用,将U87细胞用不同浓度的DOX、UA和DOX+UA处理24小时,并测定细胞抑制率。结果表明,DOX和UA在U87细胞中表现出协同作用(CI<0.9)。为确认DOX和UA是否表现出加合或协同作用,将U87细胞用不同浓度的DOX、UA和DOX+UA处理24小时,并测定细胞抑制率。结果表明,DOX和UA在U87细胞中表现出协同作用(CI<0.9)。肿瘤微环境中内源性白介素-6(IL-6)的存在已被确立为肿瘤细胞增殖的关键驱动因素。从机制上讲,I 6 P 8肽通过与IL-6R特异性结合来拮抗IL-6信号传导。基于这种靶向抑制机制,我们假设LOP-I(脂质体-I6P8)会抑制肿瘤生长,并通过纵向监测胶质瘤肿瘤球体积来量化这一效果。研究结果表明,在IL-6给药条件下,胶质瘤样球体生长加速,而使用I 6 P 8和LOP-I显著抑制了这种增殖(图3f–g)。这些发现不仅证实了脂质体制剂中I6P8生物活性的保留,还展示了通过联合递送增强的治疗效果。
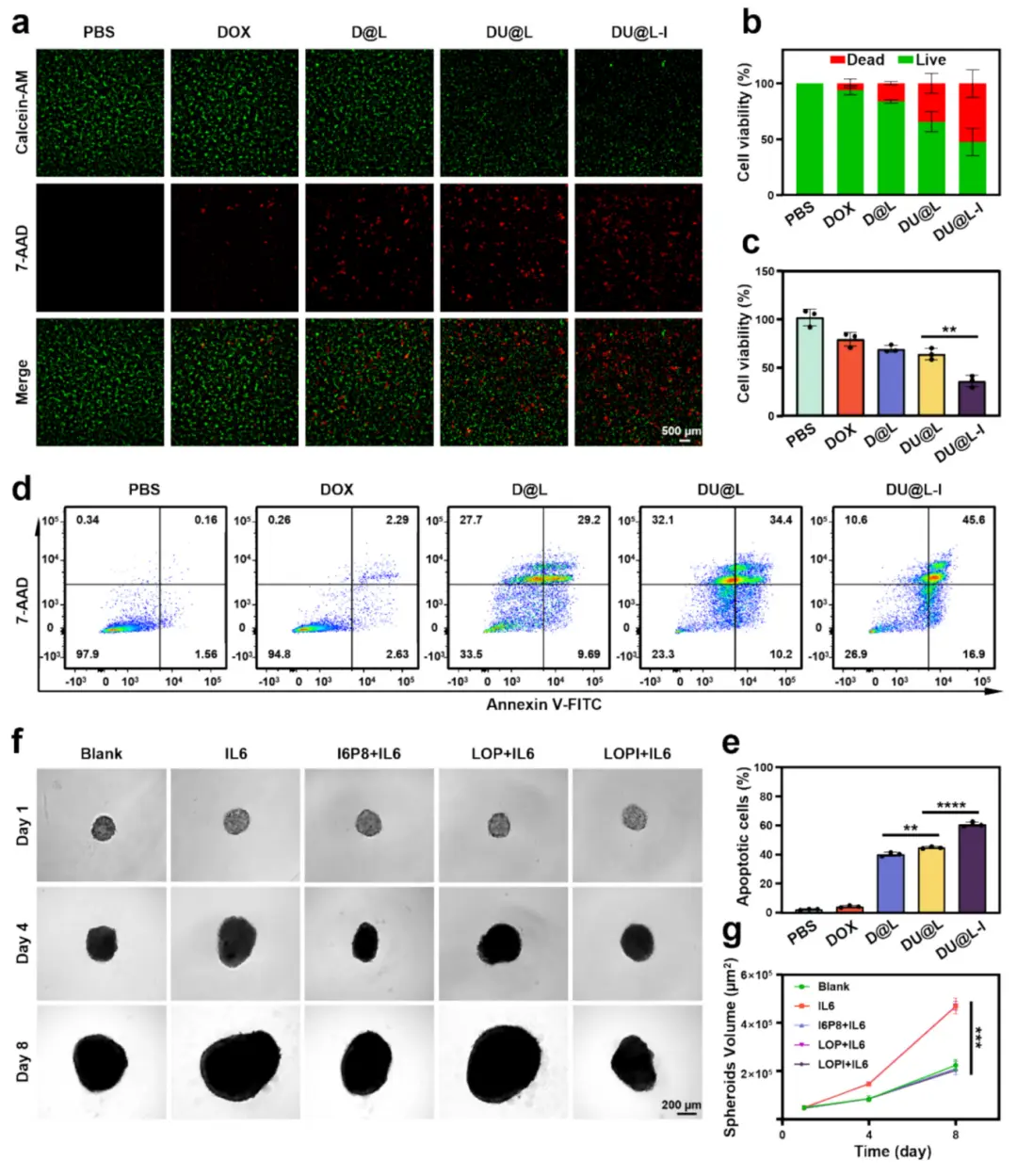
图4.DU@L-I体外毒性。(a)活/死染色(绿/红,标尺500μm);(b)活力定量(n=3);(c)CCK-8测细胞活力(n=3);(d)凋亡水平;(e)凋亡定量(n=3);(f)胶质瘤球形态(标尺200μm);(g)球体积统计(n=3)
(4)DU@L-I的体内分布和抗肿瘤效果
通过尾静脉注射将纳米颗粒注入胶质瘤小鼠体内,并使用IVIS观察纳米颗粒在体内的分布(图4a)。实时IVIS成像显示,各组纳米颗粒最初主要在腹腔器官(肝脏/脾脏)积累。值得注意的是,注射后4小时,DU@L-I-DIR表现出逐步的BBB穿透。8小时时的离体器官成像显示,DU@L-I-DIR持续靶向胶质瘤并保持滞留,脑部荧光强度比DU@L-DIR高4.29倍(图4b–d)。这些结果证实,I6P8肽修饰赋予双重功能:增强BBB穿透和主动靶向胶质瘤。正位胶质瘤模型的建立随后通过IVIS进行了验证。将小鼠随机分为六组进行体内治疗实验:PBS(对照组)、DOX、D@L、DU@L和DU@L-I。通过尾静脉于肿瘤植入后第6、9、12和15天给予制剂(5 mg/kg DOX当量)进行静脉注射,随后通过纵向IVIS成像评估纳米粒子的治疗效果。纵向IVIS成像显示PBS组和游离DOX组肿瘤快速进展,而D@L组和DU@L组表现出中等程度的生长抑制。值得注意的是,DU@L-I治疗在第18天实现了83.8%的肿瘤抑制率(图4e-g)。通过Kaplan-Meier曲线的生存分析显示,DU@L-I显著延长了GBM荷瘤小鼠的中位生存期至29天——比PBS对照组(18天)长2.2倍,并超过其他治疗组(游离DOX:19天,D@L:22天,DU@L:24天;图4h)。体重动态变化进一步支持了治疗安全性,接受DU@L-I治疗的小鼠维持了稳定的体重(图4i)。这种稳定性与有效的肿瘤抑制相关,与晚期胶质瘤进展通常相关的恶病质现象相反。为验证组织学层面的治疗效果,在治疗第18天对接种GBM的小鼠进行安乐死,并进行组织病理学分析。代表性H&E染色脑切片显示,DU@L-I治疗的小鼠肿瘤残留量极少(图4j),与纵向生物发光数据(图4e–g)相吻合。通过TUNEL染色进行定量凋亡评估,发现DU@L-I肿瘤中的凋亡细胞密度高于DU@L(图4k)。Ki67的免疫组化分析进一步证实了增殖受到显著抑制(图4l)。这些综合的组织病理学发现系统地验证了DU@L-I在原位Luc-U87胶质瘤模型中的优越治疗效果。
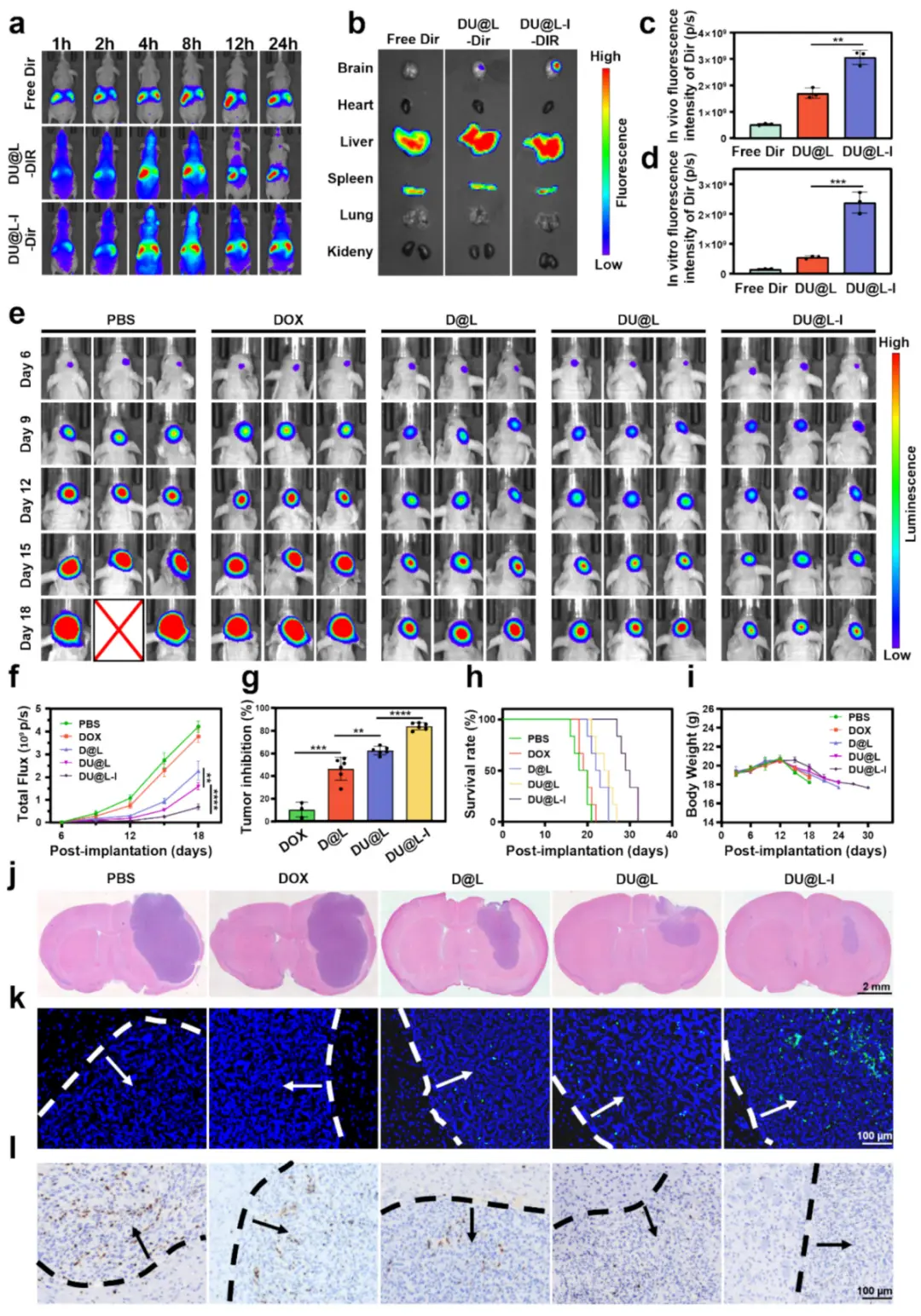
图5.DU@L-I原位Luc-U87胶质瘤靶向与疗效。(a)尾静脉注射DIR制剂后活体荧光成像;(b)8 h脑靶向生物发光与DIR荧光(n=6);(c)活体DIR强度;(d)离体脑DIR强度;(e)治疗期间生物发光成像;(f)肿瘤发光定量(n=6);(g)平均抑瘤率;(h)Kaplan–Meier生存曲线(n=6);(i)体重监测;(j)脑切片H&E(标尺2 mm);(k)TUNEL凋亡(绿,标尺100μm);(l)Ki67增殖(标尺100μm)
(5)心脏保护作用
为系统评估DU@L-I对DOX诱导的毒性的心脏保护作用,进行了经胸超声心动图以评估心脏功能(图5a)。在游离DOX处理的小鼠中,LVEF和LVFS严重受损,而DU@L-I使心脏功能保持在接近正常水平(图5b–c)。此外,还测量了乳酸脱氢酶(LDH)和肌酸激酶(CK)的血浆水平,这些是心肌损伤的指标(图5d–e)。在游离DOX组中,LDH和CK水平分别比基线升高了1.3倍和1.4倍,而DU@L-I组没有观察到显著变化。组织病理学分析进一步证实了游离DOX组的明显心脏毒性,其特征为炎症细胞浸润(H&E)和广泛的间质纤维化,而DU@L-I保持了近乎完整的心肌结构(图5f–g)。这些综合结果明确表明,DU@L-I可以减轻DOX诱导的心脏毒性。当讨论减少DOX引起的心脏毒性时,必须提到地舒拉明(DEX)。DEX是FDA唯一批准用于此目的的药物。然而,研究表明DEX可能会影响DOX的抗肿瘤效果,加剧骨髓抑制,并导致长期使用产生继发性恶性肿瘤。然而,与DEX相比,UA在减少DOX诱导的心脏毒性的同时,还能与DOX协同治疗胶质瘤。UA和DOX的组合减轻了DOX诱导的心脏毒性,这可能是通过UA抑制eNOS解偶来介导的。为了阐明UA的心脏保护机制,我们增加了DOX剂量以增强毒性,并建立了四个实验组:PBS、UA、DOX和DOX+UA。此外,从心脏中提取的蛋白质进行了Western blot分析,结果显示,与对照组相比,加入UA有助于增加p-eNOS表达,降低eNOS单体/二聚体比例和NOX4水平(图5h–l)。从机制上讲,DOX通过上调NOX4诱导eNOS解偶联,将NO合成转化为ROS产生。UA通过增强eNOS磷酸化、恢复eNOS二聚体稳定性并抑制NOX4衍生的超氧阴离子产生来对抗这一病理级联反应。这种调节通过提高心脏保护性NO的生物利用度并减轻氧化应激,重新平衡NO/ROS稳态,最终保护心脏功能。
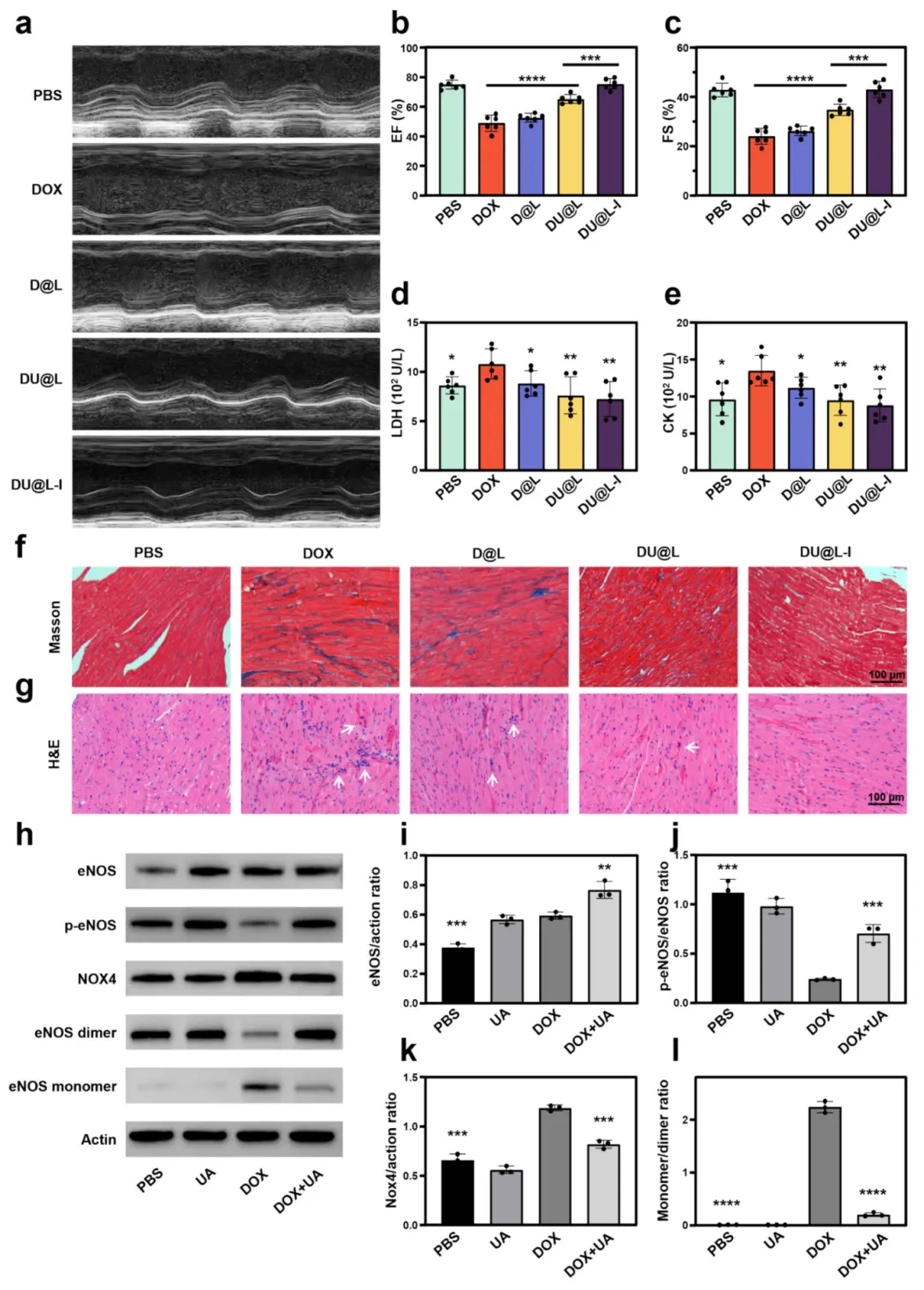
图6.化疗心脏毒性减轻。(a)代表性超声心动图;(b,c)LVEF、LVFS定量(n=6);(d,e)血浆LDH、CK水平(n=6);(f)Masson三色染色示纤维化(标尺100μm);(g)H&E示炎症浸润(标尺100μm);(h–l)Western blot检测eNOS、p-eNOS、NOX4及eNOS单体/二聚体表达
(6)DU@L-I的生物安全性
为了评估纳米粒子的整体生物安全性,通过组织切片和血液生化检测进行安全性评价。在治疗组中,GBM荷瘤小鼠的主要器官(肝脏、脾脏、肺部和肾脏)的H&E染色切片未观察到明显的组织或结构损伤(图6a)。相关血液生化检测结果,包括ALT(图6b)、AST(图6c)、ALB(图6d)、TBIL(图6e)、BUN(图6f)和CREA(图6g)均在正常范围内,组间无显著差异。结果表明肝肾功能方面无显著影响。因此,可以得出结论,DU@L-I具有优良的生物医学应用安全性。
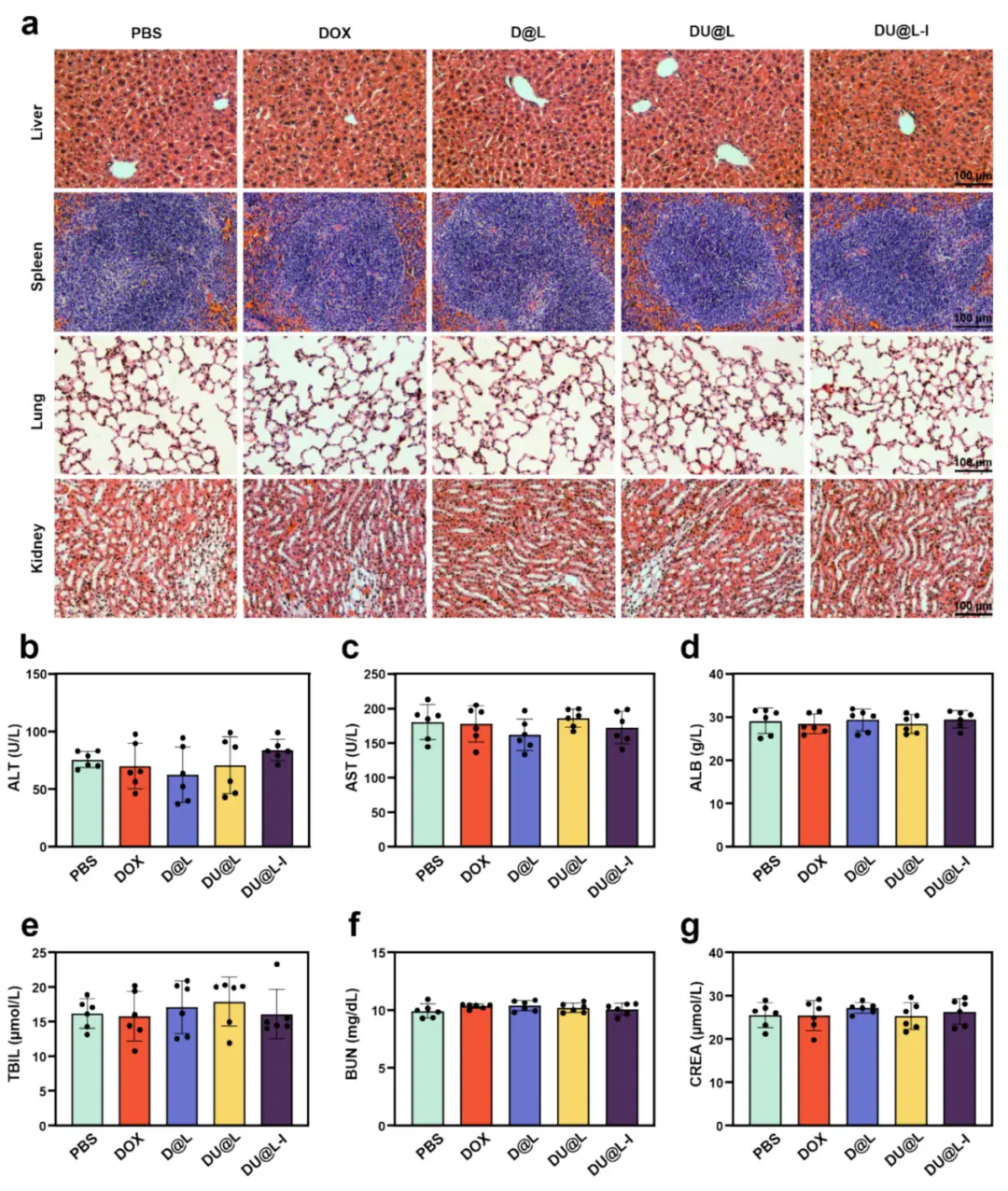
图7.DU@L-I生物安全性。(a)主要器官H&E染色(标尺100μm);(b–g)血清ALT、AST、ALB、TBIL、BUN、CREA水平(n=6)
本研究构建的DU@L-I共递送DOX与UA,借助I6P8肽实现跨血脑屏障并富集于胶质瘤;UA既协同增敏化疗,又通过抑制IL-6/NOX4轴阻断肿瘤增殖并保护心肌,显著延长原位GBM小鼠生存期且毒副作用低。研究证实“靶向+联合+减毒”一体化纳米策略具备临床转化前景,但需解决规模化生产、大动物验证与法规审批等瓶颈。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

