
口腔溃疡(Oral Ulcer, OU)是最常见的口腔黏膜疾病之一,患病率高达5–20%,常伴随剧烈疼痛,严重影响患者的咀嚼、进食和言语功能。当前临床治疗主要依赖局部药物,但往往效果有限,且易产生不良反应。溃疡愈合受阻主要源于两大难题:持续的过度炎症反应和局部血管生成不足。虽然间充质干细胞(MSCs)疗法展现出良好的再生潜力,但其临床应用仍面临细胞存活率低、免疫排斥和分化不可控等挑战。此外,口腔内潮湿且高度动态的环境也使传统生物药物容易被唾液稀释和降解,导致生物利用度降低。

针对上述问题,温州医科大学罗丽华、王周光、徐俊鹏和蔡晓军团队提出了一种创新的无细胞治疗策略:他们将人脱落乳牙干细胞(SHEDs)裂解物(CL) 封装于纤维蛋白原/凝血酶(FT)水凝胶中,构建出具有抗炎与促血管生成双重功能的FT/CL智能水凝胶系统。该文章于2025年07月28日以《A cell-free SHED lysate-hydrogel system for oral ulcer healing with anti-inflammatory and pro-angiogenic effects》为题发表于《Journal of Nanobiotechnology》(DOI: 10.1186/s12951-025-03597-3)。
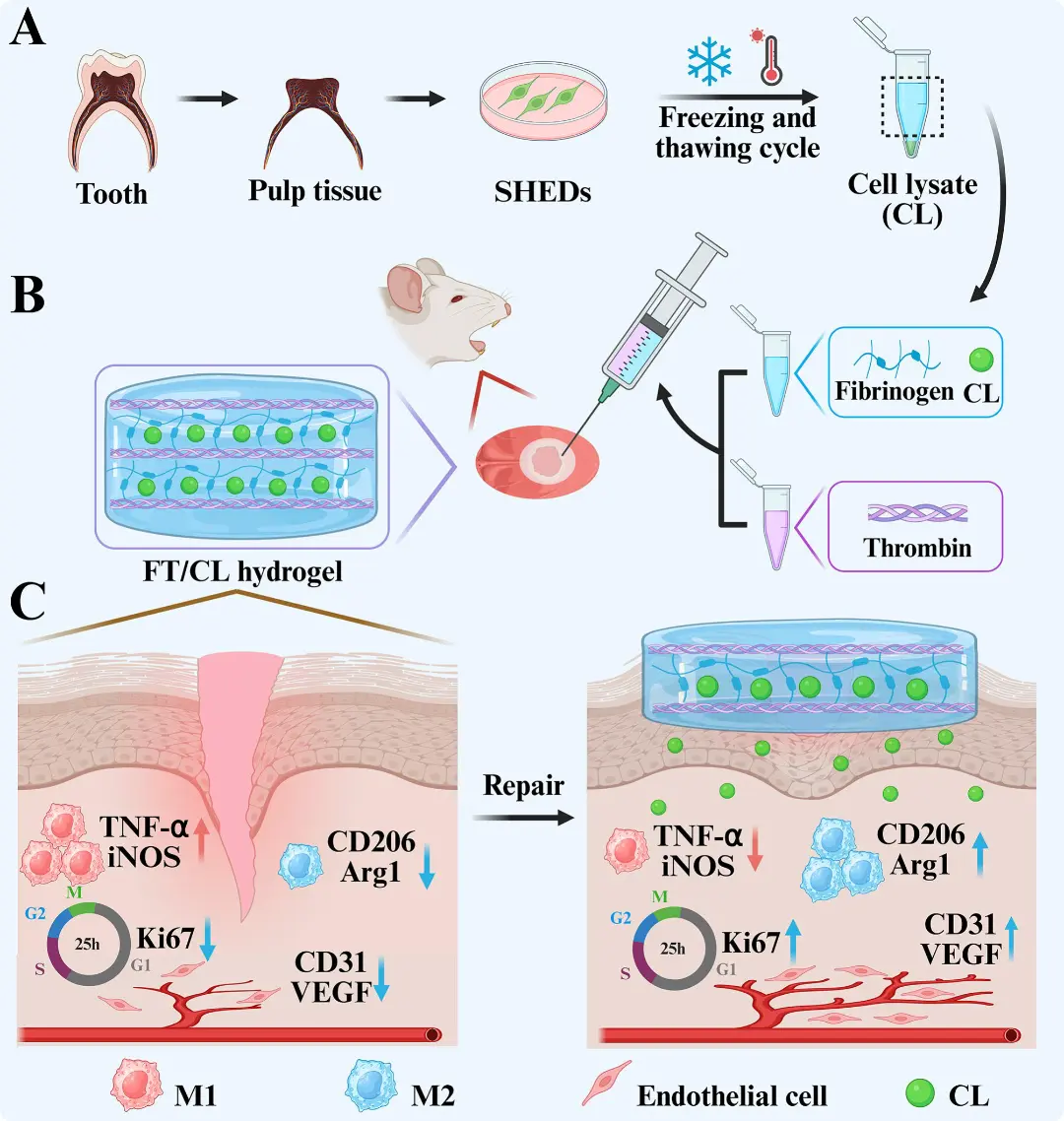
图1 研究示意图
(1)SHEDs和CL的成功培养与表征
成功从人脱落乳牙牙髓中分离出SHEDs,细胞表现出典型的MSC特性:免疫荧光染色CD146和Stro-1呈阳性;图2A-C: 显示原代SHEDs生长良好,表达MSC标志物(CD146/Stro-1),并具有成骨、成脂、成软骨分化能力。具备成骨、成脂、成软骨的多向分化潜能;通过反复冻融法成功制备SHEDs来源的CL;考马斯亮蓝染色证实CL的蛋白质谱与原始SHEDs高度相似。图2D: 考马斯亮蓝染色证明CL的蛋白成分与原始SHEDs相似。CCK-8和活/死细胞染色表明CL无细胞毒性,且最佳浓度(150 μg/mL)能促进人脐静脉内皮细胞(HUVECs)的增殖。图2E-G: CCK-8和活/死染色表明CL无细胞毒性,且150 μg/mL浓度能最佳促进HUVECs增殖。
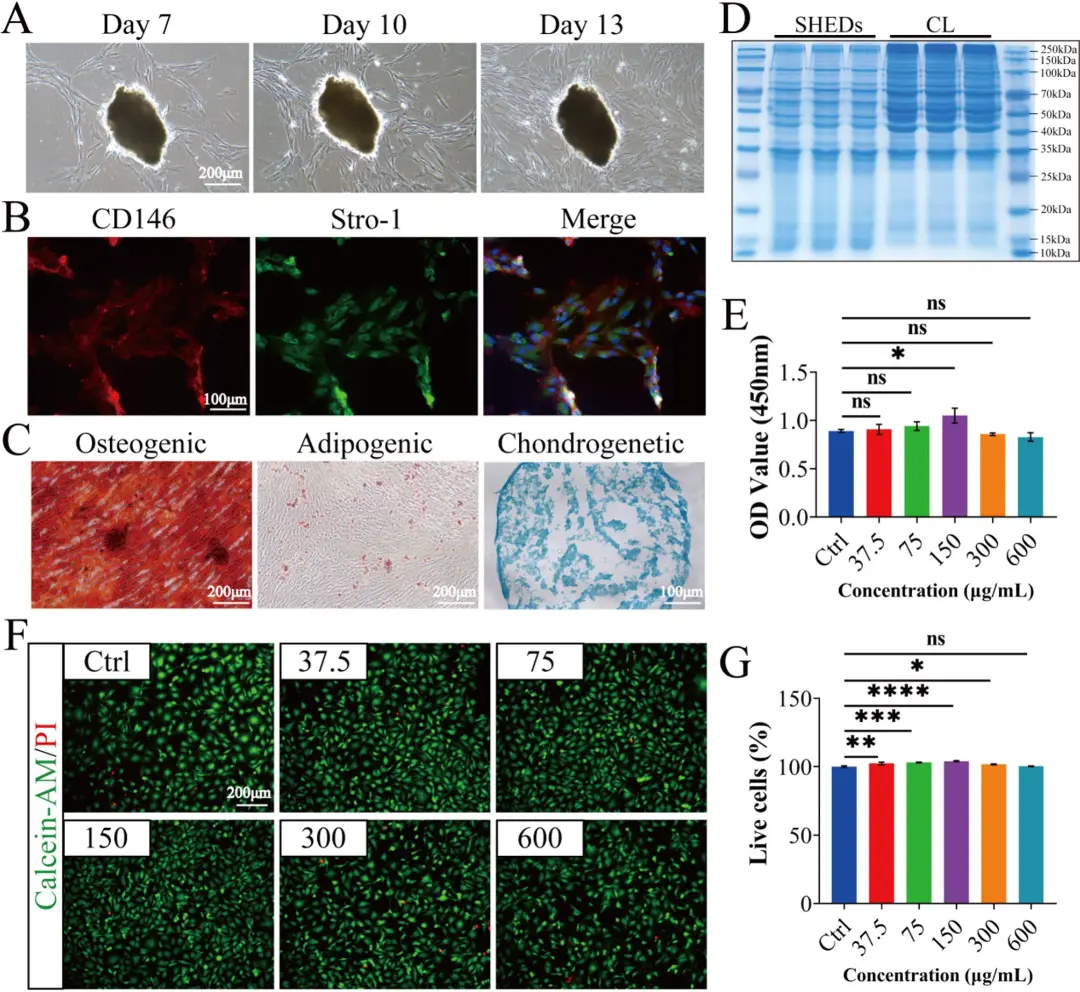
图2 SHED和CL的培养和表征。A SHED的原代培养。B MSC标记CD146和Stro-1的免疫荧光染色。C SHED的成骨、成脂和软骨发育分化。D相同数量细胞的SHED和CL考马斯蓝染色。E不同CL剂量下HUVECs细胞增殖情况F钙黄素-AM(绿色)和PI(红色)染色不同CL浓度下HUVECs G各组平均活细胞数F在所有实验中,n=3个生物重复的数据均以平均值±SD表示。*p<0.05,**p<0.01,***p<0.001,****p<0.0001
(2)FT/CL水凝胶的优化与性能表征
SEM图像显示图3A:水凝胶具有均匀多孔结构。图3B-C: 降解和释放曲线表明FT (1:1.5) 水凝胶能持续降解并控制CL释放超过60小时。图3D-F: 活/死染色和CCK-8证明水凝胶生物相容性好,且FT (1:1.5) 促进细胞增殖效果最佳。通过筛选不同纤维蛋白原与凝血酶比例,确定FT (1:1.5) 为最佳配方,兼具良好的凝胶时间、降解速率和生物相容性。该水凝胶具备:均匀的多孔三维结构。图3G-H: 水凝胶表现出良好的可注射性,且FITC标记显示其能在口腔溃疡面稳定粘附超过24小时。可控的CL释放能力(36小时释放超过60%),展示出优异的可注射性和强大的组织粘附性。
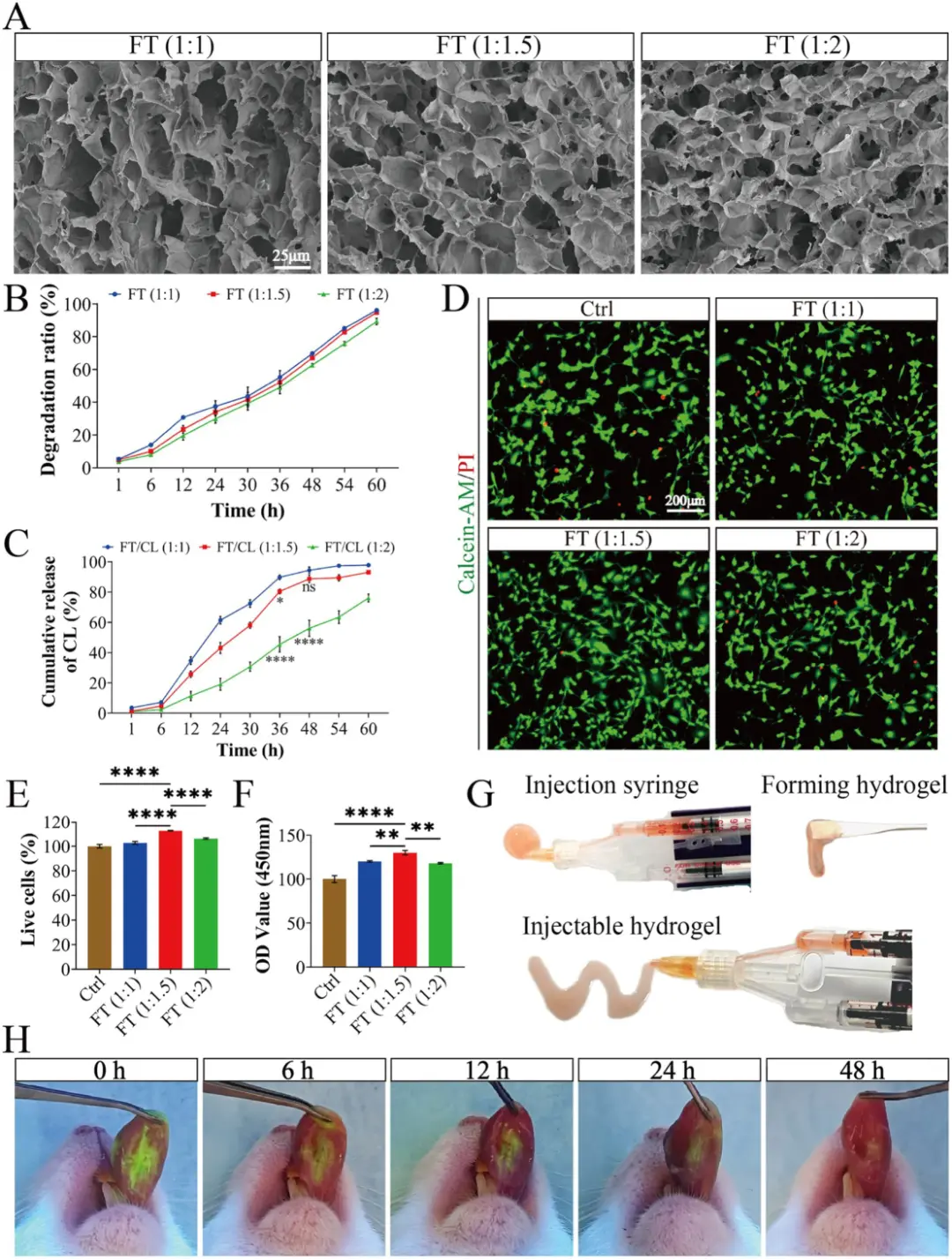
图3 FT水凝胶的表征。A FT水凝胶的SEM图像。B FT水凝胶在PBS中孵育的降解曲线。C 不同比例水凝胶中CL的累积释放。D 与FT水凝胶共培养的HUVECs的钙黄绿素-AM/PI染色图像和(E)通过Image J的定量。F 与FT水凝胶共培养的HUVECs的OD值。G FT水凝胶的可注射性和宏观凝胶化。H 通过监测荧光染料评估异硫氰酸荧光素(FITC)标记的FT水凝胶的滞留性。在所有实验中,数据均以 n = 3 次生物学重复的平均值±SD表示:*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
(3)FT/CL水凝胶在体外展现出抗炎与促血管生成双重功效
抗炎作用:在与巨噬细胞共培养实验中,FT/CL水凝胶能:在LPS诱导的M1模型中,显著抑制促炎因子iNOS和TNF-α的表达。图4A-H: 免疫荧光染色及定量显示,FT/CL能显著抑制LPS诱导的M1标志物(iNOS, TNF-α),并促进IL-4诱导的M2标志物(CD206, Arg1)表达。在IL-4诱导的M2模型中,显著促进抗炎因子CD206和Arg1的表达。图4I-K: 血管形成实验表明,FT/CL处理组的管状网络更复杂,管腔长度和数量显著高于对照组。促血管生成作用:在血管形成实验中,与FT/CL水凝胶共培养的HUVECs:形成的管腔长度是对照组的2.5倍。形成的管状结构数量是对照组的3.7倍。
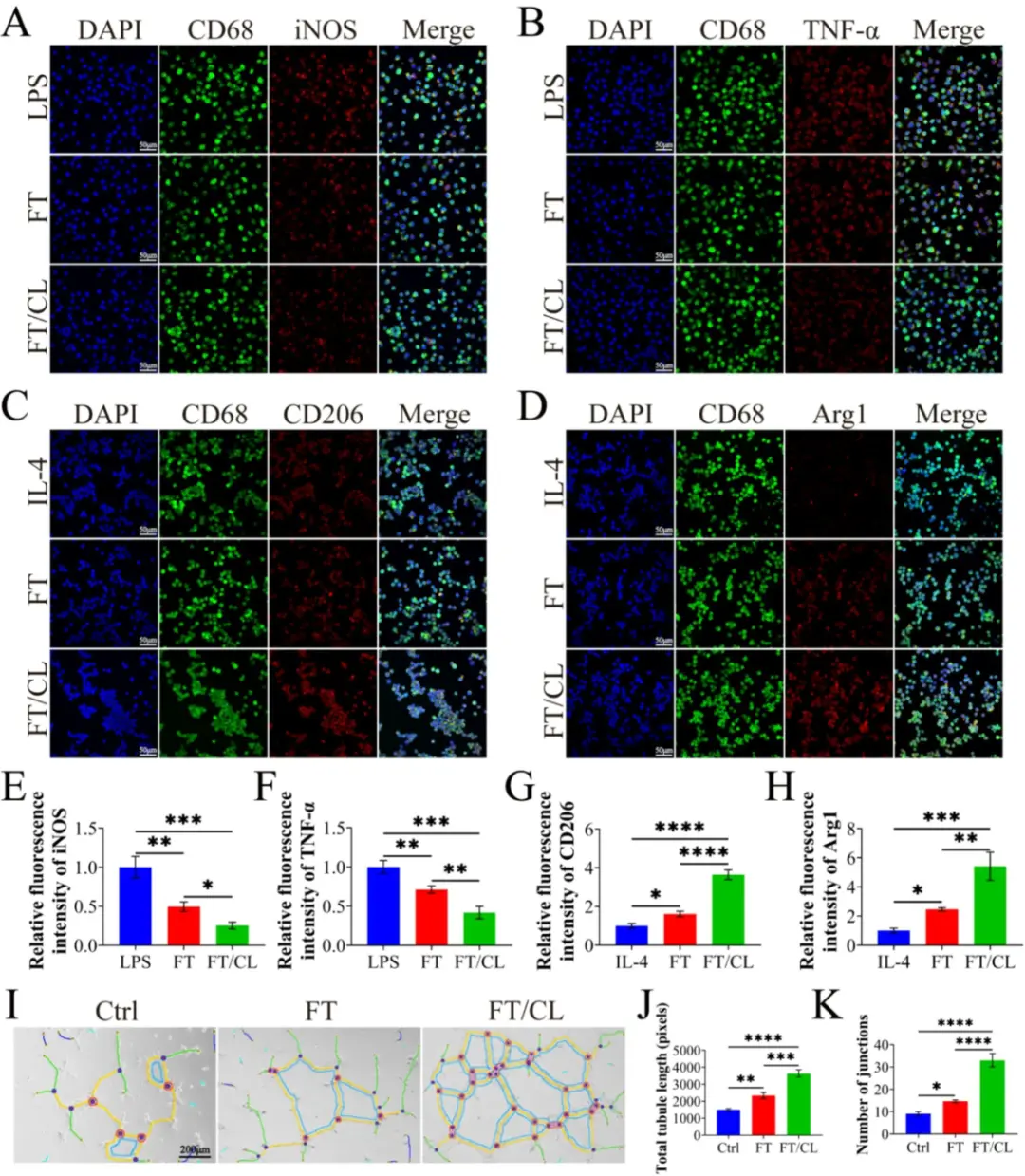
图4 FT/CL水凝胶在体外抑制炎症并促进血管生成。A iNOS, B TNF-α, C CD206 和 D Arg1(红色)以及CD68(绿色,巨噬细胞标志)在不同组中的免疫荧光染色。各组E iNOS, F TNF-α, G CD206 和 H Arg1 表达的统计分析。I 8小时后HUVECs的血管形成图像。J 描绘管长度的半定量分析。K 描绘管数量的半定量分析。在所有实验中,数据均以 n = 3 次生物学重复的平均值±SD表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
(4)FT/CL水凝胶在大鼠口腔溃疡模型中加速愈合
宏观愈合:FT/CL治疗组溃疡面积缩小最快,在第3、5、7天均保持最小。图5B: 系列舌部照片显示FT/CL组溃疡愈合最快,第5天上皮几乎完全恢复。行为学改善:显著减少由疼痛引起的面部擦拭和口腔摩擦行为。图5C-F: 行为学分析表明FT/CL组能显著减少疼痛引起的面部擦拭和口腔摩擦次数。 促进体重恢复,表明全身状况改善。临床评分:宏观评分显示FT/CL组临床严重程度最低,无出血或脓肿。图5G-H: FT/CL组体重恢复最快,宏观临床评分最低。

图5 FT/CL水凝胶治疗组在伤口愈合和酸诱发口腔溃疡(OU)的行为评估方面显示出更好的改善。A 显示伤口产生和随后的愈合阶段的说明图。B 7 天内舌头的代表性图像。白线表示舌头上的特定伤口。C 说明图和第 1、2、3 天 3 分钟时间内擦拭面部的次数。 D Ctrl 组和 FT/CL 组之间的比较。E 说明图以及第 1、2 和 3 天 3 分钟块期间的口腔摩擦次数 (F)。*,Ctrl 组和 FT/CL 组之间的比较。G 与酸刺激后第 0 天相比体重的变化。H 宏观评分评估 OU 的临床严重程度。在所有实验中,数据均以 n = 3 次生物学重复的平均值±SD 表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
(5)FT/CL水凝胶促进高质量的组织重塑
组织学显示:治疗第7天,FT/CL组表现出:最完整的再上皮化,上皮层更厚、结构更成熟。图6A-B: HE染色显示FT/CL组上皮最完整、血管最丰富(黑色箭头)。丰富的再生血管和成熟有序的胶原纤维沉积。图6C-D: Masson染色显示FT/CL组胶原排列有序且沉积量合理。细胞水平验证:Ki67阳性细胞数显著增加,表明细胞增殖活跃。TUNEL阳性细胞数显著减少,表明细胞凋亡被有效抑制。 图6E-H: Ki67和TUNEL染色表明FT/CL组细胞增殖最活跃,凋亡最少。
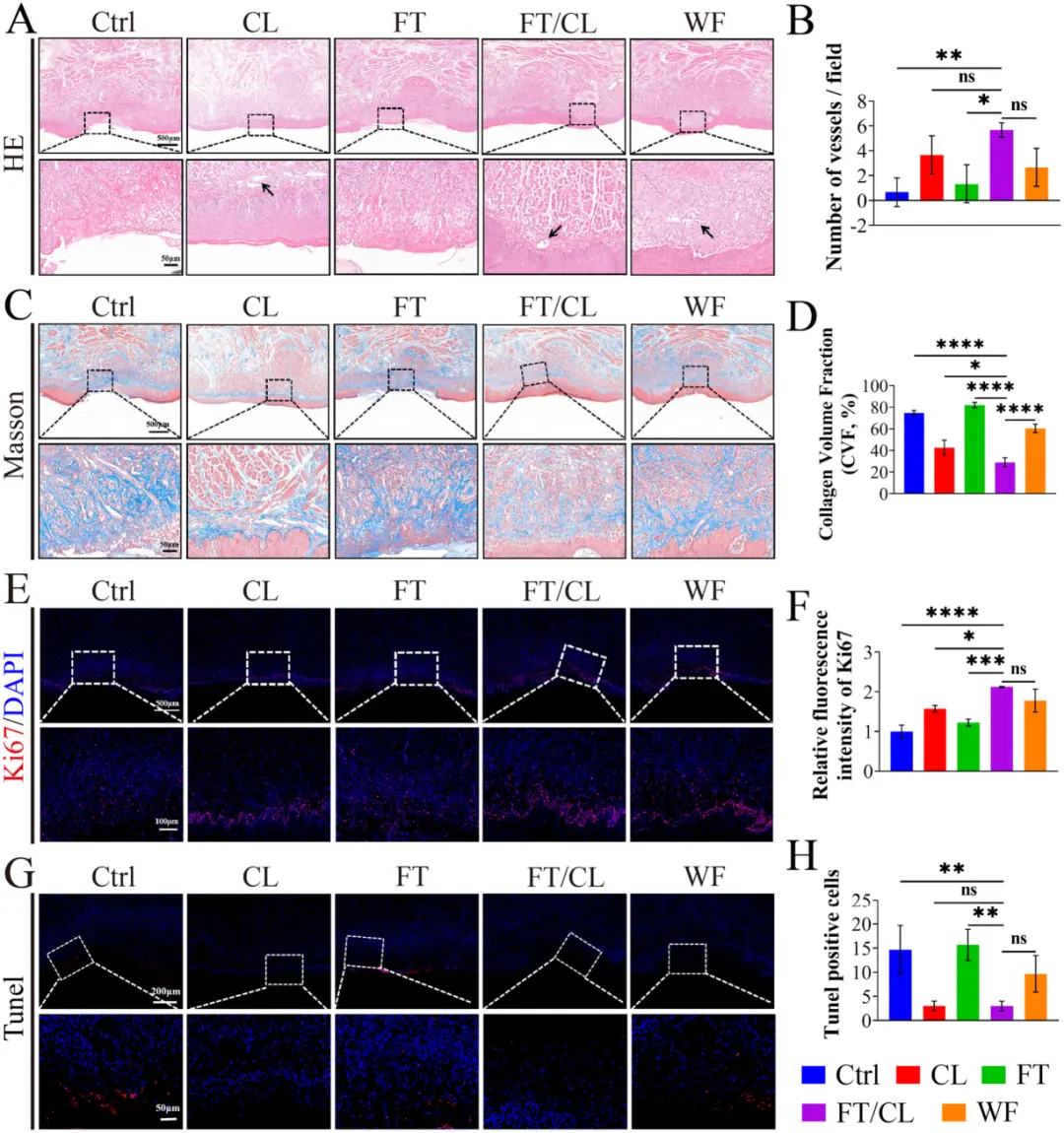
图6 FT/CL水凝胶在第7天修复OU大鼠舌组织的有效性。A 溃疡舌组织的HE染色。黑色箭头表示再生血管。B 溃疡舌组织的Masson染色。C 基底膜下血管的定量。D 胶原合成的定量分析。E 酸诱导溃疡组织中 Ki67 的代表性免疫荧光图像。F 各组Ki67表达量的统计分析。G 溃疡舌组织的 Tunel 染色。H 各组tunel阳性细胞的定量分析。在所有实验中,数据均以 n = 3 次生物学重复的平均值±SD 表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
(6)FT/CL水凝胶在体内强力促进血管再生
治疗第7天,通过多种技术验证其促血管生成能力:图7A-D: 免疫荧光显示FT/CL组CD31和VEGF表达强度最高,表明新生血管密度最高。qPCR与WB:CD31和VEGF在mRNA和蛋白水平的表达均显著上调。图7E-F: qPCR证实FT/CL组CD31和VEGF的mRNA水平最高。图7G-I: Western Blot进一步在蛋白水平验证了CD31和VEGF的上调。
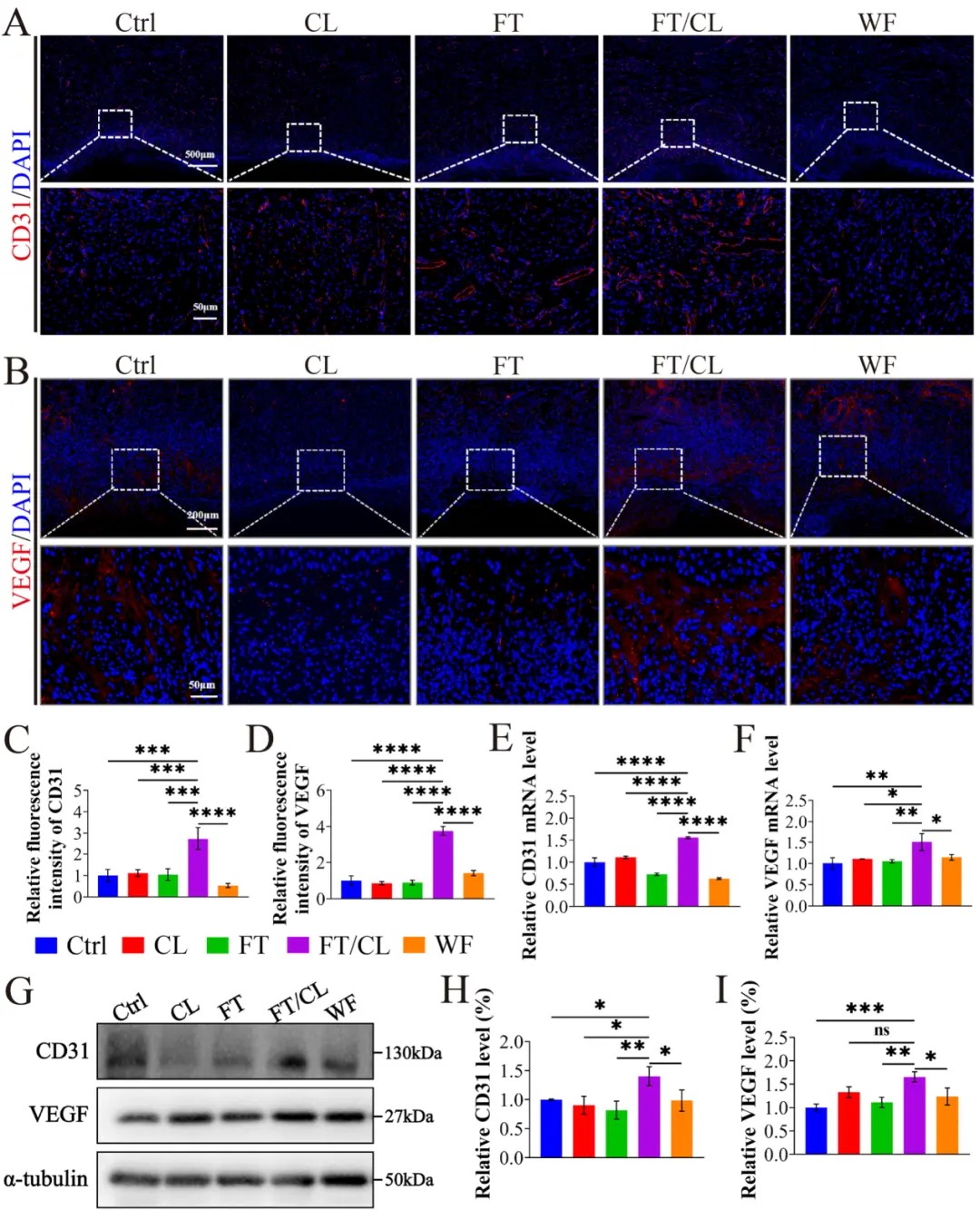
图7 FT/CL治疗组在第7天显示出更好的血管再生促进作用。A 酸诱导溃疡组织中CD31的代表性免疫荧光图像和(B) VEGF的代表性免疫荧光图像。C 各组CD31表达量的统计分析和(D) VEGF表达量的统计分析。E 各组CD31的mRNA表达水平和(F) VEGF的mRNA表达水平。G 免疫印迹(WB)检测各组CD31和VEGF蛋白表达水平。H CD31 和 (I) VEGF 的平均蛋白表达水平。在所有实验中,数据均以 n = 3 次生物学重复的平均值±SD 表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
(7)FT/CL水凝胶在体内有效调控炎症反应
治疗第3天(炎症高峰期)的组织分析显示:HE染色:FT/CL组炎症细胞浸润最少,基底膜再生最早。图8A: 第3天HE染色显示FT/CL组炎症浸润最轻,组织架构恢复最好。图8B: 免疫荧光显示FT/CL组iNOS/TNF-α信号最弱,而CD206/Arg1信号最强。免疫荧光与WB:促炎M1标志物(iNOS, TNF-α)表达最低,而抗炎M2标志物(CD206, Arg1)表达最高,证明其能有效将巨噬细胞从M1表型极化为M2表型,从而控制炎症。图8C-H: Western Blot定量证实FT/CL组显著抑制了M1蛋白表达,促进了M2蛋白表达。
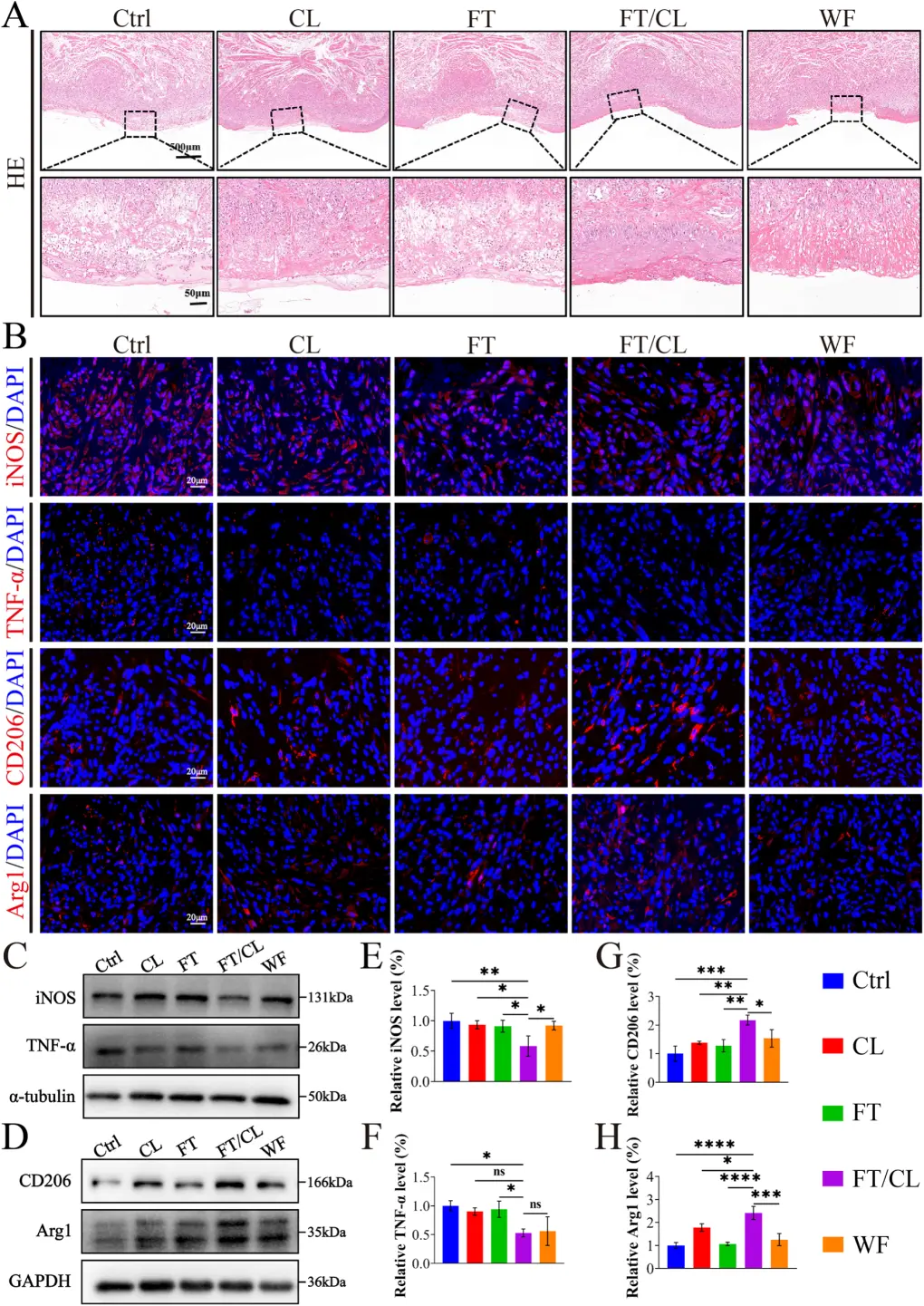
图8 FT/CL治疗组在第3天表现出更好的炎症调节。A 溃疡舌组织的HE染色。B 酸诱导溃疡组织中 iNOS、TNF-α、CD206 和 Arg1 的代表性免疫荧光图像。C M1 标记物 iNOS 和 TNF-α 的蛋白质印迹分析。D M2 标记 CD206 和 Arg1 的蛋白质印迹分析。E iNOS 和 (F) TNF-α 的蛋白表达水平。G CD206 和 (H) Arg1 的蛋白表达水平。在所有实验中,数据均以 n = 3 次生物学重复的平均值±SD 表示。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
本研究巧妙地利用来源广泛、无伦理争议的人脱落乳牙干细胞(SHEDs),制备其细胞裂解物(CL) 作为“无细胞”的治疗核心,规避了直接细胞移植的风险。同时,利用FT水凝胶作为高效载体,解决了口腔环境下药物滞留时间短的瓶颈。 该FT/CL智能水凝胶系统通过三重协同作用——抑制过度炎症、促进血管新生、加速上皮修复,实现了对口腔溃疡的高效、高质量愈合。它不仅为口腔溃疡的临床治疗提供了一种安全、高效且易于转化的新方案,其“无细胞”的治疗理念和智能递送技术,也为其他黏膜损伤和慢性创面的治疗带来了广阔的启示与应用前景。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

