
糖尿病足溃疡(DFU)影响约15 %糖尿病患者,50 %以上合并感染,近半数最终截肢,已成为全球重大公共卫生问题;高血糖环境诱导线粒体功能障碍、能量代谢缺陷及铁死亡(ferroptosis),驱动ROS蓄积与脂质过氧化,阻碍创面修复,而细胞外铁(ex-iron)过载是触发铁死亡的关键却尚未阐明。

针对上述问题,温州医科大学肖健团队开发一种可注射铁响应水凝胶TC@BS(单宁酸-壳聚糖负载BSA@Se),利用单宁酸螯合ex-iron降铁负荷,同时释放BSA@Se清除ROS,抑制铁死亡、恢复线粒体形态与功能;该体系可在DFU创面提供机械支撑并促进血管新生,从而加速糖尿病小鼠创面愈合,并揭示其通过调控铁死亡代谢通路增强内皮细胞活性的机制。该文章于2025年8月22日以《A multifunctional hydrogel promotes diabetic wound healing by remodeling iron balance and energy metabolism》为题发表于《Biomaterials》(DOI:10.1016/j.biomaterials.2025.123640)。
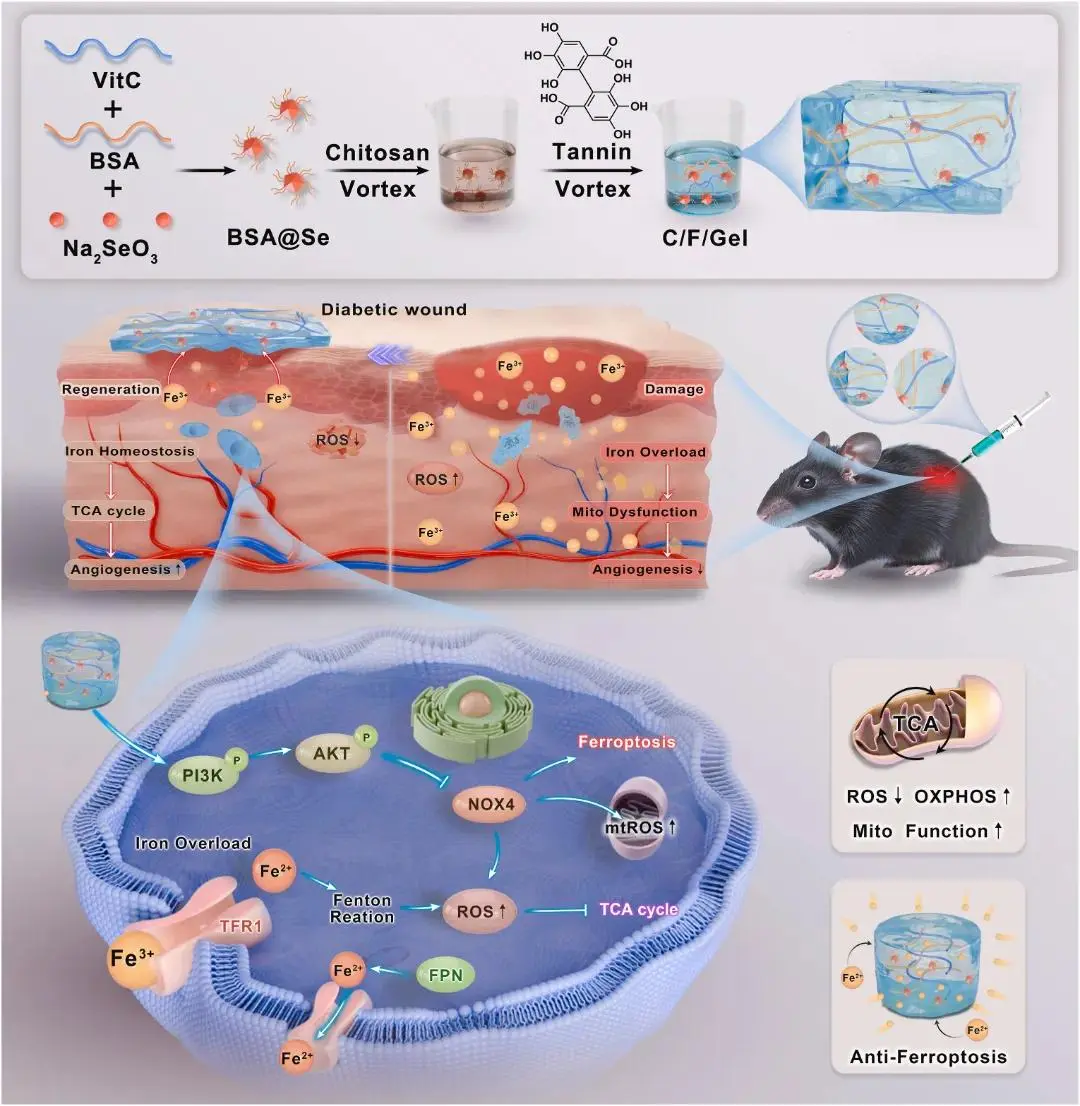
图1.高糖状态下TC@BS在内皮细胞铁代谢平衡和线粒体TCA循环中的作用示意图
(1)糖尿病创面铁过载和铁死亡水平升高
铁死亡是一种新型程序性细胞死亡形式,与多种病理状况相关。在糖尿病伤口愈合中,单细胞组学分析显示,来自愈合和未愈合糖尿病足溃疡的细胞被聚类成七个不同细胞群体(Fig. 2A)。内皮细胞在两组间表现出显著差异。GO富集分析揭示脂肪酸代谢、脂肪酸运输和脂质运输等关键生物过程在两组间显著改变(Fig. 2B)。拟时序分析表明,血管内皮细胞的发育轨迹与GPX4和VEGF的下调以及IL-6的上调相关(Fig. 2C和D)。细胞进展与铁死亡、血管生成和炎症有更强关联(Fig. 2E)。蛋白质印迹结果显示,在DM组中,FTH1和GPX4的表达显著低于对照组,而TFR1表达较高(Fig. 2F和G)。免疫组织化学染色显示,DM组伤口组织中GPX4和FTH1的阳性点显著较少(Fig. 2J–L和K-M)。免疫荧光染色显示,4-HNE的荧光强度在DM组较高(Fig. 2H和I)。普鲁士蓝染色表明,DM组伤口组织中的铁浓度显著增加(Fig. 2N和O-Q)。人样本的蛋白质印迹结果同样显示,DM患者伤口组织中FTH1和GPX4表达较低,而TFR1表达较高(Fig. 2R)。
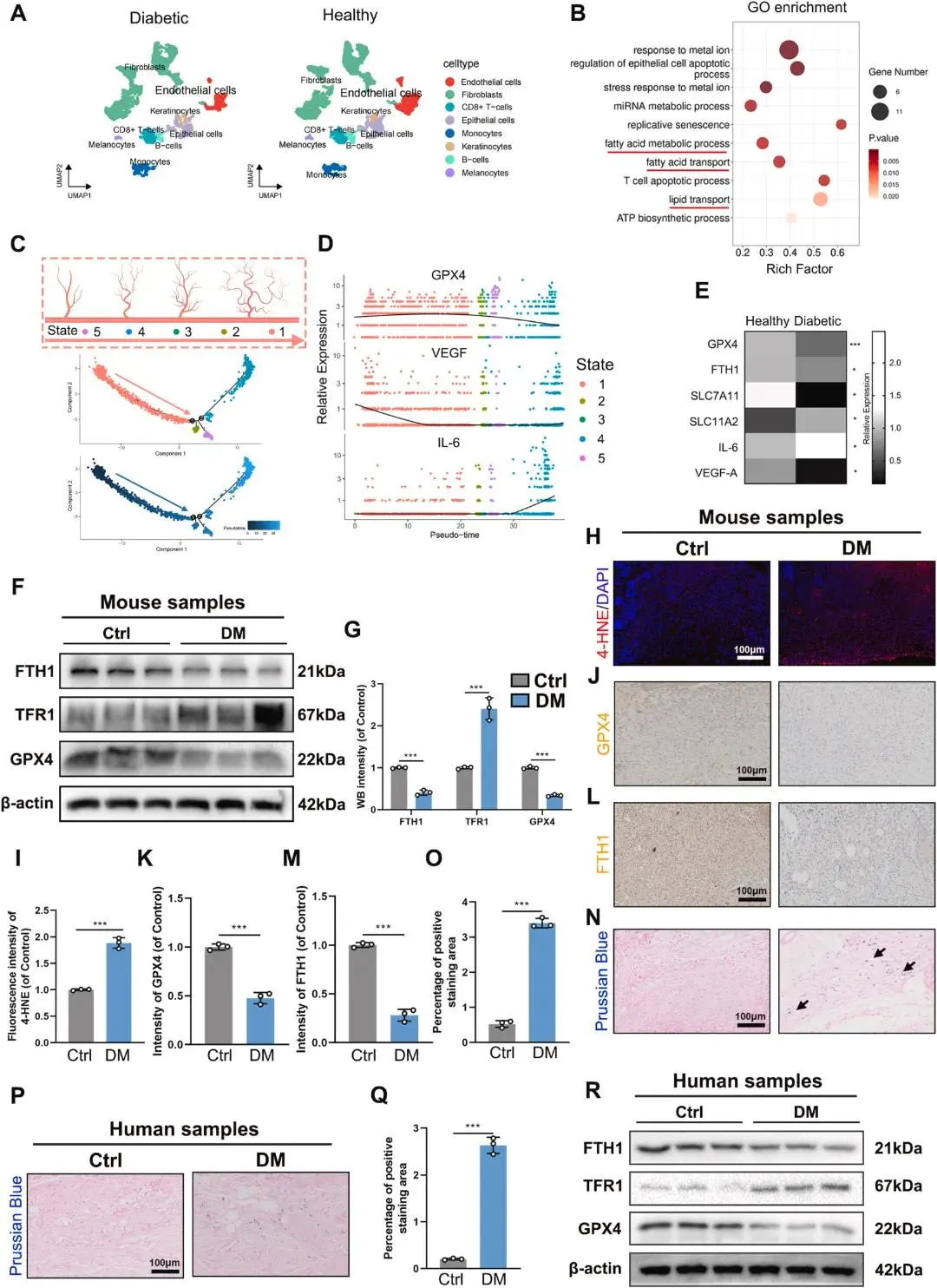
图2 铁离子诱导糖尿病创面铁死亡的验证。(a)非糖尿病与糖尿病患者足部皮肤单细胞tSNE聚类图,细胞按类型着色;(b)内皮细胞GO富集分析;(c)内皮细胞伪时序发育轨迹;(d)随拟时序GPX4、VEGF下降而IL-6上升;(e)两组创面内皮细胞GPX4、FTH1、SLC7A11、IL6、VEGFA表达对比;(f–g)小鼠正常与糖尿病创面FTH1、TFR1、GPX4的WB结果;(h–i)小鼠创面4-HNE免疫荧光代表性图像及定量;(j–k)小鼠创面GPX4免疫组化代表性图像及定量;(l–m)小鼠创面FTH1免疫组化代表性图像及定量;(n–o)小鼠正常与糖尿病创面普鲁士蓝染色代表性图像及铁沉积定量;(p–q)患者正常与糖尿病创面普鲁士蓝染色代表性图像及铁沉积定量;(r)患者创面FTH1、TFR1、GPX4的WB结果。*p < 0.05,**p < 0.01,***p < 0.001,n = 3
(2)高糖和Fe³⁺诱导内皮细胞铁死亡和能量代谢障碍
在HG和Fe³⁺处理组中,ROS和脂质过氧化水平显著高于对照组(Fig. 3A, I, sFig. 1A, B)。细胞内Fe²⁺浓度在HG和Fe³⁺刺激下显著升高(Fig. 3B, J)。线粒体膜电位下降,表现为红荧光减少和绿荧光增加(Fig. 3C, K)。线粒体融合减少或分裂增加(Fig. 3E-F, L),且线粒体超微结构显示膜破碎、嵴缺失、紊乱和空泡化(Fig. 3D)。抗铁死亡蛋白GPX4表达在HG和Fe³⁺组下调(Fig. 3G-H, M)。蛋白质印迹分析表明,TFR1表达在Fe³⁺组显著高于HG组,DMT1表达在两组均高于对照组但无显著差异,而FPN表达在HG和Fe³⁺组下调(Fig. 3N)。HUVECs的迁移能力被HG和Fe³⁺抑制(Fig. 3O, P)。ATP水平下降,MDA水平上升(Fig. 3Q, R)。OCR显示呼吸能力相关参数降低(Fig. 3S)。

图3 铁离子诱导HUVEC铁死亡及能量代谢紊乱的体外验证。(a)CellROX代表性图像及定量;(b)FerroOrange代表性图像及定量;(c)JC-1检测线粒体膜电位代表性图像及定量;(d)TEM超微结构;(e-f)MitoTracker线粒体形态代表性图像及定量;(g-h)GPX4免疫荧光代表性图像及定量;(i)铁代谢相关蛋白FTH1、TFR1、FPN、DMT1的WB;(j-k)划痕实验代表性图像及迁移率定量;(l-m)ATP与MDA含量;(n)Cell Mito Stress Test检测OCR曲线。*p < 0.05,**p < 0.01,***p < 0.001,ns无显著性,n = 3
(3)TC@BS水凝胶的表征
根据管反转试验,TA与CC混合物在室温凝胶化后能稳定附着于管底,表明水凝胶形成(Fig. 4A)。SEM显示TC具有均匀的多孔结构,适合作为载体(Fig. 4B)。流变学实验证实水凝胶具备稳定的流变学性能和可注射性(Fig. 4C–F)。随着TC水凝胶中TA浓度增加,FeCl3溶液颜色由黄变为深绿,表明Fe³⁺被还原为Fe²⁺(Fig. 4G)。铁离子螯合能力检测显示TC对铁的螯合能力显著高于CC(Fig. 4H)。EDS分析确认BSA@Se纳米颗粒中S和Se元素均匀分布(Fig. 4I)。SEM显示BSA@Se呈圆形,粒径小于100 nm(Fig. 4J, K)。负载BSA@Se后TC水凝胶的形态与孔结构未发生显著改变,BSA@Se成功附着于孔隙表面(Fig. 4L)。在PBS环境中,TC@BS能良好粘附于心脏、肝、脾、肺及肾组织表面(Fig. 4M, sFig. 2A)。溶胀实验表明TC@BS在FeCl3中的溶胀率显著高于PBS环境(Fig. 4N)。释放实验显示TC@BS在FeCl3中的释放效果更优(Fig. 4O)。
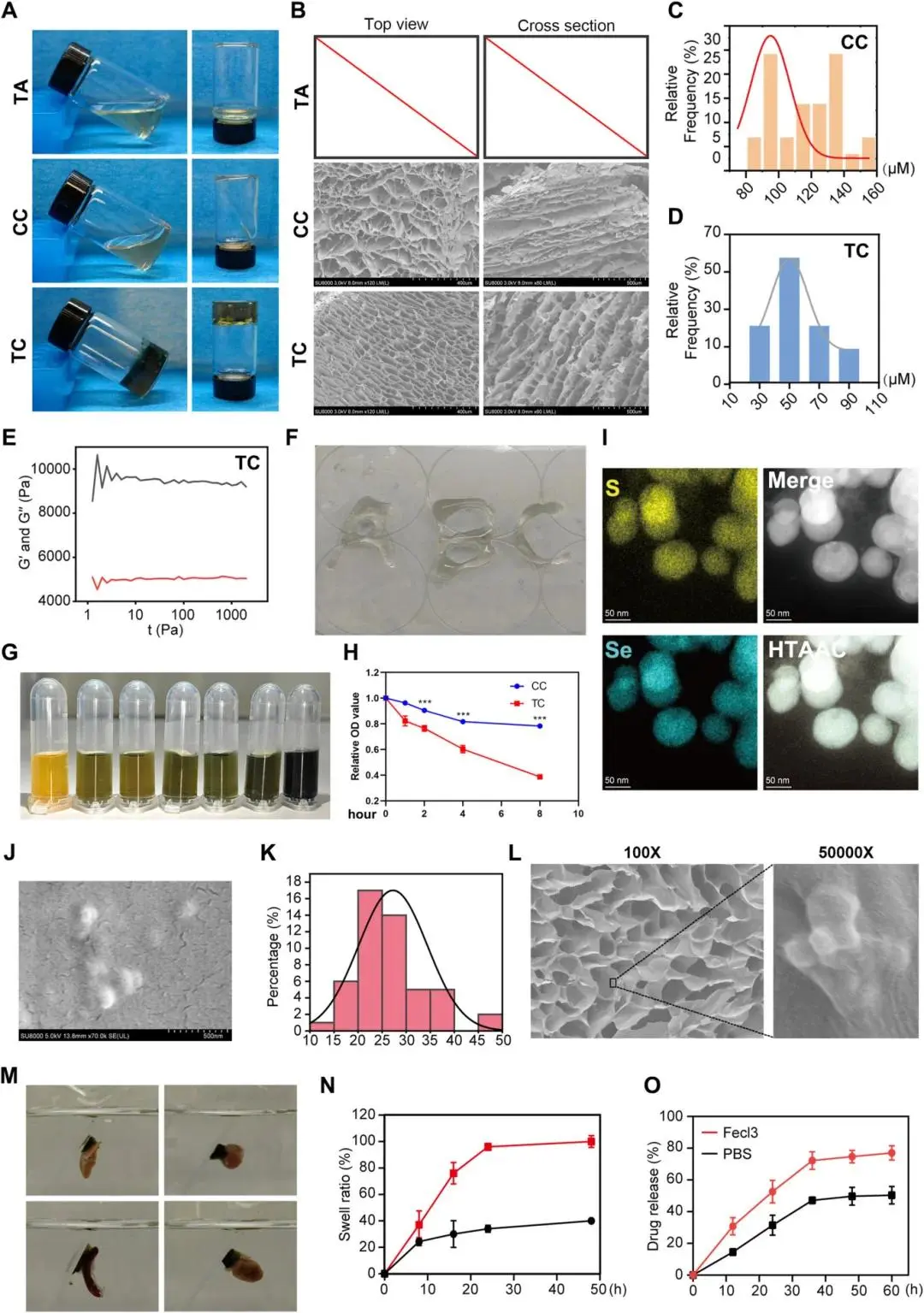
图4 TC@BS的表征。(a)TA、CC与TC倒置实验;(b)CC与TC表面及截面SEM图;(c-d)CC与TC孔径分布;(e)TC水凝胶流变性能;(f)水凝胶可注射演示;(g)TC与不同浓度Fe³⁺溶液反应颜色变化;(h)CC与TC铁螯合能力;(i)BSA@Se的EDS元素分布;(j)BS的SEM图;(k)BS粒径;(l)TC@BS的SEM图及BS在TC中的分布;(m)TC@BS在PBS中粘附心、肝、脾、肾组织切片;(n)TC@BS在PBS与Fe³⁺溶液中的溶胀行为;(o)TC@BS在PBS与Fe³⁺溶液中BS的体外释放曲线
(4)TC@BS水凝胶的生物安全性和生物相容性
溶血试验显示TC、BS和TC@BS的溶血率与PBS组无显著差异,均低于5%,表明材料具有良好的生物相容性(Fig. 5A, B)。CCK-8和EdU染色实验证实Fe³⁺处理引发细胞毒性,而TC、BS和TC@BS处理能显著恢复细胞活力(sFig. 3A–C)。Calcein-AM/PI双染色结果显示TC@BS处理有效减少Fe³⁺诱导的细胞死亡(Fig. 5C, D)。纤维连接蛋白粘附实验表明Fe³⁺处理显著降低HUVECs粘附能力,TC@BS预处理可减轻该抑制作用(Fig. 5E, F)。管形成、迁移和划痕实验证明Fe³⁺暴露损害内皮细胞的管形成和迁移功能,TC@BS处理则恢复这些功能参数(Fig. 5G–L)。Western blot分析显示Fe³⁺处理导致VE-Cadherin、AAMP和VEGF-A表达下调,而TC@BS后处理能逆转这些分子变化(Fig. 5M, N)。
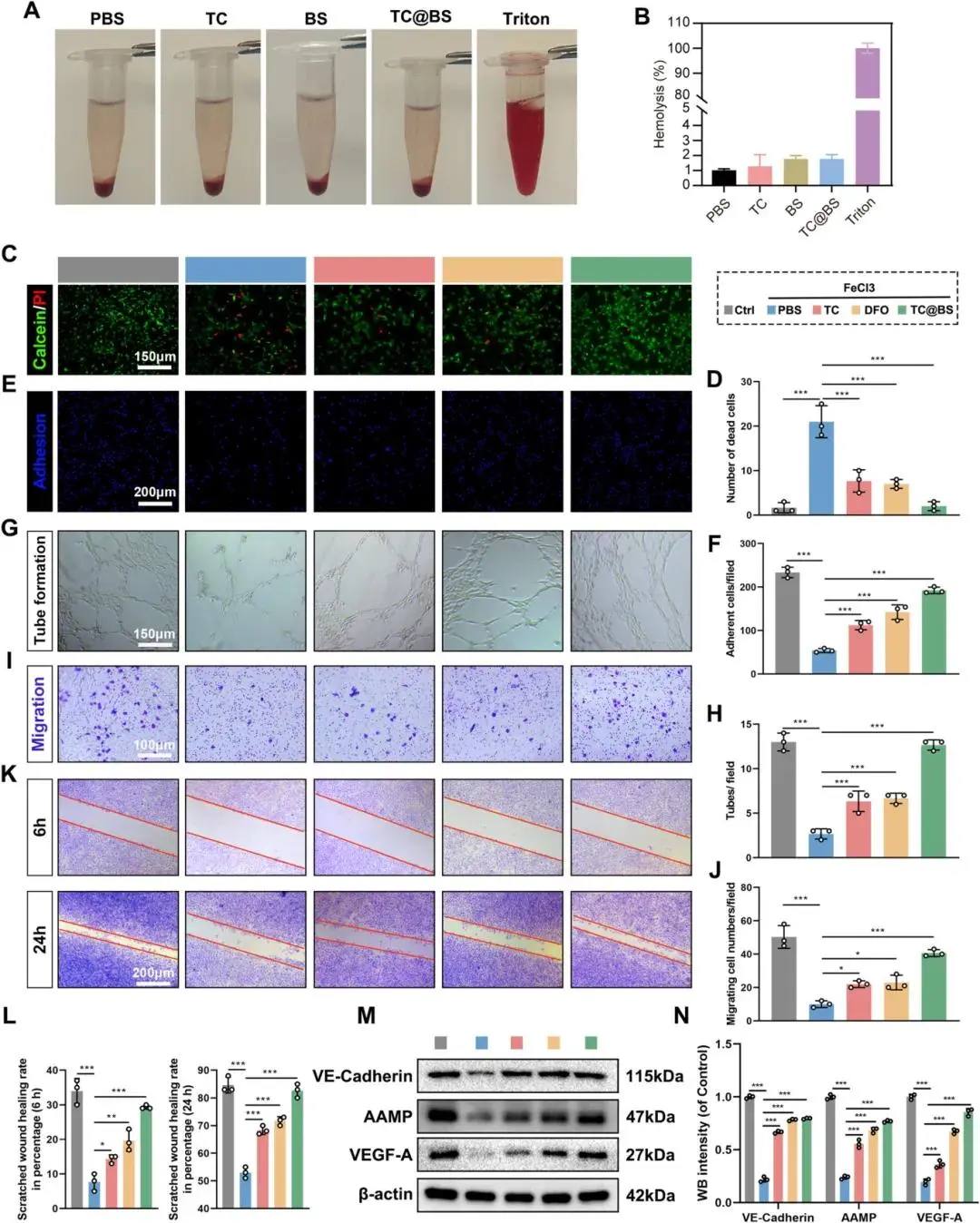
图5 TC@BS的生物相容性。(a)溶血率对比(PBS、TC、BS、TC@BS,Triton为阳性对照);(b)Calcein/PI活死染色图像及定量;(c)细胞-基质黏附实验图像及定量;(d)成管实验图像及节点数定量;(e)Transwell迁移实验图像及计数;(f)划痕愈合实验图像及迁移率;(g)WB检测VE-Cadherin、AAMP、VEGF-A表达
(5)TC@BS体外抑制人脐静脉内皮细胞铁死亡水平
在高糖微环境中,将HUVECs与水凝胶共培养后进行分析。DCFA-DA染色显示,TC、DFO和TC@BS组的细胞ROS水平均显著低于Fe³⁺组,其中TC@BS组效果最为显著(Fig. 6C, H)。FerroOrange染色表明TC@BS组在降低细胞内游离亚铁离子方面作用最为明显,其水平接近对照组(Fig. 6D, I)。C11-BODIPY染色显示TC@BS组脂质过氧化显著降低,而Fe³⁺组则显著升高(Fig. 6E-F, J)。FTH1免疫荧光结果与FerroOrange染色趋势一致(Fig. 6G, K)。蛋白质印迹分析显示,与Fe³⁺组相比,TC、DFO和TC@BS组的FTH1和FPN表达显著增强,而TFR1和DMT1表达则显著降低(Fig. 6L, M)。综上,靶向水凝胶能减少细胞外铁积累,抑制HUVECs铁死亡,并维持细胞活性(Fig. 6N)。
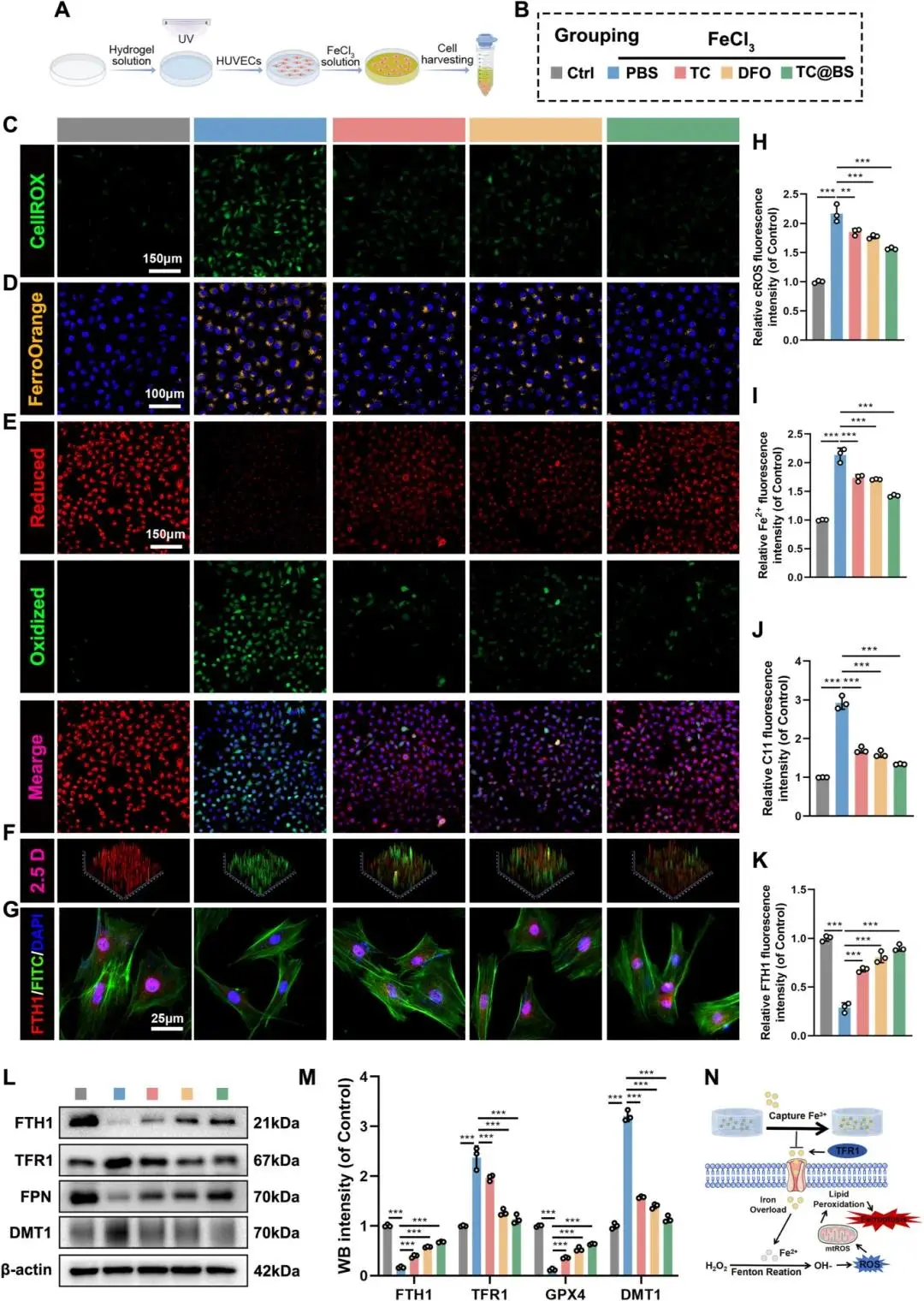
图6 TC@BS体外维持HUVEC铁代谢平衡。(a)共培养实验示意图;(b)分组方案;(c)CellROX荧光图像及定量;(d)FerroOrange铁离子荧光图像及定量;(e-f)C11-BODIPY581/591脂质过氧化荧光与2.5D重建图像及定量;(g)FTH1免疫荧光图像及定量;(h-k)WB检测FTH1、TFR1、FPN、DMT1表达;(l)TC@BS在高铁微环境中抗铁死亡机制示意图。*p < 0.05,**p < 0.01,***p < 0.001,n = 3
(6)TC@BS介导的糖尿病创面修复通过减轻线粒体功能障碍的能量代谢重编程
MitoSox Red检测显示Fe³⁺组线粒体ROS荧光增强,而DFO与TC@BS水凝胶处理后荧光减弱(Fig. 7A, C)。JC-1染色表明Fe³⁺组线粒体膜电位下降,DFO与TC@BS处理可恢复膜电位,红荧光强度显著增强(Fig. 7D, E)。MitoTracker Red染色与线粒体透射电镜显示Fe³⁺组线粒体过度分裂、肿胀、嵴结构紊乱或消失,而DFO与TC@BS组线粒体分裂减少、嵴结构完整、膜结构未破坏(Fig. 7F–I)。蛋白质印迹分析表明DFO与TC@BS处理可升高Opa1、Mfn1及Mfn2表达,降低Drp1表达(Fig. 7K)。实时PCR结果显示DFO与TC@BS能够促进线粒体呼吸链复合体I、IV、V相关基因表达(Fig. 7J)。OCR检测表明Fe³⁺诱导后呼吸能力相关参数下降,TC、DFO及TC@BS处理可恢复这些参数,其中TC@BS的治疗效果强于TC和DFO(Fig. 7L)。TC、DFO及TC@BS处理可提升ATP水平并降低MDA水平,TC@BS的作用效果优于TC和DFO(Fig. 7M, N)。结果表明,TC@BS可恢复线粒体氧化代谢平衡、形态与功能,并纠正细胞能量代谢失衡(Fig. 7O)。
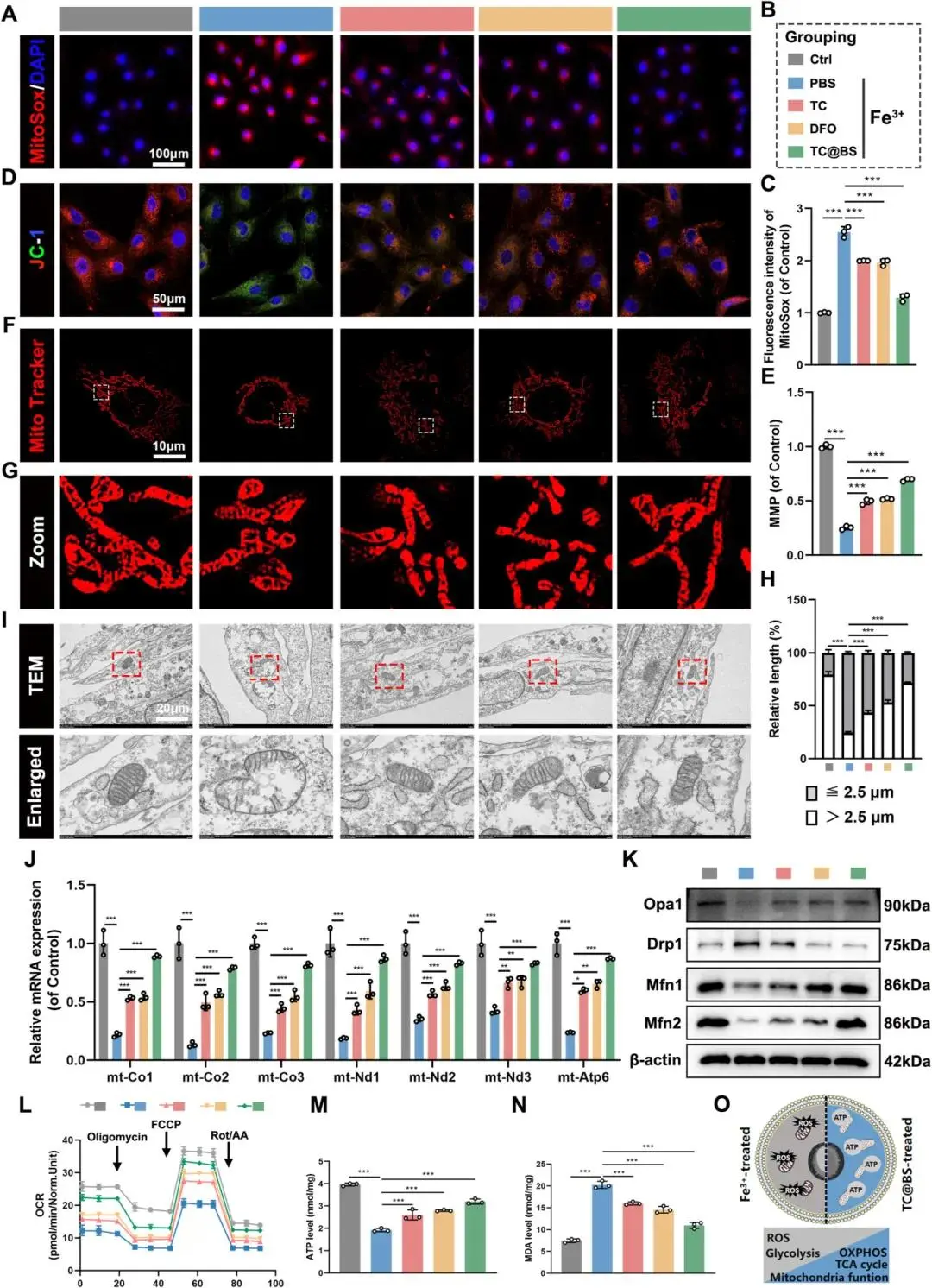
图7 TC@BS体外修复HUVEC线粒体功能。(a)实验分组示意;(b)MitoSOX超氧阴离子荧光图像及定量;(c-d)JC-1线粒体膜电位图像与定量;(e-f)MitoTracker线粒体形态图像及定量;(g)TEM超微结构;(h)呼吸链复合物基因RT-PCR热图;(i)WB检测Opa1、Drp1、Mfn1、Mfn2;(j)OCR曲线;(k-l)ATP与MDA含量;(m)水凝胶调控高铁微环境代谢重编程机制图。*p < 0.05,**p < 0.01,***p < 0.001,n = 3
(7)TC@BS促进糖尿病小鼠创面愈合
在STZ诱导的糖尿病小鼠模型中评估TC/DFO/TC@BS对伤口修复的影响。宏观观察图像显示,尽管所有组别的伤口面积均随时间减小,但TC@BS组在第5、10、15天时的伤口面积均小于TC组和DFO组(Fig. 8B-D)。TC@BS组的愈合效果接近未注射STZ的对照组水平。组织H&E和Masson染色显示,与第5天未见明显上皮化的DM组相比,TC/DFO/TC@BS处理的糖尿病伤口形成了结构清晰的新生表皮,其中TC@BS组效果最为显著。通过H&E结果计算伤口长度发现,术后第5天和第10天,TC@BS组的伤口长度最短,其次为DFO组、TC组和DM组(Fig. 8E-G)。
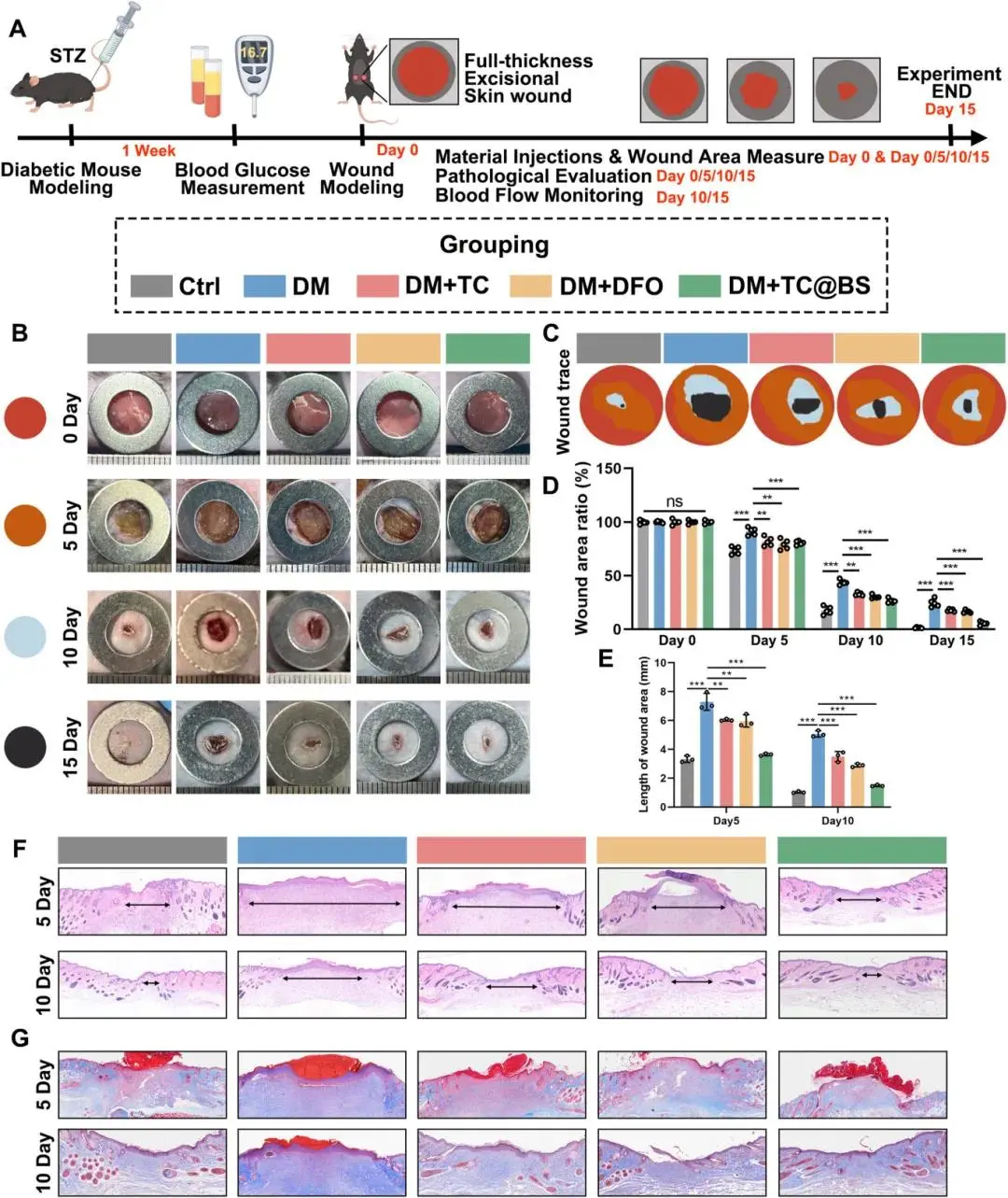
图8 TC@BS促进糖尿病鼠创面愈合。(a)动物实验流程;(b-c)创面愈合照片及示意图;(d)五组相对创面面积定量;(e-f)第5、10天H&E与Masson染色及伤口长度统计。*p < 0.05,**p < 0.01,***p < 0.001,n = 3
(8)TC@BS促进糖尿病小鼠创面血管生成,减少铁过载和脂质过氧化
激光多普勒血流成像显示,在术后第5天和第10天,TC/DFO/TC@BS处理组的伤口边缘及创面血流灌注量均高于DM组,其中TC@BS组血流灌注量接近对照组水平(Fig. 9A, F)。α-SMA免疫荧光染色表明,TC/DFO/TC@BS组在术后第5天和第10天的新生血管及成熟血管数量均多于DM组,以TC@BS组最为显著(Fig. 9B, G)。免疫组化染色显示TC/DFO/TC@BS处理可恢复伤口组织中FTH1的表达(Fig. 9C, H)。普鲁士蓝染色表明各处理组降低了体内铁离子含量(Fig. 9D, I)。4-HNE免疫荧光显示TC/DFO/TC@BS处理显著降低了体内脂质过氧化水平,TC@BS组效果最为明显(Fig. 9E, J)。伤口组织蛋白的Western blot结果与上述实验结论一致(Fig. 9K, L)。免疫荧光结果显示TC@BS可促进巨噬细胞向M2表型极化(sFig. 4A-F),并减少中性粒细胞浸润(sFig. 4G);ELISA检测证实TC@BS降低了体内炎症水平(sFig. 4H-J)。透射电镜分析表明TC@BS处理在体内可显著改善内皮细胞线粒体形态(sFig. 9A)。血液检测及主要器官H&E染色证明TC@BS水凝胶无明显毒性(sFig. 5A-K)。结果表明,TC@BS水凝胶能显著促进糖尿病伤口血管生成,降低铁离子含量、炎症水平及脂质过氧化程度。
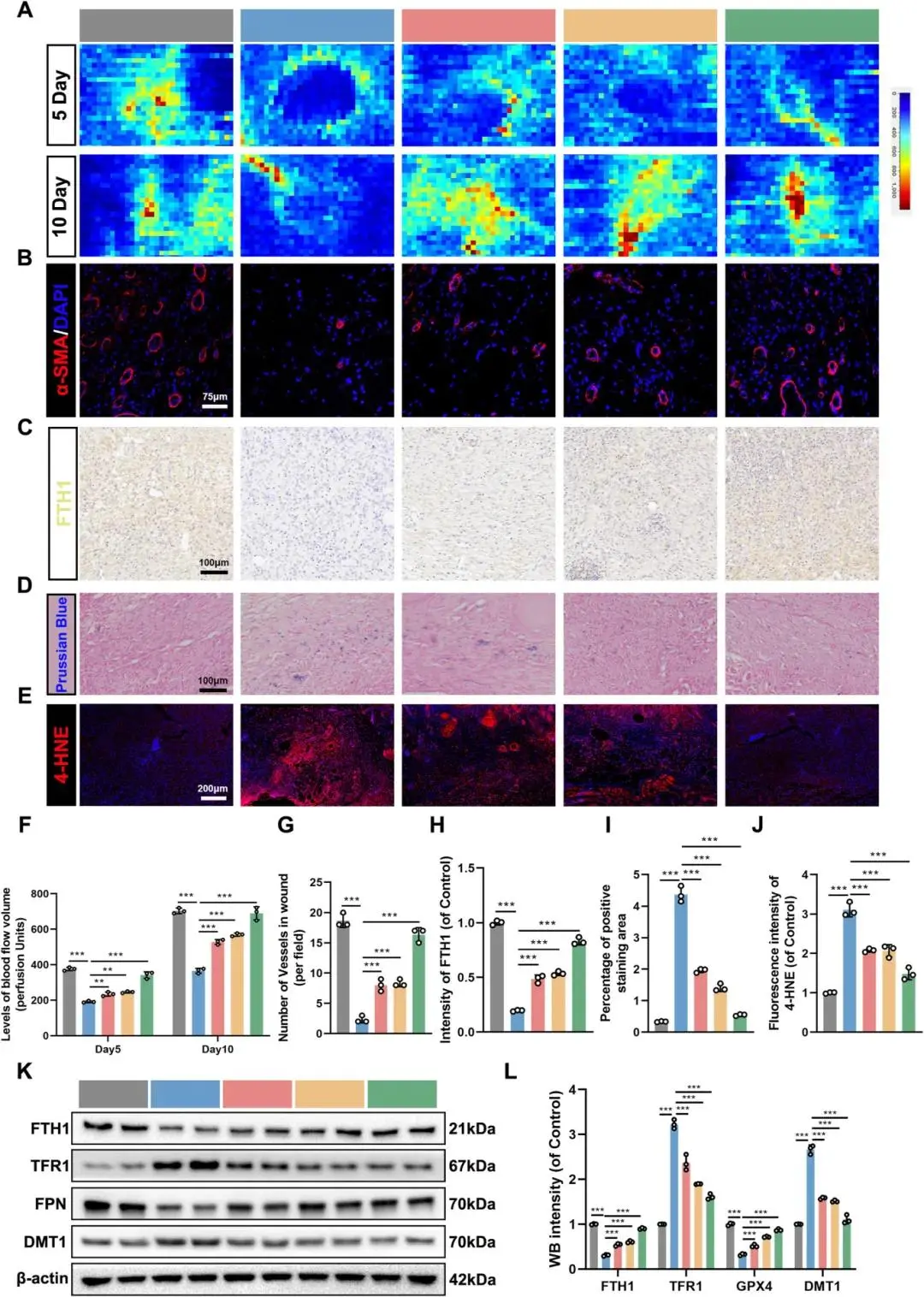
图9 TC@BS重塑内皮铁代谢并降低脂质过氧化以促进血管新生。(a)术后3、7天激光多普勒血流图;(b)α-SMA免疫荧光及定量;(c)FTH1免疫组化及定量;(d)普鲁士蓝铁染色及定量;(e)4-HNE免疫荧光及定量;(f-g)创面组织FTH1、TFR1、FPN、DMT1的WB分析。*p < 0.05,**p < 0.01,***p < 0.001,n = 3
(9)TC@BS通过激活PI3K-AKT途径抑制铁死亡
对DM组和TC@BS+DM组的伤口组织进行转录组测序分析。火山图显示两组间存在显著差异表达基因(Fig. 10A),主成分分析表明样本具有良好重复性(sFig. 8A)。KEGG富集和桑基图分析显示,PI3K-AKT信号通路与铁死亡通路在前10条通路中存在显著差异,其中铁死亡在下调生物过程中被显著抑制(Fig. 10B, sFig. 8B)。GO富集分析表明两组在脂质代谢、脂肪酸结合及NADPH氧化酶复合物等方面存在显著差异(Fig. 10C)。基因集富集分析结果与KEGG和GO分析一致(Fig. 10D-F)。两组间铁死亡相关和血管生成相关mRNA表达结果与前期实验结果相符(Fig. 10G)。结果表明靶向水凝胶可能通过上调PI3K-AKT通路抑制铁死亡,进而促进伤口愈合。
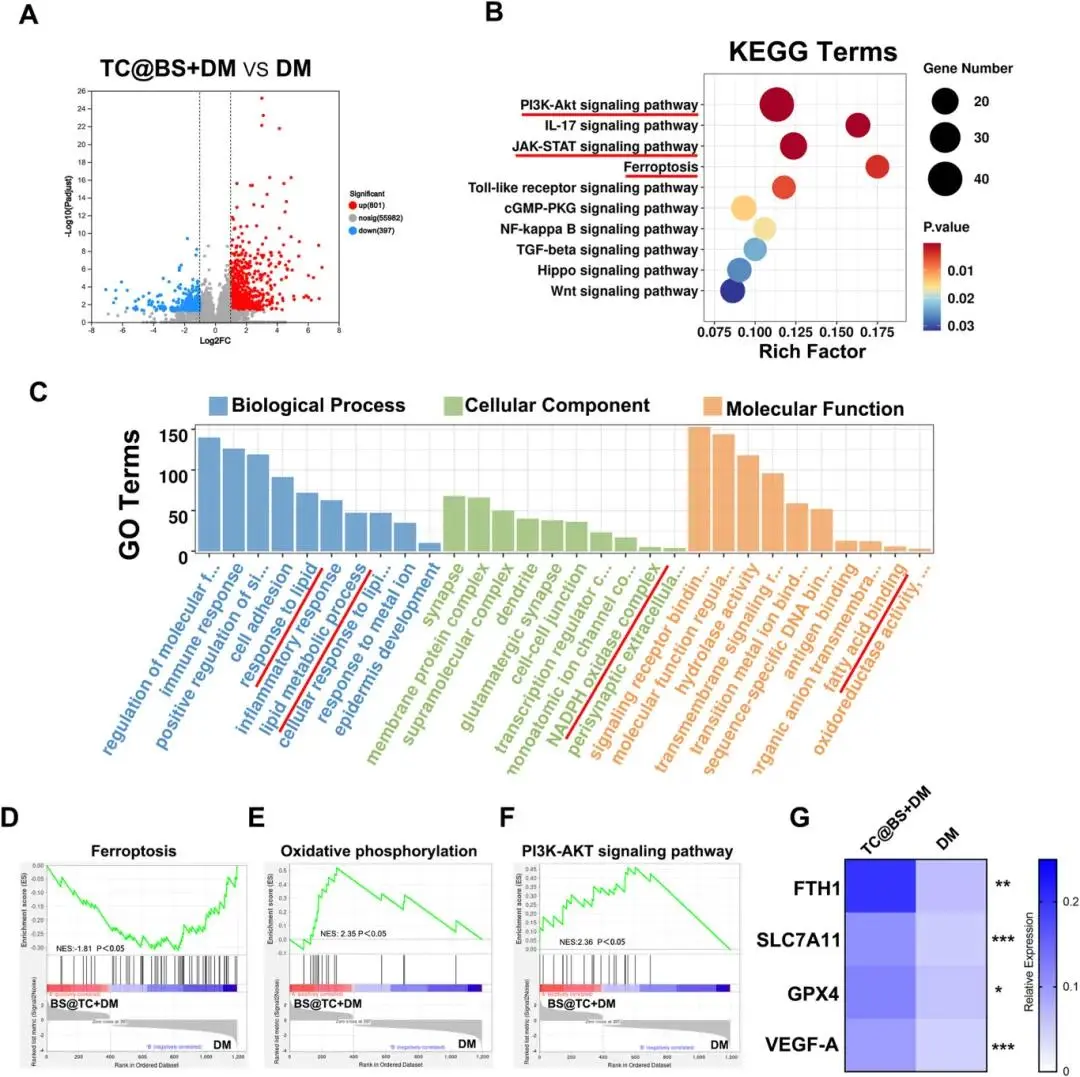
图10 TC@BS处理的RNA-seq分析。(a)TC@BS+DM vs DM差异基因火山图(红/蓝分别示显著上/下调);(b)KEGG富集气泡图(大小示基因数,颜色示p值);(c)GO富集(蓝、绿、橙分别对应生物过程、细胞组分、分子功能);(d-f)GSEA铁死亡、氧化磷酸化、PI3K-AKT通路的NES与p值;(g)FTH1、SLC7A11、GPX4、VEGFA、DRP1表达验证。*p < 0.05,**p < 0.01,***p < 0.001,每组n = 4
(10)NOX4参与DM介导的创伤和Fe³⁺处理的人脐静脉内皮细胞铁性下垂
对经Fe³⁺处理且有无TC@BS干预的细胞蛋白进行WB分析,结果显示DFO与TC@BS处理显著促进PI3K和AKT的磷酸化(Fig. 11A–C)。IHC染色表明在体内TC@BS处理组p-PI3K和p-AKT表达高于DM组(Fig. 11D–G, sFig. 10A–D)。蛋白质相互作用网络分析显示AKT与NOX4存在强关联(Fig. 11H)。WB与IF结果显示TC@BS组显著降低NOX4表达(Fig. 11I–J, Q),IHC染色同样表明TC@BS组NOX4表达较低(Fig. 11K, L)。使用PI3K-AKT通路抑制剂LY294002进行预处理,可显著抑制PI3K-AKT通路磷酸化并促进NOX4表达(Fig. 11M–P)。结果表明TC@BS水凝胶通过激活PI3K/AKT通路并抑制NOX4表达,为糖尿病伤口提供了一种调控铁代谢和铁死亡的治疗策略(Fig. 11R)。
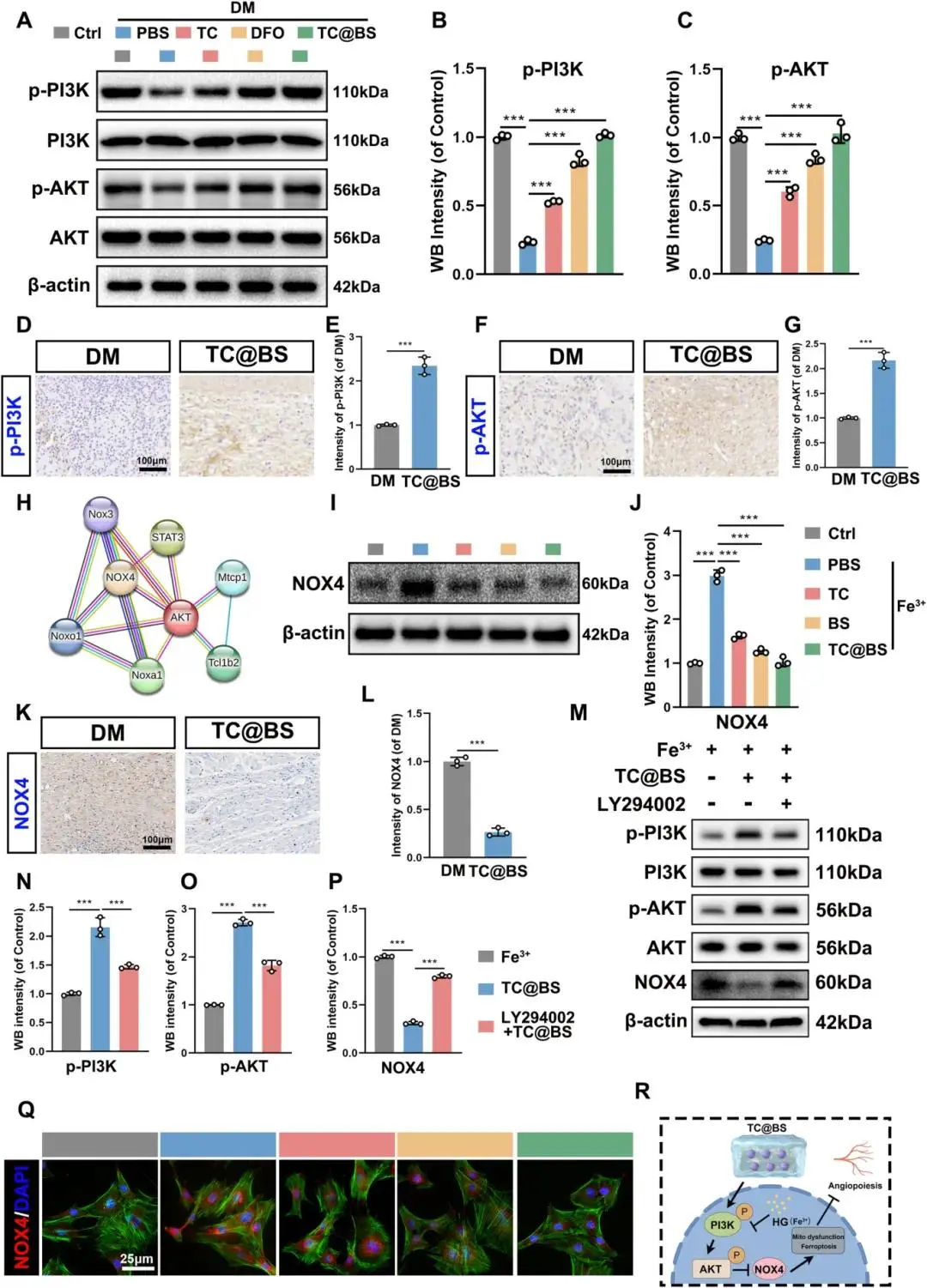
图11 TC@BS通过激活PI3K/AKT通路抑制NOX4介导的铁死亡。(a)PI3K、AKT及p-AKT的WB分析;(b-c)p-PI3K免疫组化图及定量;(d-e)p-AKT免疫组化图及定量;(f)蛋白互作网络图;(g-h)NOX4的WB分析;(i-j)NOX4免疫组化图及定量;(k)NOX4免疫荧光图及定量;(l-o)不同处理组p-PI3K、p-AKT与NOX4的WB分析;(p)TC@BS调控铁死亡与线粒体的信号通路示意图。*p < 0.05,**p < 0.01,***p < 0.001,n = 3
本研究开发了一种兼具生物相容性和可注射性的铁靶向水凝胶TC@BS可高效螯合Fe³⁺,恢复铁代谢平衡,抑制NOX4-ROS通路,激活PI3K-AKT信号,从而减轻脂质过氧化、保护线粒体功能,并显著促进血管新生与创面愈合。该材料为临床干预糖尿病慢性创面提供了可转化的铁死亡靶向新策略。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

