
当细胞受到氧化或炎症等应激刺激时,线粒体DNA(mtDNA)可能泄漏到细胞质中,作为损伤相关分子模式(DAMP)激活cGAS-STING等炎症信号通路,诱发过度免疫反应。然而,目前尚不清楚细胞如何特异性清除这些“误入歧途”的mtDNA。传统上,线粒体质量控制主要依赖整体线粒体降解(如线粒体自噬),但针对已释放到胞质的单个mtDNA分子的精准清除机制仍属空白。

针对上述问题,广州医科大学冯杜教授团队提出“线粒体核样自噬(nucleoid-phagy)”新机制:发现线粒体转录因子A(TFAM)可兼做自噬受体,通过其LIR2基序直接识别并绑定LC3,将泄漏到胞质的mtDNA精准投递至自噬溶酶体降解,从而切断cGAS-STING炎症信号轴。该策略为细胞提供了“按需清除”游离mtDNA的主动防御,突破了传统整体线粒体自噬无法精细处理单分子损伤的局限。该文章于2024年05月23日以《TFAM is an autophagy receptor that limits inflammation by binding to cytoplasmic mitochondrial DNA》为题发表于《Nature Cell Biology 》(DOI:10.1038/s41556-024-01419-6)。
(1)自噬参与细胞质暴露的mtDNA和TFAM的去除
应激状态下,更多TFAM从TOM20标记的线粒体泄漏至细胞质(图1a,b);渐进式氧化应激会降低HeLa细胞和THP-1细胞中的TFAM与SQSTM1水平,同时升高LC3-II/LC3-I比率。溶酶体抑制剂Baf-A1而非蛋白酶体抑制剂MG-132,可在不影响转录的情况下恢复TFAM(图1c,d);自噬相关蛋白7(ATG7)基因敲除的HeLa细胞中,TFAM水平的下降被阻断(图1e,f),证实该过程依赖自噬。
通过NP-40仅通透质膜,可特异性检测逃避线粒体自噬的泄漏类核,排除线粒体与细胞核DNA的干扰;该处理成功分离细胞质组分与致密细胞器组分,证实HeLa细胞(图1g,h)和THP-1细胞中均存在TFAM向细胞质的释放,且ATG7缺陷细胞中胞质TFAM积累增强(图1i,j)。
共聚焦显微镜与PCR检测显示,应激状态下线粒体DNA(mtDNA)显著释放到胞质,Baf-A1处理后释放量进一步增加(图1k,l);氧化应激下,ATG7缺陷细胞的胞质mtDNA较对照细胞增多(图1m-q),免疫金标记也证实这一结果(图1r-t)。
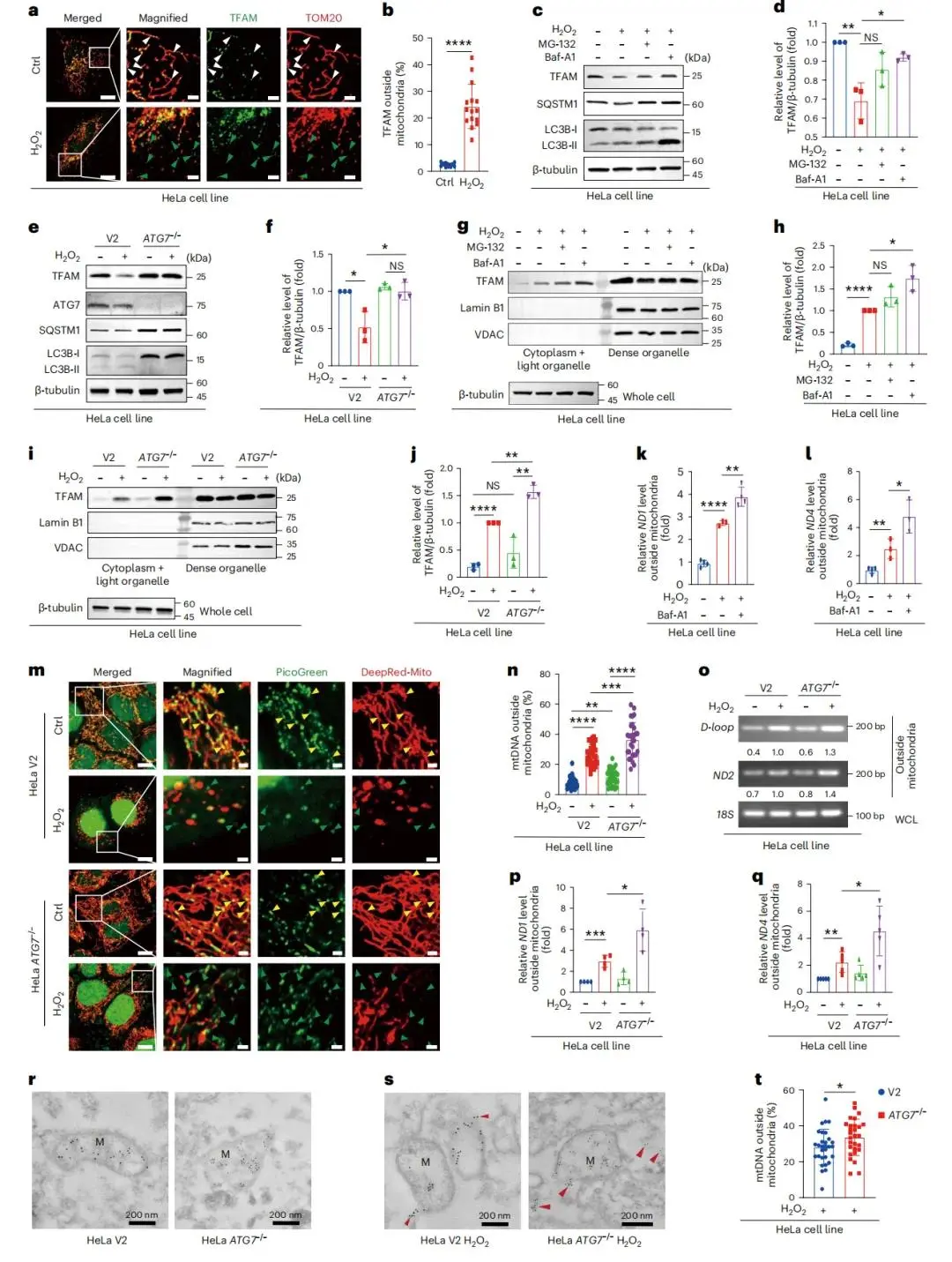
图1 自噬参与胞质暴露mtDNA和TFAM的清除(a)H2O2处理HeLa细胞线粒体外TFAM图像;(b)对应百分比;(c、d)H2O2、MG-132和Baf-A1刺激HeLa细胞的SDS-PAGE结果及统计分析;(e、f)H2O2刺激的ATG7缺陷型和V2对照HeLa细胞的SDS-PAGE、免疫印迹结果及统计分析;(g、i)免疫印迹验证;(h、j)对应统计分析;(k、l)ND1/ND4引物qPCR检测胞质mtDNA;(m)H2O2刺激的ATG7缺陷型HeLa细胞线粒体外mtDNA代表性图像;(n)对应百分比;(o)D-loop/ND2引物PCR检测胞质mtDNA;(p、q)ND1/ND4引物qPCR检测;(r、s)线粒体外mtDNA免疫电镜图像
(2)mtDNA-TFAM复合物与细胞质中的LC3B结合
应激条件下,HeLa和THP-1细胞中的mtDNA与TFAM仍保持结合状态(图2a–d)。亚细胞分离和细胞质DNA免疫沉淀实验显示,氧化应激会使细胞质中抗TFAM抗体上的mtDNA–TFAM复合物水平升高,且Baf-A1处理后该效应更显著(图2e–g)。通过抗LC3B抗体进行免疫共沉淀,结合RT-qPCR和PCR检测相关mtDNA发现,氧化应激下与LC3B结合的mtDNA增多,Baf-A1抑制后该水平进一步上升(图2h–j)。共聚焦显微镜观察显示,无应激时细胞质中GFP标记的LC3B(GFP-LC3B)斑点较少,经H2O2和Baf-A1处理后,GFP-LC3B水平升高且与泄漏的mtDNA共定位(图2k,l);ATP刺激的LPS预处理THP-1细胞中,LC3B同样增多并与释放的mtDNA共定位(图2m,n)。此外,应激条件下HeLa和THP-1细胞中,LC3B与泄漏的TFAM也存在共定位(图2o–r)。
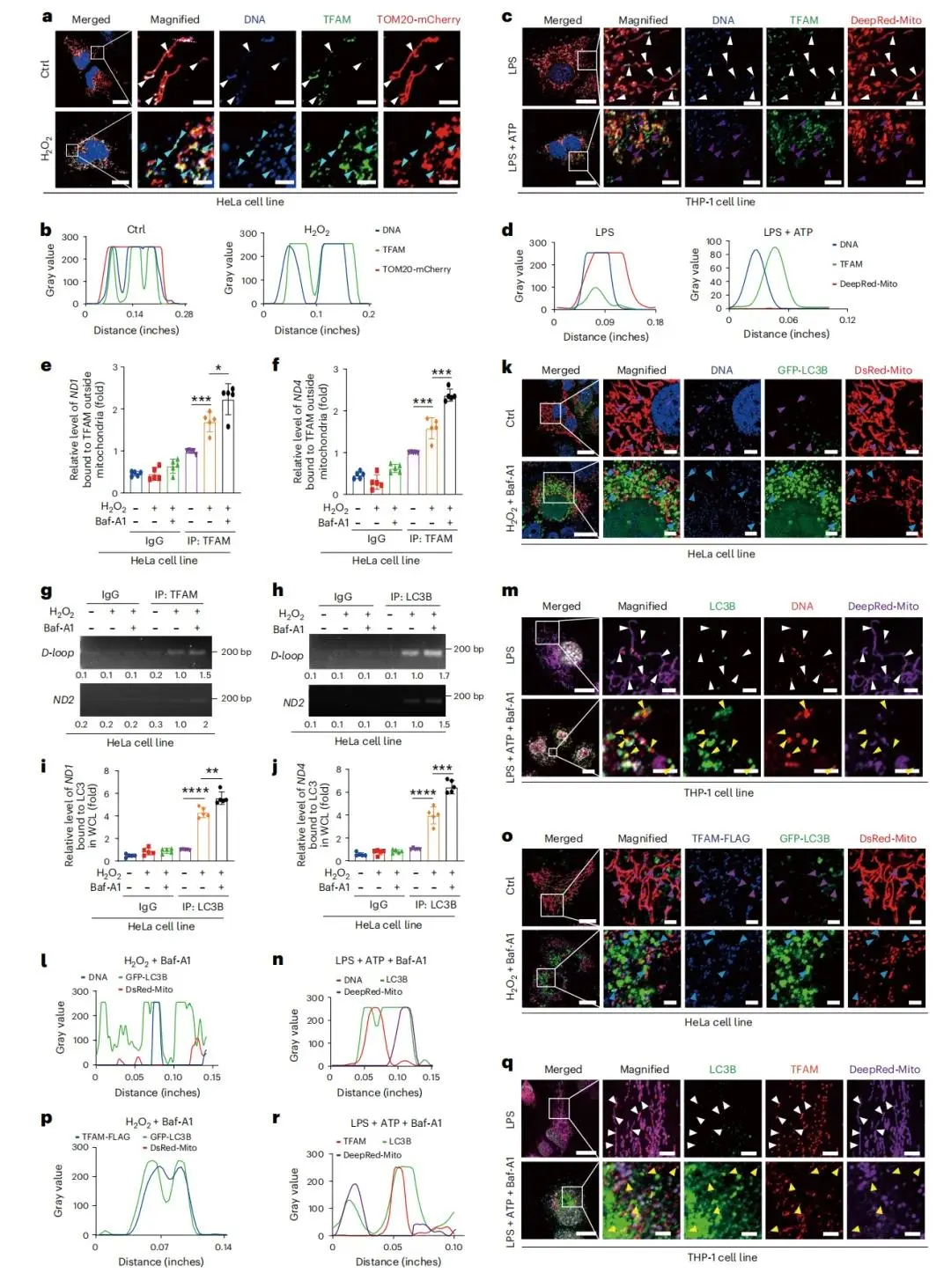
图2 mtDNA–TFAM复合物与细胞质中的LC3B结合。H2O2处理HeLa细胞中线粒体外mtDNA–TFAM复合物的代表性图像(a)及共定位分析(b);LPS+ATP处理THP-1细胞中线粒体外mtDNA–TFAM复合物的代表性图像(c)及共定位分析(d);(e)-(g)H2O2+Baf-A1刺激HeLa细胞胞质裂解物抗TFAM免疫沉淀,ND1(e)、ND4引物(f)qPCR及PCR(g)检测沉淀mtDNA;同上处理HeLa细胞全细胞裂解物抗LC3B免疫沉淀,PCR(h)及ND1(i)、ND4引物(j)qPCR检测沉淀mtDNA;(k)(l)(o)(p)H2O2+Baf-A1处理的GFP-LC3B稳定转染HeLa细胞中,胞质释放mtDNA(k、l)或TFAM-FLAG(o、p)与GFP-LC3B共定位的图像(k、o)及分析(l、p);(m)(n)(q)(r)LPS+ATP+Baf-A1刺激THP-1细胞中,胞质释放mtDNA(m、n)或TFAM(q、r)与LC3B共定位的图像(m、q)及分析(n、r)
(3)TFAM与LC3B相互作用
氧化应激条件下,HeLa细胞胞质中TFAM-FLAG与GFP-LC3B发生共沉淀(图3a,b);炎症和氧化应激条件下,THP-1细胞内源性LC3B与胞质TFAM共沉淀(图3c)。HeLa细胞的半下拉实验显示,内源性和外源性TFAM均可被His-LC3B下拉(图3d)。体外实验中,大肠杆菌表达并纯化的His-TFAM能下拉LC3家族的LC3A、LC3C、GABARAPL1和GABARAPL2,无法下拉GABARAP(图3e)。
(4)TFAM通过自噬溶酶体途径介导mtDNA的降解
通过 mRFP-eGFP-LC3B 区分自噬体与自溶酶体,应激条件下观察到 LC3 与 TFAM、mtDNA 的共定位增加,部分 GFP 淬灭的红色斑点提示其被递送至高酸性自溶酶体(图 4a–d)。稳定转染 GFP-LC3B 的 HeLa 细胞中,无刺激时 DsRed-TFAM 和 mtDNA 与 TOM20 标记的线粒体共定位,氧化应激后 GFP-LC3 与 TOM20- DsRed-TFAM、mtDNA 共定位增强。构建 TFAM-mRFP-eGFP 质粒后,正常条件下 TFAM-mRFP-eGFP 与 mtDNA、TOM20 标记的线粒体共定位(图4e,f);H2O2刺激后,TFAM/mtDNA 斑点失去线粒体共定位并呈现 GFP 淬灭的红色荧光(图 4e–h),证实其暴露于细胞质且被递送至溶酶体。四色成像显示,应激状态下 DsRed-TFAM 与 GFP-LC3 及 LAMP1 标记的溶酶体共定位(图 4i–l),提示大量 DsRed-TFAM 脱离线粒体,与 GFP-LC3 斑点和 LAMP1 标记的溶酶体共定位。
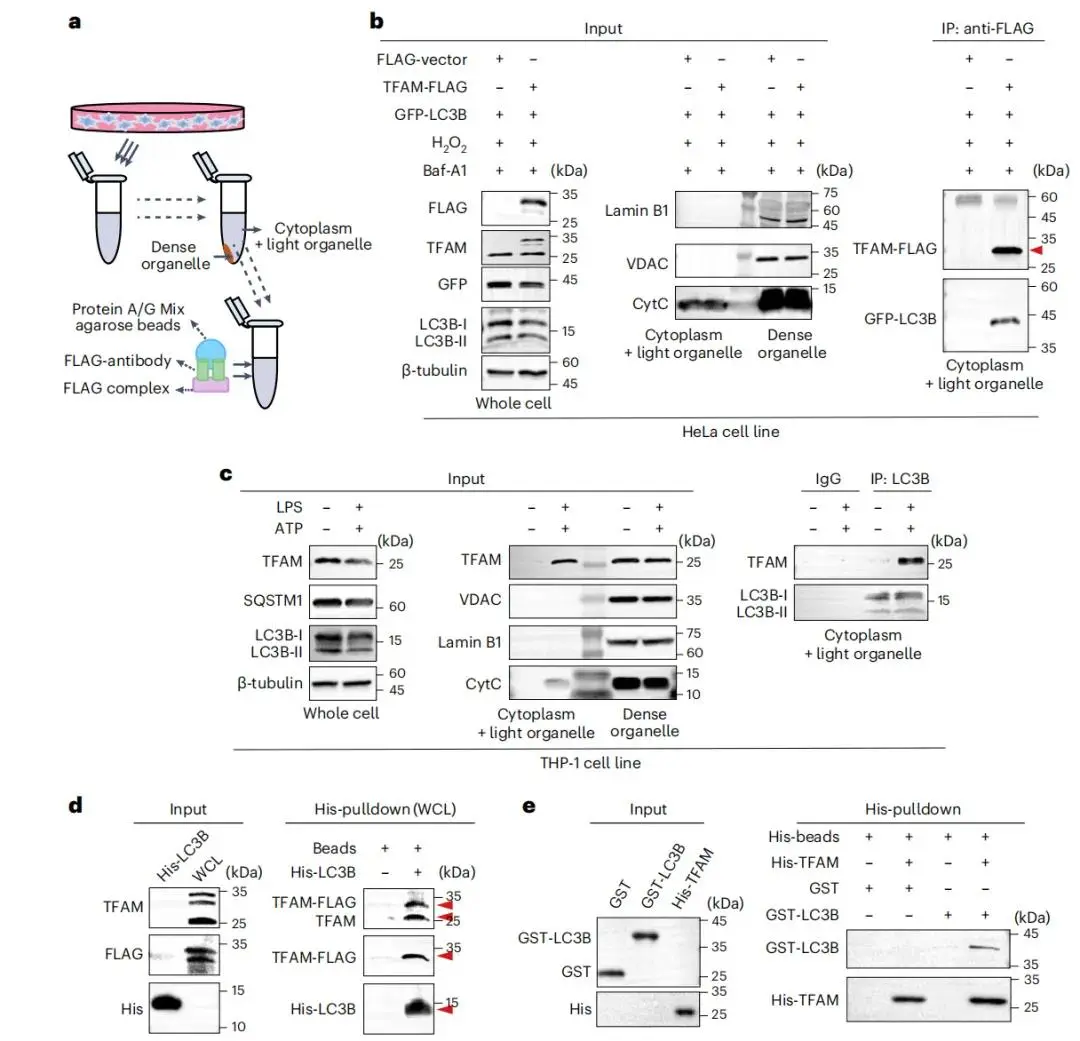
图3 TFAM与LC3B的相互作用。(a)实验策略示意图;(b)H2O2和Baf-A1刺激的GFP-LC3B转染且过表达TFAM-FLAG的HeLa细胞胞浆裂解液中,anti-FLAG免疫共沉淀验证TFAM-FLAG与GFP-LC3B的相互作用;(c)LPS和ATP刺激的THP-1细胞胞浆裂解液中,anti-LC3B免疫共沉淀验证TFAM与LC3B的相互作用;(d)重组His-LC3B下拉H2O2和Baf-A1处理的TFAM-FLAG过表达HeLa细胞全细胞裂解液中的TFAM及TFAM-FLAG;(e)重组His-TFAM下拉重组GST-LC3B
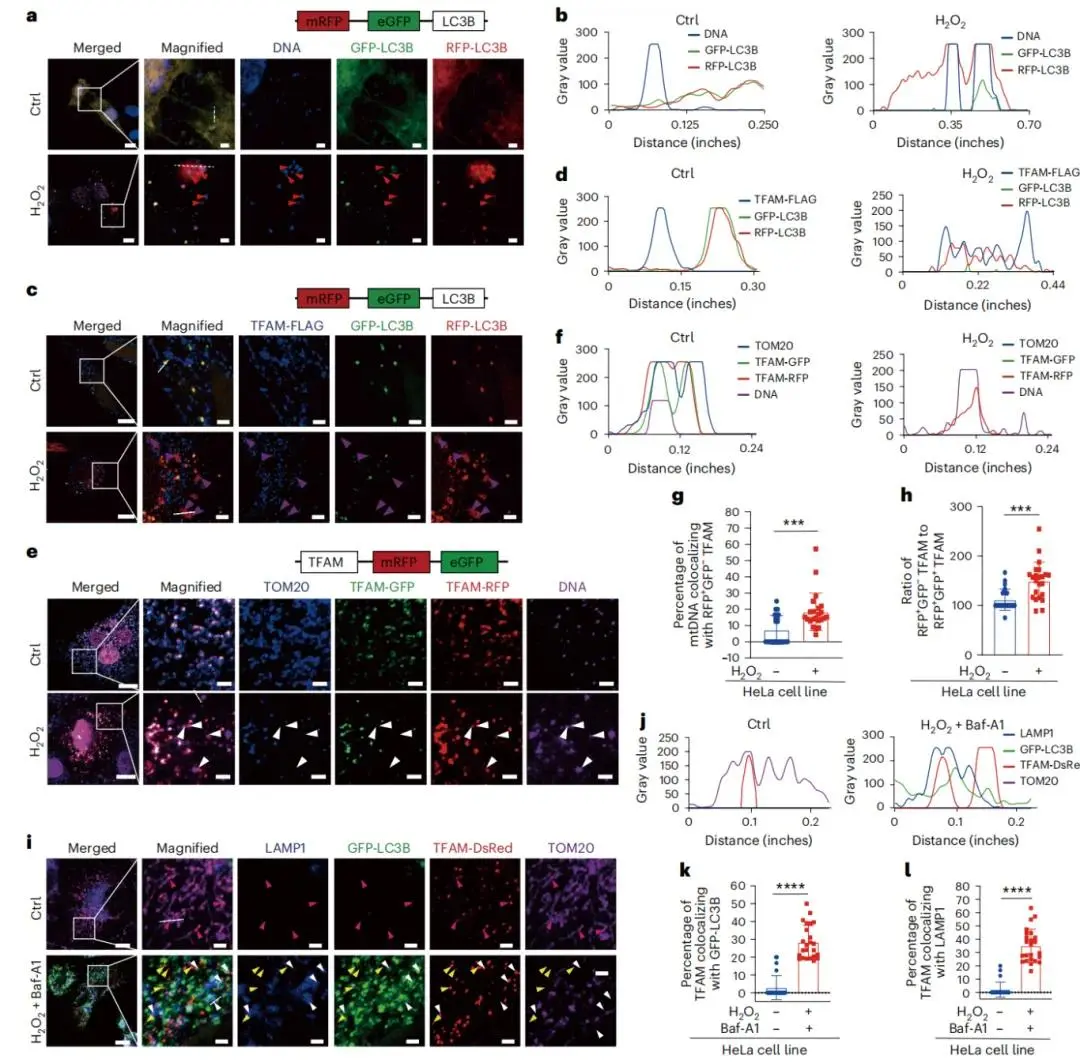
图4 TFAM通过自噬溶酶体途径介导mtDNA降解。(a)H2O2处理的HeLa细胞中mtDNA与GFP淬灭的RFP-LC3B共定位代表性图像;(b)对应共定位分析;(c)H2O2处理的HeLa细胞中TFAM-FLAG与GFP淬灭的RFP-LC3B共定位代表性图像;(d)对应共定位分析;(e)H2O2处理的HeLa细胞中TFAM与mtDNA共定位代表性图像;(f)对应共定位分析;(g)(h)统计分析;(i)H2O2和Baf-A1刺激的GFP-LC3B稳定转染HeLa细胞中TFAM与自噬体、溶酶体共定位代表性图像;(j)对应共定位分析;(k)(l)统计分析
(5)TFAM 敲低通过 cGAS–STING 通路加剧炎症
线粒体应激增加会降低 TFAM 水平,同时激活 cGAS–STING 通路,使 HeLa 细胞和 THP-1 细胞中磷酸化干扰素调节因子 3(p-IRF3)与 IRF3 的比值升高。应激条件下,用 Baf-A1 抑制自噬会进一步增强 IRF3 磷酸化和 IFNβ 上调,无应激时也会轻微增强该信号。ATG7 缺陷 HeLa 细胞中,TFAM 水平保留较高,IRF3 激活(图 5a、b)和 IFNβ 表达(图 5c)均增加,证实 TFAM 介导的自噬降解减少会加剧该通路信号。ATG7 敲除细胞中 STING 水平升高(图 5a);STING 敲除 HeLa 细胞中,氧化应激无法降低 TFAM 或诱导对照组中出现的 IRF3 磷酸化(图 5d–f),但胞质线粒体 DNA(mtDNA)释放情况类似。应激条件下,TFAM 敲低激活的 STING 信号会进一步增强(图 5g–j),而 STING 敲除细胞中,尽管仍保留胞质 mtDNA 应答,但 IRF3 激活被阻断(图 5k、l)。
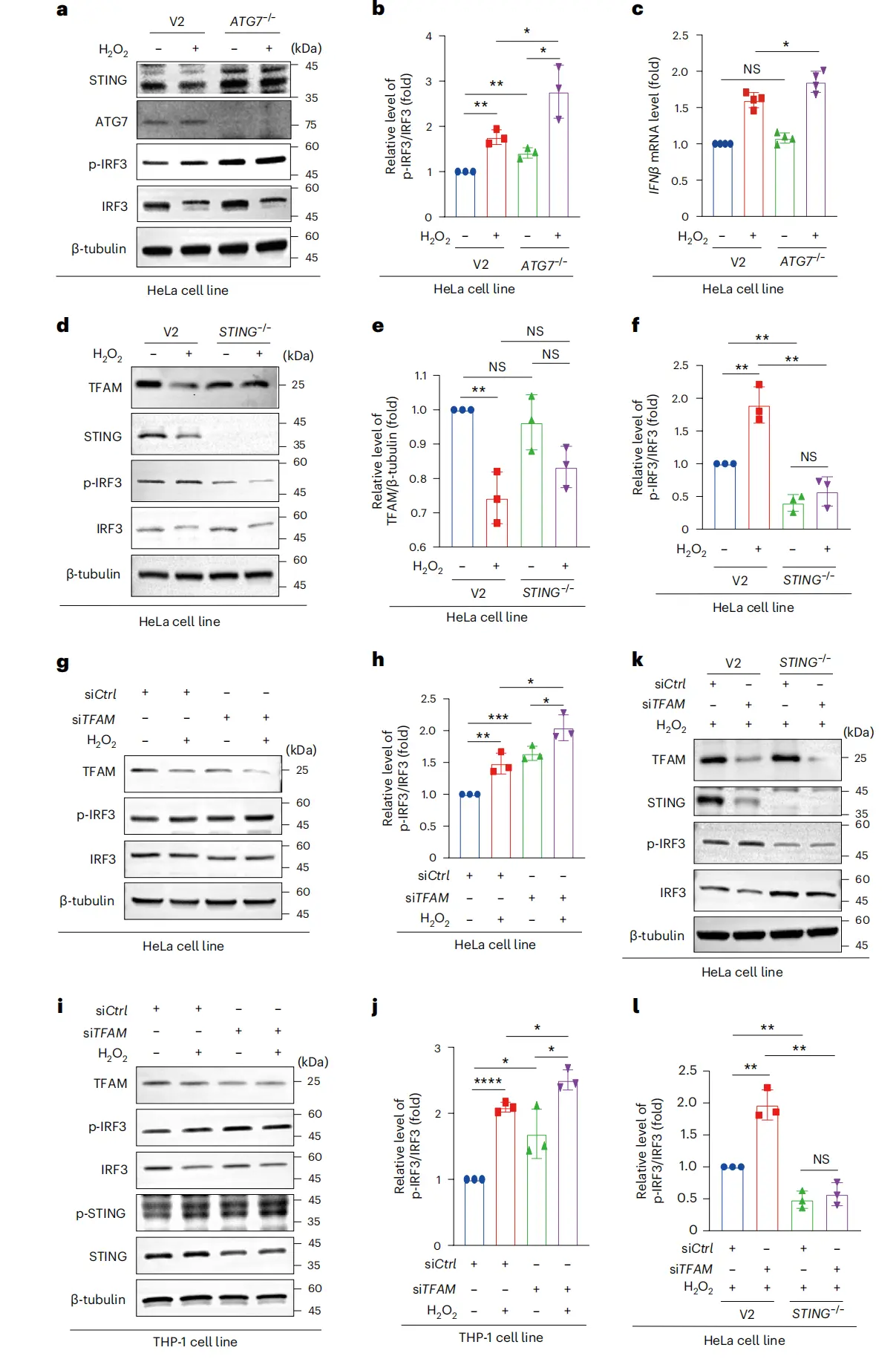
图5 TFAM敲低通过cGAS–STING通路加重炎症。(a)ATG7缺陷和对照HeLa细胞的SDS-PAGE分析;(b)上述细胞p-IRF3/IRF3比值统计分析;(c)上述细胞IFNβ表达;(d)STING缺陷和对照HeLa细胞的SDS-PAGE分析;(e)上述细胞TFAM/β-tubulin比值统计分析;(f)上述细胞p-IRF3/IRF3比值统计分析;(g)TFAM敲低HeLa细胞的SDS-PAGE分析;(h)上述细胞p-IRF3/IRF3比值统计分析;(i)TFAM敲低THP-1细胞的SDS-PAGE分析;(j)上述细胞p-IRF3/IRF3比值统计分析;(k)H2O2处理下STING缺陷HeLa细胞的SDS-PAGE分析;(l)上述细胞p-IRF3/IRF3比值统计分析
(6)自噬受体可通过 LIR 基序与 LC3 相互作用
自噬受体可通过LIR基序与LC3相互作用,生物信息学分析预测缺失信号肽的成熟TFAM含LIR1和LIR2两个LIR基序(Fig. 6a),相关变异体质粒的表达及线粒体定位已检测。免疫共沉淀结果显示,改变LIR2而非LIR1残基会破坏与LC3B的相互作用,体外实验也证实LIR2缺失的TFAM无法拉取LC3B(Fig. 6b-d),即TFAM的LIR2基序特异性介导其与LC3B的相互作用。在氧化应激(HeLa细胞中H2O2处理)或炎症应激(THP-1细胞中LPS处理)下,与野生型TFAM相比,LIR2缺失的TFAM挽救的TFAM敲低细胞,其细胞质免疫沉淀复合物中检测到更多mtDNA释放(Fig. 6e-i),但LIR2改变不影响TFAM与mtDNA的相互作用;免疫荧光显示氧化应激下LIR2缺失的TFAM过表达会导致更多TFAM和mtDNA释放到细胞质(Fig. 6j-m),qPCR验证H2O2处理后LIR2缺陷TFAM挽救的细胞中胞质mtDNA更多,且Δ4、Δ5、Δ6变异体无显著差异,未受应激时LIR2缺陷单独不触发mtDNA释放(Fig. 6n-q),表明LIR2缺陷的TFAM无法调控自噬介导的mtDNA降解,导致胞质mtDNA积累。氧化应激会诱导线粒体膜电位丧失和ROS生成增加,但野生型与LIR2缺失的TFAM过表达挽救组在 mitochondrial 表型(膜电位、ROS)及pH敏感mt-Keima探针检测的线粒体自噬水平上均无明显差异。人TFAM与秀丽隐杆线虫HMG-5具有保守性,但HMG-5的LIR基序氨基酸序列不保守;免疫共沉淀显示氧化应激下,HMG-5的LIR缺失(尤其是Δ3,91-94位氨基酸)会干扰其与LC3的相互作用,且与野生型HMG-5相比,H2O2处理后过表达HMG-5 Δ3的秀丽隐杆线虫,其免疫反应(IRG-1表达)和抗氧化反应(CTL-1表达)均增强)。
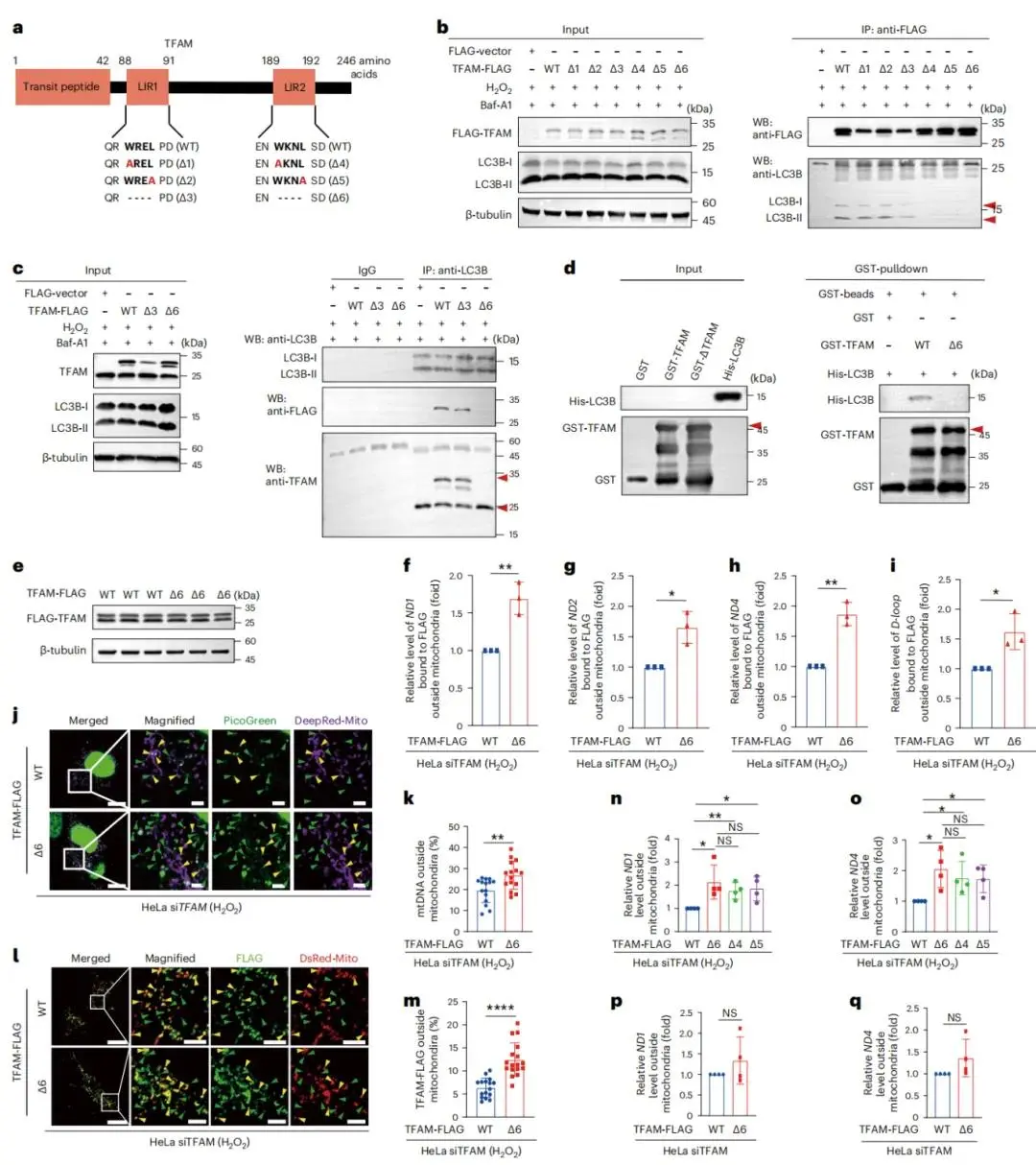
图6 TFAM的LIR基序对其与LC3B的相互作用及mtDNA降解的必要性。(a)典型LIR序列与TFAM的手动比对,及TFAM上LIR1或LIR2核心残基突变或缺失相关的不同质粒示意图;(b)H2O2和Baf-A1处理的HeLa细胞全细胞裂解液中,用抗FLAG共免疫沉淀验证LC3B与不同TFAM-FLAG变体的相互作用(WB为蛋白质印迹);(c)H2O2和Baf-A1处理的HeLa细胞全细胞裂解液中,用抗LC3B共免疫沉淀验证LC3B与LIR1核心残基缺失(Δ3)或LIR2核心残基缺失(Δ6)的TFAM-FLAG的相互作用;(d)重组GST-TFAM Δ6无法拉取重组His-LC3B;(e–i)TFAM敲低的HeLa细胞经TFAM-FLAG WT或TFAM-FLAG Δ6挽救,H2O2刺激后用抗FLAG抗体免疫沉淀细胞质裂解物,通过qPCR检测与细胞质TFAM-FLAG结合的mtDNA;(j–m)H2O2处理后,TFAM敲低并经TFAM-FLAG WT或TFAM-FLAG Δ6挽救的HeLa细胞中,线粒体外mtDNA或TFAM-FLAG的共聚焦图像及百分比;(n–q)TFAM敲低的HeLa细胞经TFAM-FLAG WT或Δ6、Δ4、Δ5挽救,有无H2O2处理时通过qPCR(ND1、ND4引物)检测细胞质mtDNA
(7)TFAM 介导的类核自噬可减弱 cGAS–STING 炎症信号
TFAM 介导的类核自噬可减弱 cGAS–STING 炎症信号。LIR2 缺失的 TFAM 在 TFAM 敲低的 THP-1 细胞(图 7a–c)和 HeLa 细胞(图 7f–h)中,应激后磷酸化 IRF3 和 STING 水平高于野生型 TFAM 拯救组,无应激时两者表达水平相似(图 7a,f),且这些细胞中 IFNβ 表达升高(图 7d,e,i)。STING 敲除且 TFAM 敲低的 HeLa 细胞经野生型 TFAM、LIR2 缺失 TFAM、野生型 STING 或 LIR 基序改变的 STING 重构后,氧化应激下 LIR2 缺失 TFAM 与 STING LIR 变体的组合使自噬底物 SQSTM1 积累更多(图 7j,k)。线粒体功能上,LIR2 缺失 TFAM 拯救的 TFAM 敲低细胞,其线粒体膜电位 ΔΨm 在应激前后与野生型 TFAM 表达细胞无差异,基础状态下 ROS 水平更高但过氧化物处理后无此差异(图 7n,o);两组细胞耗氧率相当,但表达 LIR2 缺失 TFAM 的线粒体更易受氧化损伤(图 7p)。TFAM 可通过结合 LC3 作为选择性自噬受体,将线粒体释放的 mtDNA 转运至自噬溶酶体降解,此即类核自噬,该途径能抵消 mtDNA 积累引发的炎症(图 7q)。
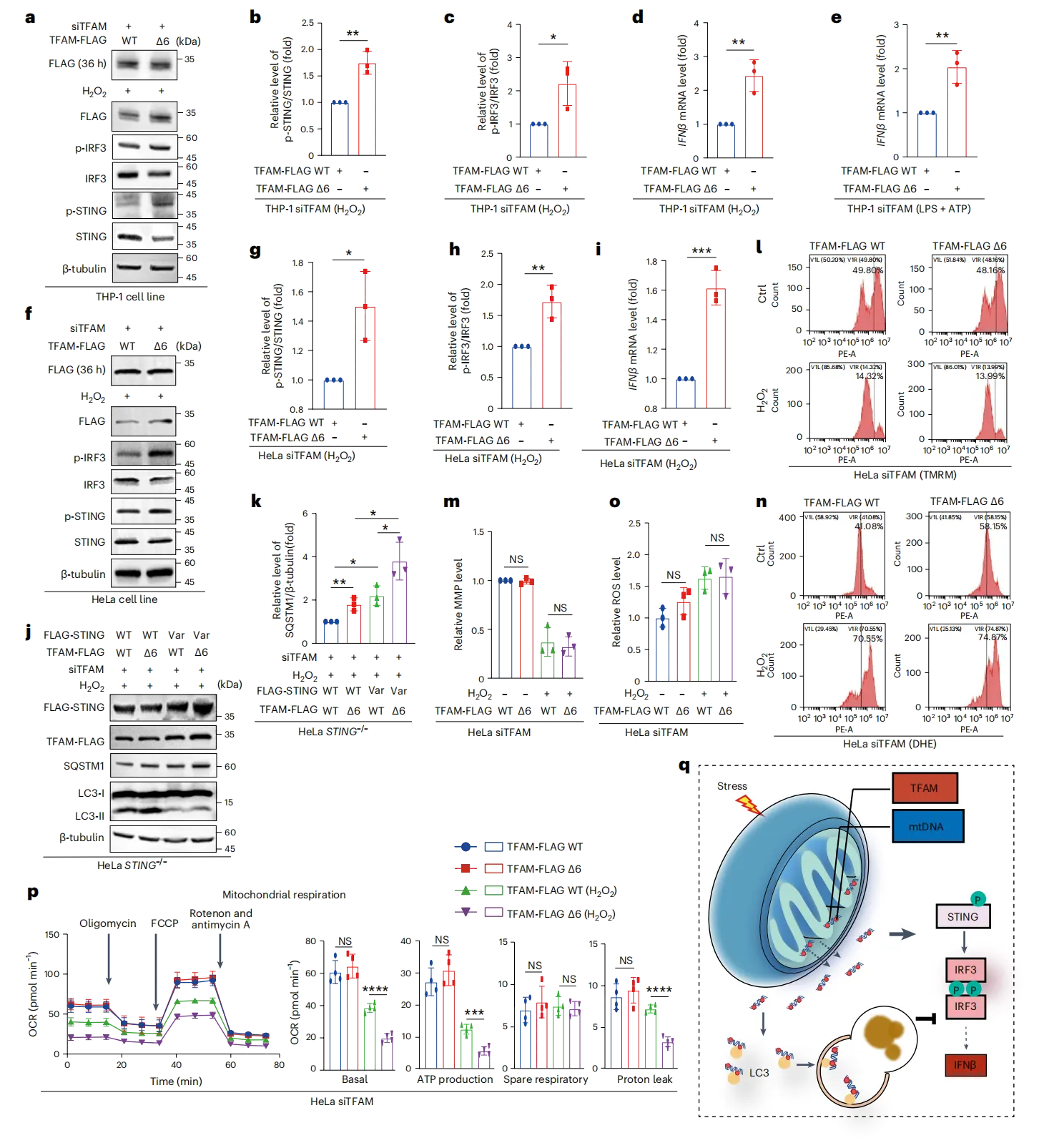
本研究揭示了线粒体转录因子A(TFAM)的全新功能——作为自噬受体介导“类核吞噬(nucleoid-phagy)”,从而调控细胞炎症反应。当细胞遭遇氧化或炎症应激时,线粒体DNA(mtDNA)会泄漏到细胞质中,而TFAM通过其LC3相互作用区域(LIR)基序与自噬蛋白LC3B结合,将mtDNA-TFAM复合物靶向转运至自噬溶酶体降解,避免泄漏的mtDNA激活cGAS-STING等炎症信号通路。实验证实,TFAM的LIR基序突变虽不影响其正常线粒体功能,却会导致细胞质mtDNA积累和炎症反应加剧,且该机制在秀丽隐杆线虫中具有保守性。这一发现阐明了细胞选择性清除胞质泄漏mtDNA的关键途径,深化了对自噬调控炎症的理解,为线粒体损伤相关炎症疾病的研究提供了新的分子靶点和理论基础。
|
科研咨询+技术服务
|
医学实验服务
|

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

