
糖尿病是一种慢性代谢性疾病,以持续性高血糖为特征,引起各种并发症,包括伤口愈合受损、慢性伤口,特别是糖尿病溃疡,由于其愈合缓慢、感染风险高和复发频繁,因此存在显著的临床挑战。尽管诸如负压疗法、皮肤替代物和生长因子疗法等治疗方法是可用的,但是它们在解决慢性炎症和促进血管生成方面的有效性仍然有限,不能完全满足临床需要。因此,迫切需要能够针对这些挑战,加速愈合并减少并发症的创新治疗材料。

针对上述问题,重庆大学郑晓媛团队设计了一种纳米复合水凝胶(KC@PF@TA),以利用由银(Ag)纳米颗粒增强的Ti 3C 2 Tx的光热抗菌性能和PF的抗炎、血管生成和细胞增殖促进作用。该水凝胶表现出优异的生物相容性、可注射性和机械性能,使其适用于治疗不规则伤口。水凝胶的KC(氧化葡甘聚糖和羧甲基壳聚糖)组分促进了药物的持续释放,负反馈减少了炎症,增强了抗菌作用,促进了细胞增殖和血管生成,不断推动伤口血运重建。研究Ti 3C 2 Tx和Ag之间的相互作用,评估了水凝胶的性质,并评估了其体外抗菌效率,细胞活力和生物相容性,并在糖尿病动物模型中应用于治疗全层感染伤口,结果显示该水凝胶能加速伤口闭合,为糖尿病伤口治疗提供了全面解决方案。该文章于2025年2月8日以《An MXene nanocomposite hydrogel for enhanced diabetic infected wound healing via photothermal antibacterial properties and bioactive molecule integration》为题发表于《MTB》(DOI:10.1016/j.mtbio.2025.101538)。
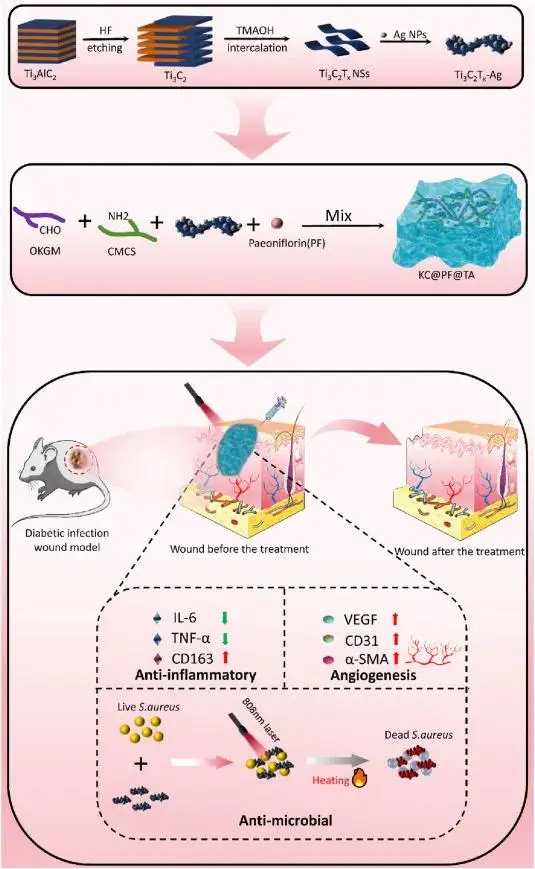
图1 研究示意图
(1)Ti₃C₂Tx-Ag复合材料的合成和表征
Ti₃C₂Tx-Ag纳米复合材料的制备过程如图2所示。对Ti₃AlC₂的致密结构(图2A)进行HF蚀刻,去除了Al层,将其转化为多层的中空手风琴状结构的m-Ti₃C₂Tx(图2B)。在TMAOH插层和超声剥离之后,获得了尺寸约为300 nm的u-Ti₃C₂Tx纳米片(图2C)。选择1:5的比例。u-Ti₃C₂Tx表面存在丰富的活性-OH基团可能是导致柠檬酸钠还原的AgNPs尺寸不均匀的原因(图2D-F)。元素分析证实了AgNPs在u-Ti₃C₂Tx纳米片上的成功沉积(图2G)。
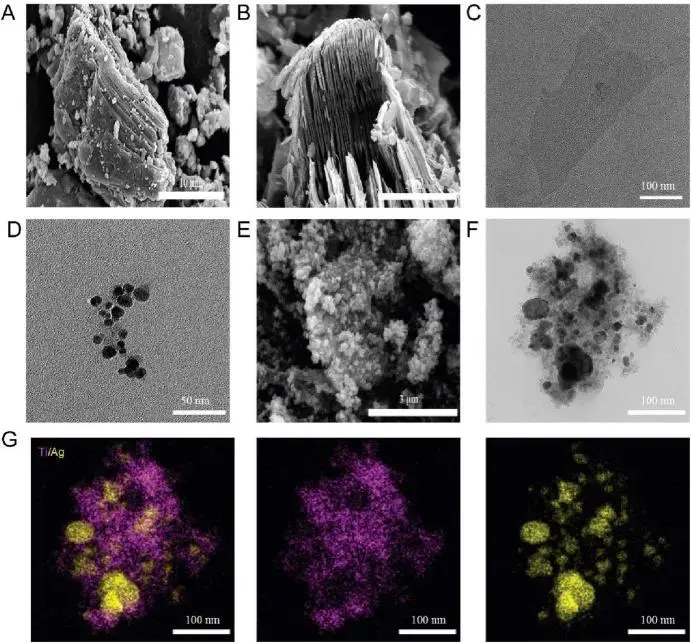
图2 Ti₃C₂Tₓ-Ag 复合材料的合成。(A)Ti3AlC2的SEM图像 (B)m-Ti3C2Tx的SEM图像 (C)u-Ti3C2Tx的TEM图像 (D)Ag NPs的TEM图像 (E)Ti3C2Tx-Ag的SEM图像 (F)Ti3C2Tx-Ag的TEM图像 (G)(F)中Ti、Ag元素的EDS分布图
XRD 分析显示,Ti₃AlC₂ 的 (104) 峰在 HF 刻蚀后完全消失,表明 Al 层被去除。同时,(004) 和 (002) 峰强度减弱并发生位移,说明层间距改变和结构有序度降低。此外,出现银特征的 (111)、(200)、(220) 峰,证实 AgNPs 成功结合到 u-Ti₃C₂Tx 纳米片中且结晶度高(图 3A)。XPS 分析显示,去除 Al 层后出现新峰(如 C 1s 在 283.3 eV、280 eV),表明 C 和 Ti 的键合环境改变。Ti 2p 峰左移,可能是由于形成表面终止基团(如 -OH、-F 或 -Cl)。Ag 3d 结合能(367.3 eV 和 373.4 eV)低于纯银,表明 Ag 3d 与 Ti₃C₂Tx 形成表面化学键。Ti 2p 峰右移进一步支持这种相互作用(图 3B - F)。
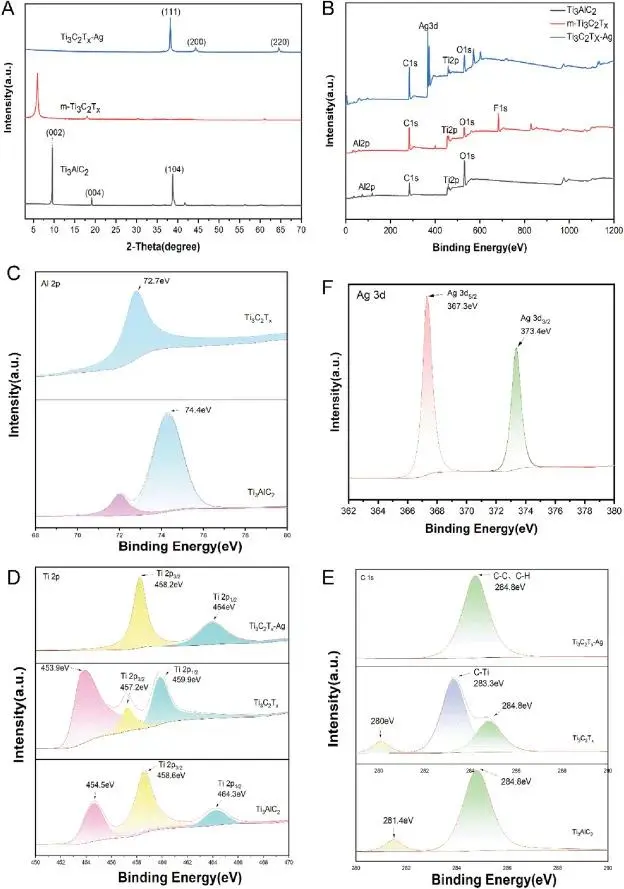
图3 纳米复合材料的表征(A)Ti₃AlC₂、m-Ti₃C₂Tx、Ti₃C₂Tx-Ag的XRD图谱(B)XPS谱图及(C)Al 2p、(D)Ti 2p、(E)C 1s、(F)Ag的高分辨率XPS谱图
(2)KC@TA水凝胶的制备和表征
所得KC水凝胶具有独特的3D孔隙结构(图4A)。引入Ti₃C₂Tx-Ag纳米复合材料后,KC@TA水凝胶呈现深绿色,孔隙明显变小,形成更紧凑的3D架构(图4B)。元素分析证实了Ti₃C₂Tx-Ag的成功结合。傅里叶变换红外光谱(FT-IR)显示,O-H和N-H键在3421 cm⁻¹处有轻微位移,可能是由于交联引起的氢键变化。C=O峰在1601 cm⁻¹处的位置和强度变化表明形成新的酰胺键或羧基,确认CMCS和OKGM成功交联并形成新型3D网络,同时保持原有化学特性(图4D)。X射线衍射(XRD)显示Ti₃C₂Tx-Ag在(111)晶面的特征峰,证实其成功加载到KC水凝胶中(图4E)。拉曼光谱分析显示KC@TA水凝胶背景强度升高,特征峰较弱,表明Ti₃C₂Tx-Ag负载量低但仍存在(图4F)。X射线光电子能谱(XPS)显示KC@TA在282.9 eV处有明显的C-Ti峰,而KC在283.0 eV处信号较弱,证实C-Ti键形成和Ti₃C₂Tx-Ag成功整合到KC基质中。O 1s谱从KC的531.1 eV移至KC@TA的530.8 eV,表明通过KC氧基团与Ti₃C₂Tx-Ag的相互作用形成了Ti-O/Ag-O键。这些结果表明Ti₃C₂Tx-Ag成功结合到KC水凝胶基质中,形成稳定的C-Ti和Ti-O/Ag-O键,增强了复合水凝胶的结构完整性。
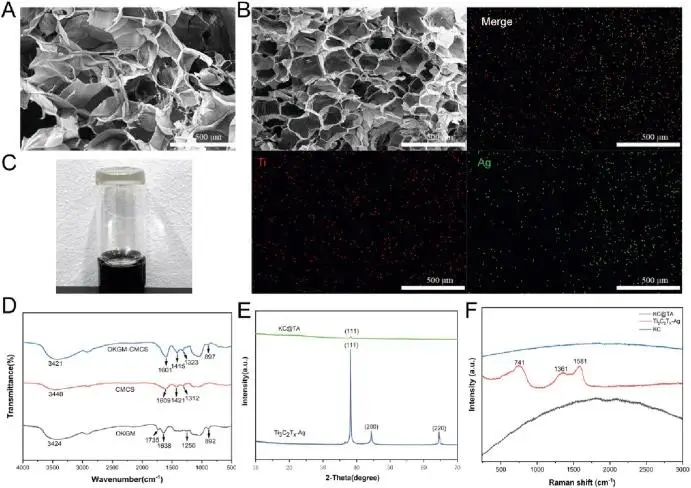
图4 水凝胶的制备与表征(A)KC的SEM图像(B)KC@TA水凝胶的SEM图像及Ti、Ag的EDS分布图(C)室温下KC@TA水凝胶的数码照片(D)OKGM、CMCS和OKGM-CMCS的FT-IR光谱(E)Ti₃C₂Tx-Ag和KC@TA的XRD图谱(F)KC、Ti₃C₂Tx-Ag和KC@TA复合水凝胶材料的拉曼光谱
CMCS、OKGM和Ti₃C₂Tx-Ag的交联在2分钟内迅速形成水凝胶(图5A),且这些水凝胶具有出色的自愈合性能,分段的水凝胶在室温下5分钟内可重新形成完整结构(图5B)。水凝胶良好的可注射性使其适用于不规则伤口治疗(图5C)。KC@TA水凝胶在第一小时内迅速膨胀,12小时内膨胀率持续增加,24小时后接近平衡(图5D)。降解过程缓慢,约11天完全降解(图5E)。此外,Ag能够从水凝胶中持续释放(图5F)。这些结果表明,KC@TA水凝胶的高吸水性和慢降解率有助于促进伤口愈合的湿润环境,同时实现药物的持续释放,减少频繁换药需求,提高治疗效果。
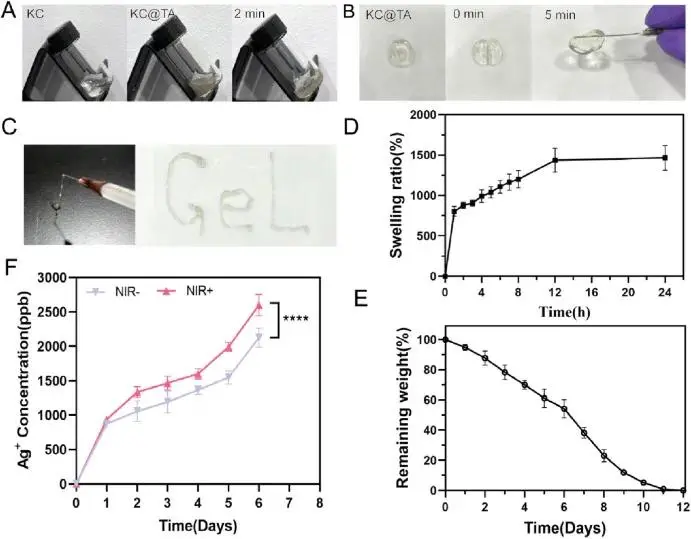
图5 水凝胶综合性能测试(A)KC@TA水凝胶形成过程的照片(B)自愈合过程的照片(C)可注射性能的照片(D)水凝胶膨胀比%随时间变化的曲线(E)水凝胶剩余重量%随时间变化的曲线(F)有无近红外(NIR) irradiation (808 nm, 1.2W/cm+2, 10 min) 下Ag浓度随时间释放的曲线(∗∗∗∗p < 0.0001, n = 3)
(3)复合材料和水凝胶的光热性能
Ti₃C₂Tx和Ti₃C₂Tx-Ag在808 nm近红外光照射下展现出浓度依赖性的光热升温效果(图6A、B),且KC@TA水凝胶的光热稳定性强于Ti₃C₂Tx-Ag纳米复合材料(图6C、D)。与纯水相比,KC@TA水凝胶在近红外光照射下温度显著升高,且在循环激光照射下光热效果稳定。这些结果表明,KC@TA水凝胶具有优异的光热转换能力。Ti₃C₂Tx-Ag和KC@TA在20分钟照射下的温度曲线(图6E)显示,KC@TA达到峰值温度较慢,可能是由于水凝胶基质调节了光热转换过程,使其温度响应更渐进和稳定。通过冷却时间与温度差比值的自然对数线性拟合计算时间常数(τ)和光热转换效率(η)。KC@TA的τ值为4.106分钟,略低于Ti₃C₂Tx-Ag的4.284分钟(图6F)。然而,KC@TA水凝胶的光热转换效率达29.39%(图6F),表明水凝胶提升了光热性能。这种提升归因于水凝胶与纳米材料的协同作用,改善了热绝缘和光热能量分布。红外热成像进一步证实,将Ti₃C₂Tx-Ag纳入KC水凝胶基质可以有效调节温度上升,提供更受控和均匀的光热响应(图6G、H),显示水凝胶基质增强了热稳定性和调节了热分布,体现了两者的协同效应。
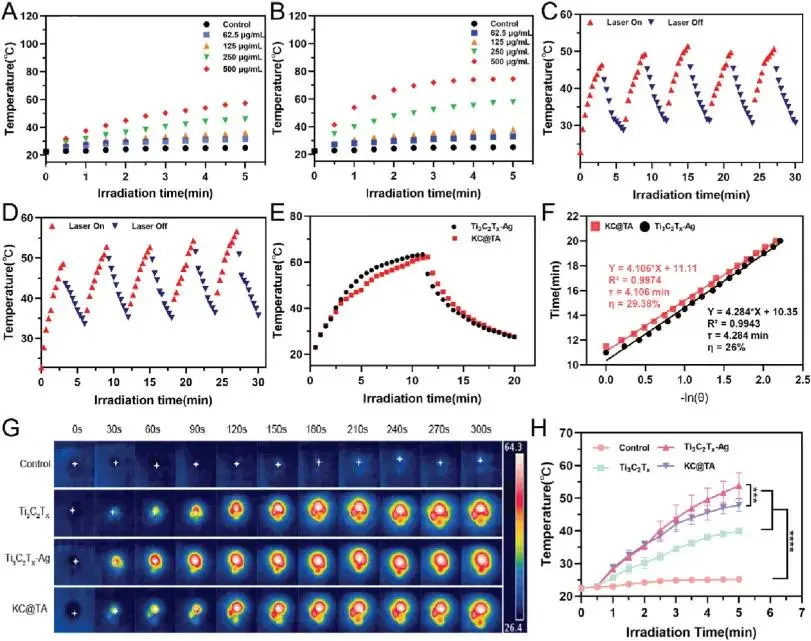
图6 光热性能测试 (A,B) Ti₃C₂Tₓ 与 Ti₃C₂Tₓ-Ag 悬浮液的温度变化曲线。(C, D) 激光“开/关”五轮循环中 (C) Ti₃C₂Tₓ-Ag 与 (D) KC@TA 水凝胶的温度波动。(E) Ti₃C₂Tₓ-Ag 与 KC@TA 水凝胶溶液在辐照-冷却全程的温度曲线。(F) 冷却阶段“时间-ln(ΔT)”线性拟合图,用于计算光热转换效率。(G) H₂O、Ti₃C₂Tₓ、Ti₃C₂Tₓ-Ag 及 KC@TA 水凝胶在近红外辐照不同时间点的典型红外热像。(H) 对应 (G) 的定量温度统计(***p < 0.001,****p < 0.0001,n = 3
(4)水凝胶的体外抗菌特性
研究三种水凝胶(KC、KC@T200、KC@TA200)对金黄色葡萄球菌(S.aureus)的抗菌效果,其中KC@TA200在近红外光(808 nm, 1.2 W/cm²)照射下展现出优越的光热抗菌活性,能显著减少细菌活性至约10%,且在该条件下未观察到细菌菌落形成(图7A和B)。扫描电子显微镜(SEM)图像显示,KC@TA200处理后的细菌出现严重变形和破坏,进一步证实了其抗菌性能的提升(图7C)。
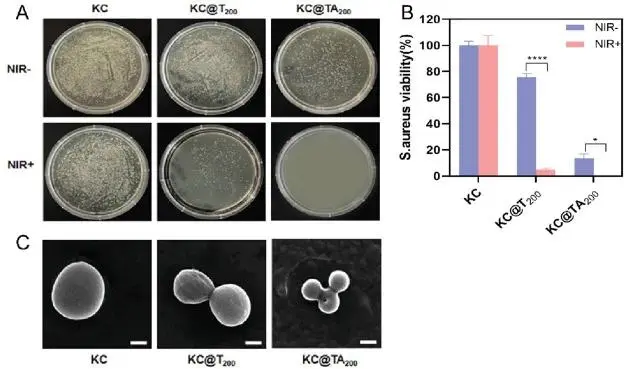
图7 体外抗菌实验(A)水凝胶与S.aureus共培养后菌落照片(B)S.aureus存活率定量分析(C)NIR照射后不同组S.aureus的SEM图像(比例尺:1 μm)
(5)PF促进HUVECs增殖和迁移
PF(从芍药中提取的活性化合物)对HUVECs细胞增殖和迁移的影响实验表明:PF浓度在3.125至200 μmol/L范围内,经48小时处理后,细胞增殖呈剂量依赖性增加,12.5 μmol/L开始显著上升,200 μmol/L时达到最高(图8A)。细胞迁移实验显示,在低(6.25 μmol/L)、中(12.5 μmol/L)、高(25 μmol/L)浓度PF下,随时间推移迁移率明显提高,尤其是48小时后,以25 μmol/L PF时迁移率最高(图8 B和C)。这些结果表明PF能促进细胞增殖和加速细胞迁移,对有效伤口愈合至关重要。
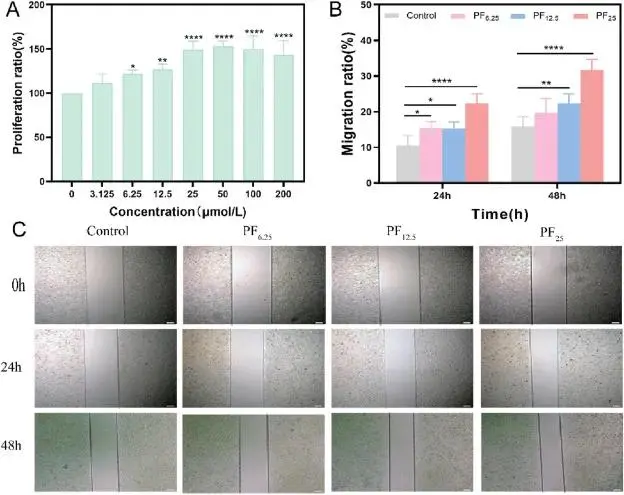
图8 HUVECs细胞增殖和迁移评估(A)不同浓度PF处理的HUVECs增殖率结果(B)PF处理的HUVECs迁移率及(C)0小时、24小时和48小时的代表性图像(∗p < 0.05, ∗∗p < 0.01, ∗∗∗∗p < 0.0001, n = 4;比例尺:200 μm)
(6)水凝胶的体外生物相容性
对KC@PF@TA水凝胶进行生物安全性评估发现,0、25、50、100、200、400 μg/mL浓度下,除400 μg/mL组外,其余组24小时共培养后细胞存活率均超75%,表明具有良好的细胞相容性,但48小时时400 μg/mL组细胞存活率降至54.86%,显示该浓度下存在显著细胞毒性,故选择200 μg/mL为最佳浓度,在此浓度下,Calcein-AM/PI染色显示共培养48小时后死细胞极少,表明细胞毒性影响小。此外,KC@PF@TA水凝胶的溶血率约为3.17%,低于生物医用材料要求的5%标准,说明其对红细胞的不良影响较小,进一步支持其体内使用的安全性。图9展示了相关实验结果。
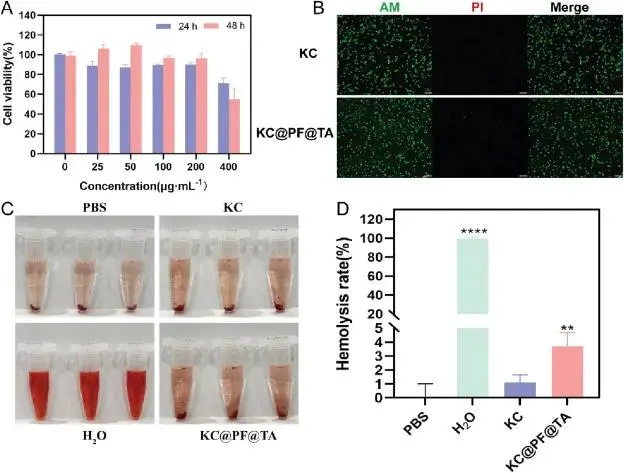
图9 体外生物相容性及溶血测试(A)KC@PF@TA水凝胶中不同浓度Ti₃C₂Tx-Ag处理的NIH3T3细胞毒性结果(24小时和48小时)(B)200 μg/mL水凝胶处理48小时后Calcein-AM/PI染色细胞的代表性图像(比例尺:100 μm)(C)溶血代表性图片及(D)溶血率定量分析(∗∗p < 0.01, ∗∗∗∗p < 0.0001, n = 3)
KC@PF@TA水凝胶在适当的纳米材料浓度下展现出良好的生物相容性和低溶血率,表明其作为伤口修复材料的安全性和有效性。
(7)KC@PF@TA水凝胶体内糖尿病感染创面愈合性能
体外研究表明,KC@PF@TA水凝胶对修复糖尿病伤口具有显著潜力。通过连续五天给C57BL/6J小鼠注射STZ,成功建立糖尿病小鼠模型,血糖水平稳定超过16.7 mM。在小鼠背部制造6 mm全层伤口,并在治疗前48小时感染金黄色葡萄球菌,随后用KC、KC@PF和KC@PF@TA水凝胶进行治疗。
如图10A和B所示,与空白水凝胶(KC组)相比,KC@PF和KC@PF@TA水凝胶处理的伤口愈合速度显著加快。在第13天之前,KC@PF和KC@PF@TA组的愈合率差异不大,但从第13天到第21天,KC@PF@TA水凝胶处理的伤口愈合加速,第21天愈合率达到约88.12%(图10C)。这表明,尽管KC@PF和KC@PF@TA组与空白水凝胶相比在愈合率上没有显著差异,但药物负载水凝胶有效缩短了炎症阶段,促进了愈合向增殖阶段的转变。重要的是,KC@PF@TA水凝胶还增强了组织重塑阶段。
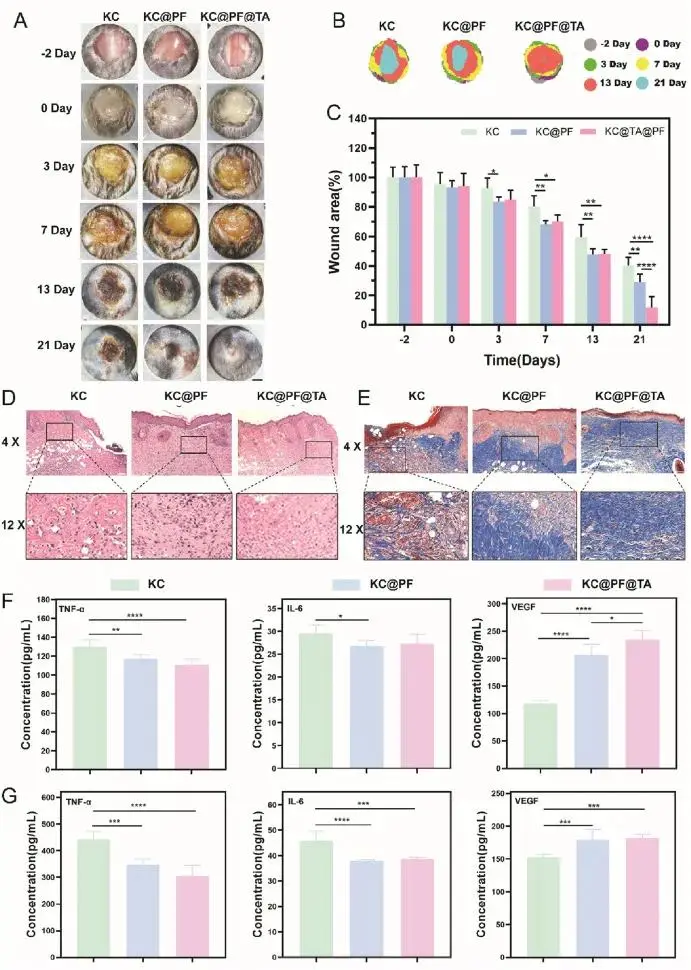
图10 糖尿病小鼠伤口愈合实验(A)不同时间点(-2、0、3、7、13、21天)伤口代表性图像(B)伤口面积随时间变化图(比例尺:20 mm)(C)伤口面积统计分析(D)21天伤口组织的HE染色(E)Masson's trichrome染色(F)血清中TNF-α、IL-6和VEGF表达水平的ELISA结果(G)伤口组织中上述因子的表达水平
HE 染色显示,KC@PF@TA 组在第 21 天愈合状态最佳,表皮厚度增加,伤口长度减少(图 10D)。Masson's trichrome 染色显示,KC 组伤口处仍有血痂残留,表皮结构不完整;KC@PF 组表皮更清晰完整,但胶原纤维排列不规则;KC@PF@TA 组伤口表皮完整,胶原纤维均匀排列,接近健康皮肤(图 10E)。此外,KC@PF 和 KC@PF@TA 水凝胶处理显著降低了血清和伤口组织中 IL-6 和 TNF-α 的表达,同时 VEGF 表达增加(图 10 F和G),表明这两种水凝胶有效抑制了炎症反应,促进了新生血管形成和组织再生。
(8)KC@PF@TA水凝胶通过抗炎和促血管生成促进伤口愈合
免疫组化染色显示,KC 组 CD163 表达较低,表明 M2 巨噬细胞活性弱,可能导致免疫调节不足而伤口愈合延迟(图 11A)。相比之下,KC@PF 组 CD163 表达显著增加,表明 PF 能有效激活 M2 巨噬细胞,增强免疫调节功能,加速伤口修复。而 KC@PF@TA 组 CD163 表达更高,凸显了 PF 和 Ti₃C₂Tx-Ag 的协同作用在促进 M2 巨噬细胞活性方面的优势,这种增强的免疫调节可能促进了组织修复和伤口愈合。Western blot 定量分析 CD163 蛋白表达的结果与免疫组化观察一致,进一步证实了 M2 巨噬细胞通过免疫调节在伤口愈合中的关键作用(图 11C–E)。免疫荧光分析显示,KC@PF@TA水凝胶处理的伤口在第21天形成更成熟、更长且管腔更大的血管,表明该水凝胶促进了血管生成(图11B)。Western blot结果表明,KC@PF和KC@PF@TA处理的伤口中α-SMA表达增加(图11C和D),表明肌成纤维细胞被激活,这些细胞通过合成细胞外基质和收缩伤口组织,在伤口愈合和重塑中发挥重要作用,同时可能促进胶原蛋白合成,进一步支持组织重塑和创伤愈合。

图11 KC@PF@TA水凝胶激活M2型巨噬细胞并促进血管新生(A)第21天再生皮肤组织中CD163的免疫组化染色(比例尺:200 μm);(B)DAPI(蓝色)、CD31(绿色)、α-SMA(红色)及合并的免疫荧光染色结果(比例尺:50 μm);(C)GAPDH、α-SMA、CD163的Western blot分析及(D)α-SMA、(E)CD163的定量分析(∗p < 0.05, ∗∗p < 0.01, ∗∗∗p < 0.001, n = 3)
该研究开发了一种新型的 KC@PF@TA 纳米复合水凝胶,展现出良好的糖尿病伤口修复潜力。实验表明,Ti₃C₂Tx-Ag 的加入增强了水凝胶的光热转换效率和抗菌性能,而 PF 则支持细胞增殖和迁移,并具有出色的生物相容性。体外和体内研究均证实,该水凝胶能够调节炎症反应、促进血管生成以及组织重塑,从而加速伤口愈合。PF 在这些过程中发挥了关键作用,显著提升了水凝胶的治疗效果。然而,目前该水凝胶的功效和安全性仅在体外和小鼠模型中进行了评估,其在大型动物模型或临床试验中的表现尚待进一步验证。同时,水凝胶的长期稳定性和降解产物对机体的影响也需要进一步研究。未来的研究应集中于优化水凝胶的组成和制备工艺,以提高其机械强度和控释性能,以满足不同类型糖尿病伤口的需求。此外,加入具有抗炎、抗氧化和促血管生成特性的活性成分,以及探索多功能水凝胶对温度、pH 等刺激的智能响应性,将为开发先进的个性化伤口护理材料提供新的机遇。

|
创赛生物 提供高品质的医疗产品和服务 |
联系我们 |
产品中心 |
扫码关注
关注公众号 扫码加客服
|

